Анализ UGT1A1 для выбора дозировки иринотекана (Кампто®): первый фармакогенетический тест в онкологии
- Аннотация
- Статья
- Ссылки

Камптотецин нерастворим в воде, поэтому для первых клинических испытаний использовалась натриевая соль этого соединения. В 1972 г. были опубликованы итоги исследования II фазы, которые продемонстрировали достаточно скромные результаты: из 64 больных, страдающих опухолями желудочно-кишечного тракта, объективный ответ опухоли на лечение наблюдался лишь в трех случаях. Существенно, что камптотецин обладал высокой и непредсказуемой токсичностью. Наиболее серьезным осложнением был геморрагический цистит, вызванный активацией препарата в моче за счет кислой среды (14). Исследования камптотецина были приостановлены в связи с кажущейся бесперспективностью, однако уже в следующем десятилетии данный алкалоид снова вызвал интерес у онкологов: было установлено, что механизм его действия объясняется ингибированием топоизомеразы I (5).
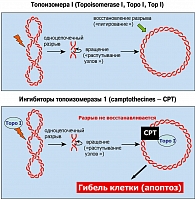
Топоизомераза I (Topoisomerase I, Topo I, Top I) играет существенную роль в процессах, связанных с репликацией, репарацией и рекомбинацией ДНК. Помимо этого, данный фермент необходим для осуществления транскрипции генов. Топоизомераза I снимает пространственное напряжение двуцепочечной ДНК, вызванное спиральной структурой этой молекулы. Топоизомераза I создает однонитевые разрывы и высвобождает те участки ДНК, на матрице которых должно осуществляться одно из перечисленных выше действий. После завершения процессов репликации, транскрипции и т. д. топоизомераза I сама устраняет однонитевой разрыв и восстанавливает исходную третичную структуру ДНК (рисунок 2). Топоизомераза I представляется привлекательной мишенью для воздействия на опухоли, т. к. подобный фермент абсолютно необходим для деления клеток и нередко активируется в процессе злокачественной трансформации. Угнетение топоизомеразы I сопровождается накоплением одно-и двуцепочных разрывов ДНК; в то время как нормальные клетки могут устранять подобные повреждения посредством репарации, опухоли зачастую характеризуются пониженной способностью к восстановлению ДНК (17, 22).
Исследования полусинтетического аналога камптотецина – иринотекана – достаточно быстро продемонстрировали заметную клиническую эффективность последнего. В частности, иринотекан стал первым препаратом, применение которого привело к заметному увеличению выживаемости больных с метастатической формой рака толстой кишки. В 1995 г. иринотекан был разрешен к применению в Европе, а в 1996 г. – в США. В настоящее время иринотекан входит в стандарты терапии первой линии для колоректальных новообразований. В Японии иринотекан был зарегистрирован еще раньше (в 1994 г.), а рекомендованный спектр его применения значительно шире и включает не только опухоли желудочно-кишечного тракта, но и карциномы легкого, шейки матки, яичника и т. д. (17, 22).
Метаболизм иринотекана
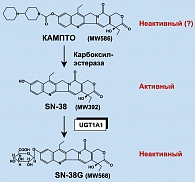
Сам иринотекан представляет собой практически неактивное соединение. Активация иринотекана осуществляется за счет действия фермента карбоксил-эстеразы (рисунок 3). В результате образуется производное 7-этил-10-гидроксикамптотецин (7-ethyl-10-hydroxycamptothecin, SN-38), характеризующий примерно 1000-кратным увеличением цитотоксических свойств. Инактивация SN-38 происходит преимущественно в печени. Главную роль в этом процессе играет фермент уридин-дифосфат-глюкуронозил-трансфераза 1A1 (uridine diphosphate-glucuronosyltransferase 1A1, UGT1A1). В случае присоединения глюкурона образуется неактивный метаболит SN-38G, который достаточно легко выводится из организма (6).
Следует подчеркнуть, что схема метаболизма иринотекана сознательно представлена в несколько упрощенном варианте. Помимо перечисленных ферментов, в активации и инактивации препарата могут принимать участие цитохромы, другие представители семейства уридин-дифосфат-глюкуронозил-трансфераз (UGT1A7, UGT1A9), различные белки-транспортеры и т. д. (2, 3, 13).
Фармакогенетика иринотекана
Иринотекан зачастую упоминается как препарат, чудом прошедший первые фазы клинических испытаний. Действительно, хотя клиническая эффективность данного цитостатика стала очевидной уже в самых первых исследованиях, столь же быстро была отмечена его тяжелая и непредсказуемая токсичность. К основным побочным эффектам иринотекана относят нейтропению и диарею; в ранних испытаниях частота летальных исходов вследствие этих осложнений достигала шокирующих цифр – 2-5% (7, 16, 19).
Еще в начале 90-х гг. XX века было отмечено, что иринотекан характеризуется значительной популяционной вариабельностью в отношении переносимости терапии. Одна из главных причин подобной вариабельности была идентифицирована достаточно быстро: оказалось, что одним из главных параметров, детерминирующих выраженность побочных эффектов при назначении иринотекана, является полиморфизм гена UGT1A1. UGT1A1 характеризуется популяционным разнообразием в отношении количества динуклеотидных повторов ТА в промоторной (регуляторной) области гена. Наиболее частым является аллель, содержащий 6 повторов ТА. Примерно 25-40% аллелей UGT1A1 представленны версией с 7 ТА-динуклеотидами. Примечательно, что аллель (ТА)7 (часто обозначаемый как UGT1A1*28) ассоциирован с пониженной экспрессией соответствующего фермента, уридин-дифосфат-глюкуронозил-трансферазы 1А1 (1, 16). При гетерозиготном и особенно при гомозиготном носительстве аллеля UGT1A1*28 нарушается соотношение между свободной и глюкурон-конъюгированной формой SN-38; как следствие, наблюдается заметное увеличение концентрации цитостатика в организме, что сопровождается усилением побочных эффектов лечения (рисунок 3).
Подавляющее большинство исследователей сходится на том, что присутствие вариантных аллелей гена UGT1A1 сопряжено с повышенной токсичностью иринотекана (8, 9, 11, 12, 21). Воспроизводимость подобных наблюдений привела к тому, что тест на полиморфизм UGT1A1 в 2005 г. получил официальную поддержку со стороны Food and Drug Administration (FDA) (19). Для пациентов, которые являются гомозиготными носителями аллеля UGT1A1*28, рекомендуется рассматривать вопрос о снижении стартовой дозировки препарата примерно на 20% (16). Примечательно, что анализ гена UGT1A1 является первым фармакогенетическим тестом, рекомендованным к применению в терапии солидных опухолей.
Практические аспекты
Существует целый ряд проблем, связанных с использованием знаний по «ириногенетике» как в целом, так и применительно к отечественным условиям.
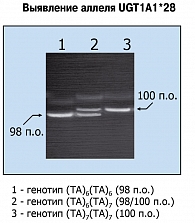
Детекция вариантных аллелей, различающихся по своей длине всего на 2 пары оснований (п. о.), является непростой задачей. В США для генотипирования UGT1A1 рекомендован т. н. Invider Assay, разработанный компанией Third Wave Technologies. Преимуществом подобного теста представляется отсутствие необходимости в амплификации ДНК посредством полимеразной цепной реакции (ПЦР), что делает всю процедуру практически одноэтапной (4, 16). Недостатком является потребность в значительных количествах ДНК, а также высокая стоимость диагностических наборов, связанная с патентными обязательствами. В НИИ онкологии им. Н.Н. Петрова нами разработан метод детекции аллеля UGT1A1*28 традиционным методом гель-электрофореза (рисунок 4). Наиболее трудным компонентом данного подхода является необходимость разделения исключительно близких по размеру фрагментов ДНК; тем не менее, подобный протокол, безусловно, может использоваться в условиях обычной молекулярно-генетической лаборатории.
Вариации внутри гена UGT1A1 не ограничиваются динуклеотидным полиморфизмом ТА. Аллель UGT1A1*28 относительно редко встречается у представителей азиатской расы; доминирующим низкоактивным вариантом UGT1A1 у последних является миссенс-полиморфизм G211A (Gly71Arg; аллель UGT1A1*6) (3, 7, 16). Его роль в фармакогенетике иринотекана изучена значительно меньше, чем для UGT1A1*28. Тем не менее, именно российская популяция нуждается в оценке встречаемости и клинической значимости аллеля UGT1A1*6; подобное утверждение основывается на высокой степени генетического сходства между жителями России и лицами азиатской расы.
Одной из наиболее заметных физиологических функций уридин-дифосфат-глюкуронозил-трансферазы 1А1 является участие в метаболизме билирубина. Примечательно, что гомозиготность по аллелю UGT1A1*28 лежит в основе синдрома Жильбера, проявляющегося гипербилирубинемией (15). В случае недоступности генетического тестирования рекомендуется внимательно учитывать уровень билирубина до начала лечения и при необходимости проводить коррекцию стартовой дозы иринотекана. Тем не менее, учитывая большие физиологические колебания уровня билирубина, подобный «фенотипический» подход представляется несколько ущербным с точки зрения требований современной медицины.
И, наконец, достижения «ириногенетики» рассматриваются не только в контексте уменьшения дозировки препарата для некоторых пациентов, но и, наоборот, с точки зрения повышения количества вводимого препарата больным с профицитными вариантами UGT1A1. Увеличение концентрации иринотекана при условии хорошей переносимости препарата представляется весьма желательным для достижения максимального ответа опухоли на терапию (11, 21, 23, 24).
Автор благодарит своих коллег К.Г. Буслова и А.Г. Иевлеву за подготовку иллюстрации по генотипированию динуклеотидного полиморфизма гена UGT1A1. Исследования по молекулярной диагностике в онкологии поддержаны грантом правительства Москвы (проект 15/07-Ген-М).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.