Впечатляющий ответ на двойное ингибирование BRAF и MEK у пациентки с внутрипеченочной холангиокарциномой с мутацией в гене BRAF
- Аннотация
- Статья
- Ссылки
- English
Введение
Термин «холангиокарцинома» (ХК) подразумевает три типа опухолей с различными факторами риска, свойствами и лечебными подходами: внутри- и внепеченочные опухоли, а также поражение желчных протоков ворот печени, относящееся к опухолям внепеченочной локализации (опухоль Клацкина). Считается, что на опухоли билиарного тракта приходится около 3% всех опухолей желудочно-кишечного тракта. Внутрипеченочные ХК составляют около 10% случаев первичного рака печени. Среди ХК на опухоль Клацкина приходится 50% случаев, из них на опухоли дистальной локализации – 40%. Внутрипеченочное поражение встречается в 10% случаев [1]. Метастатическая ХК обычно характеризуется агрессивным течением и низкой чувствительностью к химиотерапии. При распространенной форме заболевания медиана продолжительности жизни не превышает одного года, на фоне применения современных режимов полихимиотерапии (ПХТ) увеличивается до 18 месяцев [2, 3].
В настоящее время ведется поиск альтернативных подходов к терапии ХК, в том числе с учетом молекулярного патогенеза заболевания. В клетках ХК регулярно обнаруживаются драйверные молекулярные нарушения, такие как мутации в генах EGFR, ERRFI1, KRAS, NRAS, BRAF, PIK3CA, IDH1 и IDH2, транслокации с участием генов ROS 1 и FGFR 2 и амплификация генов ERBB 2 (HER2/neu) и MET [4, 5]. BRAF изменен у 5% пациентов с ХК. При этом BRAF V600E присутствует у 1,7% пациентов с ХК [6]. У пациентов с ХК поздних стадий в основном используется паллиативная терапия, направленная на предотвращение прогрессирования заболевания. Стандартной химиотерапией первой линии считается комбинация цисплатина и гемцитабина [3]. Альтернативные схемы включают гемцитабин с оксалиплатином или капецитабином, капецитабин с оксалиплатином или цисплатином, 5-фторурацил с цисплатином или оксалиплатином и монотерапию гемцитабином, 5-фторурацилом или капецитабином [7]. Стандартной схемы цитотоксической терапии второй линии не существует.
У больных ХК с драйверной мутацией BRAF V600E определенную активность показала комбинация дабрафениба и траметиниба. Эффективность данного подхода у пациентов со злокачественными новообразованиями редких локализаций успешно изучается в продолжающемся открытом несравнительном многоцентровом исследовании фазы II (ROAR). Все пациенты в исследовании получали лечение дабрафенибом 150 мг два раза в день и траметинибом 2 мг один раз в день до прогрессирования заболевания или непереносимости лечения. Промежуточный анализ данных исследования ROAR показал высокую частоту объективных ответов на фоне указанной терапии [8].
Рассмотрим клинический случай бурно прогрессирующей метастатической внепеченочной ХК, в котором комбинация дабрафениба и траметиниба привела к быстрому развитию терапевтического ответа после прогрессирования заболевания на первой линии терапии гемцитабином и оксалиплатином. В основу определения междисциплинарной комиссией стратегии лечения с применением таргетной терапии лег результат секвенирования нового поколения (NGS), показавший наличие в опухоли мутации BRAF V600Е.
Клинический случай
У пациентки 58 лет в апреле 2019 г. на профилактическом осмотре в отсутствие клинических проявлений, по данным ультразвукового исследования (УЗИ) брюшной полости, выявлено солидное очаговое образование в печени размером 67 × 53 мм. Магнитно-резонансная томография брюшной полости показала наличие опухоли левой доли печени, осложненной сегментарной билиарной гипертензией, кисты левой доли печени. Данные колоноскопии: патологии не выявлено. Гастроскопия: рефлюкс-эзофагит, недостаточность кардии. Антральный очаговый поверхностный гастрит. Онкомаркеры: СА 15-3 – 21, АФП – 1,45 МЕ/мл, РЭА – 1,9 нг/мл, СА 125 – 12,3 МЕ/мл, СА 19-9 – 1000 МЕ/мл, СА 72-4 – 1,0 МЕ/мл. Мультиспиральная компьютерная томография (МСКТ) грудной клетки: единичные очаги правого легкого (пневмофиброз). УЗИ малого таза, маммография – без патологии. Пациентку направили в онкологический диспансер. Под УЗИ-контролем выполнена пункция образования в печени. Цитологически – аденокарцинома. Состояние пациентки по шкале ECOG – 0, биохимические показатели крови в пределах нормы.
20 июня 2019 г. выполнена операция – резекция левого латерального сектора печени, резекция двух сегментов печени (S2 + S3), холецистэктомия, гистология и иммунофенотипирование – гистоструктура и иммунофенотип соответствуют аденокарциноме из желчных протоков (холангиокарциноме) с метастазами в лимфоузлах.
Проведено восемь курсов адъювантной ПХТ: гемцитабин 1000 мг/м² в первый и восьмой дни + оксалиплатин 130 мг/м² в первый день, цикл – 21 день. Химиотерапию перенесла относительно удовлетворительно. Отмечались нежелательные явления: полинейропатия 1-й степени по СТС АЕ, токсический гепатит 1-й степени по СТС АЕ (купирован адеметионином в течение двух недель). Лечение завершено в декабре 2019 г.
Контрольное обследование: МСКТ органов брюшной полости и малого таза показала состояние после резекции левой доли печени. Признаков рецидивного роста и метастатического поражения не выявлено. МСКТ органов грудной клетки и средостения: единичное очаговое уплотнение верхней доли правого легкого без динамики за шесть месяцев (фиброз). Онкомаркеры: АФП – 3,00 МЕ/мл (0,00–5,80), РЭА – 2,98 нг/мл (0,00–4,70), СА 19-9 – 30,14 МЕ/мл (0,00–39,00), СА 125 – 11,73 МЕ/мл (0,00–35,00). Пациентка находилась под динамическим наблюдением, контрольное обследование (МСКТ грудной клетки, брюшной полости и малого таза и онкомаркеры) проводилось каждые три месяца.
В январе 2020 г. по парафиновым блокам послеоперационного материала проведено секвенирование нового поколения (NGS). Результаты NGS: активирующих мутаций в экзонах 2, 3, 4 гена KRAS и в гене NRAS не выявлено. Обнаружена активирующая мутация V600E (c.1799T>A) в экзоне 15 гена BRAF. Активирующих мутаций в экзоне 20 гена ERBB2 не выявлено. Опухоль ALK-негативная и ROS-1-негативная, признаки микросателлитной нестабильности отсутствуют.
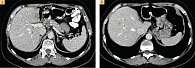
В ноябре 2020 г. уровень СА 19-9 повысился до 622,5 МЕ/мл. КТ брюшной полости: состояние после резекции левой доли печени, в динамике от сентября 2020 г. по краю резекции в области сегмента 4б и крайне нечетко в области сегмента 8 определяются гиподенсные участки, плотность в нативной фазе 39 ед.Н, после внутривенного усиления до 58 и 83 ед.Н в портальной фазе, приблизительные размеры – 20 × 18 и 10 мм соответственно (рис. 1). Под УЗИ-контролем выполнена пункция описанных на МСКТ образований печени. Цитологически – в пунктате образования печени среди реактивных гепатоцитов найдены комплексы опухолевых элементов умеренно дифференцированной аденокарциномы. Иммунофенотипирование – иммунофенотип совпадает с опухолью печени, оперированной в 2019 г.
В биохимическом анализе крови – повышение печеночных показателей и синдром холестаза (аланинаминотрансфераза – 156 ЕД/л, аспартатаминотрансфераза – 102 ЕД/л, билирубин общий – 31 мкмоль/л, прямой – 9,9 мкмоль/л, щелочная фосфатаза – 267 ЕД/л, лактатдегидрогеназа – 960 ЕД/л). Жалобы на выраженную общую слабость, отсутствие аппетита, снижение массы тела на 7 кг за два месяца. Состояние по шкале ECOG – I. Выставлен диагноз: рак печени (холангиоцеллюлярный) T3N1M0, IVa стадия (2019 г.). Прогрессирование. Метастазы в печени (мутация гена BRAF V600Е). План лечения: таргетная терапия + монохимиотерапия (дабрафениб + траметиниб + панитумумаб + иринотекан) с оценкой эффекта каждые три месяца. С 14 декабря 2020 г. начата терапия по схеме:
- дабрафениб 150 мг 2 раза в сутки ежедневно (соответствует суммарной суточной дозе 300 мг) (капсулы препарата Тафинлар следует принимать внутрь не позднее чем за час до приема пищи или не раньше чем через два часа после приема пищи, соблюдая 12-часовой интервал между приемом каждой дозы. В случае пропуска приема очередной дозы препарата Тафинлар пропущенную дозу принимать не нужно, если до приема следующей дозы остается менее шести часов);
- траметиниб 2 мг в сутки один раз в день ежедневно. Однократную суточную дозу траметиниба следует принимать каждый день в одно и то же время вместе с утренней или вечерней дозой препарата Тафинлар;
- иринотекан 180 мг/м² в первый день;
- панитумумаб 6 мг/кг в первый день; цикл – 14 дней.
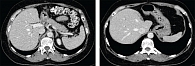
Через месяц от начала терапии пациентка отмечала значительное улучшение состояния (нормализовался аппетит, возросла толерантность к физической нагрузке, стабилизировалась масса тела). В биохимическом анализе крови – нормализация уровней трансаминаз и билирубина, снижение уровней щелочной фосфатазы и лактатдегидрогеназы. Контрольное обследование через три месяца от начала лечения: СА 19-9 – 33 МЕ/мл, КТ – в сегментах 4б и 8 правой доли печени визуализируются гиподенсные очаги 9 и 7 мм в диаметре соответственно. По критериям RECIST 1.1 констатирована частичная регрессия опухоли. Из нежелательных явлений за первые три месяца терапии зафиксирована кожная токсичность 1-й степени по СТС АЕ (на панитумумаб). Лечения не потребовалось. Контрольное обследование через шесть месяцев терапии: СА 19-9 – 29 МЕ/мл, на КТ по критериям RECIST 1.1 – сохранение частичной регрессии опухоли. Биохимические показатели крови в норме. Нежелательные явления – кожная токсичность 3-й степени по СТС АЕ (на панитумумаб). Антигистаминные, местные глюкокортикостероиды и антибиотики, системные глюкокортикостероиды – без эффекта. Панитумумаб и иринотекан отменены. Продолжена таргетная терапия: дабрафениб 150 мг два раза в сутки ежедневно + траметиниб 2 мг в сутки один раз в день ежедневно. Через месяц после отмены панитумумаба кожная токсичность купирована. Контрольное обследование после 14 месяцев таргетной терапии в феврале 2022 г.: КТ по критериям RECIST 1.1 показала полную регрессию опухоли (рис. 2).
Пациентка получает терапию дабрафенибом и траметинибом в течение 17 месяцев. Состояние по ECOG – 0. На контрольном обследовании – сохранение полной регрессии опухоли. Нежелательных явлений не наблюдалось. Пациентка ведет активный образ жизни, социально активна, продолжает работать. Планируется продолжить терапию дабрафенибом и траметинибом до прогрессирования заболевания или появления непереносимой токсичности с оценкой эффективности каждые три месяца.
Обсуждение
Представленный клинический случай демонстрирует техническую реализуемость и высокую эффективность персонализированного молекулярно-направленного лечения, основанного на подавлении патологически активированных внутриклеточных киназ при метастатической ХК, ассоциированной с онкогенной мутацией V600E в гене BRAF. Данное лечение позволило не только продлить время до прогрессирования заболевания, но также значительно увеличить медиану общей выживаемости и сохранить качество жизни и социальный статус больной.
Белки семейства RAF – ARAF, BRAF и CRAF (RAF1) представляют собой один из ключевых элементов сигнального каскада MAPK, передающего сигнал от ростовых факторов (рецепторов внеклеточных мембран) в клеточное ядро. В норме эти белки принимают активирующий сигнал от белков семейства RAS и передают его на белки семейства MEK. Мутации типа V600E переводят белок BRAF в постоянно активированное состояние, что обеспечивает непрерывную стимуляцию клеточного деления (пролиферации), не зависящую от внешних факторов. Ингибиторы мутантного белка BRAF – дабрафениб и вемурафениб блокируют этот патологический сигнал к пролиферации, но одновременно парадоксальным образом активируют белок CRAF, который начинает генерировать практически аналогичный, хотя и более слабый пролиферативный сигнал и передавать его белкам MEK. Вследствие этого максимальную противоопухолевую активность ингибиторы мутантного BRAF проявляют именно в сочетании с ингибиторами MEK, такими как траметиниб, кобиметиниб и селуметиниб. Эффективность указанных препаратов зафиксирована у пациентов с различными гистологическими типами BRAF-мутированных злокачественных опухолей – меланомой, ХК, колоректальным раком, немелкоклеточным раком легкого, саркомой мягких тканей, злокачественными глиомами и гемобластозами [9].
При ХК монотерапия ингибитором BRAF вемурафенибом показала сравнительно скромные результаты: из восьми пациентов объективный эффект зарегистрирован у одного, еще у четырех наблюдалась стабилизация [9]. Комбинированная терапия ХК по модели колоректального рака (вемурафениб + панитумумаб + иринотекан), экспериментально примененная у одного пациента, индуцировала полный регресс опухоли [10]. Однако в других работах показано, что при ХК можно добиться выраженного регресса опухоли за счет сочетания ингибиторов BRAF и MEK без дополнительного воздействия на белок EGFR [11].
В ходе клинического исследования фазы II (NCT02034110) с использованием комбинации дабрафениба и траметиниба при распространенной ХК наблюдалась высокая частота наступления объективных ответов на лечение у пациентов с мутацией BRAFV600E в опухоли. Частота общего ответа достигла 51%. При этом все пациенты ранее получали как минимум первую линию терапии. Медиана продолжительности ответа составила 8,7 месяца при комбинированном лечении, у семи пациентов ответ сохранялся более 12 месяцев. Медиана выживаемости без прогрессирования составила 9,1 месяца, общей выживаемости – 13,5 месяца. В целом 56,4% пациентов были живы через 12 месяцев, а 35,8% – через 24 месяца [12]. В этом исследовании комбинация показала приемлемый профиль токсичности. По крайней мере одно нежелательное явление наблюдалось у всех пациентов. Наиболее частыми нежелательными явлениями были лихорадка, тошнота, рвота, диарея и утомляемость. Нежелательные явления 3–4-й степени отмечались у 24 (56%) пациентов, наиболее частым из которых было увеличение уровня гамма-глутамилтранспептидазы, фермента, обнаруживаемого в печени и желчных протоках. Но эта токсичность соответствует наблюдаемой при использовании комбинации при других типах рака [13].
Несмотря на эти достижения, ХК по-прежнему остается фатальным заболеванием с пятилетней выживаемостью менее 20%. Но в обозримом будущем могут появиться многообещающие варианты лечения. Описанный случай подтверждает необходимость поиска таргетируемых активирующих мутаций в ХК, резистентных к стандартной цитотоксической терапии [14].
Следует отметить, что терапия дабрафенибом и траметинибом удовлетворительно переносится и приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими методами лечения. Спектр нежелательных явлений в рассмотренном клиническом случае позволил сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [13].
Заключение
Представленный случай подтверждает возможность проведения комбинированной терапии ингибиторами BRAF и MEK при ХК с мутацией BRAF V600E и ее потенциальную эффективность, сопоставимую с эффективностью при других злокачественных новообразованиях с мутацией BRAF V600E. В эру таргетных препаратов системные терапевтические подходы при метастатической ХК смещаются от малоэффективной традиционной химиотерапии к персонализированной медицине. С учетом молекулярной гетерогенности ХК для выбора потенциальной мишени может быть рекомендовано комплексное молекулярно-генетическое тестирование. Поскольку ХК встречается относительно редко, частота отдельных мутаций, вызывающих лекарственное воздействие, еще меньше, проведение клинических испытаний с участием пациентов с ХК крайне затруднено. В данном аспекте сложно переоценить значение презентации клинических случаев, демонстрирующих эффективность и рациональность таргетной терапии, основанной на молекулярно-генетическом профилировании метастатической ХК [15].
D.Yu. Yukalchuk, D.M. Ponomarenko, T.N. Yukalchuk, S.S. Sidorova, A.M. Novopashin
District Oncologic Dispensary, Irkutsk
Contact person: Denis Yu. Yukalchuk, dyuyu558@mail.ru
Presented the case of successful application of targeted therapy in a patient with metastatic cholangiocarcinoma resistant to chemotherapy. After the discovery of the BRAF V600E mutation in the tumor, it was prescribed the therapy with dabrafenib, trametinib, panitumumab and irinotecan, which provided significant improvement in the general condition and marked regression of most of the tumor foci. After achieving the maximum response, the patient was transferred to targeted therapy with dabrafenib and trametinib. The effect persisted for 17 months after the start of therapy and continues to this day. The described case demonstrates the potential of an individual approach to the treatment of common malignant tumors based on the data of molecular profiling of tumor tissue.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.