Аналоги соматостатина в лечении кастрационно-резистентного рака предстательной железы
- Аннотация
- Статья
- Ссылки
при данной патологии.
при данной патологии.
Рак предстательной железы (РПЖ) сегодня считается одной из самых серьезных медицинских проблем среди мужского населения. Ежегодно в мире выявляется до 396 тысяч случаев РПЖ, что в структуре онкологической заболеваемости мужчин составляет 9,2% (14,3% в развитых странах и 4,3% – в развивающихся) [1]. К тому же в настоящее время в Европе РПЖ занимает второе место среди основных причин смерти мужчин от рака [2]. В 2008 г. в России зарегистрировано 22 129 новых случаев рака простаты, а в 2011 г. – уже 28 027; 19% таких больных при первичном обращении имели отдаленные метастазы. За десятилетний период (2001–2011) на фоне значительного снижения стандартизованных показателей смертности от всех злокачественных новообразований показатели смертности от РПЖ увеличились с 8,23 до 11,61 на 100 тысяч населения (прирост на 41,39%) [3].
РПЖ встречается чаще у пожилых мужчин, следовательно, он представляет большую проблему в развитых странах, где процент пожилых мужчин выше. Риск обнаружения РПЖ у мужчины возрастает ежегодно на 2–3%. Так, в развитых странах РПЖ составляет около 15% случаев рака у мужчин, тогда как в развивающихся странах – 4% [4]. В России за последние пять лет заболеваемость РПЖ выросла с 25,61 до 38,41 на 100 тысяч мужчин (прирост составил 40,2%), а смертность от РПЖ за тот же период увеличилась с 12,44 до 15,19 на 100 тысяч мужчин [3, 5].
Больные с генерализованным гормонозависимым РПЖ, как правило, получают антиандрогенную терапию. Известно, что путем блокады андрогенов достичь стабилизации заболевания удается более чем у 80% пациентов с распространенным РПЖ [6, 7]. Эффект гормональных воздействий носит временный характер, и у большинства больных после 18 месяцев лечения отмечается прогрессирование заболевания. Неудачи терапии РПЖ во многом обусловлены развитием резистентности опухоли к осуществляемому медикаментозному лечению и формированием кастрационно-рефрактерного рака предстательной железы [8–10]. Дальнейшее лечение имеет, как правило, симптоматический характер и включает в себя применение наркотических анальгетиков, глюкокортикостероидов, бисфосфонатов, паллиативной лучевой терапии (на наиболее болезненные участки пораженной костной ткани), радиофармтерапии Sm153 или Sr89 [11, 12].
В основе формирования КРРПЖ лежит нарушение регуляции андрогенных рецепторов (АР). Измененные АР редко встречаются в опухолях, не подвергавшихся лечению, что позволяет говорить о влиянии гормональной терапии на появление изменений в АР. Большинство мутаций АР вызывает активацию их функции. К изменению структуры и функциональной активности наиболее часто приводят генные мутации АР, чаще всего в 4–8-м экзонах гена, кодирующего лигандсвязывающий домен, что делает возможным активацию АР другими лигандами (метаболитами стероидогенеза). Также возможны гиперактивация АР за счет стимуляции вспомогательными факторами транскрипции АР и лиганднезависимая активация АР различными факторами роста и цитокинами. В 1–2% случаев причиной изменения структуры АР является амплификация гена АР. Следует обратить особое внимание на то, что при лигандзависимом механизме активации АР такие изменения могут способствовать активации АР минимальными количествами андрогенов, например, синтезированными самой опухолью. Таким образом, опухоль стимулирует свой рост по интракринному механизму. Интракринный синтез андрогенов продолжается даже при кастрационных уровнях тестостерона, поэтому крайне важным условием лечения КРРПЖ является подавление синтеза андрогенов до минимального возможного уровня [13–15].
Лечение КРРПЖ – сложная проблема, разногласия в тактике ведения больных КРРПЖ присущи клиницистам во всех странах мира. Это связано с тем, что эффективность большинства традиционных химиотерапевтических агентов при лечении КРРПЖ крайне низкая. В последние годы клинически изучены новые препараты, воздействующие на молекулярные механизмы роста опухоли. Эти препараты демонстрируют значительный терапевтический эффект, выражающийся в увеличении общей выживаемости и повышении качества жизни пациентов, снижении уровня простатспецифического антигена (ПСА), стабилизации костных метастазов. В связи с этим усилия исследователей всего мира сфокусированы на поиске наиболее эффективных лекарственных комбинаций, которые смогли бы улучшить результаты лечения этой очень тяжелой категории больных [16, 17].
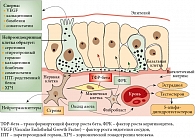
Одним из перспективных направлений в лечении КРРПЖ является назначение комбинированной терапии аналогами соматостатина (октреотид) и дексаметазоном. Соматостатин играет важную регуляторную роль в физиологическом контроле различных органов, в том числе простаты. Рецепторы соматостатина и его аналогов являются потенциальными мишенями при лечении РПЖ. Аналоги соматостатина, например октреотид, ингибируют рост рака простаты в эксперименте, оказывая непрямой антигормональный (за счет обратной связи) и прямой антимитотический эффекты, связанные с ингибированием соматостатиновых рецепторов (Somatostatin Type Receptor, SSTR) 2–5-го типов [18, 19].
Потенциальный противоопухолевый эффект аналогов соматостатина может быть связан с торможением клеточного роста и ангиогенеза в опухоли, а также с увеличением интенсивности апоптоза опухолевых клеток. Ингибирующие эффекты на клеточном опухолевом уровне, предположительно, основаны на прямом действии, зависящем от экспрессии опухолью рецепторов к соматостатину, и непрямом, имеющем значение в регуляции нормальных клеток, экспрессирующих рецепторы к соматостатину.
Прямое действие заключается в ингибировании внутриклеточных тирозинкиназ за счет связывания с рецепторами SSTR-2 и SSTR-5 и снижении пролиферации опухолевых клеток.
Непрямое действие является результатом ингибирования секреции факторов роста, таких как инсулиноподобный фактор роста 1 (Insulin-Like Growth Factor 1, IGF-1) и трансформирующий фактор роста (Transforming Growth Factor, TGF). IGF-1 вырабатывается, главным образом, в печени и стромальных клетках простаты. До 90% IGF-1 в крови связано с протеином, связывающим инсулиноподобный фактор роста 3-го типа (Insulin-Like Growth Factor Binding Protein, IGFBP-3). Свободный IGF-1, связываясь с соответствующими рецепторами, которые находятся на эпителиальных клетках простаты, стимулирует их рост и развитие. Под действием плазминогенного активатора класса урокиназ, который вырабатывается раковыми клетками простаты, а также под действием ПСА происходит расщепление IGFBP-3. Это снижает аффинность IGFBP-3 к IGF-1 и создает благоприятные условия для взаимодействия IGF-1 с соответствующим рецептором, что приводит к дальнейшей прогрессии заболевания [20]. Назначение аналогов соматостатина уменьшает синтез IGF-1 преимущественно в печени [21]. Назначение дексаметазона уменьшает биодоступность IGF-1 в метастатические костные очаги [22, 23].
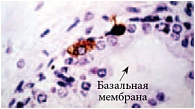
Соматостатин – ингибирующий пептид с экзокринной, эндокринной, паракринной и аутокринной активностью (выделен в 1973 г.). Включает группу пептидов, содержащих 14 и 28 аминокислот. В настоящее время идентифицировано не менее 5 типов соматостатиновых рецепторов (SSTR 1–5), располагающихся на плазматической мембране клеток. Клетки ряда опухолей и их метастазы экспрессируют рецепторы соматостатина с высокой плотностью, существенно превышающей их плотность на клетках нормальных тканей. Наибольшая экспрессия соматостатиновых рецепторов (2-го и 5-го типов) наблюдается в нейроэндокринных клетках КРРПЖ. Нейроэндокринные клетки присутствуют в нормальной ткани предстательной железы, и их находят на всех стадиях рака простаты (рис. 1).
Нейроэндокринные клетки не пролиферируют, не содержат андрогенных рецепторов, ПСА-негативны, секретируют множество нейропептидов, таких как хромогранин-А (рис. 2).
Имеется ряд клинических исследований, в которых были показаны эффективность и безопасность применения аналогов соматостатина с дексаметазоном на фоне медикаментозной кастрации аналогами гонадотропин-рилизинг-гормона (ГнРГ) у больных с КРРПЖ.
M. Koutsilieris и соавт. (2001) в исследовании с участием 11 больных КРРПЖ оценивали эффективность комбинированной терапии трипторелином (3,75 мг), дексаметазоном и ланреотидом (30 мг). У 8 из 11 (72,7%) пациентов было зарегистрировано уменьшение ПСА на 50% и более. Все пациенты отметили ослабление интенсивности болевого синдрома и улучшение соматического статуса. Общая выживаемость составила 18 месяцев, общая средняя продолжительность времени до прогрессирования была равна 7 месяцам [24].
В другой работе M. Koutsilieris и соавт. (2004) оценивали эффективность комбинированной терапии аналогом ГнРГ, дексаметазоном и депо-октреотидом (20 мг). У 33 из 38 больных (60,5%) КРРПЖ отмечен клинический ответ (снижение ПСА на 50% и более), стабилизация (прекращение роста ПСА) и прогрессирование болезни (рост ПСА) отмечены у 9 (21%) и 7 (18,4%) пациентов соответственно. У 47,7% пациентов с клиническим ответом не зарегистрировано снижения ПСА до нормального уровня. Среднее время до достижения исходного уровня ПСА составило 12 месяцев, среднее время до прогрессирования было равно 7 месяцам, общая выживаемость составила 18 месяцев [25].
M.A. Dimopoulos и соавт. (2004) в рандомизированном исследовании с участием 40 больных КРРПЖ сравнивали эффективность полихимиотерапии (эстрамустин, этопозид) с эффективностью комбинированной терапии диферелином (3,75 мг), аналогом соматостатина ланреотидом (30 мг) и дексаметазоном. Снижение ПСА на 50% и более зарегистрировано у 45% и 44% пациентов соответственно (р > 0,05). Частичный клинический ответ на лечение имел место в 29% и 30% случаев соответственно (р > 0,05). Не отмечено значимых различий в изменениях соматического статуса и интенсивности болевого синдрома. Проявления гематологической токсичности отмечались с достоверно более высокой частотой (80% больных) в группе пациентов, получавших химиотерапию. Нарушение толерантности к глюкозе чаще развивалось среди пациентов, получавших гормонотерапию (22% больных). Общая выживаемость в первой группе составила 18,8 месяца, во второй – 18 месяцев (р > 0,05). Общая средняя продолжительность времени до прогрессирования была равна 6 и 4 месяцам соответственно, а среди пациентов, у которых на фоне лечения отмечено снижение ПСА, – 8 и 7,7 месяца соответственно (р > 0,05). Авторы полагают, что новый вид комбинированного лечения с включением аналога ГнРГ, аналога соматостатина и дексаметазона имеет эффективность, аналогичную таковой при стандартной химиотерапии, но значительно лучше переносится [26].
F. Di Siverio и соавт. (2003) в исследовании с участием 10 больных КРРПЖ оценивали эффективность комбинированной терапии аналогом ГнРГ, этинилэстрадиолом и ланреотидом (30 мг). У 9 из 10 больных (90%) отмечен объективный клинический ответ (снижение ПСА на 50% и более). У 3 (30%) пациентов зарегистрировано снижение ПСА до нормального уровня. Все пациенты отметили ослабление интенсивности болевого синдрома и улучшение соматического статуса [27].
C.S. Mitsiades и соавт. (2006) в рандомизированном исследовании с участием 38 больных кастрационно-резистентным метастатическим РПЖ сравнивали эффективность золедроновой кислоты (препарат Зомета) (1-я группа) с сочетанным применением депо-формы октреотида (20 мг), дексаметазона и Зометы (2-я группа). Все пациенты получали аналоги ГнРГ. Клинический ответ на лечение (снижение ПСА на 50% и более) имел место у 13 из 20 больных (65%) 2-й группы. В 1-й группе снижение ПСА не отмечено. Авторы пришли к выводу о том, что комбинированная терапия более эффективна [28].
В 2010 г. Б.Я. Алексеев и соавт. опубликовали исследование с участием 66 больных КРРПЖ. Оценивалась эффективность комбинации аналога соматостатина длительного действия Октреотида-депо 20 мг с дексаметазоном у больных до 1-й линии химиотерапии (n = 36) и у больных с прогрессированием заболевания после химиотерапии доцетакселом (n = 30). Среднее количество курсов лечения в 1-й группе составило 6,8 (1–15); во 2-й группе – 5,9 (2–16). Снижение уровня ПСА > 50% и > 80% в 1-й группе составило 38,9% и 16,7% соответственно, во 2-й группе – 26,7% и 6,7% соответственно. Стабилизация уровня ПСА 41,7% достигнута в 1-й группе лечения и 53,3% – во 2-й. Больший клинический эффект наблюдался у больных, ранее не получавших цитотоксическую терапию [29].
Д.И. Ганов и С.А. Варламов в 2011 г. опубликовали результаты терапии по аналогичной схеме 15 больных КРРПЖ. Снижение уровня ПСА отмечено в 60% случаев, стабилизация – в 26,7%, прогрессирование – у 13,3% больных. Снижение градации боли отмечено у 80% больных. Общая средняя продолжительность времени до прогрессирования составила 8 месяцев [30]. Следует отметить, что данный режим терапии отличает удовлетворительная переносимость, отсутствие тяжелых токсических побочных эффектов. В связи с этим применение данного режима особенно оправдано у пожилых пациентов с отягощенным соматическим статусом.
Октреотид, в отличие от соматостатина, подавляет секрецию гормона роста в значительно большей степени, чем секрецию инсулина. Введение октреотида не сопровождается феноменом гиперсекреции гормонов по механизму отрицательной обратной связи. Применение препарата Октреотид-депо сопровождается меньшей частотой побочных эффектов, чем при использовании октреотида короткого действия. Причина – стабильная концентрация препарата в сыворотке крови.
Резюмируя вышесказанное, можно отметить, что при КРРПЖ андрогенная депривация вместе с Октреотидом-депо и дексаметазоном имеет приемлемый профиль переносимости и позволяет достичь объективного и паллиативного эффектов более чем в 50% случаев. Таким образом, применение аналогов соматостатина длительного действия (депо-форм) целесообразно в симптоматической и сопроводительной терапии, что открывает дополнительные возможности лекарственного лечения онкологических больных.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.