Определение тактики лечения больных РПЖ с доказанным нейроэндокринным статусом
- Аннотация
- Статья
- Ссылки



При рождении нейроэндокринные клетки (НЭК) присутствуют во всех отделах предстательной железы (ПЖ). Во время пубертатного периода число НЭК, рассеянно расположенных в ткани железы, значительно увеличивается, после чего остается относительно стабильным в возрастном интервале 25–54 года. Основными маркерами НЭК являются хромогранин А, серотонин, секретогранин, тиреоидстимулирующий гормонподобный пептид, кальцитонин, катакальцин, паратиреоидный гормонсвязанный пептид и др. [1, 2].
В предыдущей публикации по данной теме мы провели обзор литературы по нейроэндокринной дифференцировке рака предстательной железы (РПЖ), в котором указывали на ценность определения сывороточного хромогранина А (сХгА) в крови у больных РПЖ [3]. Итогом нашей работы стало заключение о необходимости дальнейшего изучения роли нейроэндокринной дифференцировки в диагностике и лечении РПЖ. Проведенный обзор литературы выявил довольно много нерешенных вопросов, а именно:
1. Существует ли зависимость уровня сХгА от того или иного заболевания ПЖ?
2. Есть ли корреляция между уровнями сХгА и простатспецифического антигена (ПСА)?
3. Какова ценность определения сХгА у пациентов с онкологическими и неонкологическими заболеваниями ПЖ?
На первом этапе работы мы провели собственное эпидемиологическое исследование, целью которого было определение средних значений показателя сХгА при различных состояниях ПЖ.
В отдельную область научного интереса стоит выделить пациентов с кастрационно-резистентным раком ПЖ (КРРПЖ). Известно, что как в нормальной ткани ПЖ, так и при наличии неопластического процесса НЭК лишены рецепторов к андрогенам, тем не менее данные клетки продуцируют эпидермальный фактор роста и тирозиновую протеинкиназу c-erbB-2 (также известную как HER-2/neu). Эти факторы создают условия для нечувствительности НЭК предстательной железы к гормональной терапии [1]. Многочисленные наблюдения указывают на то, что у абсолютного большинства больных РПЖ, получающих гормональную терапию, в среднем через 18–36 месяцев после начала лечения развивается рефрактерность к андрогенной аблации. Первичная резистентность к гормональной терапии регистрируется в 10–15% наблюдений [4].
Отсутствие аффинности КРРПЖ к гормональной терапии создает потребность в поиске новых методов лечения этой категории больных. Большой интерес в лечении КРРПЖ у исследователей вызывает аналог соматостатина октреотид.
В исследовании 2012 г., проведенном E.M. Wolin, указывается на то, что октреотид длительного действия в форме депо обладает антипролиферативным эффектом, увеличивая время до прогрессии заболевания у пациентов с нейроэндокринной опухолью [5]. Гормональная терапия метастатического КРРПЖ в комплексе с аналогом соматостатина в течение 6 месяцев позволяет добиться частичного снижения уровня ПСА (на 50%) и ответа на терапию в 59,5% (49,3–69,3%) случаев [6].
В России наиболее долго используется и подробно изучен в наших клинических исследованиях аналог соматостатина длительного действия под торговым названием Октреотид-депо (ЗАО «Фарм-Синтез»).
Исходя из полученных данных, мы провели второй этап исследования, целью которого было выявление больных КРРПЖ с нейроэндокринным статусом опухоли и оценка эффективности и безопасности комбинированной терапии этих пациентов в условиях медикаментозной (аналогами гонадотропин-рилизинг-гормона (ГнРГ)) или хирургической кастрации.
Материалы и методы
На момент публикации результатов эпидемиологического исследования в него было включено 148 мужчин с различными состояниями ПЖ: доброкачественная гиперплазия предстательной железы (ДГПЖ), простатическая интраэпителиальная неоплазия высокой степени (high-grade Prostatic Intraepithelial Neoplasia, HPIN), низкой степени (low-grade Prostatic Intraepithelial Neoplasia, LPIN), локализованный РПЖ (ЛРПЖ), местнораспространенный РПЖ (МРРПЖ) и метастатический РПЖ (МРПЖ). При этом в отдельную группу были выделены пациенты с КРРПЖ.
Пациенты с онкологическими заболеваниями других органов, заболеваниями желудочно-кишечного тракта, эндокринной системы, неконтролируемой гипертензией, а также пациенты с предшествующими хирургическими манипуляциями на ПЖ не были включены в данное исследование, так как известно, что вышеперечисленные состояния могут влиять на уровень сХгА.
Всем пациентам указанных групп выполнялся забор крови натощак с дальнейшим определением уровня сХгА методом ELISA Kit (Eurodiagnostica). Референсные значения сХгА при определении данным методом составили от 0 до 3 нмоль/л.
Пациентам с КРРПЖ в качестве второго этапа исследования впоследствии проводилась комбинированная терапия по следующей схеме: Октреотид-депо по 20 мг 1 раз в 28 дней в/м в комплексе с дексаметазоном в дозе 4 мг в сутки в течение 1 месяца, затем дексаметазон назначался в дозе 2 мг в сутки в течение 2 недель, после чего доза дексаметазона уменьшалась до 1 мг в сутки (поддерживающая доза). Также всем больным КРРПЖ назначали аналоги ГнРГ (депо-форма) – за исключением больных с предшествующей хирургической кастрацией. При этом, если после трех месяцев лечения не удавалось достичь адекватного клинического и биохимического ответа, доза Октреотида-депо увеличивалась до 30 мг 1 раз в 28 дней в/м. В исследование был включен 21 больной КРРПЖ. Ежемесячно всех больных оценивали по пятибалльной шкале оценки общего состояния онкологического больного Восточной объединенной группы онкологов (Eastern Cooperative Oncology Group, ECOG), проводили оценку выраженности болевого синдрома, уровней ПСА, сХгА, показателей клинического и биохимического анализов крови, нежелательных явлений.
Применялись следующие критерии оценки эффективности лечения: уровни ПСА, сХгА, данные компьютерной томографии (КТ) брюшной полости и малого таза, данные остеосцинтиграфии, изменение болевого синдрома по шестибалльной шкале, оценка по шкале ECOG, оценка ответа на лечение по критериям RECIST (Response Evaluation Criteria in Solid Tumors – критерии оценки ответа солидных опухолей на терапию) (оценка таргетных очагов).
Результаты эпидемиологического исследования
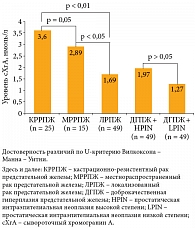
Согласно полученным результатам, средний уровень сХгА составил 1,27, 1,97, 1,69, 2,89 и 3,6 нмоль/л при ДГПЖ + LPIN, ДГПЖ + HPIN, ЛРПЖ, МРРПЖ и КРРПЖ соответственно.
Не получено достоверных различий в уровнях сХгА между пациентами с LPIN и HPIN: 1,27 и 1,97 нмоль/л (р > 0,05, t-критерий), однако среди пациентов с HPIN число пациентов, имеющих уровень сХгА более 3 нмоль/л, было выше, чем среди пациентов с LPIN: 14,8 и 6% соответственно (р = 0,05, по точному методу Фишера (ТМФ-критерий)).
Сравнительный анализ среднего уровня сХгА у пациентов с ЛРПЖ и МРРПЖ показал наличие достоверной разницы: 1,69 и 2,89 нмоль/л соответственно (р < 0,05, t-критерий) (рис. 1). Число больных, имеющих уровень сХгА более 3 нмоль/л, было выше среди пациентов с МРРПЖ по сравнению с пациентами с ЛРПЖ: 33 и 12% соответственно (р < 0,05, ТМФ-критерий). Уровень сХгА у больных МРРПЖ был выше, чем у больных с простатической интраэпителиальной неоплазией: 2,89 и 1,55 нмоль/л соответственно (р < 0,05, t-критерий).
Средний уровень сХгА у пациентов с КРРПЖ (3,6 нмоль/л) был выше, чем у пациентов c ЛРПЖ (1,69 нмоль/л) и МРРПЖ (2,89 нмоль/л) (р < 0,01 и р = 0,05, t-критерий).
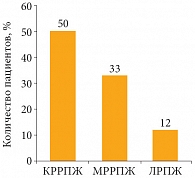
Число больных, имеющих уровень сХгА более 3 нмоль/л, при КРРПЖ (50%) оказалось выше, чем среди больных ЛРПЖ (12%) и МРРПЖ (33%) (р < 0,05; р < 0,01, ТМФ-критерий) (рис. 2).
Результаты лечения Октреотидом-депо больных КРРПЖ
Из общего числа больных КРРПЖ (21 пациент) 13 прошли трехмесячный этап лечения Октреотидом-депо. Именно по этим 13 пациентам и представлены результаты лечения. Ответ на проводимую комбинированную терапию был отмечен у 8 (61,5%) из них. При этом у 4 (1-я группа) было выявлено снижение ПСА ≥ 50% и у 4 (2-я группа) наблюдалось снижение ПСА < 50% или его стабилизация. Третью группу составили 5 пациентов, не ответивших на лечение.
В связи с малым числом пациентов различия в начальном уровне сХгА не достигли уровня статистической значимости (табл. 1), однако выявлена тенденция к более высокому начальному уровню сХгА у больных 1-й группы по сравнению с пациентами из 3-й группы (р < 0,1, U-критерий).
Из 13 пациентов, получавших комбинированную терапию, уровень сХгА снизился у 12 (92%) (р < 0,05; парный Т-критерий Вилкоксона) (табл. 2). Различия между 1-й и 2-й группами пациентов, ответивших на лечение, достоверны (р < 0,01). Различия между пациентами, не ответившими на терапию, и 1-й группой пациентов, ответивших на лечение, также достоверны (р < 0,01, U-критерий Вилкоксона – Манна – Уитни).
У всех пациентов 1-й группы (ответивших на лечение) ПСА снизился в течение 3 месяцев терапии. У пациентов 2-й группы (ответивших на лечение) ПСА снизился или произошла его стабилизация в течение 3 месяцев. У всех лиц, не ответивших на терапию, ПСА устойчиво повышался уже после 1-го и 2-го месяца лечения (табл. 3).
Различия степеней снижения ПСА между 1-й и 2-й группами ответчиков достоверны (р < 0,01). Различия между пациентами, ответившими и не ответившими на лечение, также достоверны (p < 0,001, U-критерий).
Выводы
На основании полученных промежуточных результатов исследования можно сделать следующие выводы:
- Уровень сХгА коррелирует со стадией заболевания предстательной железы и является ценным маркером РПЖ, особенно в диагностике нейроэндокринной дифференцировки КРРПЖ.
- Сывороточный ХгА снижается у всех пациентов с КРРПЖ, получающих комбинированную терапию с Октреотидом-депо, что указывает на адекватность терапии КРРПЖ с учетом нейроэндокринного статуса опухоли.
- У пациентов, имеющих максимальный ответ по степени и длительности снижения ПСА, отмечается максимальное и продолжительное снижение уровня сХгА.
- У пациентов 2-й группы (ответивших на лечение), демонстрирующих меньший ответ по степени и длительности снижения ПСА, отмечается меньшая степень снижения уровня ХгА.
- Сывороточный ХгА является важным показателем выбора, прогнозирования и контроля эффекта лечения больных КРРПЖ, направленного на подавление активности нейроэндокринных клеток опухоли, с использованием пролонгированной формы Октреотида-депо.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.