Антибактериальная терапия острых и рецидивирующих тонзиллитов у детей
- Аннотация
- Статья
- Ссылки
- English

Вопросы антибактериальной терапии были, есть и будут одной из самых больших проблем современной медицины. На восьмом десятилетии истории применения антибиотиков в практическом здравоохранении врачи столкнулись с проблемой высокого уровня приобретенной резистентности у ряда респираторных патогенов при фактическом отсутствии перспектив разработки новых классов антибактериальных препаратов. Эта ситуация возникла вследствие нерационального использования существующих классов антибактериальных препаратов как практикующими врачами, так и самими пациентами при попытках самолечения. Нередким примером неправильного использования антибиотиков в повседневной клинической практике являются острые и рецидивирующие воспалительные заболевания глотки. Так, по данным одного из отечественных многоцентровых исследований, антибиотики получают более 95% пациентов с жалобами на боль в горле, при этом в 71% случаев имеет место «неправильный» выбор антибиотика [1].
Однако, учитывая высокий риск развития острой ревматоидной лихорадки как осложнения стрептококкового тонзиллита, необоснованный отказ от применения антибактериальной терапии также не является выходом из сложившейся ситуации [2]. Чтобы избежать ошибки в определении показаний к антибактериальной терапии и в выборе оптимального антибиотика, практикующему врачу необходимо помнить этиологию острых и рецидивирующих заболеваний глотки, некоторые особенности клинической микробиологии респираторных патогенов и хорошо знать современные принципы дифференциальной диагностики различных форм тонзиллитов (в зарубежной литературе – тонзиллофарингитов).
Острый стрептококковый тонзиллит
При остром тонзиллите у детей отмечается приблизительно равная вероятность вирусной и бактериальной инфекции, что определяет проблемы дифференциальной диагностики. Острые воспалительные изменения в ротоглотке, вызванные респираторными вирусами, составляют 30–40% в структуре заболеваний глотки. Почти в 30% случаев этиологию острого фарингита установить не удается [3, 4]. На долю острых бактериальных заболеваний ротоглотки, требующих проведения антибактериальной терапии, приходится около 30–40% всех случаев острых тонзиллитов. При этом абсолютно главенствующая роль отводится бета-гемолитическому стрептококку группы А (БГСА, Streptococcus pyogenes). Значительно реже в качестве основного возбудителя острых воспалительных заболеваний ротоглотки выделяются другие группы бета-гемолитических стрептококков, в основном групп C и G. Доля остальных бактериальных патогенов, в том числе атипичных, в этиологической структуре не превышает 1% и не учитывается при эмпирическом выборе антибактериального препарата [3, 4].
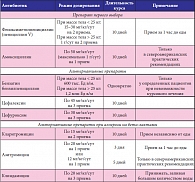
Важным свойством БГСА, о котором необходимо помнить практикующим врачам, является сохранение in vitro 100%-ной чувствительности ко всем бета-лактамным антибиотикам, линкозамидам и фторхинолонам. В России сохраняется хорошая чувствительность БГСА к макролидам – уровень резистентности к ним колеблется от 2 до 8% в зависимости от региона [5]. Как и все стрептококки, БГСА не чувствителен к аминогликозидам. На основании данных об этиологической структуре острых тонзиллитов и особенностях БГСА, представляющего собой главенствующий бактериальный патоген при данном заболевании, разработана повсеместно принятая – как в России, так и за рубежом – схема антибактериальной терапии острого стрептококкового тонзиллита (табл. 1) [6–9]. Согласно данной схеме, препаратом выбора у пациентов при подтвержденной или высоко вероятной стрептококковой природе тонзиллита является феноксиметилпенициллин.
Учитывая фармакокинетические свойства феноксиметилпенициллина, прежде всего необходимость приема препарата натощак, в ряде североамериканских практических рекомендаций вторым препаратом выбора указан амоксициллин [7]. Препарат амоксициллин входит в действующий на территории Российской Федерации «Перечень жизненно необходимых и важнейших лекарственных препаратов». Амоксициллин относится к группе пенициллинов широкого спектра действия, препарат активен в отношении основных возбудителей ЛОР-инфекций (Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae). Препарат Флемоксин Солютаб (таблетки диспергируемые) является уникальной растворимой формой амоксициллина [10]. Флемоксин Солютаб характеризуется самой высокой биодоступностью среди твердых лекарственных форм амоксициллина (93%), оказывает минимальное влияние на нормальную микрофлору кишечника благодаря низкой «остаточной» концентрации [10]. Эта форма обеспечивает удобство приема: таблетку можно проглотить целиком, разжевать или растворить в воде.
Возможность для пациента выбрать предпочтительный способ приема препарата повышает приверженность пациентов терапии. Препарат входит в стандарты оказания медицинской помощи и национальные клинические рекомендации по терапии инфекций ЛОР-органов. При непереносимости пациентом препаратов пенициллинового ряда альтернативой являются цефалоспорины 1-го (цефалексин), 2-го (цефуроксим), 3-го поколения (цефиксим). При применении цефалоспоринов 1-го поколения у пациентов с непереносимостью антибиотиков пенициллинового ряда необходимо помнить о приблизительно 10%-ной вероятности перекрестных аллергических реакций [11]. У некоторых групп пациентов при невозможности курсового применения антибактериальных препаратов альтернативным методом лечения стрептококкового тонзиллита является однократная инъекция бензатина бензилпенициллина [6–9]. Однако при применении бензатина бензилпенициллина требуется большая осторожность, так как в случае возникновения аллергической реакции на этот препарат пролонгированного действия ее купирование может вызвать определенные трудности.
При непереносимости всей группы бета-лактамных антибиотиков альтернативными препаратами выбора становятся макролиды и линкозамиды. Применение линкозамидов в педиатрической практике не получило широкого распространения из-за высокого риска развития нежелательных побочных явлений со стороны желудочно-кишечного тракта [12]. Есть свои нюансы и при выборе макролидных антибиотиков в терапии острого стрептококкового тонзиллита у детей. Так, использование большинства макролидов, особенно эритромицина и азитромицина, предполагает прием лекарства натощак (обычно за 1 час до еды), что неудобно пациентам и снижает выполняемость врачебных назначений. К исключениям относится лишь небольшое число антибиотиков макролидного ряда, в частности джозамицин, прием которого возможен независимо от приема пищи [6]. Очевидным преимуществом применения макролидов в лечении острого стрептококкового тонзиллита является способность этих антибиотиков накапливаться в высоких концентрациях в тканях лимфоглоточного кольца. Так, например, при тонзиллите концентрация джозамицина в ткани нёбных миндалин в несколько раз превышает таковую в плазме крови [13].
Важной особенностью джозамицина в условиях нарастающей резистентности к макролидам и азалидам является сохранение его высокой антимикробной активности, в том числе в отношении резистентных к эритромицину штаммов возбудителей. Применение джозамицина снижает риск развития резистентности и демонстрирует стабильную высокую эрадикационную активность на протяжении нескольких десятилетий, что позволяет использовать его в качестве препарата для эмпирической терапии. Еще одно преимущество современных макролидов заключается в том, что они оказывают минимальное воздействие на нормальную микрофлору ротоглотки и кишечника, благодаря чему снижается риск развития таких нежелательных побочных эффектов, как диарейный синдром и тонзилломикоз [14]. Несмотря на низкий уровень приобретенной резистентности к макролидам в России, злоупотребление данной группой антибактериальных препаратов может привести к быстрой селекции штаммов, резистентных к 14- и 15-членным макролидам, что подтверждает опыт ряда стран Америки, Европы и Азии [15–17].
Важным условием применения антибактериальных препаратов в терапии острого стрептококкового тонзиллита является длительность курса антибиотикотерапии. Для достижения полной эрадикации БГСА и, как следствие, минимизации риска развития острой ревматоидной лихорадки длительность антибактериальной терапии должна составить 10 дней. Есть лишь 2 исключения из этого правила, связанные с применением препаратов пролонгированного действия. Это однократное введение бензатина бензилпенициллина и использование азитромицина трехдневным или, согласно североамериканским рекомендациям, пятидневным курсом [6, 7]. Необходимость принимать антибиотики в течение 10 дней непонятна большинству пациентов, учитывая значительное улучшение самочувствия больного обычно уже на 2–3-й день лечения, к тому же это не очень удобно. Именно поэтому лечащий врач при назначении препаратов пациенту должен провести разъяснительную беседу о важности выполнения своих рекомендаций.
Существуют, тем не менее, данные о возможности сокращения курса антимикробной химиотерапии БГСА-тонзиллита с применением бета-лактамных антибиотиков до 5–7 дней без ущерба эффективности лечения. Но авторы этих работ все же подчеркивают необходимость десятидневного курса антибактериальной терапии в регионах с высоким риском острой ревматической лихорадки [18]. Основным фактором, повышающим частоту выполнения врачебных назначений в лечении стрептококкового тонзиллита, является использование в амбулаторной практике форм антибиотиков для приема внутрь – таблеток, а у детей дошкольного возраста – суспензий [6, 7]. Диспергируемые таблетки Солютаб позволяют применять антибиотики у пациентов всех возрастных групп.
Таким образом, при наличии убедительных данных за стрептококковую этиологию острого тонзиллита его терапия не должна вызывать затруднений у практикующих врачей. Однако существуют очевидные проблемы дифференциальной диагностики БГСА-ассоциированного тонзиллита и некоторых случаев вирусных тонзиллитов. Так, нередко клиническое течение вирусной инфекции Эпштейна – Барр, аденовирусной инфекции и энтеровирусной инфекции имеет признаки, характерные для стрептококкового тонзиллита: лихорадка выше 38,3 °С, налеты на миндалинах, увеличение и болезненность шейных и поднижнечелюстных лимфатических узлов. Рекомендованное во всех случаях при подозрении на стрептококковый тонзиллит бактериологическое исследование не решает эту проблему в амбулаторной практике, так как выделение культуры БГСА со сред возможно не ранее 2–5-го дня после забора материала.
Использование дифференциально-диагностических шкал, например шкалы МакАйзека, в какой-то мере облегчает задачу врача, но даже при наличии всех 5 признаков стрептококкового тонзиллита риск диагностической ошибки возможен [19, 20]. Именно поэтому на сегодняшний день «золотым стандартом» в диагностике острого стрептококкового тонзиллита считаются данные экспресс-тестов на БГСА, подтвержденные последующими результатами бактериологического исследования мазка-отпечатка с поверхности нёбных миндалин и задней стенки глотки [7, 19]. В настоящее время в мире существует около 200 наименований экспресс-тестов на БГСА-инфекцию. В зависимости от используемого диагностического метода условно выделяют три поколения подобных тест-систем. Первые два поколения экспресс-тестов основаны на выявлении антигена группового полисахарида БГСА. Различия состоят в том, что в основе тестов 1-го поколения лежит реакция агглютинации (коагглютинация или латекс-агглютинация), 2-го поколения – иммуноферментный анализ, иммунохроматография или оптический иммунный анализ. Тесты 3-го поколения основаны на выявлении специфических участков ДНК БГСА (ДНК-гибридизация, полимеразная цепная реакция). Тестовые системы всех поколений имеют специфичность более 90%. Однако чувствительность тестов 1-го поколения находится на уровне 55–60%, 2-го поколения – 85–87%, 3-го поколения – более 95% [20, 21].
На российском рынке на конец 2012 г. были представлены лишь тестовые системы 1-го и 2-го поколений. Согласно данным европейских исследований, использование в течение нескольких лет в рутинной клинической практике экспресс-тестов 2-го поколения на БГСА позволило существенно снизить частоту нерационального применения антибиотиков в лечении воспалительных заболеваний ротоглотки [22]. С практической точки зрения необходимо помнить о том, что здоровым носителям БГСА и лицам, контактировавшим с больным стрептококковым тонзиллитом, но не имеющим клинических проявлений заболевания, проведение системной антибактериальной терапии не показано [6].
Обострения хронического тонзиллита
По поводу антибактериальной терапии обострений хронического тонзиллита у детей (в зарубежной литературе рецидивирующего тонзиллита) возникает широкий спектр вопросов. Необходимость системной антибактериальной терапии при обострении хронического тонзиллита, как и при остром стрептококковом тонзиллите, продиктована угрозой развития острой ревматической лихорадки. Нередким осложнением обострения хронического тонзиллита является паратонзиллярный абсцесс. Существуют определенные различия в этиологической структуре острого и рецидивирующего или хронического тонзиллита. При хроническом тонзиллите вирусная инфекция чаще всего играет роль «пускового механизма» в развитии обострений процесса. Бактериальные патогены, вызывающие обострение процесса, обычно персистируют в ротоглотке. При этом большинство бактериальных патогенов находятся не на поверхности слизистой оболочки, а в основном в строме нёбных миндалин, что определяет низкую информативность бактериологического исследования мазка-отпечатка, взятого с поверхности нёбных миндалин или задней стенки глотки в период ремиссии [21, 23].
Как и при остром тонзиллите, в этиологии хронического тонзиллита важную роль играет БГСА. Согласно данным последних исследований, Streptococcus pyogenes выделяется из ткани удаленных нёбных миндалин у 20–30% пациентов с хроническим тонзиллитом [23–26]. Однако ведущим бактериальным патогеном при хроническом тонзиллите на сегодняшний день принято считать золотистый стафилококк (Staphylococcus aureus), выделяемый, по разным данным, из ткани нёбных миндалин у пациентов с хроническим тонзиллитом в 30–80% случаев [23–25]. Подавляющее большинство случаев паратонзиллярных абсцессов, развивающихся как осложнение хронического тонзиллита, обусловлено именно этим патогеном [23]. Но, несмотря на выраженные суперантигенные свойства этого возбудителя, данные о роли золотистого стафилококка в развитии острой ревматической лихорадки у пациентов с хроническим тонзиллитом отсутствуют.
В 10–15% случаев из ткани нёбных миндалин при хроническом тонзиллите выделяется гемофильная палочка (Haemophilus influenzaе), однако значение этого патогена в этиологии хронического тонзиллита на сегодняшний день не выяснено [23–27]. По данным ряда авторов, некоторые атипичные возбудители, в частности Mycoplasma pneumoniae, играют значимую роль в этиологии хронического тонзиллита у детей [14, 28]. Учитывая имеющиеся данные об этиологической структуре хронического тонзиллита у детей, в некоторых отечественных методических рекомендациях предложена представленная в таблице 2 схема антибактериальной терапии [6]. Препаратами выбора являются амоксициллин/клавуланат или цефалоспорины 2–3-го поколения (цефиксим, цефуроксим); при непереносимости бета-лактамных антибиотиков предпочтение отдается линкозамидам и, у детей старше 8 лет, тетрациклинам. Длительность терапии, как и при остром тонзиллите, составляет 10 дней. Североамериканские практические рекомендации по терапии рецидивирующих БГСА-тонзиллитов в качестве препаратов выбора рассматривают применение амоксициллина/клавуланата, клиндамицина, комбинацию феноксиметилпенициллина и рифампицина десятидневным курсом [7].
На сегодняшний день нет убедительных данных о роли неинфекционных факторов в этиологии хронического тонзиллита, а роль вирусов и грибковой флоры также не доказана [21]. Одной из особенностей жизнедеятельности бактерий в условиях хронического воспалительного процесса является их существование в виде инвазивных форм. Согласно данным последних исследований, при хроническом тонзиллите в виде инвазивных форм существуют до 87% бактериальных патогенов [23]. Так, в экспериментальных исследованиях было продемонстрировано, что БГСА и золотистый стафилококк способны проникать внутрь эпителиальных клеток респираторного тракта человеческого организма, где они оказываются недоступными для действия бета-лактамных антибиотиков [23, 29]. Считается, что это свойство бактерий обусловлено незавершенным фагоцитозом, нередко отмечающимся при хронических воспалительных реакциях, когда микроорганизмы, располагаясь внутриклеточно, персистируют и размножаются непосредственно в фагоцитарных клетках [30].
Другой особенностью микроорганизмов является склонность к образованию биопленок. Применение большинства классов антибиотиков позволяет уничтожать лишь планктонные клетки, количество которых увеличивается при обострении процесса. Бактерии, находящиеся в биопленках, антибиотики не затрагивают, и такие бактерии способны жить и размножаться, когда терапия закончена. Существует достаточное количество работ, указывающих на высокую частоту выявления биопленок бактериальных патогенов на нёбных миндалинах у пациентов с хроническим тонзиллитом. Так, в исследовании R.E. Kania и соавт. (2007) биопленки обнаруживались в 70,8% (17 из 24) образцов нёбных миндалин [31]. В работе итальянских оториноларингологов при исследовании 16 образцов нёбных миндалин и аденоидов биопленки были обнаружены в 57,5% случаев [32]. В одном из последних опубликованных исследований биопленки золотистого стафилококка выделены у 50% детей с хроническим тонзиллитом [25].
В первом российском исследовании, посвященном вопросам бактериальных биопленок в оториноларингологии, БГСА был выделен у 28,3% пациентов с хроническим тонзиллитом, при этом 100% выделенных штаммов стрептококка имели способность к биопленкообразованию [26]. Среди остальных причин отсутствия эрадикации бактериальных патогенов в ротоглотке после проведения антибактериальной терапии назовем использование инфицированных зубных щеток, несоблюдение схемы антибактериальной терапии пациентом и использование низкокачественных генерических препаратов [21]. Одним из возможных способов преодоления вышеперечисленных защитных механизмов бактерий является применение антибиотиков макролидного ряда. Давно известна способность макролидов воздействовать на атипичные (внутриклеточные) бактериальные патогены. Аналогичное действие макролидов в отношении инвазивных форм БГСА и золотистого стафилококка было подтверждено клиническими исследованиями [23, 33].
Не менее важным свойством макролидов является способность повреждать матрикс бактериальных биопленок. Так, в клинических и экспериментальных исследованиях было установлено, что макролиды даже в низких дозах (вдвое ниже терапевтических) приводят к разрушению биопленок, продуцируемых Pseudomonas aeruginosa, Staphylococcus aureus (в том числе метициллинрезистентными штаммами (MRSA)) и БГСА [33, 35]. Еще одним преимуществом современных макролидных антибиотиков, реализуемым в лечении хронических респираторных заболеваний, являются их неантибиотические свойства: противовоспалительный и иммуномодулирующий эффект. В клинических и лабораторных исследованиях было показано, что макролидные антибиотики подавляют продукцию медиаторов воспаления и значительно повышают фагоцитарную активность нейтрофилов и макрофагов, обладают синергидным эффектом с комплементом сыворотки и увеличивают активность Т-киллеров [36].
При этом, по данным Т.И. Гаращенко (2001), 16-членные макролидные препараты (джозамицин) обладают существенными преимуществами перед 14- и 15-членными при лечении рецидивирующих тонзиллитов и паратонзиллярных абсцессов. Так, лечение азитромицином обострений рецидивирующего тонзиллита курсовой дозой в 30 мг/кг (в течение 3 или 5 дней) дает положительные клинические и бактериологические результаты в ближайшие сроки лечения (на 7–10-й день) – 95 и 88,3% соответственно. Однако через 3 месяца при достаточно высокой сохраняющейся положительной клинической эффективности (90%) снижается эффективность бактериологической санации (70%) [14]. Таким образом, учитывая вышеизложенные данные, можно сделать вывод о том, что существующие на сегодняшний день схемы антибактериальной терапии обострения хронического тонзиллита не идеальны, и проблема требует дальнейшего обсуждения. При этом в отечественной литературе неоднократно поднимался вопрос о роли макролидов в схемах терапии обострений хронических воспалительных заболеваний глотки [14, 21, 30]. Упомянутые в этой статье результаты клинических и экспериментальных исследований свойств современных макролидов делают патогенетически обоснованным применение этой группы препаратов, в частности джозамицина, в терапии обострений хронического тонзиллита.
State Budgetary Educational Institution for Continuing Professional Education ‘Russian Medical Academy of Postgraduate Education’, Pediatric Otorhinolaryngology Department
Contact person: Denis Andreyevich Tulupov, tulupovdenis@yandex.ru
The authors review the recent literature data on the antibacterial treatment of acute streptococcal tonsillitis and chronic tonsillitis in children focusing on the role of modern macrolides in the diseases of pharynx in the pediatric population.
Key words: acute streptococcal tonsillitis, chronic tonsillitis, Streptococcus pyogenes, Staphylococcus aureus, amoxicillin, amoxicillin/clavulanic acid, josamycine
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.