количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Диабетическая нейропатия: фокус на патогенетическое лечение
Эффективная фармакотерапия. Эндокринология. СПЕЦВЫПУСК №1.
- Аннотация
- Статья
- Ссылки
Диабетическая нейропатия (ДН) – одно из самых частых и серьезных осложнений сахарного диабета. Основным методом патогенетической терапии ДН является воздействие на ключевой механизм поражения нервных волокон при ДН – окислительный стресс – путем применения антиоксидантов. Альфа-липоевая кислота (АЛК) обладает мощным антиоксидантным действием, улучшает утилизацию глюкозы клетками, способствует регенерации периферических нервных волокон и может эффективно применяться в терапии различных форм ДН, что доказано рядом зарубежных и отечественных исследований. Генерические препараты АЛК, среди которых особое место занимает Октолипен, выпускаемый в соответствии с европейскими стандартами качества, эффективны, безопасны и обеспечивают высокий уровень приверженности больных лечению, поскольку стоимость их значительно ниже, а эффект сопоставим с таковым оригинального препарата.
В организме человека нервная и эндокринная системы теснейшим образом связаны друг с другом. В этой связи неудивительно, что нервная система вовлекается в патологический процесс при большинстве эндокринных заболеваний. При сахарном диабете (СД) наиболее уязвимым становится ее периферический отдел. Головной мозг чаще страдает опосредованно, в результате сосудистой недостаточности, обусловленной нарушениями метаболизма углеводов.Поражение периферической нервной системы у больных СД встречается в 40–60% случаев и проявляется в виде диабетической нейропатии (ДН). Заболеваемость ДН увеличивается с возрастом и длительностью СД. Как правило, клинические симптомы нейропатии развиваются спустя 5–10 лет от начала основного заболевания. Независимыми факторами риска развития этого серьезного осложнения СД являются неудовлетворительный контроль уровня гликемии, повышенное содержание липидов в крови и ожирение. Нейропатией страдают 10–15% людей в возрасте 20–60 лет с нарушением толерантности к глюкозе.
ДН коррелирует с высоким риском сердечно-сосудистых осложнений, является одной из ведущих причин образования длительно не заживающих трофических язв, часто приводящих к ампутациям нижних конечностей. Смертность по причине СД, осложненного ДН, по-прежнему остается высокой во всех странах мира, независимо от их социально-экономического статуса. Пациенты с нейропатией часто не могут обходиться без посторонней помощи при выполнении простейших действий, что, безусловно, отражается на качестве их жизни.
Клинические проявления и диагностика ДН
Диабетическая нейропатия представляет собой поражение периферической нервной системы, подтвержденное клинически или параклинически, возникающее при наличии диабета, но в отсутствие других причин. Клинические проявления ДН представляют собой нарушения функций соматической и/или автономной части периферической нервной системы. Комбинация клинических признаков при ДН весьма вариабельна и индивидуальна для каждого больного. В зависимости от распространенности поражения периферической нервной системы выделяют две группы ДН:
- диффузные/симметричные полинейропатии (сенсорные, моторные и вегетативные);
- фокальные (мультифокальные)/асимметричные нейропатии (мононейропатии, множественные мононейропатии, плексопатии, радикулопатии и краниальные нейропатии).
Наиболее частый вариант поражения периферической нервной системы при СД – дистальная симметричная сенсомоторная нейропатия. Обычно данное осложнение возникает спустя несколько лет от начала основного заболевания. Эта форма ДН развивается медленно (хронически), первые симптомы (онемение и парестезии) появляются в нижних конечностях, иногда унилатерально. Дистальная симметричная сенсомоторная нейропатия является причиной развития хронического нейропатического болевого синдрома (около 15% больных ДН). При этой форме нейропатии поражаются слабо миелинизированные и тонкие немиелинизированные волокна в различных комбинациях; в большинстве случаев в начале заболевания неврологический дефицит обусловлен поражением тонких волокон. Симптомы их поражения проявляются нестерпимыми жгучими или стреляющими болями, гипералгезией, парестезиями и дизастезиями, нарушением болевой и температурной чувствительности, ульцерацией стоп и снижением болевой перцепции со стороны внутренних органов. Больные СД испытывают как спонтанные, так и вызванные различными раздражителями боли. В процессе обследования таких пациентов необходимо дифференцировать гипералгезию (избыточная чувствительность к болевым стимулам) и аллодинию (боль, вызванная неболевым фактором).
С поражением миелинизированных (толстых) волокон связано нарушение глубокой и вибрационной чувствительности, снижение или выпадение сухожильных рефлексов.
Вегетативные нарушения у пациентов, страдающих СД, обычно проявляются в сочетании с другим неврологическим дефицитом, но могут быть представлены изолированно от других симптомов. Автономная ДН рассматривается как наиболее потенциально опасное осложнение диабета. К сожалению, вегетативная недостаточность часто остается нераспознанной. В зависимости от ведущего синдрома выделяют кардиальную, урогенитальную, желудочно-кишечную (диабетический гастропарез) и трофическую формы автономной ДН. Наиболее частый симптом – сфинктерная дисфункция, проявляющаяся недостаточностью сфинктера или атонией мочевого пузыря, диареей, особенно в ночное время, и импотенцией.
Частыми симптомами периферической вегетативной недостаточности также являются тахикардия, ортостатическая гипотензия, отеки стоп и суставов, сухость кожных покровов. Доминирование этих признаков характерно для наиболее опасной формы автономной нейропатии – кардиальной. 25–50% больных умирают через 5–10 лет после диагностики кардиальной вегетативной нейропатии.
В результате нарушения симпатического и парасимпатического контроля работы сердца у пациентов с автономной нейропатией наблюдается феномен, получивший название «фиксированный пульс»: различные физические нагрузки (вставание, ходьба и т.д.) не сопровождаются адекватным изменением частоты сердечных сокращений при четко выраженной тенденции к тахикардии в покое.
Грозным симптомом ДН является ортостатическая гипотензия – нарушение регуляции сосудистого тонуса на фоне расстройств функционирования автономной нервной системы, проявляющееся выраженным снижением артериального давления (АД) при длительном пребывании больного в вертикальном положении или при переходе из горизонтального положения в вертикальное. Клиницисты часто оставляют без внимания ортостатические изменения АД у пациента, в то время как именно с ними связаны жалобы на головокружение. Основными осложнениями кардиальной формы нейропатии являются «денервированное сердце», безболевой или малосимптомный инфаркт миокарда, аритмии, ведущие к «синдрому внезапной смерти».
Диагностика ДН в фазе манифестации клинических симптомов обычно не представляет каких-либо затруднений. Согласно определению ДН, диагноз может быть установлен еще на доклиническом этапе, на основании параклинических находок. Именно ранняя доклиническая диагностика важна для успешного лечения заболевания. Традиционный неврологический осмотр выявляет бессимптомную нейропатию у 30% пациентов. Более детальное обследование, включающее количественное сенсорное тестирование и электрофизиологическое исследование скорости проведения импульса по нервам, позволяет выявить нейропатию у 30–40% больных из числа тех, у которых не были отмечены отклонения в неврологическом статусе при традиционном осмотре. К сожалению, в клинической практике больным СД редко проводится электрофизиологическое тестирование. Тем не менее каждый клиницист должен стремиться, по крайней мере, мониторировать неврологический статус больного СД.
Патогенез ДН
Механизм развития ДН сложен и полностью не изучен, но большинство ученых сходятся во мнении, что основным звеном патогенеза данного осложнения СД является неудовлетворительный контроль гликемии. Повышение уровня глюкозы приводит к нескольким значимым последствиям:
- активируется полиоловый путь утилизации глюкозы, приводящий к накоплению сорбитола и истощению запасов мио-инозитола, что способствует снижению активности натрий-калиевой АТФазы;
- нарушается функция микрокапилляров эндоневрия и возникает их гипоксия вследствие инактивации оксида азота;
- накапливаются конечные продукты усиленного гликозилирования, которые, связываясь со специфическими рецепторами нейронов, вызывают оксидативный стресс и способствуют накоплению нуклеарного фактора каппа-B (НФ-κB).
Данные ряда исследований позволяют сделать вывод, что вещества, способные изменять уровень НФ-κB, также способствуют увеличению концентрации активных форм кислорода, а защитная реакция организма в виде повышенной экспрессии антиоксидантных белков может, в свою очередь, приводить к угнетению активации НФ-κB.
Немаловажным звеном патогенеза ДН является активация протеинкиназы С (РКС). В норме РКС активируется благодаря повышению концентрации диацилглицерола (ДАГ), поэтому гипергликемия также способствует активации РКС, особенно ее изоформы бета-2, благодаря синтезу ДАГ de novo. Вследствие активации РКС-бета-2 нарушается кровоток в эндоневрии. Современные исследования показали, что активация РКС приводит к увеличению определенной популяции калиевых каналов, которые играют важную роль в восприятии боли. Существенное значение в патогенезе ДН имеет нарушение метаболизма кальция, необходимого для активации РКС.
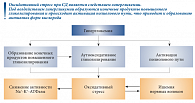
Следует отметить, что все вышеперечисленные патологические процессы приводят к ишемии и активации перекисного окисления липидов (рис. 1) [1].
На экспериментальной модели гипергликемии у мышей была продемонстрирована ассоциация ДН со снижением скорости кровотока в нервах на 50%. Таким образом, гипоксия эндоневрия является вторичной по отношению к дефициту кровотока и повышению резистентности сосудов. Влияние гипергликемии проявляется уменьшением образования оксида азота, что, в свою очередь, приводит к нарушению тонуса сосудов, уменьшению кровотока в нервных волокнах и гипоксии эндоневрия. При недостатке кислорода нервные волокна могут функционировать благодаря анаэробному гликолизу. Реализация этого процесса приводит к активации полиолового пути, что влечет увеличение концентрации сорбитола и снижение уровня мио-инозитола. Сорбитол сам по себе не обладает нейротоксичностью, следовательно, его аккумуляция не является ведущим звеном в патогенезе нейропатии, однако параллельное уменьшение концентрации мио-инозитола напрямую связано с возникновением нейропатии. Каким именно образом активация полиолового пути влияет на уровень мио-инозитола, до конца не выяснено, но известно, что гипергликемия может уменьшать содержание мио-инозитола в нервной ткани, так как повышенный уровень глюкозы полностью препятствует его захвату периферическими нервными волокнами, блокируя как осмотический, так и неосмотический пути поступления.
Роль оксидативного стресса в патогенезе ДН изучена наиболее подробно. Оксидативный стресс, вызванный гипергликемией, индуцирует запрограммированную гибель клеток, что способствует развитию ДН. Было проведено исследование, которое продемонстрировало снижение частоты апоптоза у животных, которые получали антиоксидант таурин. Результаты другого исследования показали увеличение числа клеток дорсальных нервных ганглиев, подвергшихся апоптозу при добавлении глюкозы.
Лечение ДН
Учитывая разнообразие этиопатогенетических механизмов возникновения ДН, найти универсальное средство, способное облегчить страдания больных, представляется весьма сложной задачей.
В основе повреждения нервных волокон лежат нарушения метаболизма глюкозы. Длительное поддержание нормогликемии у больных с выраженными проявлениями ДН приводит к задержке прогрессирования деструктивных процессов в периферических нервах, но не способствует быстрой ликвидации симптомов заболевания. Именно поэтому еще одним стратегическим направлением терапии является воздействие на известные звенья патогенеза и дополнительные факторы, влияющие на течение нейропатии. Эти мероприятия включают применение витаминов группы В, назначение вазоактивных препаратов, антиоксидантную терапию. Поскольку при диабете наблюдается дефицит ацетил-L-карнитина, назначение этого вещества может скорректировать последствия изменений концентрации мио-инозитола и оксида азота. Ацетил-L-карнитин улучшает регенерацию нервных волокон и нивелирует симптомы, особенно боль, у пациентов с манифестной формой ДН.
Важную роль в лечении ДН играют препараты альфа-липоевой кислоты (АЛК). В экспериментальных исследованиях было показано, что АЛК нормализует активность натрий-калиевой АТФазы. Наблюдения за ретинальными клетками продемонстрировали, что вследствие активации натрий-калиевой АТФазы улучшается захват миo-инозитола периферическими нервными волокнами благодаря влиянию на Na+/мио-инозитолко-транспортер. АЛК влияет на утилизацию глюкозы, дополнительно активируя полиоловый путь, а также участвует в регуляции цикла Кребса. Эти свойства АЛК, равно как и ее способность увеличивать активность пируватдегидрогеназы и альфа-кетоглутарата в различных клетках, требуют дополнительного изучения.
АЛК увеличивает уровень глутатиона, который ниже у пациентов с СД по сравнению с людьми без нарушения метаболизма углеводов. Глутатион – один из важнейших эндогенных антиоксидантов, вместе с липоевой кислотой он играет основную роль в окислительно-восстановительных реакциях повреждения клетки. АЛК способна поглощать свободные липидные радикалы в периферической нервной ткани, таким образом препятствуя образованию активных форм кислорода. Увеличение концентрации глюкозы способствует образованию конечных продуктов повышенного гликозилирования. Этот процесс получил название аутооксидативного гликозилирования. Он считается одной из основных причин повышения содержания активных форм кислорода и угнетения антиоксидантных систем. Кроме того, повышение уровня фруктозы, образующейся за счет активации полиолового пути, приводит к образованию предшественников конечных продуктов повышенного гликозилирования. Уникальность АЛК как антиоксиданта обусловлена ее способностью:
- напрямую элиминировать свободные радикалы;
- участвовать в регенерации эндогенных антиоксидантов (глутатион, витамины Е и С);
- угнетать образование свободных радикалов благодаря металлохелатной активности.
АЛК обладает еще одним дополнительным свойством: она стимулирует образование фактора роста нервной ткани и способствует регенерации нервных волокон. Исследование влияния АЛК на двигательные и чувствительные нервные волокна, подвергающиеся оксидативному стрессу, является на сегодняшний день первоочередной задачей. Известно, что АЛК положительно влияет на двигательные волокна и защищает периферические чувствительные волокна от ишемии.
Естественная форма АЛК состоит из R-изомера, а ее синтетическая форма представляет собой рацемическую смесь двух изомеров: R- и S-формы. R-форма участвует в утилизации глюкозы, S-форма обладает лучшим аффинитетом к глутатион-редуктазе. Таким образом, АЛК оказывает влияние сразу на несколько патогенетических механизмов формирования ДН. В 1990-х гг. проведены основополагающие исследования эффективности и безопасности АЛК в лечении ДН в соответствии с требованиями доказательной медицины. В первом крупном исследовании – ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy), проведенном в Германии, – оценивалась эффективность и безопасность трех различных доз АЛК. Исследование включало 328 больных СД 2 типа. Пациенты получали внутривенно 1200 мг, 600 мг, 100 мг АЛК или плацебо в течение трех недель. Снижение выраженности клинических симптомов на 30% и более наблюдалось у 71% пациентов, получавших 1200 мг АЛК в сутки; у 82% больных, получавших 600 мг АЛК в сутки; у 65% участников, получавших 100 мг АЛК в сутки; у 58%, получавших плацебо. В исследовании ALADIN II анализировались результаты лечения 65 пациентов, получавших таблетированную форму АЛК в дозе 600 мг/день или 1200 мг/день или плацебо в течение более двух лет. Результаты исследования продемонстрировали убедительные доказательства клинического улучшения у больных нейропатией. Для определения степени выраженности ДН применялась общая шкала симптомов TSS (Total Symptom Score), позволявшая оценить интенсивность и частоту основных проявлений нейропатии (стреляющая боль, жжение, онемение и парестезии) в течение последних 24 часов. На основании этих результатов был разработан дизайн исследования ALADIN III, в ходе которого проверялась гипотеза об эффективности короткого курса внутривенного введения АЛК с последующим длительным пероральным приемом препарата для лечения ДН [2]. Пациенты получали 600 или 1200 мг АЛК в день в течение трех недель с последующим приемом таблетированной формы 1800 мг/день в течение шести месяцев. Результаты исследования продемонстрировали устойчивую тенденцию к уменьшению болевого синдрома, но не достигли статистической достоверности.
Исследование ORPIL (Oral Pilot), в котором пациенты с СД 2 типа получали АЛК в дозе 1800 мг/день, показало достоверное улучшение эндоневральной функции после трех недель лечения [3].
Благодаря рандомизированному двойному слепому плацебоконтролируемому исследованию SYDNEY (Symptomatic Diabetic NEuropathY Trial), проведенному в России, было доказано влияние АЛК на сенсорные симптомы ДН. В исследовании участвовали пациенты с компенсированным диабетом, осложненным сенсомоторной нейропатией, которые получали внутривенно 600 мг АЛК или плацебо пять дней в неделю (всего 14 вливаний) [4]. После лечения наблюдался значимый регресс симптомов по шкале TSS: общая сумма баллов уменьшилась на 5,7 пунктов в группе активного лечения по сравнению с группой плацебо (на 1,8 пунктов; p < 0,001). Помимо быстрого уменьшения выраженности сенсорных симптомов наблюдалась редукция процессов дегенерации нервных волокон. Проанализировав результаты приведенных исследований, авторы пришли к выводу, что АЛК может успешно использоваться для лечения нарушений чувствительности при ДН.
Еще одним осложнением диабета, в отношении лечения которого изучалась эффективность АЛК, является кардиоваскулярная автономная нейропатия (обнаруживается как минимум у 25% пациентов, страдающих СД). Эта форма ДН характеризуется нарушением вариабельности сердечного ритма и ассоциирована с повышением риска смерти пациентов с диабетом. В этой связи интерес представляет исследование DEKAN (Deutsche Kardiale Autonome Neuropathie), в ходе которого проводилась оценка эффективности четырехмесячного курса АЛК по 800 мг/день на кардиоваскулярную автономную нейропатию. По окончании исследования было показано улучшение показателей вариабельности сердечного ритма на фоне терапии АЛК по сравнению с плацебо. Таким образом, получены доказательства преимущества долговременного курса пероральных форм АЛК для лечения диабетической сенсомоторной нейропатии (600–1800 мг/день) и кардиальной автономной нейропатии (800 мг/день).
Кроме того, была оценена эффективность комбинированного курса АЛК (600 мг/день внутривенно в течение 10 дней с последующим приемом таблетированной формы препарата – 600 мг/день в течение 50 дней) у пациентов с различными формами автономной нейропатии [5]. Авторы отмечали регресс симптомов диабетической энтеропатии, уменьшение жалоб на головокружение/неустойчивость в вертикальном положении, улучшение сексуальной функции. В контрольной группе не наблюдалось изменений интенсивности симптомов со стороны вегетативной нервной системы. Результаты исследования позволили сделать вывод, что АЛК эффективна в лечении различных форм диабетической автономной нейропатии.
В 2004 г. были опубликованы данные метаанализа, базирующегося на четырех рандомизированных плацебоконтролируемых исследованиях (ALADIN I, ALADIN III, SYDNEY, NATHAN II), суммарно включающих свыше 1000 больных. Метаанализ убедительно показал, что уже после 3 недель внутривенного введения АЛК в дозе 600 мг положительный эффект наблюдался более чем у 50% больных [6]. Улучшение отмечалось в отношении как нейропатических симптомов, так и неврологического дефицита. Это весьма обнадеживающие данные, поскольку неврологический дефицит является главным фактором риска развития ульцерации стоп.
Ежедневный пероральный прием АЛК в дозе 600 мг показал оптимальное соотношение безопасности/эффективности (клиническое исследование SYDNEY 2) [7]. При приеме препарата в суточной дозе 1200 мг умеренная тошнота возникала у 21% пациентов, что оказалось выше, чем в клинических исследованиях ALADIN I (у 15% больных) и ALADIN II (в 7% случаев), в которых применялась такая же доза АЛК. Таким образом, постмаркетинговые наблюдения подтвердили высокий профиль безопасности АЛК [8].
Результаты проведенных клинических исследований позволили сформировать алгоритм лечения больных СД, осложненным ДН, путем внутривенного введения АЛК. Лечение начинают с внутривенного введения препарата в разовой дозе 600 мг в течение 14–15 дней, в дальнейшем применяют таблетированные формы АЛК.
У российских клиницистов накоплен богатый опыт использования АЛК при ДН. Следует отметить, что в настоящее время в России доступны отечественные и зарубежные инъекционные и таблетированные препараты АЛК. Тем не менее на выбор оптимального средства терапии влияют не только медицинские, но и экономические факторы. Высокая стоимость лечения, как правило, не обеспечивает достаточной комплаентности пациентов: немногие больные согласятся длительно принимать дорогостоящий препарат, эффект от лечения которым не наступает мгновенно (курс лечения в среднем составляет 3 месяца и более).
Эта проблема может быть решена благодаря препаратам-генерикам. Доказано, что препарат Октолипен биоэквивалентен оригинальному препарату АЛК. При этом Октолипен, выпускаемый по европейским стандартам качества, доступен большинству пациентов, поскольку стоимость его значительно ниже по сравнению с оригинальным препаратом. Таким образом, большее число больных может получить эффективное патогенетическое лечение ДН.
Высокий уровень приверженности лечению – один из ключевых моментов в лечении ДН, так как от длительности проводимого курса терапии во многом зависит ее эффект и, как следствие, качество жизни
больного. В рамках последнего, самого продолжительного контролируемого исследования NATHAN-1 с участием больных ДН было доказано, что АЛК в дозе 600 мг/сутки, принимаемая в течение 4 лет, способна клинически значимо снизить нейропатический дефицит [6].
Отдельного внимания заслуживает симптоматическое лечение, в основном направленное на коррекцию болевого синдрома, сопутствующего сенсорной нейропатии. Подходы к лечению нейропатической боли в настоящее время достаточно хорошо разработаны. Как правило, последовательно или одномоментно используют антиконвульсанты (прегабалин, габапентин, окскарбазепин, карбамазепин, препараты вальпроевой кислоты) и антидепрессанты (трициклические антидепрессанты и антидепрессанты двойного действия – дулоксетин, венлафаксин). Перечисленные препараты не оказывают влияния на механизмы развития ДН, но эффективны для купирования отдельных клинических проявлений заболевания.
Таким образом, генерические препараты АЛК, среди которых особое место занимает Октолипен, выпускаемый в соответствии с европейскими стандартами качества, эффективны, безопасны и обеспечивают высокий уровень приверженности больных лечению ДН, поскольку стоимость этих препаратов значительно ниже, а эффект сопоставим с таковым оригинального препарата.
1. Vallianou N., Evangelopoulos A., Koutalas P. Alpha-lipoic acid and dia- betic neuropathy // Rev. Diabet. Stud. 2009. Vol. 6. No 4. P. 230–236.
2. Ziegler D. et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter rando- mized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-Lipoic Acid in Diabetic Neuropathy // Diabetes Care. 1999. Vol. 22. No 8. P. 1296–1301.
3. Ruhnau K.J. et al. Effects of 3-week oral treatment with the antioxidant thioctic acid (alpha-lipoic acid) in symptomatic diabetic polyneuropa- thy // Diabet. Med. 1999. Vol. 16. No 12. P. 1040–1043.
4. Ametov A.S., Barinov A., Dyck P.J., Hermann R., Kozlova N., Litchy W.J., Low P.A., Nehrdich D., Novosadova M., O'Brien P.C., Reljanovic M., Samigullin R., Schuette K., Strokov I., Tritschler H.J., Wessel K., Yakhno N., Ziegler D.; SYDNEY Trial Study Group. The sensory symp- toms of diabetic polyneuropathy are improved with alpha-lipo- ic acid: the SYDNEY trial // Diabetes Care. 2003. Vol. 26. No 3. P. 770–776.
5. Yadav V., Marracci G., Lovera J., Woodward W., Bogardus K., Marquardt W., Shinto L., Morris C., Bourdette D. Lipoic acid in multiple sclerosis: a pilot study // Mult. Scler. 2005. Vol. 11. No 2. P. 159–165.
6. Ziegler D., Nowak H., Kempler P., Vargha P., Low P.A. Treatment of symptomatic diabetic polyneuropathy with the antioxidant al- pha-lipoic acid: a meta-analysis // Diabet. Med. 2004. Vol. 21. No 2. P. 114–121.
7. Ziegler D., Ametov A., Barinov A., Dyck P.J., Gurieva I., Low P.A., Mun- zel U., Yakhno N., Raz I., Novosadova M., Maus J., Samigullin R. Oral treatment with alpha-lipoic acid improves symptomatic diabetic poly- neuropathy: the SYDNEY 2 trial // Diabetes Care. 2006. Vol. 29. No 11. P. 2365–2370.
8. Ziegler D. Thioctic acid for patients with symptomatic diabetic poly- neuropathy: a critical review // Treat. Endocrinol. 2004. Vol. 3. No 3. P. 173–189.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.