Клинические маски диабетической нейропатии
- Аннотация
- Статья
- Ссылки
- English



Одной из глобальных медицинских и социально-экономических проблем мирового сообщества является сахарный диабет (СД). Распространенность этого хронического заболевания в популяции достигает 10%, существенно увеличиваясь с возрастом [1, 2]. Распространенность нарушения углеводного обмена (предиабет) в пять раз превышает распространенность СД, что способствует дальнейшему росту заболеваемости [3]. Согласно прогнозам экспертов Международной федерации диабета (International Diabetes Federation – IDF), уже к 2030 г. число пациентов с СД будет составлять 552 млн, к 2040 г. – 642 млн [4].
СД является классическим примером междисциплинарной проблемы в клинической практике, поскольку при этом заболевании наблюдается широкий спектр разнообразных патологических процессов в целом ряде органов и систем организма в результате нарушения метаболических процессов, обусловленных гипергликемией, в первую очередь поражение периферической нервной системы на разных уровнях: от спинномозговых корешков до тонких нервных волокон [5], проявляющееся как изолированно, так и в сочетании с другими хроническими осложнениями СД.
Диабетическая нейропатия представляет собой комплекс полиморфных клинических и субклинических синдромов, характеризующихся очаговым или диффузным поражением волокон периферической и/или автономной нервной системы в результате метаболических, сосудистых и других нарушений, сопутствующих СД, и имеет характерные проявления и течение. Это самое частое осложнение СД, приводящее к нарушению трудоспособности, выраженной дезадаптации, ранней инвалидизации и смерти больных. По данным разных исследований [1, 2, 5, 6], частота диабетических нейропатий среди больных СД варьируется от 25 до 90% в зависимости от используемых критериев диагностики и методологии обследования, в том числе применения электрофизиологических методов и исследования вегетативных функций. Частота встречаемости диабетической нейропатии прогрессивно нарастает по мере увеличения тяжести и длительности СД, возраста пациентов и выраженности гипергликемии. Следует отметить, что на момент установления диагноза у четверти пациентов с СД уже наблюдаются клинические проявления поражения нервной системы. Нередко диабетическая нейропатия развивается за несколько лет до клинической манифестации основного заболевания.
Существуют разные варианты диабетических нейропатий, отличающиеся полиморфными проявлениями, патогенетическими механизмами, клиническим течением, реакцией на проводимое лечение и прогнозом (табл. 1) [7]. Надо отметить, что при СД могут отмечаться нейропатии недиабетического генеза, в частности хроническая воспалительная демиелинизирующая полинейропатия или острая болевая нейропатия волокон малого диаметра (индуцированная лечением) [7]. В зависимости от клинического течения диабетические нейропатии подразделяют на острые и хронические (табл. 2) [1, 8].
В повседневной клинической практике у пациентов с СД чаще всего выявляется хроническая дистальная сенсомоторная полинейропатия. Согласно оценке экспертов IDF, в 2015 г. частота ее встречаемости достигала 30–40 млн [4]. У больных отмечаются чувствительные, двигательные и вегетативно-трофические нарушения, преимущественно в нижних конечностях, причем доминируют именно сенсорные расстройства в виде нейропатической боли, онемения и разнообразных парестезий. Это обусловлено более ранним поражением тонких миелинизированных и немиелинизированных волокон и значительно более поздним и менее выраженным вовлечением в патологический процесс крупных миелинизированных волокон, а также преимущественно аксональным поражением [7, 9]. Сенсорный дефицит может колебаться от легких, выявляемых только при дополнительном обследовании, до тяжелых афферентных расстройств, сочетающихся с двигательными нарушениями. При этом может наблюдаться как безболевой вариант с минимальной клинической симптоматикой и постепенным развитием сенсомоторного дефицита, так и болевой вариант развития диабетической нейропатии, который нередко сочетается с признаками дисфункции вегетативной нервной системы и может носить острый или хронический характер с чередованием периодов ремиссии и обострений.
У пациентов с недавно диагностированным СД или плохо контролируемым уровнем глюкозы может развиться транзиторная гипергликемическая полинейропатия, которая достаточно быстро регрессирует после восстановления эугликемии [10]. Следует подчеркнуть, что повторные эпизоды выраженной и длительной гипогликемии на фоне неадекватной терапии инсулином способны приводить к возникновению сенсомоторной и вегетативной полинейропатии у пациентов с СД [7].
Значительно меньший процент случаев приходится на острые сенсорные нейропатии, дебютирующие с нестерпимой жгучей боли в дистальных отделах конечностей, чаще в области стоп, в отсутствие чувствительных нарушений или минимальных проявлений при неврологическом осмотре и двигательных расстройств. Болевой синдром самопроизвольно купируется в течение одного-двух лет [11, 12]. В качестве патогенетического фактора развития этого варианта диабетической нейропатии рассматривается резкое колебание уровня гликемии [11].
У пациентов с СД 1 типа наблюдается нейропатия Элленберга, сопровождающаяся значительной потерей веса и развитием депрессии, поражением тонких и вегетативных волокон на фоне кетоацидоза и других признаков декомпенсации заболевания, и острая инсулиновая нейропатия, возникающая после быстрой нормализации уровня глюкозы на фоне адекватной инсулинотерапии, особенно если предшествующий контроль гликемии был неудовлетворительным [11].
Хроническая сенсорная диабетическая нейропатия, напротив, является прогрессирующим необратимым осложнением СД, постепенно развивающимся через несколько лет от начала заболевания. Этот вариант нейропатии, как правило, протекает латентно и диагностируется поздно. Нарушение чувствительности обнаруживается случайно, например при ожоге или травме кожных покровов, развитии язв на стопах в местах наибольшего давления. В дальнейшем отмечаются полиморфные сенсорные расстройства нейропатического характера, в том числе болевой синдром, интенсивность которого значительно варьируется, и синдром беспокойных ног. При последующем прогрессировании патологического процесса к клинической картине добавляются двигательные нарушения в виде мышечной слабости и их постепенной атрофии [12].
К редким формам болевых нейропатий у пациентов с СД относится диабетическая радикулоплексонейропатия, ранее описываемая как диабетическая амиотрофия. Она характеризуется поражением спинномозговых нервов, сплетений и корешков, преимущественно на пояснично-крестцовом уровне [13]. Этот вариант чаще наблюдается у больных старше 60 лет, лиц мужского пола с СД 2 типа и легкими нарушениями углеводного обмена [10]. Через несколько дней или недель после возникновения интенсивного болевого синдрома на передней поверхности бедра или в поясничной области развиваются слабость и атрофия передних мышц бедра и тазового пояса вплоть до утраты способности к самостоятельному передвижению. При этом сенсорные расстройства минимальны либо вообще отсутствуют. Данный вариант диабетической нейропатии отличается благоприятным прогнозом. В течение года болевой синдром регрессирует. Восстановление мышечной силы занимает больший период времени – от нескольких месяцев до нескольких лет. У части пациентов сохраняется резидуальный дефект [10].
Существенно реже наблюдаются фокальные или мультифокальные диабетические нейропатии. Чаще они протекают остро, могут возникать на любой стадии заболевания, в некоторых случаях их тяжесть коррелирует с уровнем гипергликемии [5]. Среди краниальных нейропатий при СД наиболее часто отмечается вариант с поражением глазодвигательного нерва (III), реже отводящего (VI), что приводит к развитию диабетической офтальмоплегии, или других черепно-мозговых нервов [14].
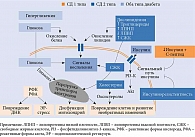
Основными патогенетическими механизмами развития диабетической нейропатии, которые могут сочетаться, являются микроангиопатия, приводящая к ишемическому повреждению нервных волокон и эндотелиальной дисфункции, метаболические расстройства в нейронах и шванновских клетках на фоне накопления нейротоксичного сорбитола и дефицита миоинозитола [5], а также митохондриальная дисфункция, эндоплазматический ретикулярный стресс и развитие необратимых повреждений нейронов (рисунок) [7]. Среди других негативно влияющих факторов указывают оксидативный стресс, гипертриглицеридемию, а также генетические и иммунные факторы [5].
Диагностический скрининг диабетической нейропатии у пациентов с СД необходимо проводить ежегодно независимо от наличия характерных жалоб. Он включает тщательный сбор анамнеза, полноценный неврологический осмотр с исследованием болевой, температурной и вибрационной чувствительности с помощью монофиламента (весом 10 г) и камертона с частотой 128 Гц, а также осмотром стоп, поскольку раннее выявление и дальнейшая адекватная терапия диабетической нейропатии позволяют уменьшить риск развития тяжелых осложнений. Важным диагностическим этапом является тщательное лабораторное обследование для динамического наблюдения за уровнем глюкозы в крови и исключения иных дисметаболических или токсических состояний или заболеваний, своевременная диагностика и коррекция которых может привести к существенному регрессу или значительному уменьшению поражения периферической нервной системы. Для выявления вегетативной недостаточности используют кардиоваскулярные тесты, наиболее чувствительным и простым среди которых признано исследование дыхательной аритмии, когда в процессе регистрации электрокардиограммы больной глубоко вдыхает шесть раз в течение минуты, продолжительность вдоха и выдоха при этом составляет пять секунд. Разница между максимальной (вдох) и минимальной (выдох) частотой сердечных сокращений в норме составляет не менее 10 [10].
К факторам риска развития и прогрессирования диабетической нейропатии при СД помимо возраста, продолжительности заболевания и недостаточного контроля гликемии относят уровень холестерина и триглицеридов, артериальную гипертензию, микрососудистые нарушения и курение [7]. Именно поэтому необходимо также уделять внимание выявлению, коррекции и/или профилактике данных расстройств у больных СД.
Стратегические направления терапии заключаются в лечении СД, включая строгий гликемический контроль, коморбидных заболеваний, коррекции имеющихся факторов риска и соблюдении поведенческих рекомендаций (табл. 3), а также в применении лекарственных средств, влияющих на разные звенья патогенеза диабетической нейропатии и ее симптоматику [15–17].
На сегодняшний день нет убедительных доказательств существования лекарственных средств или методов терапии, которые могли бы предотвратить развитие диабетической нейропатии. Вместе с тем основным условием стабилизации и регресса поражения периферической нервной системы признана нормализация уровня глюкозы в крови, при этом показатель гликозилированного гемоглобина должен быть менее 7% [3]. Особенно важно в этой связи выявлять пациентов с предиабетом и поражением нервных волокон, поскольку ранняя коррекция наиболее эффективна в данной популяции. В частности, в исследовании DCCT с участием более 1000 пациентов с СД 1 типа показано, что на фоне интенсивной инсулинотерапии частота развития нейропатии и микроангиопатий через шесть с половиной лет была на 60% ниже, чем при использовании традиционной терапии инсулином [18]. Аналогичные результаты получены в широкомасштабном исследовании UKPDS с участием более 5000 больных СД 2 типа, уровень глюкозы которых поддерживался ниже 6 ммоль/л. К концу девятого года исследования частота диабетической нейропатии у них была на 16%, а к концу 15-го года – на 40% ниже, чем у пациентов с более высоким уровнем глюкозы (≤ 15 ммоль/л) [18].
Важным патогенетическим направлением терапии диабетической нейропатии является восстановление анатомической целостности и функциональной активности нервного волокна, что напрямую влияет на улучшение проведения нервного импульса и в свою очередь приводит к снижению выраженности симптомов, предотвращает прогрессирование нейропатии и способствует повышению качества жизни пациентов. В качестве патогенетической терапии, направленной на основные механизмы развития диабетической нейропатии, рассматриваются различные препараты. Среди них только α-липоевая, или тиоктовая, кислота доказала эффективность в многочисленных экспериментальных и клинических рандомизированных плацебоконтролируемых исследованиях с уровнем рекомендаций класса А [19–21].
Альфа-липоевая кислота представляет собой естественный метаболит, мощный эндогенный антиоксидант, кофактор важнейших митохондриальных ферментных комплексов, принимающих участие в процессах окислительного метаболизма в условиях нормального функционирования клетки [1, 22].
История открытия α-липоевой кислоты в 1937 г. и ее выделения в 1951 г. связана с именами двух американских биохимиков – E.E. Snell и Lester J. Reed [1]. Впервые в качестве лекарственного средства α-липоевая кислота была использована немецкими клиницистами в 1959 г. для лечения больного с острым отравлением бледной поганкой [1]. Впоследствии они с успехом использовали этот препарат для лечения нейропатической боли у пациентов с СД [23].
В настоящее время доказан большой спектр мультимодальных механизмов действия α-липоевой кислоты [19, 24, 25]:
- прямое влияние на метаболизм глюкозы и липидов (посредством активации транспортеров глюкозы 1 и 4 типов в инсулинозависимых тканях, фосфорилирование тирозиновых остатков инсулиновых рецепторов);
- антиоксидантное действие (элиминация и снижение продукции свободных радикалов, регенерация эндогенных антиоксидантов – глутатиона, витаминов Е и С);
- метаболический эффект (кофермент комплексов окислительного декарбоксилирования пировиноградной и α-кетокислот, активация пируватдегидрогеназы и подавление пируваткарбоксилазы, участие в энергообразовании);
- влияние на эндотелиальную дисфункцию (ингибирование экспрессии молекул межклеточной адгезии, сосудистого эндотелия и адгезии моноцитов к эндотелиоцитам интимы, блокирование активации и поступления в ядро клеток эндотелия транскрипционного ядерного фактора каппа B);
- противовоспалительное действие (снижение уровня интерлейкинов 6 и 17, пролиферации Т-клеток и подавление активности естественных киллеров).
Метаанализ результатов рандомизированных двойных слепых плацебоконтролируемых исследований ALADIN I, II, III, SYDNEY, NATHAN II и др. убедительно продемонстрировал клиническую эффективность α-липоевой кислоты при диабетической полинейропатии в виде существенного уменьшения выраженности неврологического дефицита и значимого улучшения результатов электрофизиологического исследования [19, 26–29]. Важно отметить, что оптимальной терапевтической, клинически эффективной и безопасной суточной дозой α-липоевой кислоты как при парентеральном, так и пероральном применении является доза 600 мг. Внутривенное введение данного лекарственного средства на протяжении двух недель ассоциируется с существенным уменьшением неврологического дефицита, развившегося вследствие сахарного диабета.
Лечение болевого синдрома является необходимым компонентом терапии пациентов с диабетической нейропатией. Оно позволяет восстановить или улучшить функционирование больного и качество его жизни. Полное купирование боли не всегда достижимо, поэтому хорошим результатом считается уменьшение ее выраженности на 50%. К средствам симптоматической терапии с доказанной эффективностью, а также наилучшим соотношением безопасности и переносимости относят антиконвульсанты – модуляторы кальциевых каналов, габапентиноиды (габапентин и прегабалин), антидепрессанты из группы ингибиторов обратного захвата серотонина и норадреналина (дулоксетин и венлафаксин) [7].
При выборе лекарственного средства помимо доказанной эффективности, безопасности и переносимости следует учитывать профиль и возраст пациента, наличие сопутствующих заболеваний, другой терапии и опыта таковой.
Эпидемический рост заболеваемости СД наряду с поздней диагностикой его осложнений, в частности диабетической нейропатии, приводит к ранней дезадаптации, значительному снижению качества жизни и инвалидизации пациентов. Поражение периферической нервной системы может протекать латентно или иметь разнообразные клинические маски, которые не позволяют клиницистам вовремя обнаружить диабетическую нейропатию и своевременно применять патогенетические лекарственные средства в соответствии с уровнем доказательности имеющихся рекомендаций – α-липоевую кислоту, что является стратегически важным у пациентов с СД, особенно при необходимости более длительного восстановления и рецидивирующем течении диабетической нейропатии.
E.V. Ekusheva, MD, PhD, Prof.
Academy of Postgraduate Education under the Federal State Budgetary Institution Federal State Budgetary Unit ‘Federal Scientific and Clinical Center for Specialized Medical Assistance and Medical Technologies of the Federal Medical-Biological Agency’
Contact person: Eugeniya V. Ekusheva, ekushevaev@mail.ru
Diabetes mellitus (DM) is a widespread chronic disease in which a wide range of various pathological processes are observed in a number of organs and systems of the body as a result of metabolic disorders caused by hyperglycemia. Diabetic neuropathy is the most common complication of DM. The epidemic increase in the incidence of DM along with the late diagnosis of its complications, in particular, diabetic neuropathy, leads to early maladaptation, a significant decrease in the quality of life and disability of these patients. Damage to the peripheral nervous system can occur latently or have a variety of clinical masks that do not allow clinicians to detect diabetic neuropathy in time and use pathogenetically based drugs in time in accordance with the level of evidence of the available recommendations – α-lipoic or thioctic acid, which is strategically important in treatment of patients with DM, especially patients with longer recovery and especially with a relapsing course of diabetic neuron patii.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.