Диабетическая автономная нейропатия: современные подходы к диагностике и лечению
- Аннотация
- Статья
- Ссылки
- English
На сегодняшний день доказано, что кардиальная автономная нейропатия сопряжена с повышением риска развития острого инфаркта миокарда и смерти пациентов с СД. Другие проявления патологии, такие как гастропарез, диарея, эректильная дисфункция, значимо снижают качество жизни больных.Ранняя диагностика автономных нарушений у лиц с СД имеет большое значение для своевременного назначения патогенетической терапии. Альфа-липоевая кислота эффективна как в отношении улучшения вариабельности сердечного ритма, так и в отношении ортостатической гипотензии.
На сегодняшний день доказано, что кардиальная автономная нейропатия сопряжена с повышением риска развития острого инфаркта миокарда и смерти пациентов с СД. Другие проявления патологии, такие как гастропарез, диарея, эректильная дисфункция, значимо снижают качество жизни больных.Ранняя диагностика автономных нарушений у лиц с СД имеет большое значение для своевременного назначения патогенетической терапии. Альфа-липоевая кислота эффективна как в отношении улучшения вариабельности сердечного ритма, так и в отношении ортостатической гипотензии.
Введение
Распространенность сахарного диабета (СД) во всем мире неуклонно возрастает. Согласно данным экспертов, в 2019 г. СД был диагностирован у 425 млн человек [1].
Сахарный диабет приводит к развитию ряда осложнений, среди которых наиболее частыми являются соматическая и автономная диабетические полинейропатии [2].
Различные формы нейропатий наблюдаются почти у половины пациентов с СД [3]. Поражение автономных волокон встречается у 60% страдающих СД более 15 лет [4].
Диабетическая автономная полинейропатия (ДАП) длительное время может протекать бессимптомно, поэтому редко диагностируется специалистами. Это негативно сказывается на прогнозе [5]. Так, поражение автономных волокон при СД признано независимым фактором риска развития инфаркта миокарда и внезапной сердечной смерти, что обусловливает снижение продолжительности жизни пациентов [6].
Настороженность врачей в отношении ДАП, своевременная ее диагностика и грамотное лечение являются основополагающими для улучшения качества жизни пациентов с СД.
Клинические формы
Поражение автономной нервной системы, которая осуществляет регуляцию витальных функций и поддержание гомеостаза, приводит к вариабельности клинической картины [7].
В зависимости от клинической картины выделяют следующие формы ДАП [1, 5, 7]:
- кардиальная автономная нейропатия (КАН);
- гастроинтестинальная автономная нейропатия (ГАН);
- урогенитальная автономная нейропатия (УАН);
- судомоторная и вазомоторная автономная нейропатия;
- нарушение зрачковых реакций;
- бессимптомная гипогликемия, возникающая вследствие поражения симпатических волокон и исчезновения симпатоадреналовой реакции.
Кардиальная автономная невропатия
Кардиальная автономная невропатия является одним из частых осложнений СД и сопряжена с увеличением сердечно-сосудистой заболеваемости и смерти [8, 9].
Для КАН характерно поражение автономных нервных волокон, которые иннервируют сердце и кровеносные сосуды, что приводит к нарушению функции сердечной мышцы и неадекватным сосудистым реакциям [10].
К факторам риска развития КАН относятся пожилой возраст, отсутствие контроля гликемии, курение, гипертоническая болезнь и дислипидемия [11, 12]. Среди основных симптомов КАН указываются тахикардия покоя, постуральная ортостатическая тахикардия, снижение вариабельности сердечного ритма, брадикардия, снижение толерантности к физической нагрузке, ортостатическая гипотензия, безболевая ишемия и инфаркт миокарда, аритмия, интра- и послеоперационная сердечно-сосудистая нестабильность [5]. Воспаление и оксидативный стресс рассматривают как предикторы ухудшения течения КАН [13, 14]. Стоит также отметить, что с КАН ассоциированы низкие уровни витаминов В12 и D [15, 16].
Клинические проявления КАН зависят от стадии заболевания. В настоящее время выделяют субклиническую и клиническую стадии КАН.
Самым ранним симптомом субклинической стадии является снижение вариабельности сердечного ритма. На этой стадии также выявляются снижение чувствительности к барорефлексу и мышечная дистония левого желудочка сердца, определяемая с помощью визуализационных методов исследования [17]. Клиническая стадия диагностируется при преобладании симпатической активности, что проявляется снижением толерантности к физическим нагрузкам и тахикардией покоя. На ранних этапах клинической стадии частота сердечных сокращений (ЧСС) находится в пределах 90–130 ударов в минуту [18]. Отсутствие изменений ЧСС во время сна, при стрессе или физической нагрузке свидетельствует о полной утрате симпатической иннервации и наблюдается на поздних этапах КАН [18, 19]. По мере прогрессирования КАН более очевидными становятся симптомы ортостатической гипотензии: ощущение дурноты, головокружения (без чувства вращения предметов), появляющиеся при переходе из горизонтального положения в вертикальное из-за резкого снижения уровня артериального давления (АД) [20]. Именно ортостатическая гипотензия является наиболее инвалидизирующим симптомом и наблюдается у 6–32% пациентов с СД [18, 21].
Гастроинтестинальная автономная нейропатия
В основе патогенеза ГАН лежит поражение ганглиев и вегетативных парасимпатических волокон в стенках желудка и кишечника [10].
Клинические симптомы ГАН можно разделить на пищеводные (дисфагия, рефлюкс/изжога), желудочные (тошнота, рвота, раннее насыщение, вздутие живота, боль или дискомфорт в эпигастрии), кишечные (диарея, запор и недержание кала) [22].
Проявления ГАН в различных сочетаниях встречаются у 50% пациентов с СД [5].
Рефлюкс-эзофагит при ГАН вызван снижением давления в нижнем пищеводном сфинктере вследствие дисрегуляции его парасимпатической иннервации [22]. Гастропарез является одним из наиболее частых проявлений ГАН и характеризуется дисфункцией блуждающего нерва. В последних исследованиях показано, что данное осложнение имеет место не только при неконтролируемом прогрессирующем течении СД, но и при легком течении. Очевидно, что гастропарез не является фактором, ухудшающим прогноз у пациентов с СД [23, 24]. Однако замедленное опорожнение желудка при СД может приводить к гипогликемии, что подтверждает необходимость своевременной диагностики ГАН. Необъяснимые скачки гликемии, тошнота, рвота, раннее чувство насыщения, боли в эпигастрии могут натолкнуть на мысль о наличии автономной гастропатии [25].
Диарея при СД объясняется не только поражением автономных волокон, но и вторичным бактериальным обсеменением, ферментативной недостаточностью и нарушением полостного и пристеночного пищеварения [26]. Диарея характеризуется безболезненным, профузным опорожнением кишечника, преимущественно в ночное время [22]. При этом диабетическая диарея представляет собой диагноз исключения. В частности, следует помнить, что ряд гипогликемических средств вызывают диарею, включая метформин (мальабсорбтивный механизм), ингибиторы альфа-глюкозидазы, например акарбоза (осмотический механизм), и агонисты рецепторов глюкагоноподобного пептида 1 [27].
Урогенитальная автономная нейропатия
К проявлениям УАН относятся дисфункция мочевого пузыря, эректильная дисфункция, ретроградная эякуляция и диспареуния. Симптомы в различной комбинации могут наблюдаться у 50% больных СД [28].
Нарушение мочеиспускания характеризуется большим спектром симптомов, таких как учащенное болезненное мочеиспускание, императивные позывы на мочеиспускание, неполное опорожнение мочевого пузыря, никтурия, атония мочеточников и мочевого пузыря, рефлюкс и стаз мочи [29]. Данные нарушения впоследствии нередко приводят к развитию инфекций мочевыводящих путей.
Судомоторная и вазомоторная автономная нейропатия
Периферическая симпатическая холинергическая система регулирует потоотделение и терморегуляцию. Дисфункция периферических вегетативных волокон вызывает отеки, расширение вен, выпадение ногтей, волос, сухость кожи и слизистых оболочек, нарушение потоотделения.
Судомоторная автономная нейропатия считается одним из ранних проявлений ДАП, для которой типично развитие симметричного дистального гипо-, гипер- или ангидроза, что способствует образованию язв на стопах и синдрома Шарко [30, 31].
Нарушение зрачковых реакций
Среди зрачковых нарушений у пациентов с СД отмечены уменьшение диаметра зрачка, снижение и исчезновение спонтанных осцилляций зрачка, замедление реакции зрачка на свет, нарушение сумеречного зрения. Такие изменения обнаруживаются у 23–59% страдающих СД [32].
Острая болевая нейропатия, вызванная лечением сахарного диабета
В последнее время в качестве причины автономных нарушений при СД все больше обсуждается роль сахароснижающих препаратов.
Нейропатия, вызванная лечением СД, представляет собой ятрогенную болевую сенсорную и автономную нейропатию.
Распространенность острой болевой нейропатии, ассоциированной с лечением СД, составляет 10% среди всех пациентов с диабетической полинейропатией [33].
Нейропатия, возникшая вследствие лечения СД, связана со снижением уровня гликированного гемоглобина (HbA1c) на 2% и более, а также с короткими сроками компенсации СД у лиц с длительной гипергликемией [34]. Снижение уровня HbA1c более чем на 5% ассоциировано с увеличением риска развития острой болевой нейропатии более чем на 90% [35]. Хотя основным клиническим проявлением данной формы нейропатии является нейропатическая боль, одновременно наблюдается развитие автономной дисфункции [33]. Характерными автономными проявлениями нейропатии являются ортостатическая гипотензия с обмороками, вздутие живота после приема пищи, гипер- и ангидроз, эректильная дисфункция [35].
Патогенетические основы
На данный момент времени патофизиология ДАП остается не до конца изученной.
Известно, что гипергликемия и дислипидемия негативно воздействуют на аксоны нервных клеток, спинальные ганглии, дорсальные корешки спинномозговых нервов и шванновские клетки. В этом процессе задействовано множество механизмов, включая активацию полиолового пути утилизации глюкозы, оксидативный стресс, активацию протеинкиназы C и образование конечных продуктов гликирования [36]. Гипергликемия в сочетании с сосудистыми факторами риска активирует данные механизмы, что приводит к повреждению сосудистого эндотелия нервных клеток и их аксонов [37]. Однако в последнее время основное внимание при СД 2 уделяется дислипидемии и повышенному содержанию триацилглицеринов как источника неэтерифицированных жирных кислот (НЭЖК). НЭЖК катаболизируются путем бета-окисления, приводя к накоплению ацетил-коэнзима А и его превращению в токсичный ацилкарнитин, который способствует аксональной дегенерации. Окисление липопротеинов низкой плотности индуцирует образование активных форм кислорода, что приводит к метаболическому и оксидативному стрессу. Появляется все больше доказательств того, что измененный метаболизм сфинголипидов при СД 2 типа коррелирует с образованием атипичных нейротоксичных дезоксисфинголипидов, которые также обусловливают повреждение нервов [38].
COVID-19 и автономные нарушения
Новая коронавирусная инфекция оказывает значимое негативное влияние на течение СД [39].
Подтверждена также связь между инфицированием SARS-CoV-2 и появлением и прогрессированием автономной нейропатии. В частности, указывалось на 27 случаев развития автономной нейропатии после перенесенной коронавирусной инфекции [40]. Американское медицинское сообщество также выделило синдром постковидной постуральной тахикардии, в основе которого лежит чрезмерная ортостатическая тахикардия (увеличение ЧСС более чем на 30 ударов в минуту у взрослых в течение 10 минут после принятия вертикального положения) [41, 42].
Диагностика
Для диагностики ДАП прежде всего необходимо провести тщательный опрос пациента, затрагивающий все возможные проявления патологии. Так, КАН можно заподозрить при таких симптомах, как головокружение, слабость, сердцебиение, обмороки [13].
Для скрининга автономных нарушений за рубежом используется COMPASS-31 (COMPosite Autonomic Symptom Score) [43]. На настоящий момент времени данная шкала не валидизирована в Российской Федерации.
При клиническом обследовании в первую очередь необходимо оценить реакцию зрачков на свет с помощью фонарика и окраску кожных покровов, измерить АД и ЧСС.
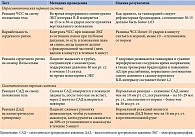
При диагностике судомоторной автономной нейропатии в качестве золотого стандарта используют CARTs (Cardiac Autonomic Reflex Tests). CARTs включают в себя измерение автономных реакций посредством изменений вариабельности ЧСС и АД с помощью различных маневров. Тесты для оценки симпатической и парасимпатической иннервации сердца и сосудов представлены в таблице [11]. Данные тесты являются эффективными инструментами при диагностике КАН, однако их применение на амбулаторном приеме затруднительно. Существует ряд более простых проб, которые можно провести как в условиях стационара, так и в условиях амбулатория. Например, тест на вариабельность сердечного ритма можно проводить с помощью пульсоксиметра, а при подозрении на ортостатическую гипотензию использовать тест Шеллонга (ортостатическую пробу). Пациента просят лечь на спину, спокойно находиться в таком положении в течение 5 минут и измеряют АД и ЧСС в покое, затем пациента просят встать и проводят повторное измерение АД и ЧСС через 1, 3 и 5 минут. Снижение АД ≥ 20/10 мм рт. ст. по сравнению с АД в положении лежа свидетельствует об ортостатической гипотензии [44, 45].
Для диагностики КАН также применяются инструментальные методы исследования, такие как R-R-кардиоинтервалография и позитронная эмиссионная томография с 123I-метайодбензилгуанидином или 11C-метагидроксиэфедрином [11].
Инструментальные методики используются и для диагностики других видов ДАП. При ГАН информативны сцинтиграфия пищевода и желудка, дыхательный тест с октановой кислотой, меченной стабильным изотопом 13С (для диагностики гастропареза), аноректальная манометрия (для оценки тонуса сфинктера), импедансное суточное рН-мониторирование, рентгеноскопия с контрастированием бариевой взвесью, колоноскопия и магнитно-резонансная томография [22, 26]. Для диагностики УАН используют уродинамическое исследование, ультразвуковое исследование мочевого пузыря с определением остаточной мочи [5].
Кроме того, следует отметить такие методы, как исследование вызванных кожных симпатических потенциалов, QSART (Quantitative Sudomotor Axon Reflex Test), TST (Thermoregulatory Sweat Testing). Они оценивают симпатическую холинергическую функцию и являются методами ранней диагностики судомоторной дисфункции [5].
Лечение
В основе современного подхода к лечению ДАП лежат контроль гликемии, изменение образа жизни, использование патогенетических и симптоматических препаратов [1].
Как обсуждалось выше, гипергликемия играет ведущую роль в патогенезе ДАП, поэтому на первом месте по значимости стоит компенсация СД. Полностью компенсированная гликемия не гарантирует отсутствия ДАП, но снижает риск ее прогрессирования [46]. В исследовании DCCT/EDIC интенсивный контроль гликемии при СД 1 типа на начальном этапе снижал частоту развития КАН более чем на 50% [47].
Контроль уровня глюкозы является единственным методом, модифицирующим течение ДАН, поскольку неконтролируемый СД приводит к выраженному оксидативному стрессу, который регрессирует при достижении контроля над заболеванием.
Патогенетическая терапия. Снизить выраженность оксидативного стресса можно с помощью антиоксидантной терапии. Самый известный антиоксидант – альфа-липоевая кислота (АЛК) доказала свою эффективность в отношении оксидативного стресса у пациентов с диабетической полинейропатией в нескольких рандомизированных контролируемых исследованиях [5, 36].
АЛК действует как хелатообразующий агент металлов. Она связывает свободные радикалы и восстанавливает эндогенные антиоксиданты, такие как глутатион, витамины С и Е. Более того, она способна повышать уровень глутатиона внутри клеток, которые хелатируют и выводят из организма широкий спектр токсинов, особенно токсичных металлов [48].
Таким образом, АЛК – это биологический антиоксидант, который является как водорастворимым, так и жирорастворимым и способен нейтрализовать активные формы кислорода в организме, внутри и снаружи клеток. По этой причине АЛК называют универсальным антиоксидантом [49].
В многочисленных контролируемых клинических исследованиях показано, что АЛК является наиболее эффективным патогенетическим препаратом при диабетической полинейропатии.
Эффективность внутривенного введения АЛК в течение 15 дней подтверждена в многочисленных клинических исследованиях (ALADIN, ALADIN III, SYDNEY I и NATHAN II), а также в одном метаанализе. Согласно рекомендациям европейских экспертов, при лечении диабетической полинейропатии АЛК имеет уровень доказательности А [50].
У больных диабетической полинейропатией при назначении АЛК улучшаются как позитивная нейропатическая симптоматика (ощущение боли, жжения, онемения и парестезий) согласно TSS (Total Symptom Score), так и негативная симптоматика (снижение чувствительности всех модальностей, рефлексов на ногах и силы мышц ног), а также результаты электронейромиографии.
Согласно результатам проведенных исследований, назначение препаратов АЛК приводит к уменьшению выраженности симптомов автономной нейропатии. Так, в исследовании DEKAN на фоне применения АЛК в дозе 800 мг/сут в течение четырех месяцев выявлено статистически значимое увеличение вариабельности ЧСС по сравнению с приемом плацебо (р < 0,05) [51].
G.L. Murray и соавт. изучали эффективность таблетированной формы АЛК в лечении ортостатической гипотензии [52]. Положительные изменения в ортостатической пробе наблюдались у 19 (66%) из 29 пациентов с ортостатической гипотензией (при измерении АД в положении стоя результат пробы изменился с -28/-6 до 0/+2 мм рт. ст. относительно положения лежа). Аналогичная закономерность выявлена у лиц с ортостатической интолерантностью. У 40 (67%) из 60 пациентов уменьшились скачки АД при смене положения тела. Так, при измерении АД в положении стоя результат пробы изменился с -9/+6 до +6/+2 мм рт. ст. относительно положения лежа. Уровень глюкозы при этом снизился у 28% пациентов с СД [52].
Однако при ДАН наиболее целесообразным представляется внутривенное введение АЛК ввиду возможного наличия у пациентов синдрома мальабсорбции, затрудняющего всасывание препарата, с последующим переходом на пероральный прием.
Рекомендуемая схема назначения АЛК: начальная терапия в дозе 600 мг внутривенно капельно в течение 15 дней, поддерживающая терапия в дозе 600 мг/сут (две таблетки по 300 мг) в течение двух – шести месяцев. Таблетированную форму препарата следует принимать за 30 минут до еды.
Симптоматическая терапия ДАН подбирается индивидуально. Так, при тахикардии покоя успешно используются селективные бета-блокаторы [19].
Ортостатическая гипотензия, связанная с тяжелой формой КАН, требует симптоматического лечения. Нефармакологические методы лечения включают физические упражнения, такие как сидение на корточках, медленное изменение позы, и коррекцию образа жизни: отказ от тяжелой пищи, богатой углеводами, увеличение потребления жидкости [53]. Уменьшить выраженность проявлений ортостатической гипотензии также могут ношение компрессионного белья и высокое изголовье. При неэффективности немедикаментозной терапии назначают флудрокортизон в дозе 0,1–0,2 мг/сут с постоянным контролем АД в положении стоя [20].
Все проявления ГАН успешно поддаются симптоматическому лечению. Лечение диабетического гастропареза включает в себя частые приемы пищи маленькими порциями предпочтительно в полужидком виде вместе с прокинетическими средствами (метоклопрамидом). Рекомендуется диета с низким содержанием клетчатки и жиров. Необходимо избегать газированных напитков и жевательной резинки. При диабетической диарее не рекомендуется метформин. Лоперамид используется по мере необходимости. Лечение гастроэзофагеальной рефлюксной болезни наряду с немедикаментозными методами предполагает применение ингибиторов протонной помпы и прокинетических средств [2, 54].
Начальное лечение диабетической дисфункции мочевого пузыря состоит в отмене лекарств, которые снижают активность детрузора (антихолинергические средства, трициклические антидепрессанты и антагонисты кальциевых каналов).
Препаратами первой линии для лечения эректильной дисфункции при диабете являются ингибиторы фосфодиэстеразы 5, такие как силденафил [5].
Заключение
Диабетическая автономная нейропатия – частое, но редко диагностируемое осложнение СД.
На сегодняшний день доказано, что КАН сопряжена с повышением риска острого инфаркта миокарда и смерти пациентов с СД. Другие проявления ДАН, такие как гастропарез, диарея, эректильная дисфункция, значимо снижают качество жизни больных.
Своевременная диагностика автономных нарушений у лиц с СД позволяет как можно раньше начать патогенетическую терапию, особое место в которой занимает АЛК.
Эффективность АЛК доказана как в отношении улучшения вариабельности сердечного ритма, так и в отношении ортостатической гипотензии. При автономных нарушениях предпочтительна ступенчатая терапия – внутривенные инфузии препарата с последующим переходом на пероральный прием.
L.T. Akhmedzhanova, PhD, Ye.V. Mandra, A.V. Peretechikova, O.A. Solokha, PhD, Ye.A. Chernysheva
N.V. Sklifosovskiy Institute of Clinical Medicine
I.M. Sechenov First Moscow State Medical University
Contact person: Luiza T. Akhmedzhanova, luiziana78@mail.ru
Diabetic autonomic neuropathy is a frequent but rarely diagnosed complication of diabetes mellitus (DM). Low detectability is due to the fact that the disease has been asymptomatic for a long time.
To date, it has been proven that cardiac autonomic neuropathy is associated with the increased risk of acute myocardial infarction and death of patients with DM. Other manifestations of pathology, such as gastroparesis, diarrhea, erectile dysfunction, significantly reduce the quality of life of patients.
Early diagnosis of autonomic disorders in people with DM is of great importance for the timely appointment of pathogenetic therapy.
Alpha-lipoic acid is effective both in improving heart rate variability and in treating orthostatic hypotension.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.