Диагностика и лечение первичного гиперпаратиреоза
- Аннотация
- Статья
- Ссылки

Введение
Первичный гиперпаратиреоз (ПГПТ) – это заболевание околощитовидных желез, которое характеризуется избыточной секрецией паратиреоидного гормона (ПТГ) с развитием синдрома гиперкальциемии. В последнее время частота выявления ПГПТ возросла в связи с улучшением диагностики этого заболевания и большей информированностью врачей различных специальностей, сталкивающихся с костными и висцеральными осложнениями ПГПТ. Наиболее часто ПГПТ диагностируется у женщин в возрасте старше 55 лет. Мужчины в значительно меньшей степени подвержены этому заболеванию. По данным Эндокринологического диспансера Департамента здравоохранения г. Москвы, среди 156 пациентов, у которых впервые был выявлен ПГПТ, – 154 женщины и 2 мужчин. Примерно в 80–85% случаев развитие гиперпаратиреоза обусловлено аденомой одной из четырех околощитовидных желез (ОЩЖ), в 10–15% случаев причиной ПГПТ является гиперплазия одной или нескольких ОЩЖ или множественные аденомы [1].
В 20% случаев отмечается эктопическое расположение аденомы ОЩЖ с локализацией в переднем средостении, перикарде, в позадипищеводном пространстве. Карцинома ОЩЖ выявляется в 3% случаев, рецидивирует в 20% случаев и, как правило, характеризуется более выраженной гиперкальциемией и более высоким уровнем ПТГ по сравнению с аденомой ОЩЖ. Объем образования при аденокарциноме, как правило, превышает 10 мл. Необходимо учитывать, что гиперпаратиреоз, обусловленный аденомой или гиперплазией ОЩЖ, может быть частью синдрома множественных эндокринных неоплазий (МЭН): МЭН 1 (синдром Вермера) и МЭН 2А (синдром Сипла). При синдроме МЭН 1 ПГПТ сочетается с множественными образованиями других эндокринных желез: в 70% случаев с опухолями передней доли гипофиза (преимущественно пролактиномы), в 40% – с объемными образованиями поджелудочной железы (инсулинома, гастринома) [2]. В 90% случаев ПГПТ является первым проявлением МЭН-синдрома, который длительное время протекает бессимптомно. В связи с этим необходимо тщательное обследование пациентов с гиперпаратиреозом для исключения МЭН-синдрома или выявления всех возможных его проявлений. Синдром МЭН 2А – редкое заболевание, передающееся аутосомно-доминантным путем и характеризующееся гиперплазией ОЩЖ, развитием медуллярного рака щитовидной железы и феохромоцитомы.
Патогенез клинических проявлений гиперпаратиреоза
Основными органами-мишенями, которые поражаются при ПГПТ, являются желудочно-кишечный тракт (ЖКТ), костно-мышечная, мочевыделительная и сердечно-сосудистая системы. Поражение костно-мышечного аппарата является результатом как прямого, так и опосредованного действия избытка ПТГ на костную ткань. Прямое действие на костную ткань связано с непосредственным участием ПТГ в процессах дифференцировки и пролиферации остеокластов. Под действием высвобождаемых остеокластами лизосомных ферментов и водородных ионов происходят растворение и деградация костного матрикса. Усиленная резорбция костной ткани преобладает над процессами ее формирования и приводит к развитию остеопороза [3]. Опосредованное действие ПТГ на костную ткань связано с его влиянием на почечные канальцы. ПТГ уменьшает реабсорбцию фосфатов в почечных канальцах, что приводит к фосфатурии, снижению уровня фосфата в плазме крови и мобилизации кальция из костей [4].
Как правило, больные предъявляют жалобы на мышечную слабость, боли в костях, частые переломы, уменьшение роста за время заболевания. Выраженность остеопоротических изменений в костях позвоночника варьирует от незначительной деформации вплоть до компрессионных переломов. Наибольшие изменения обнаруживаются в костях, имеющих кортикальное строение (дистальный отдел лучевой кости и проксимальный отдел бедренной кости). Гиперпаратиреоидные остеодистрофии, образующиеся в результате усиленной резорбции как предшествующих, так и новообразованных костных структур, являются причиной низкотравматичных переломов [5].
Основной причиной развития висцеральных нарушений на фоне ПГПТ является гиперкальциемия. У 50% больных с ПГПТ наблюдаются заболевания ЖКТ с развитием пептических язв желудка и двенадцатиперстной кишки, что связано с увеличением секреции гастрина и соляной кислоты в условиях гиперкальциемии. Течение язвенной болезни у пациентов с ПГПТ сопровождается тошнотой, рвотой, анорексией, болью в эпигастральной области [6]. Пациенты с ПГПТ часто подвержены депрессивным состояниям. При уровне кальция в крови выше 3,0 ммоль/л возникает чувство недомогания и сонливости, при уровне кальция более 3,5 ммоль/л возможно развитие психоза [7].
ПГПТ сопровождается нарушением функции почек и проявляется инсипидарным синдромом. Повышенная экскреция кальция с мочой приводит к снижению чувствительности почечных канальцев к антидиуретическому гормону, что проявляется в снижении почечной реабсорбции воды и концентрационной способности почек. Рецидивирующая мочекаменная болезнь (МКБ) встречается более чем у 60% пациентов с ПГПТ. Длительно протекающая гиперкальциемия приводит к развитию нефрокальциноза и как следствие – к снижению скорости клубочковой фильтрации и развитию хронической почечной недостаточности (ХПН) [5].
При легком течении ПГПТ у пациентов выявляют структурные изменения коронарных сосудов при отсутствии симптомов поражения сердечно-сосудистой системы. При более тяжелом течении ПГПТ поражение сердечно-сосудистой системы сопровождается кальцификацией коронарных артерий и клапанов сердца, гипертензией, гипертрофией левого желудочка. Артериальная гипертензия выявляется при ПГПТ в 15–50% случаев. Наряду с гиперкальциемией в механизме развития артериальной гипертензии участвуют повышение содержания внутриклеточного кальция, увеличение активности ренина плазмы, гипомагниемия, а также снижение скорости клубочковой фильтрации с развитием ХПН [8, 9].
Диагностика и лечение различных форм ПГПТ
Лабораторная диагностика ПГПТ основывается на неоднократном определении повышенного уровня ПТГ в плазме крови и гиперкальциемии. У пациентов с ПГПТ наблюдается также снижение уровня неорганического фосфора в крови, повышение суточной экскреции кальция и фосфора с мочой [10]. Топическую диагностику локализации аденомы околощитовидной железы проводят с помощью ультразвукового исследования (УЗИ). Информативность этого метода исследования может достигать 95%, но при массе железы менее 0,5 г она снижается до 30%. УЗИ ОЩЖ малоинформативно и при атипичной локализации аденомы (медиастинальная область, позадипищеводное пространство).
Для более детальной топической диагностики аденомы проводится сцинтиграфия ОЩЖ с использованием Технетрила 99мTc. По данным ряда авторов, чувствительность метода при аденоме ОЩЖ достигает 100%, а при гиперплазии ОЩЖ – 75%. В случае если при проведении сцинтиграфии аденома ОЩЖ не визуализируется или результаты УЗИ расходятся с данными сцинтиграфии, проводится мультиспиральная компьютерная томография (МСКТ) органов средостения и шеи. При отрицательных результатах МСКТ пациентам с высоким уровнем кальция и ПТГ при наличии костных и висцеральных осложнений проводится оперативное вмешательство с ревизией всех зон возможного расположения ОЩЖ и интраоперационным определением уровня ПТГ для подтверждения радикальности удаления аденомы ОЩЖ [6].
Для выявления костных осложнений ПГПТ используется двухэнергетическая рентгеновская абсорбциометрия дистального отдела лучевой кости, поясничного отдела позвоночника, проксимальных отделов бедренных костей. Необходимость включения в исследование дистального отдела лучевой кости обусловлена значительным снижением минеральной плотности костной ткани в этой области при ПГПТ. При тяжелом манифестном течении ПГПТ рентгенологическое исследование позволяет выявить тяжелые костные нарушения: кистозно-фиброзную остеодистрофию, субпериостальную резорбцию костной ткани. Для выявления висцеральных осложнений ПГПТ проводят эзофагогастродуоденоскопию (ЭГДС), УЗИ почек. Скорость клубочковой фильтрации (СКФ) рассчитывается по формуле Кокрофта – Голта. Диагноз ПГПТ ставится по результатам проведенного обследования с обязательным указанием формы заболевания: асимптомная, мягкая или манифестная. Мягкая форма ПГПТ диагностируется в следующих случаях:
- уровень кальция в сыворотке крови превышает верхнюю границу нормы не более чем на 0,25 ммоль/л;
- отсутствуют висцеральные проявления ПГПТ;
- по результатам денситометрии минеральная плотность кости (МПК) по Т-критерию снижена не более чем на 2,5 стандартных отклонения (SD);
- в анамнезе отсутствуют указания на низкотравматичные переломы [10].
Лечение пациентов с мягкой, малосимптомной формой ПГПТ с остеопенией без переломов в анамнезе, как правило, консервативное. Всем пациентам рекомендуется диета с ограничением употребления кальция до 800 мг в сутки и увеличением потребления жидкости [11]. Для лечения костных осложнений ПГПТ назначают препараты из группы бисфосфонатов. Препараты на основе алендроновой кислоты принимаются 1 раз в неделю в дозе 70 мг. Препараты на основе ибандроновой кислоты назначают в дозе 150 мг 1 раз в месяц либо 1 раз в 3 месяца в виде инъекций 3 мг. Препараты на основе золедроновой кислоты принимаются в дозе 5 мг в/в капельно 1 раз в 12 месяцев. Динамическое наблюдение проводится с интервалом в 6 месяцев и включает контроль ПТГ, общего и ионизированного кальция, креатинина, суточной экскреции кальция с мочой. Каждые 12 месяцев проводят УЗИ ОЩЖ, почек, денситометрию [12–14]. При прогрессировании мочекаменной болезни (МКБ), развитии остеопороза и возникновении низкотравматичных переломов, а также при отрицательной динамике лабораторных показателей (повышение уровня кальция и ПТГ в сыворотке крови) рекомендовано оперативное лечение [10]. Манифестная форма ПГПТ может быть диагностирована в следующих случаях:
- уровень общего кальция в крови повышен более чем на 0,25 ммоль/л от верхней границы нормы;
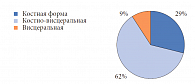
- имеются костные, висцеральные или костно-висцеральные осложнения ПГПТ (остеопороз, МКБ, нефрокальциноз, язвенная болезнь желудка или двенадцатиперстной кишки).
При выявлении манифестной формы ПГПТ рекомендовано оперативное лечение. Объем операции: удаление паратиромы или гиперплазированных околощитовидных желез, при выявлении карциномы ОЩЖ – паратиреоидэктомия. Послеоперационным осложнением ПГПТ является стойкая или транзиторная гипокальциемия. В связи с этим пациенты длительное время нуждаются в приеме активных метаболитов витамина D (альфакальцидол, кальцитриол) и препаратов кальция. В послеоперационном периоде средняя доза альфакальцидола может составлять 1,75 мкг/сут, средняя доза кальция – до 2000 мг/сут. При стойкой нормокальциемии дозы препаратов постепенно снижают до поддерживающих – 1,0–1,5 мкг активных метаболитов витамина D и 1000 мг кальция в сутки [6]. Хирургическое лечение и прием в послеоперационном периоде активных метаболитов витамина D и препаратов Са приводит к достоверному снижению показателей костного метаболизма и повышению МПК в течение 12 месяцев.
Консервативное ведение пациентов с манифестной формой ПГПТ проводится при наличии противопоказаний к хирургическому лечению: это тяжелые сопутствующие заболевания, рецидивирующее течение гиперпаратиреоза. Манифестная форма ПГПТ сопровождается высоким уровнем кальция в крови. В связи с этим пациентам по жизненным показаниям назначается препарат из группы кальцимиметиков – цинакалцета гидрохлорид (Мимпара) [15, 16]. Действие препарата основано на повышении чувствительности кальций-чувствительных рецепторов, расположенных в клетках паращитовидных желез, к внеклеточному кальцию, что приводит к уменьшению выработки ПТГ. Снижение концентрации ПТГ сопровождается снижением содержания кальция в сыворотке крови. Начальная доза препарата составляет 30 мг 2 раза в сутки с последующим титрованием дозы каждые 2–4 недели до достижения целевого уровня кальция. Максимальная доза препарата – 90 мг 4 раза в сутки. Препарат принимается перорально, с приемом пищи или сразу после. Доза препарата титруется под контролем уровней общего и ионизированного кальция, ПТГ, креатинина, экскреции кальция и фосфора с мочой [17, 18].
Пациентам с манифестной формой ПГПТ, имеющим тяжелые костные осложнения, для предотвращения дальнейшей потери костной массы и снижения риска переломов назначается антирезорбтивная терапия препаратами из группы бисфосфонатов (БФ). Бисфосфонаты представляют собой аналоги неорганических пирофосфатов. Фосфатные группы бисфосфонатов имеют две основные функции: связь с клеточным минералом и клеточно-опосредованную антирезорбтивную активность [19]. Основная клетка-мишень для бисфосфонатов – остеокласт. При попадании в остеокласт путем эндоцитоза БФ воздействуют на мевалонатный путь – блокируют фермент фарнезилпирофосфатсинтазу, что приводит к торможению модификации сигнальных белков, необходимых для нормальной функции остеокласта, и снижению его резорбтивной активности [20, 21]. В Эндокринологическом диспансере Департамента здравоохранения г. Москвы с 2010 г. под наблюдением находятся 38 пациентов (37 женщин, 1 мужчина) с диагнозом «первичный гиперпаратиреоз, манифестная форма». Средний возраст пациентов – 70 лет.
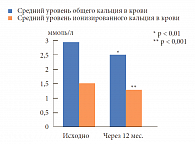
По результатам проведенной денситометрии у 78% пациентов был диагностирован остеопороз. Среди них у 34% пациентов – остеопороз тяжелого течения, с множественными переломами в анамнезе. Пациенты этой группы имели противопоказания к оперативному вмешательству. С учетом гиперкальциемии и высокого уровня ПТГ всем 38 пациентам был назначен цинакалцет (Мимпара) в дозе 30–90 мг в сутки в зависимости от уровня кальция в крови. На фоне лечения уже через месяц отмечалось снижение среднего уровня общего кальция в крови с 2,91 до 2,68 ммоль/л (р < 0,079), через 12 месяцев лечения – 2,53 ммоль/л (р < 0,001) (норма 2,2–2,75 ммоль/л). Отмечалось также уменьшение среднего уровня ионизированного кальция с 1,5 до 1,27 ммоль/л (р < 0,001) через 3 месяца. Через 12 месяцев лечения средний уровень ионизированного кальция составил 1,3 ммоль/л (р < 0,001) (норма 0,98–1,30 ммоль/л). Результаты лечения представлены на рисунке 2.
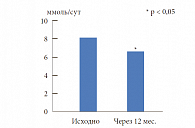
Лечение цинакалцетом позволило не только снизить уровень кальция в крови в течение первого месяца лечения, но и, что наиболее важно, поддерживать нормальный уровень кальция в крови в течение всего периода наблюдения. Средний уровень ПТГ исходно составлял 20,48 пмоль/л, через 12 месяцев лечения – 19,15 пмоль/л (р = 0,7). Динамика уровня кальция в суточной моче представлена на рисунке 3. Поскольку у подавляющего большинства больных с манифестной формой ПГПТ был выявлен остеопороз, 20 пациентам дополнительно была назначена антирезорбтивная терапия препаратом из группы бисфосфонатов (алендроновая кислота 70 мг в неделю; ибандроновая кислота 150 мг в месяц или 3 мг в/в 1 раз в 3 месяца; золедроновая кислота 5 мг 1 раз в 12 месяцев). Через 12 месяцев лечения отмечалась положительная динамика показателей минеральной плотности кости. Наибольшая активность этих процессов наблюдалась в трабекулярных костях. За весь период лечения не было отмечено новых переломов (табл. 1). Таким образом, цинакалцет (Мимпара) является препаратом выбора в терапии пациентов с ПГПТ, имеющих противопоказания к оперативному лечению. Включение в терапию бисфосфонатов позволяет улучшить качество костной ткани и снизить риск возникновения новых переломов.
