Гиперкальциемия как актуальная междисциплинарная проблема: вопросы диагностики и терапии
- Аннотация
- Статья
- Ссылки
- English

Гиперкальциемия, представляющая собой частое и потенциально опасное для жизни нарушение минерального обмена, встречается у 1–4% населения, особенно часто среди женщин старше 60 лет [1–3]. Это состояние может проявляться разнообразными клиническими симптомами – от легких и незначительных или даже с полным их отсутствием при хронической гиперкальциемии до угрожающих, таких как гиперкальциемическая кома при значительном повышении уровня кальция (Ca) в крови [2, 4]. Чаще всего гиперкальциемия является случайной находкой, когда в ходе биохимического анализа крови, проведенного по другим причинам, обнаруживается повышенный уровень общего кальция [3, 4]. Для правильной интерпретации причин повышения сывороточной концентрации кальция, проведения дифференциальной диагностики и выбора оптимальной лечебной стратегии необходимо глубокое понимание физиологических механизмов регуляции его обмена.
Регуляция обмена кальция в норме
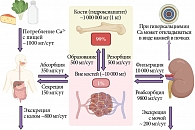
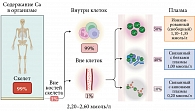
Кальций – один из самых распространенных элементов в человеческом организме, играющий ключевую роль во многих физиологических и биохимических процессах. Во взрослом организме содержится около 1000–1500 мг кальция, 99% которого находится в костях скелета в виде кристаллов гидроксиапатита (депо кальция в организме) и 1% – во внутриклеточном (0,99%), а также во внеклеточном (0,1%) пространствах (рис. 1) [1, 2, 5].
В сыворотки крови Ca находится в нескольких формах: 50% – в связанной с белками форме (преимущественно с альбуминами, общий кальций), 40% – в ионизированном состоянии (Ca2+) и 10% – в комплексах с малыми поливалентными анионами (рис. 2) [1]. Биологические эффекты кальция зависят от величины физиологически активной свободной формы – Ca2+. Концентрация Ca2+ находится в обратной зависимости от уровня рН крови, в частности, повышение ее кислотности приводит к увеличению содержания Ca2+, тогда как защелачивание – к его снижению [2, 4].
Механизмы, участвующие в поддержании физиологической концентрации Ca2+, регулируют его абсорбцию в желудочно-кишечном тракте, экскрецию и реабсорбцию в почках, обменные процессы в костной ткани. Основная роль в регуляции гомеостаза кальция, фосфата, витамина D и метаболизма костной ткани отводится паратиреоидному гормону (1–84), или паратгормону (ПТГ), который вырабатывается и секретируется паращитовидными железами (ПЩЖ). Физиологические эффекты гормона реализуются при связывании с собственным рецептором в почках и костной ткани (ПТГ1-Р) [1, 6, 7]. Установлено, что ПЩЖ плода начинают функционировать уже на 12-й неделе беременности. В течение дня и вечера уровень ПТГ остается относительно стабильным, после чего он увеличивается примерно на 50%, достигая максимальных значений к 02.00. Далее происходит его снижение, и к 09.00 уровень ПТГ оказывается на 50% меньше дневных показателей [8].
Период полувыведения циркулирующего ПТГ составляет от двух до четырех минут. При этом он выводится преимущественно через печень и почки. Суммарное воздействие ПТГ на ключевые органы-мишени приводит к повышению концентрации кальция и снижению уровня фосфатов в крови. Из-за короткого периода полураспада (приблизительно две минуты) интактного ПТГ (1–84) его эффекты, направленные на повышение уровня кальция в крови, быстро нивелируются при достижении нормальной концентрации кальция [2, 3].
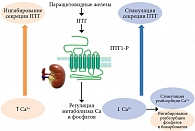
Концентрация Ca2+ в сыворотке крови является основным модулятором секреции ПТГ и функции ПЩЖ через кальций-чувствительные рецепторы (CaSR), представляющие собой поверхностный клеточный белок, располагающийся преимущественно на поверхности клеток околощитовидных желез и почечных канальцев (рис. 3) [2, 3, 8, 9]. Важным стимулом для секреции ПТГ является гипокальциемия. Нормализация уровня кальция в крови достигается за счет стимуляции высвобождения этого макроэлемента из костей и его реабсорбции почками в дистальных канальцах [7–9]. Паратиреоидный гормон также стимулирует активность 1α-гидроксилазы в проксимальных канальцах почек, усиливая синтез 1,25-дигидроксихолекальциферола, или кальцитриола (1,25(OH)2D), активного метаболита витамина D, который в свою очередь увеличивает всасывание кальция в кишечнике и оказывает воздействие на секрецию ПТГ на уровне ПЩЖ [9, 10]. Паратгормон также снижает почечную реабсорбцию фосфатов в проксимальных канальцах, а в дистальных почечных канальцах увеличивает экскрецию фосфора и бикарбонатов, тем самым снижая уровень фосфатов в сыворотке крови, интенсифицирует почечный клиренс и объем выделяемой мочи [1, 6, 9].
Итак, ПТГ оказывает на почки комплексное влияние, которое заключается в усилении реабсорбции кальция в дистальных канальцах нефрона, увеличении экскреции фосфатов и бикарбонатов, а также в повышении скорости клубочковой фильтрации и объема выделяемой мочи. Кроме того, ПТГ стимулирует активность 1α-гидроксилазы, фермента, участвующего в образовании активной формы витамина D [9, 10].
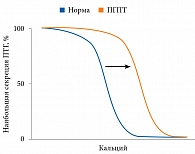
В случае первичного гиперпаратиреоза (ПГПТ) происходит сбой в механизме обратной связи между ПТГ и Ca2+ (рис. 4) [11]. Гиперсекреция ПТГ может быть обусловлена либо снижением чувствительности клеток ПЩЖ к нормальному уровню кальция в крови, либо абсолютным увеличением массы и количества секретирующих клеток и/или уменьшением количества CaSR [5, 11].
Паратгормон непосредственно влияет на кости, используя их в качестве источника Ca для быстрого восстановления баланса с внеклеточной жидкостью [1, 7, 9]. Благодаря этим четким регуляторным механизмам уровень Ca2+ в крови поддерживается в сыворотке в узком физиологическом диапазоне [1, 6, 9]. В физиологических условиях ПТГ обладает двунаправленным воздействием на костную ткань (парадокс паратиреоидного гормона). Он способен активировать как образование, так и резорбцию кости. Тем самым ПТГ может обеспечивать сопряжение анаболических и катаболических процессов, баланс процессов образования и резорбции кости, что необходимо для обновления костной ткани, которая находится под постоянной механической нагрузкой [8, 9]. Постоянное воздействие этого гормона связано с активностью остеокластов (ОК), периодическое – со стимуляцией функции остеобластов (ОБ) и улучшением плотности костной ткани. Это свойство гормона в настоящее время используется в клинической практике для лечения остеопороза. Опыт применения аналогов ПТГ при осуществлении динамического контроля за биомаркерами новообразования кости и ее резорбции позволил установить в действии гормона на кость наличие так называемого анаболического окна [6, 8].
В костях ПТГ оказывает непосредственное воздействие на ОБ и опосредованное на ОК, на которых отсутствуют ПТГ1-Р, через модуляцию активности клеток остеобластического ряда [6, 7, 9]. Паратгормон усиливает секрецию ОБ инсулиноподобного фактора роста 1 и ряда цитокинов, вызывающих пролиферацию и дифференцировку предшественников ОК [8, 9]. Стимуляцию остеокластической активности ПТГ осуществляет опосредованно через колониестимулирующий фактор макрофагов 1 и лиганд рецептора-активатора ядерного фактора каппа-β (RANKL), что усиливает остеокластогенез. Данный лиганд дополнительно влияет на активацию зрелых ОК. В результате происходят пролиферация и дифференцировка ОК, а также активация остеокластической резорбтивной способности. Зрелые ОК участвуют в резорбции кальция и фосфора из кости для поддержания их концентрации в сыворотке крови. В ОБ и остеоцитах ПТГ активирует Wnt-сигнальный путь, который повышает экспрессию остеопротегерина. Последний препятствует мобилизации, пролиферации и активации ОК, тем самым блокируя резорбцию кости в необходимый момент [6, 8, 9].
При ПГПТ наблюдается постоянная стимуляции ОБ паратгормоном, приводящая к повышенной секреции RANKL и ингибированию образования остеопротегерина. Итогом являются избыточная активация ОК и нарушение баланса между процессами образования и резорбции кости, что приводит к снижению костной массы и повышению риска переломов [11].
Помимо ПТГ важным компонентом регуляции минерального метаболизма признан витамин D [4, 10, 11]. Витамин D представляет собой жирорастворимую молекулу. Его концентрация в организме здорового взрослого человека колеблется от 0,3 до 1,0 мкг/сут. Ввиду многообразных биологических эффектов витамина D, проявляющихся посредством взаимодействия со специфическими ядерными рецепторами (VDR), которые представлены во многих органах и тканях, он получил название D-гормона [12–14]. Этот витамин поступает в организм с пищей (20%) в виде эргокальциферола (D2). Однако большая его доля (D3) синтезируется в верхних слоях кожи из 7-дигидрохолестерина под воздействием ультрафиолетового излучения [14, 15]. При дефиците витамина D содержание ПТГ в сыворотке крови обычно возрастает.
Физиологические эффекты витамина D проявляются после цепи метаболических реакций. Его активация происходит путем гидроксилирования в положении C25 ферментными системами печени и почек. В печени с помощью мембранного фермента системы цитохрома P450 2R1 происходит преобразование в промежуточную транспортную форму 25-гидроксивитамин D3 (25(ОН)D), или кальцидол, – основную циркулирующую форму витамина D [16]. Определение концентрации 25(ОН)D в сыворотке крови используется для оценки статуса витамина D [13, 17].
В результате последующего 1α-гидроксилирования в почках при участии фермента 1α-гидроксилазы кальцидол превращается в биологически активную форму – 1,25-дигидроксивитамин D3 (1,25(OH)2D), способную связываться с VDR [16]. Этот процесс стимулируется ПТГ. Глюкокортикоиды, кальцитриол, фактор роста фибробластов 23 подавляют активность 1α-гидроксилазы, а гипофосфатемия, напротив, усиливает [16, 18, 19].
Паратгормон и D-гормон взаимодействуют по системе обратной связи. Паратгормон является основным стимулятором синтеза витамина D в почках, в то время как D-гормон оказывает отрицательное воздействие на секрецию ПТГ. Активация VDR кальцитриолом увеличивает экспрессию CaSR в ПЩЖ [10, 16].
Активация VDR кальцитриолом сопровождается усилением транскрипции ряда генов, которые влияют на обмен кальция, в частности гена кальцийсвязывающего белка кальбиндина 9K, и продукты которых обеспечивают увеличение абсорбции ионов кальция в желудочно-кишечном тракте. Остеобласты экспрессируют VDR, которые при стимуляции D-гормоном усиливают выработку RANKL этими костными клетками. RANKL в свою очередь взаимодействует с активатором ядерного фактора каппа-β (RANK) на предшественниках ОК, что приводит к созреванию ОК [10, 16].
D-гормон стимулирует канальцевую реабсорбцию фосфатов. Снижение его концентрации в крови ассоциировано с подавлением реабсорбции и уменьшением уровня фосфатов в крови. Активные формы витамина D путем активации VDR повышают экспрессию гена FGF-23, формируя тем самым отрицательную обратную связь в регуляции канальцевой реабсорбции фосфатов [19, 20].
Кальцитонин, секреторный продукт С-клеток щитовидной железы, синтезируется в ответ на повышение концентрации кальция. Он также участвует в регуляции гомеостаза кальция и во многих отношениях противодействует ПТГ и D-гормону [21]. В костной ткани кальцитонин подавляет резорбирующую активность ОК, снижает их количество, тем самым тормозя резорбцию и стимулируя минерализацию кости. В почках кальцитонин снижает реабсорбцию кальция, оказывает фосфатурический эффект, угнетая реабсорбцию фосфатов в канальцах. Кроме того, путем увеличения активности 1α-гидроксилазы он способствует повышению образования D-гормона в почках [3, 16].
Причины и патофизиологические механизмы гиперкальциемии
На сегодняшний день гиперкальциемия представляет значимую клиническую проблему. Это связано с тем, что данное состояние может наблюдаться при широком спектре заболеваний, как часто, так и редко встречающихся, а также при применении различных лекарственных средств. Подавляющее большинство причин этого нарушения минерального обмена обусловлено повышенной активностью околощитовидных желез и наличием онкопатологии, включая гематологические злокачественные новообразования [11, 22–24]. У детей среди причин нарушения обмена кальция и фосфора доминируют генетические заболевания, а также ятрогенные факторы [2, 4]. Необходимо подчеркнуть, что гиперкальциемия иногда протекает бессимптомно и выявляется при проведении лабораторных исследований, ее наличие может свидетельствовать о недиагностированной ранее патологии, в частности онкологической [1, 2, 5].
В зависимости от концентрации ПТГ гиперкальциемические состояния подразделяется на ПТГ-зависимые и -независимые. Напомним, что результаты исследования уровня ПТГ можно интерпретировать только при наличии точной информации об уровне кальция в крови. Гиперкальциемия, не обусловленная первичным поражением ПЩЖ (ПТГ-независимая), обычно характеризуется сниженным уровнем ПТГ в сочетании с повышенной концентрацией кальция в сыворотке крови [2, 5, 23]. Однако полное подавление секреции ПТГ наблюдается не всегда.
Около 80% случаев ПГПТ обусловлены аденомой одной ПЩЖ, в 20% случаев гиперпродукция гормона происходит в двух или трех железах, крайне редко – в четырех, менее 1% случаев приходится на карциному ПЩЖ [11, 24]. От 5 до 10% случаев развития ПГПТ связаны с наследственными синдромами, включая множественные эндокринные неоплазии, синдром опухоли челюсти при гиперпаратиреозе, семейный изолированный гиперпаратиреоз, несиндромальный первичный гиперпаратиреоз [24].
Дифференциальная диагностика ПТГ-независимой гиперкальциемии является более обширной. Чаще всего встречается форма, которая ассоциируется с различными онкологическими заболеваниям, костными осложнениями (онкоиндуцированная злокачественная гиперкальциемия) и значительно ухудшает непосредственный прогноз [4]. Гиперкальциемия при злокачественных новообразованиях (ГКЗНО) – одно из самых частых электролитных нарушений, особенно на поздних стадиях, выявляемость которого варьируется от 2 до 30% в зависимости от вида и стадии рака [22, 23, 25]. Наиболее частые онкологические заболевания, сопровождающиеся гиперкальциемией, включают солидные опухоли, такие как рак молочной железы, легких и почек, а также множественную миелому. Повышение уровня кальция в крови при злокачественных новообразованиях, как правило, характеризуется быстрым нарастанием уровня кальция и ухудшением прогноза [2, 26]. Согласно данным исследований, гиперкальциемия является независимым фактором неблагоприятного прогноза. Так, смертность при ее наличии в течение одного месяца достигает 50%, а через три месяца после постановки диагноза – 75% [26].
К патофизиологическим механизмам ГКЗНО относят выработку ПТГ-родственного протеина (ПТГрП) опухолью (~80% случаев), метастазы в кости (~20% случаев рака молочной железы и других видов рака, миеломы), избыточную экспрессию 1α-гидроксилазы, приводящую к увеличению продукции кальцитриола (при лимфомах) [2, 5, 27].
Эктопическая выработка ПТГ опухолью встречается очень редко, при мелкоклеточном раке легких.
Необходимо отметить, что ПТГрП, который продуцируется клетками многих опухолей, обладает схожими эффектами с ПТГ. Это активация остеокластической дифференцировки и функции, увеличение почечной реабсорбцию кальция [5, 27, 28]. Некоторые типы метастазов (при раке молочной железы, предстательной железы и др.) способны локально продуцировать ПТГрП [27, 28]. Важное место среди ГКЗНО занимает разрушение костной ткани метастазами, часто сопровождающееся высокой концентрацией щелочной фосфатазы. В настоящее время известно, что костные метастазы могут секретировать различные воспалительные цитокины (интерлейкины 1, 3 и 6, фактор некроза опухоли α, трансформирующий фактор роста β), которые стимулируют продукцию RANKL остеобластами, что усиливает остеокластогенез и активирует остеокласты, тем самым увеличивая поступление кальция в кровоток [27, 28]. Эктопическая избыточная продукция кальцитриола лимфомами по причине высокой локальной 1α-гидроксилазной активности приводит к увеличению как всасывания кальция в желудочно-кишечном тракте, так и почечной реабсорбции [5, 22].
Интоксикация витамином D, как правило связанная с его передозировкой при приеме с лечебной или профилактической целью, также может стать причиной гиперкальциемии. Как было отмечено ранее, витамин D растворяется в жирах, и большие его количества накапливаются в жировой ткани, что при чрезмерном потреблении может привести к токсическим эффектам. В последнее время наблюдается рост числа случаев гипервитаминоза витамина D, вызванного неконтролируемым употреблением его добавок. Распространенность дефицита витамина D в сочетании с возрастающим интересом к нему из-за многочисленных физиологических эффектов, растущее число назначений терапевтических доз (включая очень высокие дозы) без медицинского контроля способствует увеличению случаев его токсического воздействия на организм [29, 30]. Хотя тяжелая форма интоксикации витамином D встречается редко, ее последствия для здоровья могут быть серьезными. Витамин D стимулирует всасывание кальция и фосфата в желудочно-кишечном тракте. Повышение концентрации кальция подавляет секрецию ПТГ, что в свою очередь приводит к увеличению уровня фосфата [10, 12]. На фоне низкого уровня ПТГ происходит усиление экскреции Са вследствие снижения канальцевой реабсорбции в почках. Увеличение почечной экскреции Са в определенной мере компенсирует его избыток. Однако, когда поступление кальция значительно превышает его выведение, развивается гиперкальциемия.
Гранулематозные заболевания (туберкулез, болезнь Хансена, криптококкоз, гистоплазмоз, саркоидоз и др.) могут вызвать гиперкальциемию в результате локальной избыточной выработки кальцитриола. Макрофаги в гранулемах продуцируют 1α-гидроксилазу, которая превращает 25(OH)D в его активную форму, увеличивая абсорбцию кальция в кишечнике [2, 12].
Причиной развития гиперкальциемии помимо патологии ПЩЖ иногда могут выступать другие эндокринные заболевания, в частности акромегалия, некомпенсированная надпочечниковая недостаточность, болезнь Грейвса, феохромоцитома [31–33].
В ряде случаев могут быть проигнорированы скрытые, способствующие формированию гиперкальциемии причины, такие как снижение почечной экскреции кальция почками из-за приема некоторых препаратов (тиазидных диуретиков, препаратов лития, терипаратида, тамоксифена, ингибиторов иммунных контрольных точек, ингибиторов натрий-глюкозного котранспортера 2) или их отмены (деносумаб), инфекция SARS-CoV-2, соблюдение кетогенной диеты и чрезмерные физические нагрузки, особенно в сочетании с недостаточным потреблением жидкости, но на их долю приходится менее 1% [2, 5]. Кроме того, употребление большого количества кальция или кальцийсодержащих антацидов может вызвать развитие молочно-щелочного синдрома, который характеризуется гиперкальциемией, алкалозом и нарушением функции почек [34, 35].
Редкой причиной формирования гиперкальциемии является иммобилизация, которая вызывает ускоренную резорбцию костной ткани. Данный феномен наиболее характерен для молодых пациентов с травмами спинного мозга, однако может наблюдаться и у лиц пожилого возраста, страдающих различными заболеваниями. К сожалению, данное состояние часто не получает должного внимания, а механизмы его развития недостаточно изучены [34].
Еще одна редкая причина обсуждаемого электролитного нарушения – семейная гипокальциурическая гиперкальциемия (СГГК), представляющая собой аутосомно-доминантное заболевание, вызванное мутацией гена кальций-чувствительного рецептора [2, 5, 36]. Данное состояние характеризуется умеренным повышением уровня кальция в крови и снижением его выведения с мочой, что обусловлено усиленной реабсорбцией кальция в почках на уровне канальцев. При этом концентрация ПТГ в сыворотке крови сохраняется в пределах нормы или незначительно превышает ее. Уменьшение чувствительности CaSR в ПЩЖ и почках требует более высокого уровня кальция в крови для обеспечения нормальной концентрации ПТГ и предотвращения его повышения [36].
Таким образом, повышение уровня кальция в сыворотке крови может быть обусловлено разными причинами – от часто встречающихся заболеваний и состояний до более редких.
Необходимо помнить, что сочетанное влияние нескольких факторов также способно приводить к развитию гиперкальциемии.
Клиническая картина
Клиническая картина гиперкальциемии варьируется от легкой, практически бессимптомной до тяжелой.
Многообразие и вариабельность клинической картины приводит к тому, что гиперкальциемия может маскироваться под другие заболевания. Например, при гуморальной гиперкальциемии злокачественных новообразований такие симптомы, как слабость, потеря аппетита и тошнота, могут ошибочно приниматься за прогрессирование онкологического процесса. В этом случае нарастающая гиперкальциемия, являющаяся непосредственной угрозой жизни пациента, может остаться незамеченной и не получит адекватного лечения. Даже незначительное повышение уровня кальция в крови не должно игнорироваться и требует тщательного обследования для выявления первопричины, в противном случае существует риск не распознать патологию [1, 4, 24, 26].
Разнообразие клинических проявлений гиперкальциемии обусловлено степенью ее выраженности, скоростью развития (острая или хроническая) и вовлечением в патологический процесс разных органов и систем [1, 2, 28]. Повышение уровня сывороточного кальция и обезвоживание часто сопутствуют друг другу. Незначительное повышение уровня общего кальция (< 3 ммоль) чаще протекает бессимптомно и выявляется в ходе лабораторного обследования по другим причинам. Умеренная гиперкальциемия (значения общего Ca от 3,0 до 3,5 ммоль/л или Ca2+ от 1,4 до 2,0 ммоль/л) может протекает как бессимптомно, так и сопровождаться симптомами (усталостью, онемением, запорами). Последнее отмечается у 20% пациентов. Тяжелая (критическая) (уровень общего Ca > 3,5 ммоль/л или уровень Ca2+ ≥ 2,5 ммоль/л) или быстро развивающаяся в течение нескольких дней или недель гиперкальциемия может вызвать тошноту, рвоту, обезвоживание, спутанность сознания, сонливость. Повышение уровня Ca > 3,75 ммоль/л, как правило, связано с быстрым угнетением функционирования нервной системы, сердца, органов желудочно-кишечного тракта, почек и развитием гиперкальциемического криза [5, 34].
Гиперкальциемия оказывает негативное воздействие на большинство органов и систем, способствуя кальцификации (табл. 1) [2, 28, 37].
Типичным проявлением гиперкальциемии является поражение почек. Гиперкальциемия может спровоцировать развитие нефролитиаза, иногда протекающего бессимптомно [1, 24]. Нефрокальциноз и нефролитиаз являются почечными нарушениями в результате длительного повышения уровня кальция в крови. В связи с этим они встречаются крайне редко при злокачественной гиперкальциемии, которая характеризуется чаще острым и быстро прогрессирующим повышением уровня кальция [38].
У части пациентов наблюдаются симптомы полиурии и полидипсии, что способствует развитию дефицита жидкости в организме и усугубляет течение основного заболевания, приводя к прогрессированию гиперкальциемии [15, 23, 24]. Повышенная концентрация кальция в организме оказывает негативное влияние на процессы обратного всасывания в канальцах почек и ингибирует эффекты антидиуретического гормона, что проявляется снижением экспрессии аквапоринов 2, мембранных водных каналов, и транслокации из цитоплазмы эпителиоцитов собирательных трубочек в их мембраны [39]. Это приводит к нарушению способности почек концентрировать мочу и, как следствие, к дальнейшему снижению выведения кальция, а также к нарастанию гиперкальциемии. Стимуляция рецепторов CaSR в восходящей петле Генле обусловливает ингибирование активности котранспортера Na+-K+-2Cl– [3, 5, 11]. В результате снижается реабсорбция калия, хлора и натрия, что ведет к их повышенному выведению с мочой и нарушению реабсорбции воды, обезвоживанию. При значительной дегидратации наблюдается снижение скорости клубочковой фильтрации, что приводит к переходу от полиурической стадии к олигурической и нарастанию уровня кальция в крови. Гипокалиемия, развивающаяся из-за нарушения концентрационной функции почек, усиливает проаритмогенный эффект гиперкальциемии [2, 5].
Существенное диагностическое значение имеет поражение органов желудочно-кишечного тракта. Патологическое воздействие гиперкальциемии стимулирует выработку желудочного сока и панкреатических ферментов, а также приводит к кальцификации сосудов и нервных окончаний слизистой оболочки. Это вызывает нарушение тонуса кишечника и может стать причиной развития диспепсических расстройств, эрозивных поражений слизистой (эзофагиты, язвы желудка и двенадцатиперстной кишки), а также возникновения панкреатитов, колитов и запоров [5, 11, 24].
К характерным признакам относят и нервно-мышечные нарушения, которые включают быструю утомляемость, заторможенность, депрессию, когнитивный дефицит, слабость. Более тяжелые поражения нервной системы возможны при нарастании гиперкальциемии (галлюцинация, дезориентация, нарушение сознания, кома) [1, 5, 24].
Боль в костях более характерна для пациентов с ПГПТ или злокачественными новообразованиями [37, 38].
Длительная гиперкальциемия способна привести к кальцификации клапанов сердца, миокарда и коронарных артерий. При умеренном повышении концентрации кальция в крови сократимость миокарда может возрастать, но при содержании этого иона в крови более 3,5 ммоль/л, наоборот, снижаться. Критическое повышение уровня сывороточного кальция может стать причиной атриовентрикулярной блокады и других нарушений проводимости сердца, что создает предпосылки для развития острых сердечно-сосудистых осложнений вплоть до фибрилляции желудочков и внезапной смерти [4, 5].
Диагностика
Согласно современным диагностическим алгоритмам, первым этапом в оценке состояния пациента с впервые выявленной гиперкальциемией должно быть повторное определение уровня общего кальция, альбумина (с расчетом альбумин-скорректированного кальция) и/или ионизированного кальция с целью исключения ложноположительных результатов лабораторных анализов [1, 5, 37]. Корректировка кальция в зависимости от уровня альбумина необходима для предотвращения искажения показателей, возникающего при изменении концентрации плазменных белков. Коррекция общего кальция рекомендуется при уровне альбумина менее 40 и более 45 г/л [1, 5, 37]. Для расчета альбумин-скорректированного кальция были предложены следующие формулы: общий кальций плазмы (ммоль/л) = измеренный уровень общего кальция плазмы (ммоль/л) + 0,02 × (40 – измеренный уровень альбумина плазмы (г/л)) и общий кальций плазмы (мг/дл) = измеренный уровень общего кальция плазмы (мг/дл) + 0,8 × (4 – измеренный уровень альбумина плазмы (г/дл)). Коэффициент пересчета: [кальций] мг/дл × 0,25 = > [кальций] ммоль/л.
Ложных результатов также можно избежать путем прямого определения уровня ионизированного кальция [1, 2, 37].
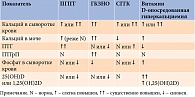
Лабораторная оценка подтвержденной гиперкальциемии начинается с измерения уровня интактного ПТГ [5, 28, 34]. Одновременная оценка концентраций кальция и ПТГ может быть начальным этапом в понимании патофизиологии нарушения обмена кальция. Определение уровня ПТГ является значимым тестом и в большинстве случаев позволяет отличить причины, зависящие от ПТГ, от причин, которые от него не зависят (табл. 2). У пациента с гиперкальциемией повышенная или нормальная концентрация ПТГ наиболее вероятно указывает на ПГПТ (в случае нормального уровня ПТГ следует исключить нормокальциемическую форму). В то же время пониженная концентрация ПТГ или находящаяся в нижнем диапазоне нормальных значений, как правило, свидетельствует о другой этиологии гиперкальциемии [1, 23, 34]. Незначительное повышение концентрации ПТГ может быть связано с СГГК [36, 37].
Определение уровня ПТГ имеет решающее значение не только для постановки диагноза, но и для направления дальнейшего обследования. В случае подозрения на саркоидоз или лимфому может быть выявлен повышенный уровень 1,25(OH)2D или 25(ОН)D [5, 28, 29].
Полученные данные позволяют сориентироваться в клинической картине заболевания и назначить соответствующее лечение.
Как было отмечено ранее, ПГПТ является наиболее распространенной причиной развития гиперкальциемии [5, 24]. Несмотря на то что существуют достаточно простые методы диагностики этой патологии ПЩЖ, по разным причинам данный диагноз часто упускается из виду, в том числе из-за отсутствия биохимических тестов или неправильной интерпретации их результатов. В частности, согласно результатам ряда исследований, только у каждого третьего пациента с лабораторно доказанной гиперкальциемией определялся уровень ПТГ [40].
В зависимости от клинических проявлений выделяют костную, висцеральную (с преобладающим поражением внутренних органов), а также смешанную формы ПГПТ. Типичными признаками являются переломы костей, не соответствующие возрасту пациента и уровню физической нагрузки, остеопороз, реже – генерализованная остеодистрофия. Могут также наблюдаться нарушения функции почек, мочекаменная болезнь, полиурия и полидипсия, миопатии, заболевания органов желудочно-кишечном тракта, такие как язвенная болезнь желудка и/или двенадцатиперстной кишки, панкреатит, панкреакалькулез и панкреакальциноз [11, 24, 37].
Диагноз ПГПТ верифицируется на основании данных лабораторного исследования. В крови необходимо исследовать уровни кальция, ПТГ, фосфора, щелочной фосфатазы, креатинина с расчетом скорости клубочковой фильтрации, в моче – уровни кальция и креатинина (суточный анализ) с расчетом отношения почечного клиренса кальция к клиренсу креатинина [1, 5, 37].
В качестве первичного инструментального метода диагностики рекомендуется ультразвуковое исследование ПЩЖ. В отсутствие визуализации четко очерченного образования или при его малых размерах (< 10 мм) целесообразно проведение дополнительных методов визуализации (сцинтиграфия ПЩЖ с технецием [99mTс] сестамиби, компьютерная томография (КТ) шеи и средостения с контрастным усилением). В настоящее время чаще используется трехмерная однофотонная эмиссионная КТ (ОФЭКТ) и гибридная технология ОФЭКТ/КТ, сочетающая в себе функциональную чувствительность ОФЭКТ с высокой анатомической детализацией многослойной КТ. Комбинация ОФЭКТ/КТ со сцинтиграфией и ультразвуковое исследование ПЩЖ экспертного класса повышают чувствительность диагностики до 95–98% [23, 37].
В подавляющем большинстве случаев гиперкальциемию, обусловленную злокачественными новообразованиями (ПТГ-независимую), обнаруживают при обращении за медицинской помощью по поводу симптомов, связанных с ростом опухоли. Однако в некоторых случаях гиперкальциемия может выступать в качестве одного из ранних проявлений заболевания. В таких ситуациях крайне важно провести тщательное обследование с целью выявления специфических признаков онкологической патологии и назначения визуализирующих методов исследования [5, 22, 28]. Описаны случаи, когда опухоли, локализующиеся вне паращитовидных желез, продуцировали ПТГ (эктопическая продукция). К таким образованиям, в частности, относятся карцинома яичников, мелкоклеточный и плоскоклеточный рак легких, нейроэктодермальные опухоли, папиллярная карцинома щитовидной железы, метастатическая рабдомиосаркома, злокачественные новообразования поджелудочной железы и карцинома желудка. В подобных ситуациях лабораторные анализы позволяют выявить повышенную концентрацию ПТГ и кальция в крови, а также пониженный уровень фосфора [28, 38].
При подозрении на передозировку витамина D необходимо провести измерение уровня 25(ОН)D в сыворотке крови. В случае развития гипервитаминоза концентрация 25(ОН)D может превосходить норму (> 150 нг/мл) в пять – десять раз в сочетании с выраженной гиперкальциемией, гиперкальциурией, гиперфосфатемией, сниженным или неопределяемым уровнем ПТГ [5, 16, 41, 42]. У пациентов с гипервитаминозом уровень 1,25(OH)2D может варьироваться в пределах нормы или быть незначительно повышен, реже понижен. Повышенная концентрация кальция в сыворотке крови оказывает подавляющее воздействие на активность ПЩЖ. Снижение уровня 1,25(OH)2D может быть обусловлено как ингибированием 1α-гидроксилазы, так и активацией 24-гидроксилазы. В силу того что 25(ОН)D накапливается в жировой ткани и медленно из нее высвобождается, симптомы гипервитаминоза могут наблюдаться в течение нескольких недель после прекращения приема витамина D [42]. Гиперфосфатемия является результатом увеличения всасывания фосфатов в кишечнике и почках [15].
При применении неадекватно высоких доз синтетических аналогов витамина D (альфакальцидола, парикальцитола и доксеркальциферола), используемых в лечении гипокальциемических состояний, таких как гипопаратиреоз и терминальная стадия хронической болезни почек, у пациентов могут наблюдаться токсические D-эффекты. В указанных ситуациях гиперкальциемия выступает как нежелательное последствие проводимой терапии, характеризующееся увеличением уровня 1,25(OH)2D [2, 41, 42].
Макрофаги могут вызвать образование гранулем (например, при саркоидозе, туберкулезе, лимфоме Ходжкина), повышенное внепочечное превращение 25-гидроксивитамина D3 в кальцитриол. При этом уровень ПТГ снижается, а уровень 1,25-дигидроксивитамина D3 повышается. При подозрении на наличие гранулематозных заболеваний (саркоидоза, туберкулеза и др.) необходим поиск их специфических проявлений в соответствующих органах и тканях [5, 42].
Лабораторные показатели при СГГК характеризуются сочетанием невыраженной гиперкальциемии (как правило, не более 3,0 ммоль/л) с нормальным или умеренно повышенным уровнем ПТГ и низкой почечной экскрецией кальция с мочой. Эта патология не требует хирургического лечения, в связи с чем крайне важна дифференциальная диагностика с ПГПТ [2, 36].
Подходы к лечению
Гиперкальциемия – серьезное состояние, требующее комплексного междисциплинарного подхода. Лечение должно быть направлено как на устранение основной причины заболевания, так и на купирование симптомов. Приоритетным направлением терапии является лечение основного заболевания, вызвавшего электролитное нарушение [2, 5, 28].
Выбор тактики лечения зависит не только от этиологии гиперкальциемии, но и от тяжести состояния, наличия сопутствующих заболеваний и других индивидуальных особенностей пациента. Интенсивность проводимой терапии определяется степенью гиперкальциемии и скоростью ее повышения [28, 35, 43].
Пациентам необходимо предоставить исчерпывающую информацию о том, как избежать факторов, способствующих усугублению состояния. К таковым относятся прием тиазидных диуретиков и препаратов лития, ограничение потребления жидкости, длительный постельный режим, потребление пищевых продуктов, содержащих много кальция. Важно отметить тесную связь между повышенным уровнем кальция в сыворотке крови и обезвоживанием. Основной терапевтический подход заключается в обеспечении достаточной пероральной гидратации (2–3 л/сут) с учетом сопутствующей патологии. Лежачим пациентам по возможности назначают легкие физические нагрузки.
В основе терапии критической гиперкальциемии лежит изотоническая гидратация с помощью физиологического раствора с целью восстановления объема циркулирующей крови [25, 38, 43]. Повышение объема внеклеточной жидкости вследствие увеличения скорости клубочковой фильтрации и уменьшения реабсорбции кальция в почечных канальцах усиливает выведение кальция почками, что способствует снижению гиперкальциемии. Инфузия в объеме 3–6 л/сут может способствовать снижению уровня кальция на 0,25–0,75 ммоль/л [2, 28]. Темп инфузии физиологического раствора определяется рядом факторов, включая возраст пациента и наличие сопутствующей патологии, в особенности заболеваний сердечно-сосудистой или мочевыделительной систем, лабораторные показатели (уровень кальция в крови, параметры функции почек и др.). В отсутствие признаков отека оптимальным режимом лечения считается введение изотонического физиологического раствора со скоростью 200–300 мл/ч. Этот темп может быть скорректирован с целью поддержания диуреза в пределах 100–150 мл/ч [5, 25]. Иногда для усиления диуреза и ускорения выведения кальция к регидратационной терапии добавляют петлевые диуретики (фуросемид). Следует помнить, что гиперкальциемия может усугубиться, если мочегонные средства назначаются до достижения адекватной гидратации. Кроме того, их применение может привести к развитию гипокалиемии, что требует тщательного контроля уровня калия в сыворотке крови.
Необходима отмена лекарственных средств, вызывающих гиперкальциемию. Для нормализации уровня кальция назначают азотосодержащие бисфосфонаты, деносумаб [2, 11, 34].
Под воздействием бисфосфонатов в ОК происходят изменения, которые нарушают их функцию и снижают резорбционную способность, что в свою очередь приводит к уменьшению костной резорбции и концентрации кальция в крови [5, 34]. Азотосодержащие бисфосфонаты (золендронат) обладают большим антирезорбтивным потенциалом при метастазах в костях, обеспечивая более быстрое и эффективное снижение концентрации кальция [38, 43].
Препаратом, эффективно снижающим костную резорбцию и гиперкальциемию, признан деносумаб – моноклональное антитело, которое блокирует RANKL, необходимый для дифференцировки и активации остеокластов [34, 38].
В особо тяжелых случаях, когда другие методы неэффективны, может потребоваться назначение глюкокортикостероидов. Следует отметить, что длительное применение глюкокортикостероидов ассоциируется с рядом побочных эффектов, поэтому их применение должно быть строго оправданно и находиться под контролем врача. Глюкокортикостероиды могут быть использованы в качестве основного средства лечения при гиперкальциемии, вызванной чрезмерным всасыванием кальция в кишечнике (интоксикация витамином D, гранулематозные заболевания, некоторые виды лимфомы) [28, 29, 42].
Единственным радикальным и эффективным методом лечения ПГПТ является селективная паратиреоидэктомия. Этот подход рекомендуется всем пациентам с классическими проявлениями заболевания. Среди преимуществ радикального лечения – быстрая нормализация уровня кальция в крови, устранение симптомов, связанных с гиперкальциемией, а также улучшение состояния костной ткани и функции почек. В тех случаях, когда проведение хирургического вмешательства невозможно либо отсрочено, оправданно консервативное лечение, направленное на коррекцию гиперкальциемии (азотосодержащие бисфосфонаты и кальций-миметики) [11, 37].
Лечение ГКЗНО в дополнение к лечению основной патологии заключается в адекватной регидратации, назначении кальцитонина, глюкокортикостероидов и антирезорбтивных препаратов (различных бисфосфонатов, деносумаба) [2, 22, 25]. При этом деносумаб считается предпочтительным.
Карцинома ПЩЖ – единственное злокачественное новообразование, для лечения которого одобрено применение кальций-миметика цинакальцета [44]. Пациентам с почечной недостаточностью показан деносумаб (при этом коррекции режима дозирования препарата не требуется) и диализ [5, 44].
Лечение гиперкальциемии, связанной с гипервитаминозом витамина D, включает отмену препаратов витамина D (аналогов) и ограничение потребления кальция с пищей. У лиц без нарушения функции почек в анамнезе прием изотонических жидкостей с петлевыми диуретиками, такими как фуросемид, или без них, а также глюкокортикостероидов обычно эффективен для снижения концентрации кальция в сыворотке крови [42]. У пациентов с хронической почечной недостаточностью, получающих 1α-гидроксилированные аналоги витамина D, может быть достаточным прекращение приема этих препаратов. Если функция почек сохраняется на достаточном уровне, целесообразно назначение изотонических жидкостей и петлевых диуретиков.
Поскольку хронические гранулематозные заболевания могут вызвать независимую от ПТГ гиперкальциемию из-за повышенного превращения 25(ОН)D в кальцитриол, для нормализации уровня кальция назначают ингибитор активности 1α-гидроксилазы кетоконазол [45].
Заключение
Изложенное выше свидетельствует о широком спектре причин повышения уровня сывороточного кальция и разнообразном характере клинических проявлений (иногда бессимптомном течении) гиперкальциемии, которая может быть признаком таких серьезных заболеваний, как ПГПТ или рак. Разнообразие клинических проявлений гиперкальциемии нередко затрудняет ее диагностику, становится причиной постановки ошибочного диагноза, задержки выявления первопричины состояния и, как следствие, отсрочки начала соответствующего лечения. Своевременное и точное выявление причины гиперкальциемии необходимо для предотвращения таких серьезных последствий, как обезвоживание, нарушение функции почек, образование камней в почках и хрупкость костей. Своевременно назначенное лечение может значительно улучшить самочувствие пациентов.
Ye.V. Biryukova, MD, PhD, Prof., M.V. Shinkin
Russian University of Medicine
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Yelena V. Biryukova, lena@obsudim.ru
The article discusses a clinical significance of hypercalcemia which is a commonly met electrolyte imbalance disorder. The physiological role of calcium in the body is also described, as well as the mechanisms of calcium-phosphorus metabolism regulation, which ensure the maintenance of its physiological concentration. A particular attention is paid to the role of key hormones involved in this process: parathyroid hormone, vitamin D and calcitonin, as well as mechanisms of their action. A wide range of hypercalcemia causes is also described, from the most common (primary hyperparathyroidism, malignant neoplasms) to the rare ones (vitamin D intoxication, granulomatous diseases, etc.). In addition, pathophysiological mechanisms of these conditions are discussed in details. It is also noted that hypercalcemia can be caused by the simultaneous action of several provoking factors. The authors also describe in details a clinical picture of hypercalcemia, which is characterized by a variety of disorders affecting different organs and systems of the body, approaches to its diagnostics and basic methods of its correction. All these depend on the underlying cause of the disease. It is emphasized that the degree of hypercalcemia and speed of serum calcium increase determine clinical symptoms and the need for emergency therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.