Дифференциальная липидкорригирующая терапия ИБС у пациентов с метаболическим синдромом
- Аннотация
- Статья
- Ссылки
Полиморбидность – независимое сочетание различных болезней у одного пациента, среди которых ИБС, ассоциированная с избыточной массой тела, занимает значительное место. С возрастом рост частоты хронических болезней и их сочетания вызывают трудности в повседневной практике врача для своевременной диагностики и подборе адекватного комплексного лечения ИБС.
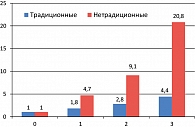
Лечение ИБС направлено на достижение двух основных целей: улучшение прогноза (профилактика ОКС, ИМ и внезапной сердечной смерти) и качества жизни (снижение частоты и интенсивности стенокардических приступов). МС – кластер (совокупность) метаболических факторов риска развития сердечно-сосудистых заболеваний атеросклеротического генеза, ассоциированных с абдоминальным ожирением и инсулинорезистентностью. Особенностями нарушения липидного спектра крови при МС являются сочетание «традиционных» (повышенный уровень холестерина, ЛПНП, снижение ЛПВП) с «нетрадиционными» маркерами высокого риска развития ИБС (высокая концентрация триглицеридов, ЛПНП, низкий уровень ЛПВП) на фоне гиперинсулинемии. По мере увеличения «нетрадиционных» факторов – маркеров риска вероятность развития ИБС повышается в 20 и более раз, в то время как при комбинации из трех традиционных маркеров риска – только в 4,5 раза (рисунок 1) (1, 5, 7).
Повышение концентрации триглицеридов (Тг), модифицированных малых плотных частиц ЛПНП, снижение уровня ЛПВП, нарушение гомеостаза глюкоза/инсулин, активация протромботического/провоспалительного состояния, нарушение эндотелиальной дисфункции, сопровождающиеся развитием артериальной гипертензии и ИБС, – основные клинические признаки МС.
В настоящее время МС в экономически развитых странах встречаются у 10-25% населения. Наличие МС в 2-4 раза увеличивает частоту внезапной смерти и развитие ССЗ, а риск формирования СД типа 2, по данным различных авторов, повышается в 5-9 раз по сравнению с пациентами с нормальным индексом массы тела (ИМТ). Настораживает еще и тот факт, что среди подростков и молодежи частота встречаемости МС за последние 60 лет возросла в 1,5 раза, а избыток массы тела среди детского населения в экономически развитых странах регистрируется в 12-14% случаев (5, 7).
Распространенность МС приобретает эпидемические масштабы, что требует интеграции различных медицинских специальностей с целью адекватной диагностики и эффективного лечения этой патологии.
В Фрамингемском исследовании от 1986 года было впервые показано, что повышение Тг увеличивает риск развития коронарных событий, которое было подтверждено Стокгольмским, Хельсинкским и Парижским исследованиями – «Тг являются независимым фактором риска ИБС». Еще в 1966 J.E. Hokanson и M.A. Austin, проанализировав результаты многих проспективных исследований, установили, что без точного учета уровней ХС ЛПВП увеличение уровней Тг на каждый ммол/л увеличивает риск развития ИБС у женщин на 76%, а у мужчин – на 32%. И, наоборот, при учете уровней ХС ЛПВП аналогичное увеличение уровней Тг увеличивает риск развития ИБС у женщин только на 37%, а у мужчин – на 14%. Результаты этих исследований позволили авторам сделать вывод: «…Тг могут быть более вероятными предикторами ишемических эпизодов, чем уровень ОХС» (1, 5, 10, 11). Многие исследователи показали, что уровни Тг являются предикторами степени протяженности поражения коронарных артерий, даже при стенозах менее 50% от диаметра просвета коронарных сосудов. Также установлено, что повышение уровня Тг ассоциируется с нарастанием толщины комплекса интима-медиа (КИМ) общей сонной артерии.
Связь Тг с толщиной сосудистой стенки и тяжестью атеросклеротического поражения сосудов и риском развития ОКС можно объяснять несколькими причинами:
- липопротеиды, богатые Тг, являются хорошими промоутерами (мессенджерами) кислородных свободнорадикальных реакций, которые могут способствовать дестабилизации и разрыву бляшки;
- Тг имеют тесную связь с уровнем инсулина сыворотки крови, который способствует гиперплазии гладкомышечных клеток и утолщению мышечного слоя сосудов (ремоделированию).
При анализе результатов исследования MARS (Мonitored Aterosclerosis Regression Study) и CLAS (Cholesterol-Lowering Aterosclerosis Study) было показано, что не только уровень Тг плазмы является независимым фактором риска ИБС, но и уровни модифицированных липопротеидов, богатых Тг, коррелируют с тяжестью ИБС, этот факт был подтвержден и другими исследователями (1, 4, 5, 7, 11).
Более того, высокие концентрации липопротеидов, богатых Тг (ЛПОНП, ЛППНП, ЛПНП), могут предсказывать темп прогрессирования ИБС. Возможно, это связано с тем, что липопротеиды богатые Тг, являются хорошими посредниками кислородных свободнорадикальных реакций (перекисное окисление липидов), которые способствуют формированию и дестабилизации атеросклеротических бляшек, их разрыву (15, 16, 17).
В настоящее время постулировано: увеличение уровней Тг, модифицированных (мелкие, с высокой плотностью) ЛПНП и снижение уровней ЛПВП являются независимыми факторами риска ИБС.
Thompson G.R. (1998) в обзорной статье, посвященной анализу 12 проспективных исследований, отметил, что липопротеиды, богатые Тг, играют важную роль в прогрессировании ИБС и являются контрольными точками, отражающими эффект гиполипидемической терапии, особенно уровень Аро С-III, который является маркером метаболизма липопротеидов, богатых Тг (15).
Большой интерес представляет тот факт, что не только тощаковые уровни Тг, но и постпрандиальные уровни Тг имеют тесную связь с прогрессированием ИБС. Причем эти связи являются независимыми от уровней ЛПВП и более сильными, чем связь с ЛПВП. Это связано с тем, что постпрандиальная гипер-Тг уменьшает протективный эффект ЛПВП и индуцирует захват окисленных ЛПОНП (гипертриглицеридных) стромальными клетками медии и адвентиции сосудистой стенки и накоплению их в макрофагах (1, 5, 7).
Нарушения метаболизма липидов тесно связаны с эндотелиальной дисфункцией. Доказано, что окисленные липопротеиды низкой плотности обладают высокой токсичностью: снижают способность сосудистого эндотелия продуцировать NO – эндотелийзависимый фактор релаксации (ЭЗФР), что сопровождается относительно избыточной продукцией вазоконстрикторных факторов (эндотелин-1, ангиотензин), активацией апоптоза сосудистых клеток.
В настоящее время в патогенезе ИБС и ИМ признана «стартовая» роль дисфункции эндотелия сосудов (ДЭ). ДЭ – нарушения эндотелийзависимой вазодилатации и повышение адгезивных свойств (тромботических) эндотелиальной выстилки сосудов.
В многочисленных исследованиях установлена прямая тесная корреляционная связь между изменениями функционального состояния коронарного русла (коронарный резерв) и реакцией периферических сосудов на ЭЗФР (вазодилатационный резерв), т.е. выраженность нарушений ЭЗФР плечевой артерии отражает степень атеросклеротического поражения коронарных и сонных артерий. Поэтому определение ЭЗФР плечевой артерии можно рассматривать как адекватный метод исследования функционального состояния эндотелия коронарных сосудов (15, 16, 17).
Установлено, что более уязвимыми являются эндотелиоциты в области деления магистральных сосудов (бифуркации), где за счет гидродинамических эффектов идет усиленная пролиферация, апоптоз и гибель клеток.
Доказано, вынужденно регенерирующие эндотелиальные клетки отчасти утрачивают способность в полной мере высвобождать оксид азота (NO – ЭЗФР), особенно в ответ на агрегационную активность тромбоцитов (2). ДЭ является стартовым моментом, инициирующим атерогенез, способствует прогрессированию сосудистого атеросклероза, что в конечном итоге приводит к дестабилизации атеросклеротической бляшки, ее разрыву, развитию ОКС и ИМ.
Важнейшими аспектами медикаментозного лечения больных ИБС, в частности стабильной стенокардии, сочетающейся с различными видами метаболических нарушений (гипергликемия, дислипидемия), являются применение лекарственных препаратов, корригирующих (повышающих) чувствительность инсулинзависимых клеток к инсулину и понижающих содержание атерогенных липидов крови.
С учетом конкретной ситуации и типа дислипидемии в настоящее время рекомендовано пять категорий гиполипидемических лекарственных препаратов (различия в их эффектах на липидный спектр хорошо известны): ингибиторы ГМГ-КоА-редуктазы (статины), фибраты, секвестранты желчных кислот, никотиновая кислота и ее производные, ингибиторы абсорбции ХС – желудочно-кишечной липазы.
К настоящему времени имеется значительное количество доказательств, полученных в тщательно проведенных рандомизированных клинических исследованиях, которые обосновывают в качестве основной терапии назначение статинов. Тактика лечения статинами у отдельных категорий больных с различной степенью риска подробно представлена в Российских рекомендациях секции атеросклероза ВНОК «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза» (2007).
Внедрение статинов в клиническую практику кардиологов явилось крупным прорывом в снижении сердечно-сосудистых осложнений и смертности. Уже в 90-х годах XX в. в проспективных исследованиях было документировано значительное снижение частоты случаев внезапной сердечной смерти и развития рецидивов коронарных событий среди пациентов с ИБС, которым систематически назначали различные статины в среднетерапевтических дозах.
В соответствие с данными метаанализа независимых исследований (4S, HPS, ASCOT-LLA, CARDS, 4D), опубликованного в 2005 году, снижение риска ИБС на фоне приема статинов в среднем составило 23% (от 11 до 51%) (4, 12). Тем не менее статины не устраняют риск, связанный с низким уровнем холестерина ЛПВП или другими проявлениями МС, также не было достоверно установлено значимого снижения остаточного риска у пациентов с нарушениями углеводного обмена (СД типа 2). Основная цель метаанализа – выделить («поймать») проблему, обозначить ее актуальность и основное направление дальнейших исследований (6).
На протяжении последних 10-15 лет проведен целый ряд крупных проспективных исследований (HHS, BIP, VA-HIT), среди которых ведущим является исследование FIELD (The Fenofibrate Intervenention and Event Lowering in Diabetes Trial) с участием 9795 пациентов с нарушениями углеводного обмена, посвященных сравнительному изучению влияния гиполипидемической терапии (статины или фибраты) на уровни сердечно-сосудистой заболеваемости и смертности. Оказалось, фибраты особенно эффективны у пациентов с СД типа 2 и/или признаками метаболического синдрома – у этих пациентов высокий риск сердечно-сосудистых осложнений достоверно снижался.
В исследованиях, включенных в программу FILD, показано плейотропное действие фибратов: фенофибраты подавляют миграцию эндотелиальных клеток сосудов, оказывают противовоспалительное действие, подавляют активность окислительного стресса. Классическое представление о механизмах действия фибратов было следующим: повышение активности липопротеинолипазы, расщепляющей липопротеиды, богатые Тг, угнетение синтеза и секреции ХС ЛПНП в печени и увеличение концентрации белка апо-А1 – основного белка ХС ЛПВП. Одновременно при применении фенофибратов документировано статистически достоверное снижение провоспалительных цитокинов, таких как ФНО-a, ИЛ-6, ИЛ-1b, снижение уровней активности супероксиддисмутазы (СОД) плазмы и малондиальдегида (МДА) – липидного гидропероксида, образующегося при окислительном стрессе (9, 10, 11, 12).
Подобные различия клинических результатов гиполипидемического эффекта статинов и фибратов среди пациентов с МС, вероятно, обусловлены специфическими особенностями их биотрансформации и механизмами воздействия на различные уровни липидного обмена.
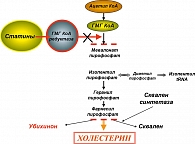
Статины – ингибиторы редуктазы 3-гидрокси-3-метилглутарила – кофермента А (ГМГ-КоА) – группа препаратов с гипохолестеринемическими эффектами. Гипохолестеринемическое действие статинов основано на их способности конкурентно ингибировать активность ГМГ-КоА-редуктазы, превращение которой в мевалоновую кислоту является ключевым этапом синтеза эндогенного холестерина (рисунок 2). Это приводит к компенсаторной экспрессии гепатоцитами повышенного числа рецепторов липопротеидов низкой плотности, что увеличивает клиренс ХС ЛПНП из плазмы. Статины, подавляя синтез ЛПОНП в печени, являющихся предшественниками ЛПНП, способствуют снижению последних, что суммарно снижает атерогенный эффект дислипидемии.
Убедительно доказанная прогностическая польза длительного приема ингибиторов ГМГ-КоА-редуктазы при атеросклерозе и сахарном диабете уверенно вывели эту группу препаратов на ведущее место в рекомендациях по современной медикаментозной терапии и профилактике сердечно-сосудистых заболеваний. Клинические результаты, полученные при лечении статинами, объясняются наличием у них не только антихолестеринемического, но и множеством других полезных эффектов. Полезные свойства статинов, не зависящие от их влияния на липиды плазмы, получили название плейотропных (от греч. pleio – множественный и tropos – действие).
Плейотропные эффекты статинов проявляются в первые 3-4 месяца лечения: обеспечивают положительное влияние на функцию эндотелия, оказывают антиишемический, антитромботический, антиаритмический, антиатерогенный и другие эффекты. Благодаря этому спектр показаний к назначению статинов при лечении ССЗ расширяется. По данным экспериментальных работ и клинических исследований, с учетом плейотропности статинов (симвастатин, аторвастатин, правастатин, розувастатин и др.) установлены несколько эффектов, оказывающих влияние на патогенез и течение МС: противовоспалительные, иммуномодулирующие (через снижение в плазме интерлейкина-6 и фактора некроза опухоли-a), увеличение мозгового натрийуретического гормона, усиление секреции NO эндотелием сосудов (10, 11). Однако, согласно схеме ингибирования статинами синтеза холестерина, возможно также снижение под воздействием статинов биосинтеза убихинона (коэнзима Q10) – основного клеточного антиоксиданта, защищающего фосфолипидный слой клеточной мембраны от перекисного окисления под воздействием свободных радикалов. Снижение синтеза убихинона является одним из нежелательных эффектов статинов.
Фибраты – дериваты фиброевой кислоты, используются при лечении нарушений липидного обмена с конца 50-х годов XX в. При этом фибраты традиционно назначаются пациентам с гипертриглицеридемией и СД, а также для лечения больных ИБС. Утрата интереса к фибратам произошла после получения результатов исследования HPS (Heart Protection Study), которое было основано на 5,5-летнем наблюдении за 20536 пациентами с высоким риском ИБС, леченных симвастатином 40 мг/сут. В этом исследовании (при использовании статинов в лечении пациентов с высоким риском заболевания сердечно-сосудистой системы) достижение конечных точек показало значительное снижение частоты ИМ, инсультов, внезапной сердечной смерти.
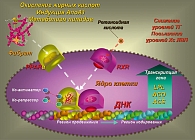
Механизм гиполипидемического действия фенофибратов опосредован через активацию внутриклеточного ядерного рецептора PPAR-a. Этот рецептор играет доминирующую роль во внутриклеточной регуляции экспрессии (переноса) и транскрипции (переписывание) геномов ДНК, ответственных за уровни липидного метаболизма и воспалительных цитокинов. Фенофибраты являются агонистами рецепторов, активируемых пролифераторами пероксисом типа альфа (PPAR-a) (рисунок 3). Активация рецепторов PPAR-a в результате связывания с фенофибратом приводит к образованию гетеродимерных комплексов PPAR-a и ретиноидного рецептора Х (РХР). Далее они связываются с чувствительными элементами («элементами ответа пролифератора пероксисом») рецептора PPAR-a (PPRE – response elements) и стимулируют экспрессию с последующей транскрипцией генов, ответственных за функциональное состояние системы липазных ферментов. Активация липазной ферментной системы сопровождается уменьшением образования частиц, богатых Тг, с благоприятной модификацией размеров частиц ЛПНП – от мелких, плотных и атерогенных частиц к более крупным, плавучим и менее атерогенным частицам, повышению уровней холестерина ЛПВП, что суммарно манифестируется уменьшением атерогенности липидного спектра крови (8, 9).
Установлено, что некоторые виды терапии оказывают отчетливое влияние на функциональное состояние эндотелия. При кратковременном приеме иАПФ, антиоксидантов, эстрогенов, L-аргинина, блокаторов кальциевых каналов проявляется кратковременный положительный эффект на функциональное состояние эндотелия, тем не менее при длительной терапии МС лучший эффект на функциональное состояние оказывают гиполипидемические препараты. Эти клинические наблюдения определяют более широкие возможности для внедрения эффективных мероприятий медикаментозного воздействия на метаболические нарушения, связанные с ИР, что позволит улучшить прогноз и снизить риск сердечно-сосудистых осложнений уже на ранних этапах, когда заболевание еще не сформировалось как диагноз.
Биотрансформация лекарственных средств осуществляется в печени под действием цитохромов Р-450. Цитохромы Р-450 относятся к энзимам, участвующим в биотрансформации и выведении (дезинтоксикация) органических, чужеродных веществ (ксенобиотиков) из организма. Реакции, катализированные этими энзимами, делятся на реакции I фазы (функциональные) и реакции II фазы (конъюгационные). Энзимы I фазы (например, цитохром Р-450 или эпоксидгидролаза) вносят в молекулы субстрата функциональные группы, например –ОН (гидроксилирование); затем энзимы II фазы (например, глютатион-S-трансфераза, N-ацетилтрансфераза, UDP-глюкоронилтрансфераза) используют группу –ОН для конъюгации с глютатионом, сульфатом, глюкороновой кислотой, в результате чего возникают гидрофильные соединения (растворимые в воде), которые легко выводятся из организма через почки и кишечник.
У человека выделено более 30 энзимов цитохромпротеинов (CYP), которые в максимальном количестве находятся в печени. Самая многочисленная группа субстратов, метаболизируемых в печени, – лекарственные средства, эндогенные вещества (статины, стероиды, ЖК, простагландины) (3).
Ингибиторы ГМГ-КоА-редуктазы (статины – аторвастатин, ловастатин, симвастатин) метаболизируются до неактивных метаболитов под действием изофермента цитохрома Р-450 3А4 (CYP 3A4).
Липантил (фенофибрат) не взаимодействует со статинами ни на уровне цитохрома Р-450 3А4, ни на уровне глюкуронирования, он использует другие подтипы цитохрома CYP-450 и UGT (уронил-глюкуронил-трансфераза), которые не используются при метаболизме статинов. Благодаря уникальному микросомальному метаболизму в печени он также безопасен при лечении больных с ожирением и ИР в комбинации со статинами (3, 12, 17). Микронизированные фенофибраты обладают большей биодоступностью, способствуют снижению уровней Тг, снижают уровни ХС ЛПНП, увеличивают размеры частиц ЛПНП, повышают уровень ХС ЛПВП и обратный транспорт ХС за счет стимуляции a-рецептора клеточного ядра, активируемого пероксисомальным пролифератором (РРАR-a), более эффективно снижают уровень мочевой кислоты. Терапия микронизированными фенофибратами не только улучшает показатели липидного спектра крови, перекисного окисления липидов (снижение СОД и МДА, образующихся при окислительном стрессе), но и состояние эндотелия у больных ИБС, что выражается в достоверном улучшение ЭЗФР плечевой артерии, отсутствием вазоконстрикторных реакций при проведении пробы с реактивной гиперемией и снижением уровня фактора Виллебранда.
Улучшение функционального состояния эндотелия при лечении микронизированными фенофибратами носит комплексный характер: увеличивается продолжительность АЧТВ, возрастает фибринолитическая активность крови (время XIIа-зависимого фибринолиза снижается на 47%, содержание фибрин-мономерных комплексов – в 4,7 раза), снижается уровень ИАП-1. Микронизированные фенофибраты снижают экспрессию адгезивных молекул и провоспалительных цитокинов, в частности интерлейкина-6, TNF-a и g-интерферона, снижают уровень С-реактивного белка (14, 16).
Положительные клинические эффекты фенофибратов при лечении пациентов с признаками МС, СД типа 2 представлены в исследованиях FIED, DAIS (12, 17). В совокупности эти наблюдения свидетельствуют о благоприятном эффекте фенофибрата на макро- и микроциркуляторное русло, который клинически проявляется снижением уровней триглицеридов на 40-55%, повышением уровня ХС ЛПВП на 15%, снижением риска осложнений ИБС на 25% (кардиопротекция), снижением прогрессирования коронарного атеросклероза на 42%, снижением прогрессирования альбуминурии на 14% (нефропротекция), снижением частоты лазерного лечения диабетической ретинопатии на 31% (офтальмопротекция).
Таким образом, не претендуя на роль универсальных гиполипидемических средств, фенофибраты имеют свою нишу в лечении больных с дислипидемией и инсулинорезистентностью. Они рекомендованы к применению у лиц с низким уровнем ЛПВП, высоким уровнем ТГ и нормальным или умеренно повышенным уровнем ЛПНП. Такой липидный профиль характерен для больных СД типа 2, лиц с инсулинорезистентностью, абдоминальным ожирением и другими проявлениями МС. Не следует также рассматривать фибраты как гиполипидемические агенты в «чистом» виде.
Эта группа препаратов имеет широкий спектр благоприятных нелипидных эффектов, среди которых особый интерес представляют противовоспалительные, антиоксидантные, антикоагулянтные эффекты, влияние на функциональное состояние эндотелия сосудистого русла. Возможно, как и в случае со статинами, именно эти свойства фибратов играют ключевую роль в снижении риска сердечно-сосудистых осложнений.
Перед практикующими врачами открываются новые возможности для эффективного снижения риска развития сердечно-сосудистых осложнений и летальности. Данные проведенных многоцентровых исследований убедительно показывают, что статины могут быть препаратами выбора для первичной и вторичной профилактики клинических проявлений атеросклероза, в частности ИБС. В настоящее время у врачей первичного звена здравоохранения имеется широкий выбор липидснижающих препаратов с различными механизмами действия, понимание которых позволит назначить патогенетически обоснованную липидснижающую терапию у больных с высоким риском и МС (в том числе СД типа 2). При лечении ИБС, ассоциированной с клиническими признаками МС, микронизированные фибраты третьего поколения могут применяться как виде монотерапии, так и в сочетании с другими липидснижающими препаратами, в первую очередь со статинами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


