Эффективность триметазидина в качестве монотерапии при стабильной ишемической болезни сердца
- Аннотация
- Статья
- Ссылки
- English

Введение
Сердечно-сосудистые заболевания (ССЗ), в основном ишемическая болезнь сердца (ИБС), являются ведущей причиной смерти и инвалидизации взрослого населения в мире. По обновленным данным исследования глобального бремени болезней (GBD, Global Burden of Disease Study 2019), включавшего информацию из 204 стран, число смертей от ССЗ за последние 30 лет увеличилось с 12,1 до 18,6 млн [1]. Разработанный Всемирной организацией здравоохранения (ВОЗ) показатель количества лет жизни с поправкой на инвалидность – DALY (disability-adjusted life years) за указанный период удвоился – с 17,7 до 34,4 млн. При этом одной из основных причин DALY в глобальном масштабе является ИБС [1, 2]. В Российской Федерации за 2018 г. смертность от ИБС составила 308,7 на 100 тыс. населения [3].
К самой многочисленной группе пациентов с ИБС относятся больные со стабильной стенокардией, ежегодный показатель смертности среди которых по-прежнему составляет 2–3%, что в два раза превышает аналогичный показатель у пациентов без ИБС [4]. В данном аспекте улучшение тактики лечения пациентов со стабильной стенокардией остается одной из приоритетных задач общественного здравоохранения. Между тем, несмотря на успехи медикаментозной терапии данного заболевания, почти треть пациентов, принимающих антиангинальные препараты, продолжают испытывать симптомы стенокардии, существенно снижающие качество жизни [5]. Не случайно в последних клинических рекомендациях Европейского общества кардиологов по диагностике и лечению хронического коронарного синдрома (2019) [6] и рекомендациях Минздрава России по стабильной ИБС (2020) [4] сказано, что медикаментозное лечение стабильной ИБС преследует две основные цели: минимизирование и купирование симптомов и улучшение прогноза за счет снижения риска смерти и нефатального инфаркта миокарда.
Безусловно, для оптимального лечения необходимо глубокое понимание патофизиологии стабильной ИБС, поскольку механизмы, усугубляющие ишемию миокарда, могут варьироваться от пациента к пациенту [5]. Ранее считалось, что ишемия миокарда – прямое следствие только дисбаланса между потреблением и поставкой кислорода и метаболитов [7]. Тем не менее традиционный гемодинамический подход к терапии ИБС не привел к ожидаемому увеличению выживаемости, предотвращению развития симптомов стенокардии и повышению качества жизни пациентов. Обычно больным со стабильной стенокардией назначают два-три антиангинальных препарата, таких как нитраты, бета-блокаторы и блокаторы кальциевых каналов. Но поскольку эти агенты влияют на гемодинамику, сочетание нескольких лекарственных средств сопряжено с увеличением риска развития побочных эффектов [8]. Кроме того, при регулярном приеме нитратов может развиваться толерантность. Следовательно, в таких случаях необходимо менять фармакологический подход, отдавая предпочтение альтернативным и в то же время эффективным методам лечения. В связи с этим медикаментозная терапия стабильной стенокардии предполагает применение препаратов, влияющих не только на улучшение кровотока и гемодинамики, но и на метаболические пути развития ишемии.
Действительно, в клинической практике врач нередко сталкивается с ситуацией, требующей индивидуального подхода к пациенту со стабильной стенокардией. Поэтому следовать традиционному алгоритму подбора антиангинальной терапии не всегда удается. В качестве примера приводим историю болезни 63-летней пациентки со стенокардией напряжения II функционального класса (ФК). В этом случае лечебный эффект был достигнут при назначении монотерапии триметазидином 70 мг (Депренорм® ОД, ЗАО «Канонфарма продакшн», Россия).
Клинический случай
Больная Д., 63 года, пенсионерка. Жалобы на момент обращения на общую слабость, неприятные (жгучие) боли за грудиной при физической нагрузке средней интенсивности (ходьба в быстром темпе, подъем по лестнице на третий этаж) и выраженном психоэмоциональном напряжении, продолжающиеся не более пяти минут и проходящие в состоянии покоя.
Анамнез болезни. Пациентка считает себя больной последние один-два года, когда впервые стала отмечать боли в области сердца, купирующиеся в течение нескольких минут в состоянии покоя, снижение толерантности к физической нагрузке (болевой синдром за грудиной при умеренной физической нагрузке). Наличие в анамнезе гипертонической болезни отрицает. По словам пациентки, на приеме у врача ранее уровень систолического артериального давления (АД) достигал 135 мм рт. ст., при этом привычное АД составляет 120–115/70 мм рт. ст., пульс в покое на протяжении многих лет – менее 60 ударов в минуту (в среднем, по данным дневника самоизмерения АД и пульса, – 50–55 ударов в минуту). Отмечается также выраженная реакция на психоэмоциональный стресс: возникновение давящей боли за грудиной, купируемой в покое, обычно после дыхательных практик. Наблюдается у кардиолога по месту жительства с диагнозом «ИБС: стенокардия напряжения II ФК». Рекомендованную лекарственную терапию принимала нерегулярно. Побочные эффекты возникали даже при использовании низких доз дигидропиридиновых блокаторов медленных кальциевых каналов. Пациентка отмечала возникновение головокружения, отечности голеней и стоп, головных болей. Лечащим врачом препараты данного класса были отменены и заменены на органические нитраты длительного действия, в том числе мононитраты, характеризующиеся лучшей переносимостью по сравнению с динитратами. Однако через неделю приема они также были отменены из-за возникновения выраженной головной боли. Последние две недели лекарственные средства не принимает. В результате была направлена в поликлиническое отделение Центральной клинической больницы «РЖД-Медицина» для дообследования и лечения.
Анамнез жизни. В детском возрасте перенесла корь, ветряную оспу, во взрослом возрасте – хронический гастрит, не ассоциированный с Helicobacter pylori, последнее обострение – более пяти лет назад. Наблюдается у гастроэнтеролога, соблюдает диету, при проведении плановой фиброгастродуоденоскопии (три года назад) патологии не выявлено. Последние семь лет беспокоят боли в спине, в области крупных суставов. Наблюдается у невропатолога (проходила курс лечения на аппарате «АЛМАГ» – десять сеансов, принимала местно нестероидные противовоспалительные препараты с положительным эффектом), специалиста по остеопорозу (последний курс лечения препаратами кальция и витамина D3 – полгода назад; денситометрия в начале 2018 г. – выписка не предоставлена). Осмотрена гинекологом две недели назад, выявлена сухость влагалища, назначена терапия. Гинекологический анамнез: две беременности, один аборт, одни роды, климакс с 56 лет, заместительную гормональную терапию не получала; четыре месяца назад выполнена маммография – со слов пациентки, без патологии. Острый инфаркт миокарда, острое нарушение мозгового кровообращения, сахарный диабет, вирусные гепатиты, ВИЧ, туберкулез отрицает. Травм и операций не было. Аллергологический анамнез не отягощен. Курит около семи лет – полпачки сигарет в день (индекс курения – 3,5 пачка/лет), алкоголем не злоупотребляет. Профессиональные вредности отрицает, работала заместителем начальника региональной службы. Наследственность не отягощена.
Объективный статус в момент обращения. Состояние удовлетворительное. Рост – 170 см, вес – 68 кг, индекс массы тела – 23,5 кг/м2, окружность талии – 82 см. Телосложение нормостеническое. Кожные покровы и слизистые оболочки физиологической окраски, влажности, не изменены, высыпаний нет. Отеков нет. Форма грудной клетки правильная, частота дыхательных движений – 18 в минуту, перкуторный звук над легкими ясный легочный, при аускультации – дыхание с жестким оттенком, хрипов нет. Пульс – 50 ударов в минуту, ритмичный, удовлетворительного наполнения и напряжения. АД в положении сидя: правая рука – 120/80 мм рт. ст., левая рука – 117/77 мм рт. ст. Границы относительной сердечной тупости не расширены. При аускультации сердца тоны слегка приглушены, ритмичные. Пульсация тыльной артерии стопы сохранена с обеих сторон. Живот при пальпации мягкий, безболезненный. Печень не пальпируется, перкуторно вертикальный размер по правой среднеключичной линии – 10 см. Симптом поколачивания отрицательный с обеих сторон.
Данные лабораторных и инструментальных методов исследования:
- клинический анализ крови и общий анализ мочи: без отклонений от нормальных значений;
- биохимический анализ крови: общий белок – 76,7 г/л, общий билирубин – 17 мкмоль/л, аланинаминотрансфераза – 16,5 ЕД/л, аспартатаминотрансфераза – 19,5 ЕД/л, креатинин – 81,4 мкмоль/л (скорость клубочковой фильтрации по формуле CKD-EPI – 65 мл/мин/1,73 м2), мочевина – 4 ммоль/л, глюкоза – 4,7 ммоль/л, общий холестерин – 4,03 ммоль/л, триглицериды – 0,7 ммоль/л, липопротеины низкой плотности – 2,3 ммоль/л, липопротеины высокой плотности – 1,3 ммоль/л, натрий – 138,5 ммоль/л, калий – 4,55 ммоль/л, хлор – 104,5 ммоль/л;
- электрокардиограмма (ЭКГ в 12 отведениях): синусовая брадикардия с частотой сердечных сокращений (ЧСС) 52 удара в минуту. Нормальное положение электрической оси сердца;
- суточное мониторирование ЭКГ по Холтеру: синусовая брадикардия, средняя ЧСС – 56 ударов в минуту, максимальная ЧСС днем – 82 удара в минуту, ночью – 62 удара в минуту, минимальная ЧСС днем – 50 ударов в минуту, ночью – 48 ударов в минуту. Максимальное удлинение интервала PQ до 0,19 секунды на фоне минимальной ЧСС. Нарушений ритма и проводимости не выявлено. Диагностически значимой депрессии сегмента ST при данной ЧСС не обнаружено;
- эхокардиография (ЭхоКГ): правое предсердие, апикальная четырехкамерная позиция – 3,8 × 4,7 см. Правый желудочек, парастернальная позиция – 2,5 см, свободная стенка – 0,4 см. Левое предсердие, парастернальная позиция – 3,9 см, апикальная четырехкамерная позиция – 4,0 × 5,1 см. Конечно-систолический размер левого желудочка (ЛЖ) в парастернальной позиции – 2,7 см, конечно-диастолический размер – 4,4 см. Толщина межжелудочковой перегородки в парастернальной и четырехкамерной позициях – 0,9 см, задняя стенка ЛЖ – 0,8 см. Индекс массы миокарда ЛЖ – 67,9 г/м2. Фракция выброса по Симпсону – 69%, конечно-систолический объем ЛЖ – 27 мл, конечно-диастолический объем – 85 мл, ударный объем – 58 мл. Аортальный клапан трехстворчатый, створки плотные, раскрытие створок – 1,9 см. Митральный клапан – створки плотные, движение противофазное, раскрытие створок – 2,8 см. Аорта – стенки плотные, диаметр корня – 3,0 см. Нижняя полая вена – 2,1 см, коллабирование больше 50%. Систолическое давление в легочной артерии – 21 мм рт. ст. При допплероэхокардиографии регургитация 1-й степени на митральном и трикуспидальном клапанах;
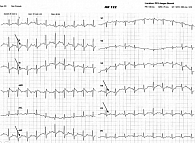
- тредмил-тест: проведен тест с дозированным ступенчатым возрастанием интенсивности ходьбы на бегущей дорожке по классическому протоколу BRUCE. Исследование проводилось в отсутствие антиангинальной терапии в течение двух недель. Исходно: на ЭКГ – синусовая брадикардия, средняя ЧСС – 53 в минуту, АД – 118/78 мм рт. ст. Достигнута нагрузка в 5,5 МЕТ (69%), на высоте нагрузки ЧСС – 83 в минуту (61% от субмаксимальной ЧСС, прогнозируемой для данной возрастной группы). АД при максимальной нагрузке – 140/80 мм рт. ст. Продолжительность нагрузки – 7 минут 20 секунд. При нагрузке зарегистрирована горизонтальная депрессия сегмента ST во II, III, aVF и левых грудных отведениях до 1,3 мм, нарушения ритма и проводимости не зафиксированы. На высоте нагрузки пациентка жаловалась на выраженную общую усталость, дискомфорт за грудиной без иррадиации. Восстановительный период – 12 минут 2 секунды, АД – 122/76 мм рт. ст. ЧСС – 58 ударов в минуту. Жалобы купировались самостоятельно. Заключение: проба сомнительная. Толерантность к нагрузке средняя. Реакция АД по нормотоническому типу. Нарушения ритма и проводимости не индуцированы (рис. 1).
На основании жалоб, анамнеза и данных лабораторно-инструментальных методов исследования был подтвержден диагноз ИБС: стенокардии напряжения II ФК. Из-за плохой переносимости дигидропиридиновых антагонистов кальция и нитратов, невозможности применения бета-блокаторов в связи с брадикардией было принято решение назначить пациентке метаболическую антиишемическую терапию триметазидином (Депренорм® ОД, ЗАО «Канонфарма продакшн», Россия) в дозе 70 мг один раз в сутки утром. С целью профилактики сердечно-сосудистых осложнений помимо антиангинальной терапии также были назначены антиагрегант (ацетилсалициловая кислота с гидроокисью магния) в дозе 75 мг один раз в сутки вечером (КардиАСК® Магний, ЗАО «Канонфарма продакшн», Россия) и аторвастатин в дозе 20 мг (Аторвастатин, ЗАО «Канонфарма продакшн», Россия) с дальнейшей титрацией.
Через две недели на контрольном визите пациентка отметила улучшение общего самочувствия, отсутствие ангинозных болей в области сердца при физической нагрузке и психоэмоциональном напряжении, повышение толерантности к физическим нагрузкам. Кроме того, однократный режим дозирования препарата Депренорм® ОД способствовал повышению приверженности пациентки постоянному приему антиангинальной терапии. При объективном осмотре АД – 120/80 мм рт. ст., пульс ритмичный с частотой 57 ударов в минуту. На ЭКГ и ЭхоКГ в динамике – без значимых изменений. При контрольном тредмил-тесте, выполненном по протоколу BRUCE: исходно на ЭКГ синусовая брадикардия с частотой ритма 57 ударов в минуту, АД – 115/75 мм рт. ст. Максимальная мощность нагрузки – 7,0 МЕТ. Продолжительность нагрузки – 7 минут 50 секунд. Максимально выполненная нагрузка – 8,9 МЕТ (127%), на высоте нагрузки ЧСС – 120 в минуту. АД при максимальной нагрузке – 142/80 мм рт. ст. Во время нагрузки пациентка жалоб не предъявляла. При ЧСС выше 110 ударов в минуту в левых грудных отведениях зарегистрирована косовосходящая депрессия сегмента ST до 0,3 мм, нарушения ритма и проводимости не зафиксированы. Восстановительный период длился 11 минут 40 секунд. За это время пациентка жалоб не предъявляла, АД – 120/78 мм рт. ст., ЧСС – 61 удар в минуту. Заключение: проба отрицательная. Толерантность к нагрузке высокая. Реакция АД по нормотоническому типу. Нарушения ритма и проводимости не индуцированы (рис. 2).
В связи с тем что на фоне лечения приступы ангинозных болей не рецидивировали, увеличилась толерантность к физической нагрузке, отмечалась положительная динамика по данным инструментального обследования, терапия хорошо переносилась, пациентке рекомендовали продолжать прием триметазидина с контрольным проведением нагрузочного теста через три месяца.
Обсуждение
Представленный клинический случай демонстрирует эффективность монотерапии триметазидином, на фоне которой была достигнута одна из двух основных целей лечения стабильной стенокардии – купировался болевой синдром, повысилось качество жизни пациентки.
Применение метаболической терапии при ишемии миокарда признано патогенетически обусловленным более 20 лет назад [9]. Во время легкой или умеренной ишемии миокарда кардиомиоциты для поддержания ионных градиентов и гомеостаза обмена кальция вырабатывают адекватное количество молекул аденозинтрифосфорной кислоты (АТФ) за счет ускорения поглощения глюкозы [8]. Однако при длительной и тяжелой ишемии, несмотря на высокую скорость образования лактата, миокард продолжает получать часть энергии за счет бета-окисления жирных кислот [10]. При таком переключении метаболических путей из-за конкурентного взаимодействия субстратов происходит ингибирование окисления глюкозы. Энергетически более выгодным способом производства молекул АТФ является полное окисление жирных кислот, но не глюкозы. Однако этот процесс требует более высокого потребления кислорода. В условиях ишемии, когда не происходит адекватного поступления кислорода к кардиомиоцитам, окисление жирных кислот способствует не только снижению синтеза молекул энергии, но и накоплению недоокисленных продуктов обмена веществ и активных форм кислорода, еще больше угнетающих работу митохондриальной дыхательной цепи [7]. Эти метаболические изменения приводят к сократительной недостаточности и электрической нестабильности сердечной мышцы, усугубляя тем самым ишемию и провоцируя нарушения сердечного ритма. Стратегии медикаментозного влияния на модуляцию метаболизма энергетических субстратов направлены либо на стимуляцию окисления глюкозы, либо на ингибирование окисления жирных кислот [11]. Последнее достигается за счет прямого блокирования ферментов, участвующих в бета-окислении.
Триметазидин является первым препаратом в классе метаболической защиты ишемического миокарда [12]. Эффект триметазидина основан на ингибировании фермента, катализирующего терминальную реакцию бета-окисления жирных кислот, – длинноцепочечный 3-кетоацилкофермент А тиолазу (3-KAT), за счет чего происходит смещение метаболизма сердечной энергии с окисления жирных кислот на окисление глюкозы [13]. Эти метаболические изменения подтверждены в клинических условиях: триметазидин действительно повышает уровни высокоэнергетических фосфатов в миокарде у пациентов с сердечной недостаточностью [14].
Согласно данным метаанализа 23 рандомизированных исследований, триметазидин улучшает симптомы стенокардии по сравнению с плацебо или другими антиангинальными препаратами [15].
Кокрейновский метаанализ показал, что антиангинальные эффекты данного препарата сопоставимы с эффектами других антиангинальных средств [16].
В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании TRIMetazidine in POLand (TRIMPOL) II [17], в котором участвовали 426 пациентов со стабильной стенокардией, оценивали противоишемическую эффективность и переносимость триметазидина в дозе 20 мг три раза в день в комбинации с метопрололом в дозе 50 мг два раза в день. В результате через 12 недель применения комбинации метаболического агента с бета-блокатором отмечались значимое сокращение времени до депрессии сегмента ST на 1 мм при проведении тредмил-теста, улучшение толерантности к физической нагрузке, уменьшение частоты приступов стенокардии по сравнению с приемом метопролола и плацебо. Аналогичная эффективность наблюдалась и в подгруппе пациентов с рецидивирующей стенокардией, которым была выполнена реваскуляризация: время до депрессии сегмента ST увеличилось (более 80 секунд) по сравнению с группой плацебо (р < 0,01). Такой же значимый результат отмечался и в отношении времени продолжительности нагрузки (р = 0,03). Среднее количество приступов стенокардии в неделю у пациентов, получавших триметазидин, снизилось по сравнению с пациентами, принимавшими плацебо (p < 0,01) [17].
A.P. Michaelides и соавт. в рандомизированном двойном слепом контролируемом исследовании с участием пациентов со стенокардией, у которых были симптомы, несмотря на прием пропранолола, продемонстрировали, что добавление триметазидина снижает в два раза среднее количество приступов стенокардии по сравнению с добавлением изосорбида динитрата [18].
В исследовании VASCO-angina study оценивали эффективность влияния триметазидина на функциональную способность 1962 пациентов в возрасте старше 50 лет с симптомами стабильной стенокардии напряжения [19]. Исследователи изучали не только антиангинальную способность триметазидина, но и безопасность стандартных и высоких доз с модифицированным высвобождением (70 и 140 мг в день) у бессимптомных и симптомных лиц, получавших фоновое лечение атенололом. В результате переносимость физической нагрузки в группе пациентов, принимавших триметазидин, была статистически значимо выше, чем в группе плацебо (р = 0,004). Таким образом, исследование VASCO-angina подтвердило эффективность и переносимость стандартных и высоких доз триметазидина у пациентов с хронической стабильной стенокардией, получавших фоновые бета-адреноблокаторы [19].
Кроме того, в метаанализе 218 исследований с участием 19 028 пациентов также показано улучшение толерантности к физической нагрузке у пациентов со стабильной стенокардией (по данным стресс-теста): +46 секунд (95% доверительный интервал (ДИ) 28–66) для общей продолжительности нагрузки, +55 секунд (95% ДИ 35–77) для депрессии сегмента ST на 1 мм и +54 секунды (95% ДИ 24–84) для времени до начала стенокардии в пользу триметазидина [20].
В исследовании, выполненном научными сотрудниками медицинского университета им. И.И. Мечникова, трехмесячная терапия триметазидином (35 мг два раза в день) у пациентов с микрососудистой стенокардией ассоциировалась с лучшим контролем симптомов стенокардии по сравнению с традиционной терапией (бета-блокаторы или блокаторы кальциевых каналов, статины, антиагреганты, нитраты длительного действия) [21]. Более того, наблюдалось улучшение функции эндотелия и перфузии миокарда [21]. Особенность данного метаболического агента заключается в том, что все эти эффекты происходят без какого-либо обнаруживаемого хронотропного или вазомоторного эффекта.
Метаанализ 17 исследований, проведенный D. Gao и соавт. [22], показал значительный защитный эффект триметазидина в отношении общей смертности, сердечно-сосудистых событий и госпитализации. Кроме того, исследователи сообщают о некоторых противовоспалительных и кардиопротективных свойствах триметазидина: ослабляя активацию нейтрофилов, он защищает постишемическое сердце от повреждения, опосредованного нейтрофилами [23].
Заключение
Уникальность данного клинического случая состоит в том, что из-за устойчивой брадикардии, отечного синдрома на фоне приема дигидропиридиновых антагонистов кальция не представлялось возможным назначить пациентке первую линию антиангинальной терапии, предусматривающую, в соответствии с клиническими рекомендациями Минздрава России по стабильной ИБС (2020) [4], применение бета-адреноблокаторов и/или блокаторов кальциевых каналов. Последующая лечебная тактика при низкой ЧСС (менее 60 ударов в минуту) подразумевала назначение препаратов второй линии из группы антигипоксантов/антиоксидантов или органических нитратов [4]. Однако их использование также оказалось невозможным из-за развития частого для них побочного эффекта – «нитратной» головной боли. В результате препаратом выбора стал триметазидин, который, согласно рекомендациям по лечению стабильной ИБС, относится к препаратам второй линии терапии стабильной ИБС [4] и эффективен в отношении улучшения общего самочувствия, купирования приступов ангинозных болей и увеличения толерантности к физической нагрузке.
В клиническом случае описан позитивный клинический эффект препарата триметазидина – Депренорм® ОД (ЗАО «Канонфарма продакшн», Россия). Согласно позиции ВОЗ и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, препараты, прошедшие исследования на биоэквивалентность и терапевтическую эквивалентность оригинальным препаратам, можно применять в клинической практике вместо оригинальных. Такие лекарственные средства являются взаимозаменяемыми [24, 25]. Препарат Депренорм® ОД имеет доказанную биоэквивалентность оригинальному препарату триметазидина [26]. Кроме того, в российском многоцентровом открытом рандомизированном исследовании КАРДИОКАНОН [26] с участием 120 пациентов со стабильной стенокардией II–III ФК в двух параллельных группах эффекты препарата Депренорм® ОД были сопоставимы с эффектами оригинальных препаратов: в обеих группах зафиксированы сопоставимое снижение уровня систолического и диастолического АД (р = 0,22 и р = 0,10 соответственно), ЧСС (р = 0,22), уровня холестерина липопротеинов низкой плотности (р = 0,21), липопротеинов высокой плотности (р = 0,15), общего холестерина (р = 0,07), уменьшение частоты приступов стенокардии в неделю (р = 0,06) и количества принятых таблеток нитроглицерина в неделю для купирования ангинозных болей (р = 0,06) [26].
Использование триметазидина при стабильной стенокардии нашло отражение в последних российских и европейских клинических рекомендациях [4, 6]. В них сказано, что триметазидин следует добавлять к терапии препаратами первой линии в случае их недостаточной эффективности, а также рассматривать в качестве препарата выбора для снижения частоты ангинозных приступов и улучшения толерантности к физической нагрузке у пациентов, которые имеют противопоказания или у которых симптомы неадекватно контролируются бета-блокаторами, блокаторами кальциевых каналов и нитратами длительного действия либо на фоне терапии указанными лекарственными средствами у них появляются нежелательные реакции, требующие снижения дозы или отмены препарата. Рекомендуется рассмотреть возможность более раннего назначения триметазидина у пациентов с артериальной гипотензией и/или брадикардией из-за отсутствия у него гемодинамического эффекта [4, 6].
Таким образом, триметазидин является единственным метаболическим цитопротектором, эффективность которого подтверждена в экспериментальных и клинических исследованиях, его использование закреплено в рекомендациях. Исходя из этого, данный препарат следует активно включать в схемы лечения пациентов со стабильной ИБС.
Статья подготовлена при поддержке компании ЗАО «Канонфарма продакшн».
O.A. Polyakova, PhD1, A.I. Kochetkov, PhD, E.V. Mironova, PhD, O.D. Ostroumova, PhD, Prof.
Russian Medical Academy of Continuous Professional Education
Central Clinical Hospital ‘Russian Railways-Medicine’
Contact person: Olga A. Polyakova, docpolyakova.olga@gmail.com
Cardiovascular diseases (CVD) are the leading cause of death and disability of the adult population worldwide. The key position in the structure of causes of death from CVD is occupied by coronary heart disease, the most common form of which is stable angina pectoris. The goals of treating patients with chronic angina should focus on relieving symptoms and reducing the mortality rate so that the patient can feel better and live longer. The traditional hemodynamic approach to the treatment of coronary heart disease is based on the fact that an increase in the supply of oxygen and a decrease in the oxygen demand of cardiomyocytes will improve the symptoms. However, the data of clinical studies demonstrate that about a third of patients, despite the ongoing antianginal therapy, continue to experience anginal pain. The traditional approach to the treatment of stable angina pectoris mainly includes drugs that affect the parameters of blood circulation (heart rate, blood pressure level), but there is also a group of metabolically active agents that have an anti-ischemic effect due to completely different, non-hemodynamic mechanisms. The article presents a clinical case demonstrating the effectiveness of trimetazidine monotherapy in the treatment of stable coronary heart disease, provided that there is no possibility of using first-line drugs (beta-blockers, calcium antagonists and nitrates). Trimetazidine modulates the metabolism of the heart without changing hemodynamic functions, therefore it is an optimal option in this clinical situation. It has a beneficial effect on the inflammatory profile and endothelial function and demonstrates various advantages by reducing the number and intensity of angina attacks and improving the clinical signs and symptoms of myocardial ischemia with monotherapy, as well as in combination with other antianginal agents. Modulators of cardiac metabolism open the way to a deeper understanding of coronary heart disease and its general clinical manifestations as an energy disorder, and not just an imbalance between the need and supply of oxygen and metabolites.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.