Возможности коррекции церебральной ишемии с помощью ключевого метаболита дыхательной цепи митохондрий – цитохрома С
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены фундаментальные механизмы церебрального ишемического повреждения, в основе которых лежит развитие митохондриальной недостаточности. Особое внимание уделено роли цитохрома С. Описаны механизмы участия цитохрома С в процессах повреждения клетки, а также его защитный (антиоксидантный) потенциал при ряде патологий, включая церебральное ишемическое повреждение. Обозначены потенциальные возможности терапевтического использования экзогенного цитохрома С при острых и хронических цереброваскулярных заболеваниях.
В статье рассмотрены фундаментальные механизмы церебрального ишемического повреждения, в основе которых лежит развитие митохондриальной недостаточности. Особое внимание уделено роли цитохрома С. Описаны механизмы участия цитохрома С в процессах повреждения клетки, а также его защитный (антиоксидантный) потенциал при ряде патологий, включая церебральное ишемическое повреждение. Обозначены потенциальные возможности терапевтического использования экзогенного цитохрома С при острых и хронических цереброваскулярных заболеваниях.
Введение
Мозг человека является самым мощным потребителем энергии в организме, на него приходится около 25% всех метаболических затрат. При этом вес мозга, как правило, не превышает 2,5% массы тела. С учетом высочайших энергетических потребностей мозг крайне чувствителен к нарушениям кровотока. Для поддержания нормальной работы средний уровень церебрального кровотока должен составлять около 50 мл/100 г ткани мозга в минуту. Данный показатель обеспечивается за счет функционирования ряда механизмов, объединяемых термином «церебральная ауторегуляция» [1]. При нарушении церебрального кровотока, снижении или, наоборот, избыточном увеличении, например на фоне сосудистого спазма, происходят снижение перфузии мозга и развитие церебральной ишемии. При острейшем развитии церебральной ишемии, а именно снижении объемной скорости церебрального кровотока менее 30 мл/100 г в минуту обычно говорят о развитии ишемического инсульта. В то же время длительное, но не критическое снижение скоростных показателей под влиянием сосудистых факторов риска способствует развитию хронической церебральной ишемии [2]. Независимо от этиологии ишемию головного мозга всегда сопровождает каскад патобиохимических изменений, или ишемический каскад, обусловленный снижением мозгового кровотока, который при неблагоприятном течении заболевания и/или недостаточной коррекции завершается необратимым повреждением нервной ткани по механизмам некроза и апоптоза. Все этапы ишемического каскада развиваются в первые минуты и часы ишемического поражения головного мозга и, взаимно потенцируя действие друг друга, приводят к тяжелому функционально-морфологическому повреждению вещества мозга. Первым важнейшим механизмом запуска ишемического каскада является снижение мозгового кровотока с развитием дефицита кислорода, а следовательно, дефицита энергии. В условиях недостатка перфузии получение энергии осуществляется за счет анаэробного гликолиза, реакции которого завершаются образованием только двух молекул аденозинтрифосфорной кислоты (АТФ) и накоплением лактата. На ранних этапах ишемии клеточный ацидоз можно рассматривать как защитную реакцию, поскольку снижение рН оказывает стабилизирующее действие на клеточные мембраны. Однако прогрессирование ацидоза вызывает денатурацию ряда клеточных белков. В дальнейшем из-за нарастания лактатацидоза блокируются и процессы анаэробного гликолиза, в клетке формируется истинный дефицит АТФ. На второй стадии ишемического каскада, через 10–30 минут от момента его возникновения, происходит выброс глутамата с развитием глутаматной эксайтотоксичности. Возбуждение глутаматных NMDA-рецепторов, регулирующих содержание K+, Na+, Са2+, Cl во вне- и внутриклеточном пространстве, активирует Ca-каналы, что приводит к усилению поступления внеклеточного Са2+ в клетку и высвобождению внутриклеточного Са2+ из депо и, как следствие, активации различных ферментных систем. В результате нарушается фосфорилирование белков, расщепляются фосфолипиды и высвобождается арахидоновая кислота, образуются токсичные продукты, свободные радикалы, оказывающие цитотоксическое, иммуногенное и мутагенное действие, повреждающие митохондрии, клеточную ДНК и РНК [3].
Таким образом, при церебральной ишемии повреждаются все клеточные элементы, но ключевой структурой, разрушение которой приводит к развитию всех последующих патофизиологических реакций, является митохондрия.
Уникальность митохондрии млекопитающих в отличие от других органелл клетки заключается в обладании собственной ДНК, кодирующей 13 субъединиц ферментов дыхательной цепи, 22 транспортные РНК и две рибосомальные РНК [4]. В митохондрии протекают все реакции цикла Кребса, в ходе которого за счет утилизации соответствующих субстратов происходят транспорт электронов и образование внутриклеточных запасов энергии в виде АТФ. Митохондрия более чем на 90% удовлетворяет энергетические потребности своей клетки. Однако функция митохондрии не ограничивается только производством энергии. Другими важнейшими системами поддержания внутриклеточного гомеостаза являются участие в транспорте ионов кальция и образование активных форм кислорода (АФК) [5, 6]. Баланс между процессом производства энергии и процессом образования АФК в митохондрии обеспечивает нормальную работу клетки. Сдвиг данного равновесия в сторону увеличения образования АФК лежит в основе развития не только ишемического поражения головного мозга, но и многих других патологических состояний, включая нейродегенеративные, онкологические заболевания, сахарный диабет [7, 8]. Митохондрия играет ключевую роль в процессах старения, что сопровождается снижением способности производить энергию и накоплением поврежденных митохондрий, в том числе митохондрий с большим количеством мутаций ДНК [9]. В процессе работы транспортной цепи электронов наряду с образованием АТФ происходит образование АФК. Показано, что до 2% используемого кислорода может трансформироваться в супероксидный анион (O2•-) [10]. Таким образом, от правильной работы митохондрии зависит как выживаемость отдельной клетки, так и здоровье живых организмов в целом. В случае преобладания негативных внутриклеточных сигналов возможен запуск так называемого внутреннего пути апоптоза II типа. Данный тип апоптоза называется также митохондриальным, поскольку запускается при повреждении митохондриальной мембраны и включает цикл реакций, в которых участвуют ферменты дыхательной цепи, что в конечном итоге приводит к гибели клетки [11]. В условиях ишемического повреждения мозга митохондрия является одной из наиболее уязвимых внутриклеточных структур. Нарушение ее функционирования, с одной стороны, приводит к критическому дефициту энергии, с другой – запускает процесс программируемой клеточной смерти.
Важнейшим ферментом дыхательной цепи митохондрий, с которым связаны процессы образования энергии и соответственно выживания клетки, а также процессы апоптотической гибели клетки, является цитохром С.
Цитохром С
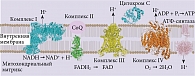
Цитохром С (Cytc) – пептид, состоящий из 104 аминокислот, с которыми ковалентно через тиоэфирные мостики связана железосодержащая группа гем (Heme). Группа Heme связана с основным пептидом в His18- и Met80-позициях, образуя аминокислотные лиганды. Мощный окислительно-восстановительный потенциал Cytc связан именно со специфическим расположением группы Heme внутри пептида. Основная часть группы Heme гидрофобна, лишь 7,5% поверхности обладает гидрофильной способностью. Эта часть и ответственна за перенос электронов с Q-цитохром С-оксидоредуктазы – комплекса, расположенного на внутренней мембране митохондрии, – на цитохром С-оксидазу [12]. Процесс окислительного фосфорилирования, протекающий на внутренней мембране митохондрии и включающий этапы электронного транспорта, приводит к синтезу АТФ (рис. 1) [13]. В этом процессе участвует ряд субстанций – доноров электронов, таких как NADH и FADH2, а также ряд белков, обладающих многоплановой биологической активностью и называемых комплексами: комплекс I – убихинон-оксидоредуктаза, комплекс II – сукцинат-редуктаза, комплекс III – Q-цитохром С-оксидоредуктаза (bc1), комплекс IV – цитохром С-оксидаза и комплекс V – АТФ-синтаза. В процессе транспорта электронов на митохондриальной мембране генерируется так называемый митохондриальный мембранный потенциал (ΔΨm). NADH-дегидрогеназа, комплекс III и цитохром С-оксидаза прокачивают протоны из митохондриального матрикса в межмембранное пространство. Конечным этапом образования АТФ считается утилизация мембранного потенциала АТФ-синтазой, являющейся по сути «микромотором», преобразующим мембранный потенциал в химическую и кинетическую энергию [14]. Cytc «работает» на конечном этапе переноса электронов с bc1-комплекса на цитохром С-оксидазу. Таким образом, Cytc – ключевой митохондриальный белок, выполняющий важнейшую роль в процессе синтеза энергии.
Большинство митохондриальных белков экспрессируются вне митохондрии. Сказанное относится и к цитохрому С. Соответственно они должны определенным образом поступать в митохондрию. Данный процесс реализуется с помощью специфических белков – транслоказ, связывающих внутреннюю и наружную мембраны митохондрии. Следует отметить, что в процессе переноса внутрь митохондрии белки, как правило, трансформируются из неактивных апоформ в активные, связанные с ко-факторами холоформы. Но для этого процесса также требуется ряд ферментов. В частности, Cytc транспортируется внутрь митохондрии в виде апоцитохрома С. Присоединение группы Heme приводит к трансформации в зрелую форму цитохрома С. Данный процесс катализируется ферментом холоцитохром С-синтазой [15]. В межмембранном пространстве митохондрии находится ряд важных, функционально связанных с цитохромом С белков – Erv1 и Mia40. В частности, Mia40 является участником процесса передачи электронов для цитохрома С [16]. Синтез АТФ регулируется за счет контроля активности процессов переноса электронов и блокируется посредством связывания АТФ с цитохромом С и цитохром С-оксидазой. Данный механизм работает по принципу обратной связи [17]. Еще одним механизмом регуляции активности цитохрома С является процесс фосфорилирования аминокислоты тирозина, что приводит к значимому снижению способности переноса электронов на цитохром С-оксидазу и соответственно подавлению процессов митохондриального дыхания [8]. В условиях ишемического повреждения нарушается процесс переноса апоцитохрома С внутрь митохондрии, а также регуляция активности Cytc за счет процессов связывания с АТФ и фосфорилирования тирозина, что усугубляет повреждение клетки.
Cytc выполняет важную роль в процессах тканевого дыхания. Установлено его участие в процессах образования и утилизации активных форм кислорода (АФК). Традиционно к активным формам кислорода причисляют супероксидный анион – ион молекулы кислорода с неспаренным электроном (O2•-), высокореакционный и короткоживущий радикал (•OH), образованный соединением атомов кислорода и водорода, а также перекись водорода (H2O2), не являющуюся свободным радикалом. Термин «свободный радикал» относится к любой молекуле, содержащей атом кислорода, стремящийся заполнить недостающий электрон на своей орбите за счет других молекул. Наличие в структуре переходных металлов характерно для свободных радикалов. Свободные радикалы – универсальные окислители, повреждающие ДНК и другие структуры клетки.
АФК в избытке образуются в митохондрии в результате работы цепи переноса электронов. Основными «пунктами» образования АФК являются NADH (комплекс I), комплекс bc1 (комплекс III) и убихинон. Комплекс I генерирует АФК на митохондриальном матриксе, комплекс III высвобождает АФК в митохондриальный матрикс и межмембранное пространство. Избыточная активность данных процессов в итоге приводит к активации реакций апоптоза [9]. Образование свободных радикалов – непрерывный процесс, протекающий в каждой клетке и требующий определенных регуляторных механизмов. Например, фермент супероксиддисмутаза обезвреживает супероксидные радикалы до перекиси водорода, в дальнейшем утилизируемой каталазой. Одной из функциональных особенностей цитохрома С также является способность обезвреживать свободные радикалы на внутренней мембране (выступает донатором электрона и восстанавливает супероксидный радикал до О2). Впоследствии этот электрон может участвовать в синтезе энергии, восстанавливая окисленную форму цитохрома С посредством транслокации через цитохром С-оксидазу [20]. Кроме того, в исследовании Z.B. Wang и соавт. (2003) показано, что цитохром С способен улавливать Н2О2 [21]. Таким образом, последовательно проходя циклы окисления/восстановления, цитохром С является универсальным внутриклеточным антиоксидантом, сочетая в себе возможности донатора электронов и окислителя.
Цитохром С участвует в процессах старения клетки. В частности, в ряде исследований показано, что с возрастом увеличивается фосфорилирование одного из регуляторных внутримитохондриальных белков p66shc, что приводит к увеличению количества свободных радикалов и интенсивности окислительного стресса [22]. Окисление p66shc происходит за счет получения электрона от цитохрома С [23]. В исследованиях клеточных линий, лишенных p66shc, количество свободных радикалов было ниже. Эти клетки были в меньшей степени подвержены окислительному повреждению после обработки перекисью водорода или ультрафиолетового облучения [24]. Увеличение количества свободных радикалов по механизму фосфорилирования p66shc является одним из механизмов запуска апоптоза и обусловлено нарастанием окисления цитохромом С кардиолипина – одного из ключевых фосфолипидов внутренней мембраны митохондрии [25]. Cytc играет ключевую роль в процессах апоптоза. Cytc, высвобождаясь в цитозоль клетки, связывается с белковым фактором, активирующим апоптоз (Apaf-1). Данный комплекс в свою очередь объединяется с деоксиаденозинтрифосфатом (dATF), что необходимо для формирования апоптосомы [26]. Цитохром С также участвует в процессе активации каспаз. В одном из исследований в клеточных линиях, лишенных гена Cytc, активность каспазы-3 была существенно ниже при стимуляции клеток активатором апоптоза [27]. В других исследованиях Cytc запускал апоптоз, связываясь с рецептором IP3, что способствовало накоплению кальция внутри клетки, активации калпаина (кальций-активируемая цистеиновая протеаза) и высвобождению апоптоз-индуцирующего фактора (AIF) (белок, запускающий повреждение хроматина и фрагментацию ДНК) [8].
Высвобождение Cytc из митохондрий носит обратимый характер. В патологических условиях, характеризующихся интенсивным образованием активных форм кислорода, выход цитохрома С в цитозоль увеличивается. В одном из экспериментальных исследований были получены интересные данные. В условиях экспериментального сепсиса внутривенное введение цитохрома С увеличивало обратный захват митохондриями кардиомиоцитов Cytc, что способствовало нормализации дыхательной функции митохондрий и достоверному увеличению количества выживших животных по сравнению с животными, не получавшими цитохром С [29]. Обратный захват, вероятно, обусловлен наличием в структуре Cytc эпитопов пептида, ответственного за пенетрацию (CPP) [30]. При апоптозе происходит перераспределение Cytc. Около 40% с внутренней мембраны митохондрии перемещается на наружную мембрану, где образуется комплекс «цитохром С – кардиолипин-пероксидаза» и затем происходит окисление кардиолипина. При этом в мембране митохондрии формируются поры, через которые цитохром С и другие участники реакций апоптоза выходят в цитозоль клетки [31]. Как уже отмечалось, комплекс «Cytc – Apaf-1» является ключевым в каскаде апоптоза. Образование данного комплекса регулируется через реакцию фосфорилирования цитохрома С. Фосфорилирование аминокислоты Tyr97 цитохрома С приводит к образованию ионного мостика с соседней аминокислотой Lys7 и блокированию процесса формирования апоптосомы. Для формирования апоптосомы необходим ряд аминокислот. Lys7 одна из них [32]. Таким образом, в патологических условиях, включая церебральную ишемию, Cytc играет ключевую роль в индукции апоптоза. Однако имеются экспериментальные данные, свидетельствующие о том, что Cytc, высвобождаясь в цитозоль клетки, способен инициировать антиапоптотический путь, связываясь с цитоплазматическим белком теплового шока 27 [33]. Кроме того, антиокислительный потенциал Cytc за счет окисления супероксидного радикала обусловливает подавление процессов апоптоза [34]. В то же время рассматривать апоптоз как однозначно патологический процесс неверно, так как посредством индукции и модуляции апоптоза через запуск различных внутриклеточных сигнальных путей регулируются процессы выживания и обновления клеток, включая процессы нейропластичности [35].
Роль цитохрома С в развитии ряда заболеваний
Реакции апоптоза играют ключевую роль в патогенезе многих заболеваний. Митохондриальная дисфункция, высвобождение цитохрома С в цитоплазму клетки и последующий апоптоз описаны при инсульте, травме центральной нервной системы, боковом амиотрофическом склерозе, хорее Гентингтона, болезни Паркинсона и болезни Альцгеймера [36]. Опубликовано также большое количество экспериментальных исследований роли цитохрома С при ряде заболеваний. Еще в 1999 г. M.A. Pérez-Pinzón и соавт. в условиях экспериментальной церебральной ишемии в поврежденной ткани отмечали избыточный уровень цитохрома С. Кроме того, проведение реперфузии ассоциировалось с увеличением уровня цитохрома С [37].
H. Hu и соавт. (2020) в условиях экспериментальной ишемии изучали механизмы, лежащие в основе повышения проницаемости гематоэнцефалического барьера (ГЭБ). Авторы показали, что уровень регуляторной микроРНК miR-34a в ишемизированной ткани напрямую связан с повышением проницаемости ГЭБ. Кроме того, уровень цитохрома С был повышен в области церебральной ишемии и прямо коррелировал с уровнем miR-34a. У трансгенных животных с выключенным геном miR-34a уровень цитохрома С был в разы ниже и зона ишемии существенно меньше [38]. Таким образом, потеря цитохрома С митохондриями приводит к нарушению функционирования дыхательной цепи, с одной стороны, и уменьшает антиокислительные возможности цитохром С-оксидазы – важного регулятора уровня свободных радикалов – с другой [39].
G. Yang и соавт. (2009) обнаружили, что потеря митохондриями цитохрома С при радиационном повреждении приводит к их выраженной дисфункции [40], что может подтверждать необходимость использования Cytc в лечебных целях.
P. Pasdois и соавт. (2011) установили, что при ишемии миокарда значительно снижается уровень Cytc в митохондриях, в результате чего существенно увеличивается количество свободных радикалов [41].
Таким образом, можно предположить, что в условиях ишемического повреждения мозга цитохром С участвует во множестве разнонаправленных патобиохимических реакций, запуская апоптоз в цитозоле клетки. В то же время потеря цитохрома С митохондриями приводит к снижению активности процессов клеточного дыхания и нарастанию внутримитохондриального окислительного стресса.
В последние годы появились исследования роли цитохрома С и других участников цепи переноса электронов в развитии хронических цереброваскулярных заболеваний. В экспериментальном исследовании D.S. Martin и соавт. (2002) оценивалась связь старения мозга с уровнем цитохрома С. Авторы показали, что у старых лабораторных животных в ткани мозга возрастает концентрация важного провоспалительного цитокина – интерлейкина (ИЛ) 1-бета, активируется протеин р38, являющийся одной из митоген-активирующих киназ (МАР). При этом увеличивается выход цитохрома С из митохондрий. Лечение специфическим блокатором р38 (SB203580) способствует нормализации уровня цитохрома внутри митохондрий [42].
В экспериментальной работе A. Auchter и соавт. (2020) моделировали лабораторным животным условия хронической церебральной ишемии – с обеих сторон перевязывались сонные артерии. Подобная процедура не критична для крыс, поскольку у большинства пород отмечается замкнутость виллизиева круга. Авторы выявили снижение во многих отделах мозговой коры уровня цитохром С-оксидазы. На протяжении месяца после операции животным на фоне введения метилтиониния хлорида выполняли когнитивное тестирование. Одной из фармакодинамических особенностей данного препарата является способность стимулировать активность цитохром С-оксидазы. В исследовании было выявлено, что животные, получавшие метилтиониния хлорид, имели достоверно менее значимое снижение активности цитохром С-оксидазы и менее значимое снижение когнитивных способностей. Исследователи предположили, что одним из направлений нейропротекции может быть именно медикаментозная активация комплексов, участвующих в цепи переноса электронов [43].
Ученые оценивали уровень маркера апоптоза – протеина Bax и цитохрома С у лабораторных животных с моделью экспериментальной церебральной гипоперфузии. Авторы обнаружили, что уровень Bax и цитохрома С был существенно выше в мозге животных с моделью хронической ишемии, причем экспериментальное лечение животных экстрактом корня пиона (биологически активная добавка, используемая в традиционной китайской медицине) способствовало нормализации уровня исследуемых субстанций [44].
В ряде работ показана роль цитохрома С в развитии некоторых нейродегенеративных заболеваний. Так, в исследовании K. Ashutosh и соавт. (2016) на модели экспериментальной болезни Паркинсона наблюдалось увеличение уровня цитохрома С в пораженных нейронах черной субстанции. Кроме того, в них были выявлены комплексы, состоящие из цитохрома С и альфа-синуклеина. В частности, в присутствии цитохрома С отмечалась значимая олигомеризация альфа-синуклеина [45].
Имеются данные о роли цитохрома С в процессах нейровоспаления, играющих ключевую роль в развитии нейродегенерации. A.K. Au и соавт. (2012) показали, что в патологических условиях цитохром С высвобождается не только в цитозоль клетки, где инициирует реакции апоптоза, но и в межклеточное пространство. Ученые обнаружили избыточную концентрацию цитохрома С в цереброспинальной жидкости у пациентов с черепно-мозговой травмой [46].
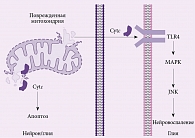
Высвобождаясь в межклеточное пространство, цитохром С связывается с толл-подобными рецепторами (TLR4), в результате чего запускается янус-киназный сигнальный путь (JNK), через который регулируется активация глиальных клеток (рис. 2) [47, 48]. В результате активированные астроциты начинают экспрессировать провоспалительные цитокины ИЛ-1-бета и ИЛ-8, выполняющие важную функцию в активации нейровоспаления [48, 49]. Имеются данные о роли цитохрома С в патогенезе развития болезни Альцгеймера. Так, J.Y. Lee и соавт. (2015) исследовали возможные связи между амилоидом бета и цитохромом С. В режиме реального времени оценивали уровень цитохрома С в живой культуре нейронов на фоне воздействия на эти нейроны амилоида бета. Исследователи выявили достаточно высокий уровень высвобождения цитохрома С в клетках, инкубированных с амилоидом бета [50].
Между тем достаточно большое количество как клинических, так и экспериментальных работ посвящено изучению роли другого связанного с цитохромом С компонента дыхательной цепи митохондрий – цитохром С-оксидазы. В 2021 г. был опубликован крупный метаанализ, включивший 1372 статьи. Результаты метаанализа показали, что при болезни Альцгеймера значимо снижается уровень цитохром С-оксидазы, что потенциально может служить мишенью терапии данного заболевания [51].
Как уже отмечалось, в нормальных условиях одним из механизмов функционирования цитохрома С является утилизация активных форм кислорода за счет донации электрона, что определяет его антиокислительный потенциал. Нарушение баланса образования и утилизации свободных радикалов лежит в основе развития многих заболеваний. Соответственно антиокислительная способность цитохрома С потенциально могла бы быть использована при лечении ряда заболеваний.
В ходе исследований доказана эффективность препарата Цитохром С при онкологической патологии. Такой эффект скорее всего связан с модулированием антиокислительной активности, с одной стороны, и возможной активацией апоптоза в клетках опухоли – с другой [13].
Работ, посвященных оценке возможности коррекции церебральной ишемии с помощью цитохрома С, практически не встречается. В то же время имеются результаты клинических исследований и экспериментальные данные, подтверждающие снижение активности цитохром С-оксидазы. Установлено, что уровень цитохром С-оксидазы в цереброспинальной жидкости значимо снижается у пациентов с ишемическим инсультом. При этом степень подобного снижения прямо коррелирует с тяжестью поражения [52].
Интересное экспериментальное исследование было опубликовано в 2018 г. Авторы изучали возможность подавления активности цитохром С-оксидазы с помощью коротковолнового инфракрасного излучения с длиной волны 750 и 950 нм для уменьшения реперфузионного окислительного повреждения. Показано, что данный метод экспериментальной терапии позволяет снизить активность цитохром С-оксидазы, а также значимо уменьшить количество погибших нейронов [53].
Еще в одной работе небольшие дозы этанола регулировали активность цитохром С-оксидазы, снизили образование активных форм кислорода и обеспечили адекватный уровень АТФ в ишемизированных нейронах, продемонстрировав тем самым нейропротективную активность [54].
Среди отечественных работ встречаются исследования эффективности лекарственного препарата Цитохром С при ряде заболеваний. В клиническом исследовании В.О. Соколов и соавт. (2017) наблюдали улучшение на фоне приема препарата Цитохром С в виде глазных капель зрительных показателей у пациентов с субэпителиальными помутнениями роговицы после перенесенных острых кератитов [55].
В диссертационной работе Н.В Дорогова (2004) в экспериментальных условиях показана эффективность цитохрома С при экспериментальной церебральной ишемии. Автор выявил, что цитохром С повышает антиоксидантную защиту и ограничивает активацию процессов перекисного окисления липидов в ткани головного мозга и плазме крови. При реперфузионном поражении головного мозга цитохром С способствует росту содержания малонового диальдегида (МДА) в ткани мозга и плазме крови, снижению показателя в эритроцитах [56].
Еще в одном экспериментальном исследовании при гипоксическом воздействии на мозг профилактическое введение цитохрома С в дозе 0,3 мг/кг оказало церебропротективный эффект, предотвратив или уменьшив патологические сдвиги, развившиеся в отсутствие применения препарата. Эффект препарата характеризовался снижением выраженности гипоксии в коре больших полушарий и предупреждением или ослаблением развития внутриклеточного и внеклеточного отека ткани мозга [57].
Заключение
С учетом физиологических и патофизиологических особенностей цитохрома С, а также наличия небольшого количества экспериментальных работ, в которых исследовались фармакодинамические механизмы действия цитохрома С, представляется целесообразным продолжение как экспериментальных, так и клинических исследований возможности использования данного вещества при острых и хронических цереброваскулярных заболеваниях. Антиоксидантный и проапоптотический профили цитохрома С в клинических условиях недостаточно изучены. Можно предположить, что терапевтический потенциал лекарственного препарата Цитохром С у пациентов с цереброваскулярными заболеваниями достаточно высок, поскольку нарушение процессов клеточного дыхания является ключевым патофизиологическим процессом у данной группы пациентов. Последующие звенья повреждения мозга, а именно апоптоз нейронов и глии, нейровоспаление, эксайтотоксичность, являются лишь результатом острой или хронической гипоксии, потенциальным и эффективным корректором которой может быть Цитохром С.
I.A. Shchukin, PhD
N.I. Pirogov Russian National Research Medical University
Contact person: Ivan A. Shchukin, ivashchukin@gmail.com
The key pathophysiological mechanism underlying the development of both acute ischemic stroke and chronic cerebral ischemia is a violation of cerebral blood flow, triggering a cascade of reactions leading to damage to the brain substance. These processes lead to irreversible damage to the nervous tissue by the mechanisms of necrosis and apoptosis. As a result of excessive excitation of glutamate NMDA receptors, intracellular accumulation of Ca2+ ions occurs, which subsequently contributes to the activation of various enzyme systems, phosphorylation of proteins, cleavage of phospholipids and release of arachidonic acid, the formation of toxic products, free radicals that have cytotoxic, immunogenic and mutagenic effects, damaging mitochondria, cellular DNA and RNA. In conditions of ischemic brain damage, the mitochondria is considered one of the most vulnerable intracellular structures, the disruption of which, on the one hand, leads to a critical energy deficit, on the other hand, triggers the process of programmed cell death. The most important enzyme of the mitochondrial respiratory chain, which is associated with the processes of energy formation and, accordingly, cell survival, as well as the processes of apoptotic cell death, is cytochrome C. The release of cytochrome C from damaged mitochondria leads to disruption of the functioning of the respiratory chain of the cell, the development of hypoxic damage to the neuron and activates apoptosis reactions.
The article discusses the fundamental mechanisms of cerebral ischemic injury, which are based on the development of mitochondrial insufficiency. Special attention is paid to the role of cytochrome C. The mechanisms of participation of cytochrome C in the processes of cell damage, as well as its protective (antioxidant) potential in a number of pathologies, including cerebral ischemic damage, are described. The potential therapeutic use of exogenous cytochrome C in acute and chronic cerebrovascular diseases is indicated.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.