Дифференцированный подход к выбору антибактериальной терапии гнойных воспалительных заболеваний придатков матки
- Аннотация
- Статья
- Ссылки



Гнойные воспалительные заболевания придатков матки (ГВЗПМ) представляют собой не только медицинскую, но и серьезную социально-экономическую проблему. ГВЗПМ – болезнь молодых женщин, так как пик заболеваемости приходится на возраст 16–25 лет. При этом нарушения репродуктивной системы возникают у каждой второй пациентки, перенесшей ГВЗПМ, а частота внематочной беременности возрастает в 10 раз [4, 6].
Высокая частота ГВЗПМ в настоящее время объясняется в первую очередь значительным уровнем сексуально-трансмиссивных заболеваний, важная этиологическая роль которых в генезе инфекционно-воспалительной патологии генитальной сферы бесспорна [3]. Кроме того, одной из основных причин и предрасполагающих факторов риска развития ГВЗПМ является использование внутриматочной контрацепции (ВМК). При этом применение ВМК увеличивает степень риска возникновения воспалительных заболеваний придатков матки в 3–9 раз [4]. В литературе имеются многочисленные сообщения о развитии воспалительных процессов матки и ее придатков, тубоовариальных абсцессов, тяжелых форм тазовой инфекции, в том числе сепсиса, на фоне ВМК. Авторы отмечают, что особенностями гнойного процесса в малом тазу у больных с ВМК являются бурное клиническое течение, высокая степень интоксикации и раннее формирование свищей [3, 4, 6].
Ведущая роль в этиологии ГВЗПМ принадлежит инфекционному фактору, при этом возбудителями гнойных процессов могут быть различные ассоциации микроорганизмов, включающие абсолютные патогены, анаэробные бактерии, факультативные грамотрицательные бактерии, факультативные стрептококки, вирусы. Однако этиологическая структура ГВЗПМ отличается динамичностью в связи с развитием устойчивости микроорганизмов к антибактериальным препаратам, бесконтрольностью их применения, самолечением больных [2, 4].
В условиях широкого распространения смешанных инфекций половых путей у женщин изучение вопроса об этиологическом значении различных возбудителей в развитии ГВЗПМ – одна из важнейших проблем. Полиэтиологичность данных заболеваний, с одной стороны, обусловливает разнообразие их клинических проявлений, а с другой – создает определенные трудности в лабораторной диагностике, а значит, и в целенаправленной терапии [2, 7].
Так как в возникновении ГВЗПМ первостепенное значение имеет микробный фактор, главной задачей в процессе лечения является адекватное применение противомикробных средств. Этиотропная антибактериальная терапия подразумевает проведение лечения на основе схем, разработанных по данным микробиологического исследования, включающего выделение возбудителей из очагов воспаления, их идентификацию и определение антибиотикочувствительности. Данные микробиологических исследований позволяют подобрать наиболее эффективные антибактериальные препараты и оптимизировать режим лечения [1, 7, 8].
Однако структура антибиотикорезистентности бактерий и их биологические свойства меняются в зависимости от географического региона их выделения и профиля стационара. Таким образом, существует постоянная необходимость мониторинга видового состава и антибиотикорезистентности микроорганизмов – возбудителей ГВЗПМ для обеспечения адекватного лечения данной патологии [5, 8].
Объект исследования и методы. С целью разработки рациональных схем антибактериальной терапии осложненных форм ГВЗПМ нами было проведено комплексное обследование и оперативное лечение лапаротомным доступом 109 больных с ГВЗПМ, поступивших в экстренном порядке в гинекологическое отделение МУЗ «Городская клиническая больница № 6» имени Н.С. Карповича г. Красноярска. Учитывая возможные этиологические и патогенетические механизмы развития заболевания, все пациентки были разделены на две группы сравнения: группа А – 43 женщины, у которых заболевание развилось на фоне применения ВМК (39,4% от общего числа больных), группа В – 66 (60,6%) пациенток с ГВЗПМ, развившимися без применения ВМК. Средний возраст пациенток составил 36,72 ± 1,12 лет. Критериями исключения служили случаи ГВЗПМ, возникшие после родов, абортов и других внутриматочных вмешательств. Кроме того, из исследования были исключены пациентки, которым была начата антибактериальная терапия до проведения бактериологического исследования.
Всем больным проведено комплексное клинико-лабораторное обследование, УЗИ органов малого таза и брюшной полости, бактериоскопическое и молекулярно-биологическое (ПЦР) исследование мазков из цервикального канала. Для бактериологического исследования производился забор следующих материалов: содержимого цервикального канала, экссудата из брюшной полости, биоптатов тканей из очага гнойного воспаления. Содержимое из цервикального канала забирали непосредственно перед операцией, материал из брюшной полости – во время операции. Фрагмент ткани из очага поражения предварительно растирали со стерильным кварцевым песком до получения однородной массы.
Для учета численности микроорганизмов посев исследуемого материала производили по методу Gould на 5% кровяной агар, анаэробный агар Шадлера с добавлением 5% крови, желточно-солевой агар, среду Эндо, среду для культивирования гонококков. Посевы культивировали в аэробных и анаэробных условиях в течение 24–48 часов, при необходимости до 96 часов при температуре 37 ºС. Для культивирования анаэробов использовали газогенераторные пакеты GEN BAG Anaer фирмы bioMerieux (Франция).
Идентификация выделенных культур проводилась с учетом морфо-тинкториальных, культуральных и биохимических свойств. Для идентификации аэробных, факультативно-анаэробных микроорганизмов использовали методы традиционной бактериальной таксономии; для идентификации анаэробных микроорганизмов применяли тест-системы rapid ID 32A фирмы bioMerieux (Франция) с последующей компьютерной обработкой результатов (программа APILAB).
Чувствительность аэробных, факультативно-анаэробных культур к антибиотикам определяли диско-диффузионным методом на среде Мюллера – Хинтона с использованием стандартных дисков с антибиотиками фирмы Bio-Rad. Для контроля полученных результатов использовали референтные штаммы S. aureus АТСС 25923, E. coli АТСС 25922, P. aeruginosa АТСС 27853. Антибиотикочувствительность анаэробных культур определяли с помощью систем ATB ANA фирмы bioMerieux (Франция).
Результаты. В результате проведенного анализа клинико-анамнестических данных нами были выявлены различия в характеристиках женщин обеих групп. Так, пациентки группы А были значимо старше (средний возраст 42,1 ± 2,6 года), заболевание у них развивалось на фоне длительного использования ВМК (от 1 до 15 лет; в среднем 7,17 ± 0,75 лет). Воспалительный процесс в области придатков матки у этих женщин чаще был односторонним в виде гнойной тубоовариальной опухоли, сопровождающейся тяжелой деструкцией тканей, абсцессом Дугласова пространства, параметритом, межкишечными абсцессами; нередко наблюдалось вовлечение в воспалительный процесс соседних органов. В группе В средний возраст пациенток составлял 30,6 ± 4,1 лет, в анамнезе у 68,7% из них отмечались различные ИППП. Воспалительный процесс в области придатков матки у женщин группы В значимо чаще был двусторонним в виде пиосальпинксов, в большинстве случаев сопровождался гнойным пельвиоперитонитом (р < 0,05).
Результаты проведенного бактериологического исследования показали, что наиболее часто микроорганизмы высевались именно из образцов деструктивных тканей придатков матки, взятых из очага поражения, и реже всего – из экссудата брюшной полости (табл. 1).
Микрофлора, выделенная из цервикального канала, в основном была представлена микроорганизмами родов Corynebacterium spp., Staphylococcus spp., Streptococcus spp. (в том числе и анаэробными), дрожжеподобными грибами рода Candida. Однако обращало на себя внимание отсутствие корреляции между микрофлорой, выделенной из цервикального канала, и микрофлорой, полученной из брюшной полости и очага поражения у обследованных пациенток. Микрофлора в очаге поражения и цервикальном канале совпадала лишь у 7 (6,4 ± 2,3%) больных. В связи с этим при проведении дальнейших исследований мы ориентировались на результаты микробиологических исследований образцов, взятых из очага гнойного поражения и экссудата из полости малого таза.
В результате проведенного исследования были выявлены особенности видового состава микрофлоры в очаге поражения у женщин исследуемых групп. Наиболее часто у больных с ГВЗПМ на фоне ВМК из очага поражения выделялись микроорганизмы родов Eubacterium – 11 (25,6 ± 6,7%), Bacillus – 7 (16,3 ± 5,6%), Peptostreptococcus – 7 (16,3 ± 5,6%), а также Fusobacterium nucleatum – 7 (16,3 ± 5,6%). Анаэробные микроорганизмы – Bacteroides ureolyticus, Porphyromonas endodontalis, Propionibacterium acnes – выделялись в 7,0 ± 3,9% случаев. Enterococcus faecalis и Pseudomonas aeruginosa также были выделены в 7,0 ± 3,9% случаев.
В группе В наиболее часто встречались микроорганизмы родов Staphylococcus – 14 (21,2 ± 5,0%) – и Peptostreptococcus – 14 (21,2 ± 5,0%). Propionibacterium acnes был выделен у 9 (13,6 ± 4,2%) больных; микроорганизмы семейства Enterobacteriaceae (Proteus mirabilis и E. coli) и Enterococcus faecalis были выделены у 6 (9,1 ± 3,5%) больных. Clostridium tyrobutiricum, Porphyromonas asaccarolytica, Prevotella oralis, Acinetobacter baumannii, Bacillus spp., Micrococcus spp. были выделены в 3 (4,5 ± 2,6%) случаях.
Необходимо отметить, что микроорганизмы рода Eubacterium (E. limosum и E. lentum), а также Fusobacterium nucleatum были выделены только у больных группы А и не встречались в группе В (p < 0,05). Напротив, микроорганизмы рода Staphylococcus (S. haemolyticus, S. hominis, S. capitis и S. shleiferi) были выделены только у больных группы В и не наблюдались в группе А (р < 0,05). Бактерии родов Bacillus, Peptostreptococcus, а также Propionibacterium acnes встречались в обеих группах.
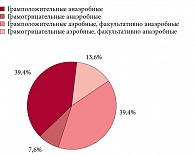
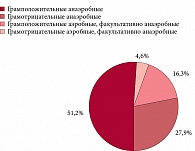
Соотношение анаэробных и аэробных / факультативно анаэробных микроорганизмов, выделенных из полости малого таза у обследованных больных, составило 27,3 ± 5,5% и 72,7 ± 5,5% соответственно, из очага гнойного воспаления – 61,5 ± 5,1% и 38,5 ± 5,1% соответственно. Таким образом, в полости малого таза отмечалось преобладание аэробной микрофлоры, а в очаге гнойного воспаления – анаэробной (p < 0,05). Грамположительная микрофлора составила 73,8%, грамотрицательная – 26,2%.
При этом соотношение анаэробных и аэробных / факультативно анаэробных микроорганизмов в исследуемых группах больных было различным (рис. 1, рис. 2).
Таким образом, в группе А из очага гнойного воспаления анаэробная микрофлора выделялась значимо чаще, чем в группе В, – соответственно у 34 (79,1 ± 6,2%) против 31 (47,0 ± 6,1%), p < 0,05. Вместе с тем процентное содержание аэробных / факультативно анаэробных микроорганизмов было достоверно выше в группе В (53,0 ± 6,1%), чем в группе А, – у 9 (20,9 ± 6,2%), p < 0,05.
Необходимо отметить, что в основном микроорганизмы были выделены в монокультуре. У 8 больных основной группы и у 12 больных группы сравнения были выделены ассоциации из двух микроорганизмов: Eubacterium limosum + F. nucleatum, Porphyromonas endodontalis + F. nucleatum, Bacillus spp. + Bacteroides ureolyticus, Bacillus spp. + P. aeruginosa, S. capitis + Pstr. anaerobius, Bacillus spp. + Micrococcus spp., Propionibacterium acnes + Pstr. prevotii, Pstr. micros + Clostridium tyrobutiricum, P. mirabilis + S. shleiferi, Propionibacterium acnes + Prevotella oralis.
Neisseria gonorrhoeae не была выделена ни у одной обследованной больной, что, вероятно, связано со сложностью культивирования этого микроорганизма в условиях полимикробных ассоциаций в очаге воспаления.
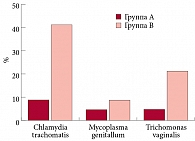
При этом обращает на себя внимание значимо большая частота выявленных (при помощи бактериоскопического и метода ПЦР) ИППП у женщин группы В (рис. 3).
Далее нами была изучена чувствительность к антибиотикам и химиопрепаратам 46 штаммов анаэробных и 62 штаммов аэробных и факультативно анаэробных микроорганизмов, выделенных у исследуемых больных с ГВЗПМ.
Выделенные анаэробные микроорганизмы были чувствительны к следующим антибиотикам: амоксициллин/клавулановая кислота, пиперациллин, пиперациллин + тазобактам, тикарциллин/клавулановая кислота, цефалоспорины II поколения (цефотетан, цефокситин), имипенем, тикарциллин. 73,8% штаммов анаэробных микроорганизмов, выделенных от больных группы А (ГВЗПМ на фоне ВМК), были устойчивы к метронидазолу, 12,5% устойчивы к клиндамицину и 6,3% – к амоксициллину. Анаэробные микроорганизмы, выделенные у больных группы В, были устойчивы в 5,1% к клиндамицину и в 18,5% – к амоксициллину.
Все выделенные у женщин группы В штаммы Staphylococcus spp. были чувствительны к цефалоспоринам: цефазолину, цефтриаксону, цефамандолу, ципрофлоксацину, амикацину, амоксициллину, спирамицину. При этом 20% штаммов этих микроорганизмов были устойчивы к доксициклину, 40% – к линкомицину, 40% – к эритромицину, 20% – к хлорамфениколу.
Выделенные штаммы Bacillus spp. были в 100% случаев чувствительны к ципрофлоксацину, эритромицину, спирамицину, рокситромицину, хлорамфениколу, цефамандолу, доксициклину. Устойчивость штаммов Bacillus spp. к линкомицину определялась в 100% случаев; к цефтриаксону 40% штаммов были устойчивы и 40% умеренно устойчивы; 40% были устойчивы к цефазолину и 40% – к амоксициллину.
Выделенные культуры неферментирующих грамотрицательных бактерий (A. baumannii, P. aeruginosa) были чувствительны к следующим антибиотикам: ципрофлоксацин, гентамицин, амикацин, цефамандол. Выделенные культуры E. coli и P. mirabilis были чувствительны к таким антибиотикам, как цефалоспорины II, III и IV поколения, аминогликозиды, ципрофлоксацин, амоксициллин.
На основании полученных результатов можно рекомендовать следующие схемы антибактериальной терапии осложненных форм ГВЗПМ.
Для больных с ГВЗПМ, развившимися на фоне ВМК:
- амоксициллин/клавулановая кислота (например, Аугментин 1,2 г внутривенно капельно 3–4 раза в сутки с возможным последующим переходом на пероральный путь приема препарата Аугментин 1,0 г 2 раза в день в течение 10–14 дней);
- моксифлоксацин (Авелокс 400 мг в/в 1 раз в сутки с последующим переходом на пероральный прием по 1 таб. (400 мг) 1 раз в сутки в течение 10–14 дней);
- в тяжелых клинических ситуациях (разлитой перитонит, сепсис, образование свищей) предпочтение следует отдавать карбапенемам (Имипенем 0,5 г внутривенно капельно 4 раза в сутки).
Следует отметить, что моксифлоксацин является единственным из существующих на рынке РФ антимикробных препаратов, который активен в отношении всего спектра потенциальных возбудителей ГВЗПМ. Это объясняется тем, что моксифлоксацин обладает широким спектром антимикробной активности, включающим грамположительные и грамотрицательные аэробные, внутриклеточные и анаэробные микроорганизмы. Однако необходимо отметить, что препарат может не проявлять достаточной активности в отношении штаммов N. gonorrhoeae, устойчивых к фторхинолонам (табл. 2) [9, 10, 11, 12]. Целесообразность выбора моксифлоксацина для лечения больных с ГВЗПМ на фоне ВМК объясняется его высокой активностью в отношении анаэробных микроорганизмов. В отличие от фторхинолонов II–III поколений, препарат обладает клинически значимой активностью в отношении как спорообразующих (Clostridium perfringens), так и неспорообразующих анаэробов (B. fragilis, Fusobacterium spp.), сопоставимой с метронидазолом и клиндамицином [13].
Кроме того, моксифлоксацин создает высокие концентрации в органах репродуктивного тракта у женщин [14]. В течение 24 ч после однократной инфузии моксифлоксацина концентрация его в тканях женских репродуктивных органов превышает величину МПК для большинства возбудителей ГВЗПМ. Важным свойством моксифлоксацина является способность создавать высокие системные концентрации как при внутривенном введении, так и при приеме внутрь [14, 15]. Это позволяет проводить ступенчатую терапию, подразумевающую переход от внутривенного введения препарата к его последующему приему внутрь.
Для больных с ГВЗПМ, развившимися без применения ВМК.
С учетом особенностей выявленной микрофлоры и высокой частоты ИППП (в частности, хламидийной и трихомонадной инфекции) можно рекомендовать следующие схемы терапии:
цефалоспорины III поколения (например, цефтриаксон 1,0–2,0 г в/в капельно 1 раз в сутки) + нитроимидазолы (например, метронидазол 0,5 г в/в капельно 3 раза в сутки) + антихламидийный препарат (например, доксициклин 0,1 г внутривенно капельно 2 раза в сутки или азитромицин 250–500 мг в/в капельно 1 раз в сутки или др.). Парентеральное лечение может быть прекращено через 24–48 ч после клинического улучшения
(t < 37,5 ºС, лейкоциты < 10 000 мм3), но пероральная терапия доксициклином должна быть продолжена до 14 дней;
фторхинолоны (например, в виде монотерапии моксифлоксацином 400 мг в/в капельно с последующим переходом на пероральный прием длительностью до 14 дней. В виде комбинации: офлоксацин 0,4 г в/в капельно 2 раза в сутки или левофлоксацин по 0,5 г в/в капельно 1 раз в сутки + нитроимидазолы (например, метронидазол 0,5 г в/в капельно 3 раза в сутки)).
В случае применения ципрофлоксацина необходимо в схему терапии добавить один из антихламидийных препаратов.
Возможность использования моксифлоксацина в виде монотерапии у данной категории больных обусловлена тем, что в отношении хламидий и микоплазм моксифлоксацин превосходит по активности ранние фторхинолоны – ципрофлоксацин и офлоксацин, а также макролид эритромицин и обладает примерно одинаковой активностью с доксициклином (табл. 3) [9, 11, 16, 17, 18]. Более того, в серии работ было показано, что моксифлоксацин создает высокие концентрации в макрофагах и фагоцитах, при этом внутриклеточная концентрация может на порядок превышать внеклеточную. Так, было установлено, что содержание моксифлоксацина в полиморфно-ядерных лейкоцитах превышает его внеклеточную концентрацию более чем в 10 раз [19]. Перечисленные фармакокинетические особенности моксифлоксацина определяют высокую эффективность препарата в отношении инфекций, вызванных внутриклеточными возбудителями, такими как C. trachomatis;
- в сложных клинических ситуациях (разлитой перитонит, сепсис) предпочтение следует отдавать карбапенемам (Имипенем 0,5 г внутривенно капельно 4 раза в сутки) в сочетании с одним из антихламидийных препаратов.
Таким образом, проведенное нами исследование свидетельствует о гетерогенности групп больных с ГВЗПМ. Прежде всего это относится к особенностям этиологической структуры патологии.
В связи с этим при назначении эмпирической антибактериальной терапии необходим дифференцированный подход с учетом полученных знаний об особенностях микробного пейзажа в очаге воспаления у больных с ГВЗПМ. Этиопатогенетический подход с обоснованным выбором лекарственных препаратов, последовательности их применения и оптимальных сроков лечения является необходимым условием успешной терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


