Динамика антибиотикорезистентности у больных урологического профиля
- Аннотация
- Статья
- Ссылки
- English
Цель исследования: изучение микробного спектра мочи при основных урологических заболеваниях и резистентности флоры к наиболее часто применяемым антимикробным препаратам.
Материал и методы. Выполнен ретроспективный и проспективный анализ результатов посева мочи (14 321 образец) с 2011 по 2018 г. с определением чувствительности флоры к антибактериальным препаратам. Оказалось, что частота выделения кишечной палочки, которая раньше лидировала в структуре возбудителей инфекций мочевых путей, снизилась в два раза, составив только 33,5% от общего числа обнаруженных микроорганизмов, а доля условно патогенной флоры увеличилась с 5,3 до 17,1%. Второе место по частоте выявляемой флоры заняли микроорганизмы рода Staphylococcus. Назначенная без учета специфичности и чувствительности антибактериальная терапия в 4% случаев стала причиной рецидива инфекций верхних мочевых путей. Отмечена устойчивость микроорганизмов к пенициллинам и цефалоспоринам второго поколения. Кроме того, уменьшилась значимость фторхинолонов и цефалоспоринов третьего поколения как препаратов, оказывающих положительный антибактериальный эффект при лечении инфекций мочевых путей. Чувствительность микроорганизмов к нитрофурантоину сохранилась на прежнем высоком уровне.
Выводы. Исследование показало изменение структуры возбудителей инфекций мочевых путей. Начало антибактериальной терапии до сдачи анализа мочи объясняет низкую частоту выявления бактериурии. Краткосрочные курсы антибиотикотерапии без учета чувствительности микроорганизмов ведут к увеличению доли устойчивых к антимикробным препаратам форм бактерий. Таким образом, на амбулаторном этапе не соблюдаются принципы рациональной антибиотикотерапии и не проводится мониторинг результатов антибиотикограмм.
Цель исследования: изучение микробного спектра мочи при основных урологических заболеваниях и резистентности флоры к наиболее часто применяемым антимикробным препаратам.
Материал и методы. Выполнен ретроспективный и проспективный анализ результатов посева мочи (14 321 образец) с 2011 по 2018 г. с определением чувствительности флоры к антибактериальным препаратам. Оказалось, что частота выделения кишечной палочки, которая раньше лидировала в структуре возбудителей инфекций мочевых путей, снизилась в два раза, составив только 33,5% от общего числа обнаруженных микроорганизмов, а доля условно патогенной флоры увеличилась с 5,3 до 17,1%. Второе место по частоте выявляемой флоры заняли микроорганизмы рода Staphylococcus. Назначенная без учета специфичности и чувствительности антибактериальная терапия в 4% случаев стала причиной рецидива инфекций верхних мочевых путей. Отмечена устойчивость микроорганизмов к пенициллинам и цефалоспоринам второго поколения. Кроме того, уменьшилась значимость фторхинолонов и цефалоспоринов третьего поколения как препаратов, оказывающих положительный антибактериальный эффект при лечении инфекций мочевых путей. Чувствительность микроорганизмов к нитрофурантоину сохранилась на прежнем высоком уровне.
Выводы. Исследование показало изменение структуры возбудителей инфекций мочевых путей. Начало антибактериальной терапии до сдачи анализа мочи объясняет низкую частоту выявления бактериурии. Краткосрочные курсы антибиотикотерапии без учета чувствительности микроорганизмов ведут к увеличению доли устойчивых к антимикробным препаратам форм бактерий. Таким образом, на амбулаторном этапе не соблюдаются принципы рациональной антибиотикотерапии и не проводится мониторинг результатов антибиотикограмм.
Актуальность
Инфекции мочевыделительной системы относятся к самым распространенным заболеваниям в амбулаторной и госпитальной практике [1, 2]. Микробный пейзаж в каждом лечебно-профилактическом учреждении – результат сложных процессов межвидовых взаимоотношений микро- и макроорганизмов, протекающих с учетом влияния различных факторов внешней среды [3]. Бактерии постоянно подвергаются селективному давлению со стороны химических агентов, например антибиотиков [4]. Изменяется структура микроорганизмов и растет резистентность к антибактериальным препаратам, что становится одной из причин неэффективности этиотропного лечения [5].
Бессимптомная бактериурия сопровождает пациентов урологического и неурологического профиля. Общепринятые урологические рекомендации определяют порядок лечения бессимптомной бактери-урии только в двух случаях: у беременных и больных перед хирургическим вмешательством [6]. В то же время без медицинских инвазивных манипуляций инфекционный процесс может стать хроническим или затронуть соседние органы [7].
Попытки пациентов самостоятельно лечить инфекции мочевых путей (ввиду доступности антибактериальных препаратов) повышают риск прогрессирования заболевания или приводят к формированию устойчивых к антибиотикам форм бактерий [8].
При выборе антибиотика врачи должны учитывать не только возбудитель заболевания, но и спектр действия препарата, его фармакокинетический и фармакодинамический профиль, нежелательные побочные действия, что не всегда выполняется в амбулаторной и стационарной практике [9].
По данным научной литературы, в настоящее время основным микробным агентом инфекций мочевых путей, который встречается с частотой 75–95%, является Escherichia coli [10]. Проведенный нами анализ позволил выявить изменения в структуре возбудителей инфекций мочевых путей и показать развитие микробной антибактериальной резистентности в динамике.
Цель исследования
Изучить микробный спектр мочи при основных урологических заболеваниях и отразить динамику антибиотикорезистентности.
Материал и методы
Выполнен ретроспективный и проспективный анализ данных Рабочего журнала микробиологических исследований (форма 253/у) и Журнала регистрации исследований и результатов установления чувствительности микроорганизмов к химиотерапевтическим препаратам (форма 254/у), утвержденных приказами Министерства здравоохранения СССР от 04.10.1980 № 1030 и от 22.04.1985 № 535 соответственно. Ретроспективно оценивались данные с 2011 по 2015 г., а проспективно – данные за 2016–2018 гг.
Анализировались результаты микробиологического исследования мочи (всего 14 321 образец) пациентов, которые находились на амбулаторном и стационарном лечении в учреждениях города Саранска Республики Мордовия и получили направление на изучение микробного пейзажа и определение чувствительности микроорганизмов в бактериологический отдел Республиканской клинической больницы № 4 города Саранска.
Забор материала и его транспортировка выполнялись по ГОСТ Р 53079.4-2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа». Верификацию лабораторных штаммов микроорганизмов проводили бактериологическими методами по классическим методикам на основании приказа Министерства здравоохранения СССР от 22.04.1985 № 535, СП 1.2.036-95, ФЗ от 30.03.1999
№ 52-ФЗ (с изменениями). Для изучения чувствительности микроорганизмов к традиционным антимикробным препаратам использовали диско-диффузионный метод МУК 4.2.1890-04.
Результаты исследования выражены в абсолютных и относительных единицах. С учетом того что элементы исследования носят описательный характер, полученные данные не принадлежат к номинальной и порядковой системе измерения и возраст пациентов представлен как отдельный категориальный признак, статистическую оценку полученных данных не выполняли. Подсчет значений, построение графических и табличных данных для видов микроорганизмов осуществлялись в автоматическом режиме с помощью программы Microsoft Excel 2010 (Microsoft Corporation, США), результаты исследований оформлены в текстовом редакторе Microsoft Word 2010 (Microsoft Corporation, США). Эффективность антибиотиков оценивалась по диаметру зон отсутствия роста для отдельных культур. Полученные результаты вносились в базу данных за все годы наблюдения и оценивались с применением непараметрического критерия – коэффициента ранговой корреляции Кендалла (программа SPSS 16.0 (SPSS Inc., США)).
Результаты
Оценка результатов микробиологического исследования мочи (14 321 образец) позволила выявить возбудителей в 21% (n = 3780) случаев. В 79% (n = 10 541) случаев возбудители не определены скорее всего из-за начала антибактериальной терапии до сдачи анализа. Повторный анализ мочи для уточнения степени бактериурии после проведенной этиотропной терапии с учетом чувствительности к антибиотикам выполнялся у 11% пациентов, из них 8% – беременные.
Больше всего возбудителей обнаруживалось в следующих возрастных группах: до 18 лет (22,6%, n = 854), 25–44 года (22,2%, n = 838) и 61–74 года (22,2%, n = 840), что составило 67% от общего количества обследуемых. Оставшиеся 33% – это пациенты в возрасте 18–24, 45–60 и 75–90 лет. Таким образом, отмечалось чередование возрастных периодов выявления максимального количества микроорганизмов в моче, обусловленное в большей степени социальными причинами. Среди них трудоустройство, наблюдение в дородовом периоде, прохождение диспансерного обследования, установление специфичных жалоб и симптомов, требующих дополнительного обследования на бактериурию.
Чаще всего (77,9%, n = 2948) возбудители определялись у женщин в возрасте 25–44 лет с диагнозами «острый рецидивирующий цистит» и «острый рецидивирующий пиелонефрит». У мужчин максимальная выявляемость пришлась на период с 61 до 74 лет, что объяснялось заболеваниями нижних мочевых путей, сочетающимися с хронической задержкой мочеиспускания.
Самой частой (72%, n = 2722) причиной обследования были различные по локализации инфекции мочевых путей: хронический пиело-
нефрит (45,2%, n = 1709), острый пиелонефрит (6,2%, n = 234), острый пиелонефрит беременных (12,9%, n = 488) и хронический цистит (7,7%, n = 291).
Вторичный хронический пиелонефрит отмечался у 8,3% (n = 314) мужчин и 36,9% (n = 1395) женщин. У женщин с увеличением возраста частота хронического пиелонефрита неуклонно росла, достигнув пика (32%) в 61–74 года. У мужчин максимум (5%) был зафиксирован в возрастной группе до 18 лет, что обусловлено нарушением уродинамики на фоне различных корригированных и некорригированных врожденных аномалий развития органов мочеполовой системы.
До начала терапии острого пиелонефрита степень бактериурии определялась только у 6,2% (n = 234) пациентов, из них 1,6% (n = 60) – мужчины, 4,6% (n = 174) – женщины. У остальных пациентов амбулаторное и стационарное лечение проводилось без учета степени бактериурии и первоначального подтверждения чувствительности обнаруженных в моче микроорганизмов к антибактериальным препаратам, что противоречит рекомендациям Европейской ассоциации урологов. Вероятно, это связано с легкой и средней степенью тяжести заболевания, когда назначенная антибактериальная терапия способна оказать значимый клинический эффект.
Повторное исследование на микрофлору проведено в 3,8% (n = 144) случаев (учитывались только те пациенты, у кого бактериологическое исследование мочи выполнялось до начала терапии). Причина направления на анализ – рецидив острого пиелонефрита, который развился у 0,6% (n = 23) мужчин и 3,2% (n = 121) женщин. У беременных с острым пиелонефритом, прошедших курс антибактериальной терапии, в 8% (n = 302) случаев последующий анализ позволил выявить бактериурию, которая не сопровождалась какими-либо клиническими симптомами. У этих женщин диагноз «бессимптомная бактериурия» стал причиной повторной госпитализации в урологический стационар.
Бессимптомная бактериурия в целом отмечена в 17% (n = 643) случаев: у 6,1% (n = 231) мужчин и 10,9% (n = 412) женщин. Было показано следующее распределение среди мужчин в зависимости от возраста: 2,8% (n = 107) в группе до 18 лет, 0,3% (n = 13) – 25–44 лет и 3% (n = 113) – 61–74 года. У женщин бессимптомная бактериурия чаще встречалась в возрасте 61–74 года – 5,8% (n = 219), чуть реже – 3% (n = 112) – до 18 лет, и 2,1% (n = 80) случаев распределены равномерно во всех остальных возрастных категориях. На обследование были направлены 11% (n = 415) пациентов с диагнозами «мочекаменная болезнь» и «лихорадка неясного генеза».
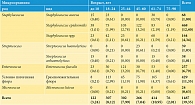
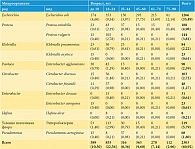
Микробный спектр мочи представлен многочисленными видами грамположительных (39,2%) (табл. 1) и грамотрицательных (60,8%) (табл. 2) микроорганизмов. Полученные результаты объединены в группы по роду и виду бактерий и выражены в абсолютных и относительных единицах к общему числу исследований без учета значений, когда микроорганизм в посевах мочи не обнаружен.
Классическое представление об Escherichia coli как основном возбудителе инфекций мочевых путей результаты исследования опровергли, поскольку на долю кишечной палочки пришлось только 33,5% среди всех микроорганизмов, а во всех возрастных категориях частота ее встречаемости не превышала 10%. За анализируемый период наблюдалось плавное снижение доли кишечной палочки в структуре высеваемых микроорганизмов мочи. Второе место (18,5%) по частоте выявляемой флоры заняли микроорганизмы рода Staphylococcus, преимущественно Staphylococcus epidermidis (12,4%). Третьими были грамотрицательные микроорганизмы рода Proteus (8,8%), из них 5,0% – Proteus mirabilis и 3,8% – Proteus vulgaris.
В структуре всех возбудителей число условно патогенных микроорганизмов, обнаруженных при обследовании мочи, с 2011 по 2018 г. выросло в три раза, увеличившись с 5,3 до 17,1% (грамположительная флора составила 11,3%, а грамотрицательная – 5,8%).
Анализ структуры микроорганизмов, определенных при посевах мочи у пациентов с острым и хроническим пиелонефритом, выявил преобладание Escherichia coli (15,6%). Значительно реже высевались Staphylococcus epidermidis (5,9%), условно патогенная флора (3,2%) и остальные микроорганизмы (Enterococcus, Proteus mirabilis, Citrobacter freundii, Citrobacter diversus) – всего не более 2,5%.
У пациентов с бессимптомной бактериурией в 41% случаев выявлена Escherichia coli, в 25% – Staphylococcus epidermidis, в 23% – условно патогенная грамположительная флора, в 11% – Enterococcus, Staphylococcus aureus, Citrobacter diversus, Proteus mirabilis. Пациенты с мочекаменной болезнью без признаков обострения пиелонефрита также проходили обследование. В 27,7% случаев у них обнаруживалась патогенная флора: Staphylococcus epidermidis (11,2%), Escherichia coli (9%), условно патогенная грамположительная флора (3%), иные микроорганизмы (4,5%).
Таким образом, количество случаев выделения кишечной палочки у пациентов с подозрением или явными признаками инфекций мочевых путей постепенно уменьшалось, а грамположительных и условно патогенных микроорганизмов – увеличивалось. Установлено, что не всегда выявленные микроорганизмы были источником инфекционного процесса. Изменение структуры микробной ассоциации у урологических пациентов, по нашему предположению, произошло вследствие нерационального применения антибиотиков.
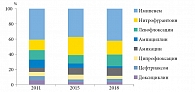
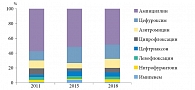
Чувствительность микроорганизмов определяли с учетом частоты использования отдельных антибактериальных препаратов в клинической практике. Наиболее часто в стационарах пациентам с инфекциями мочевых путей назначали цефтриаксон, амикацин, ампициллин, доксициклин, ципрофлоксацин и имипенем, а амбулаторно – левофлоксацин, амоксициллин, доксициклин, нитрофурантоин и ципрофлоксацин. Построение нормированной диаграммы с накоплением для чувствительности и устойчивости микроорганизмов к антибактериальным препаратам основано на частоте встречаемости признака и его доле в общей категории. Результат выражен в процентном отношении каждого антибиотика с учетом частоты его использования в общем спектре чувствительности.
Полученные данные продемонстрировали высокую эффективность имипенема, нитрофурантоина, амикацина, которая практически не снизилась за изучаемый период (рис. 1). Зарегистрировано уменьшение эффективности ампициллина и ципрофлоксацина, а также цефтриаксона и доксициклина. Частота антибиотикоустойчивых форм микроорганизмов коррелировала с постоянно увеличивающейся неэффективностью ампициллина и цефуроксима (рис. 2). За исследуемый период устойчивость штаммов к нитрофурантоину и имипенему оставалась на низком уровне. Отмечено постепенное уменьшение эффективности левофлоксацина и цефтриаксона.
Достоверность полученных графических материалов для нитрофурантоина, имипенема, ампициллина и ципрофлоксацина оценивали путем расчета коэффициента W Кендалла. Относительное снижение результативности нитрофурантоина и имипенема, оцененное с применением коэффициента W Кендалла, выявило достаточную взаимосвязь всех групп с 2011 по 2018 г. (коэффициент W Кендалла 0,801, χ2 78,112, p = 0,000), что свидетельствует об отсутствии статистически значимой разницы между значениями. Эффективность ампициллина и ципрофлоксацина, оцененная с 2011 по 2018 г. по коэффициенту W Кендалла 0,135, χ2 67,432, p = 0,001, демонстрирует значимую разницу между полученными значениями.
Таким образом, эмпирическое использование ампициллина и ципрофлоксацина в лечении инфекций мочевых путей обосновано недостаточно. Сохраняется высокая эффективность нитрофурантоина и имипенема. Дальнейший мониторинг антибиотикограмм позволит выявить динамику роста резистентности микроорганизмов к другим антибактериальным препаратам.
Обсуждение результатов
Представления об инфекциях мочевых путей за последние несколько лет кардинально изменились. Новые классификации, подходы к диагностике и лечению в большой степени обусловлены неэффективностью проводимой терапии. Доступность антибактериальных препаратов, часто их бесконтрольное необоснованное назначение и применение привели к изменению структуры микробного спектра, высеваемого при изучении микробиоты мочи.
Следует отметить значение формирования антибиотикоустойчивых форм микроорганизмов в рецидивировании и прогрессировании инфекционного процесса. Снизилась роль Escherichia coli как основного возбудителя инфекций мочевых путей – на ее долю, по нашим данным, пришлось не более 33,5% от общего числа обнаруженных микроорганизмов. Увеличилась представленность грамположительной флоры, вызывающей частое рецидивирование инфекционного процесса. Условно патогенные грамположительные и грамотрицательные бактерии чаще стали определяться у пациентов с инфекциями мочевых путей. Важным остается вопрос, является ли обнаруженная флора источником воспалительного процесса.
Анализ чувствительности микроорганизмов к применяемым в рутинной практике антибиотикам продемонстрировал неэффективность пенициллинов и цефалоспоринов второго поколения как препаратов, оказывающих антибактериальный эффект при лечении инфекций мочевых путей. Фторхинолоны и цефалоспорины третьего поколения постепенно потеряли значимость в урологической практике. Высокоэффективным на протяжении всего наблюдения оставался нитрофурантоин.
Выводы
С учетом низкой частоты выявления бактериурии при выполнении антибиотикограммы у урологических больных следует строго придерживаться рекомендаций по сбору, транспортировке биологических материалов и способам проведения самого бактериологического исследования.
Необходим мониторинг результатов микробиологического исследования мочи на госпитальном и амбулаторном этапах лечения урологических больных.
Изменившаяся структура микробиоты мочи диктует необходимость строго соблюдать принципы рациональной антибиотикотерапии с учетом региональных особенностей высеваемой флоры.
V.E. Ryazantsev, PhD, V.V. Vlasov, F.V. Rumyantsev, V.O. Kiushkin
National Research Ogarev Mordovia State University, Saransk
Contact person: Vladimir E. Ryazantsev, bobsonj@mail.ru
Relevance. Over the past few years, approaches to the classification and treatment regimens of urinary tract infections have changed. The growth of antibiotic-resistant flora and the recurrence of urinary tract infections are due to a violation
of the principles of rational antibiotic therapy in urology.
Purpose: to study the microbial spectrum of urine in major urological diseases and to study the resistance of flora to the most commonly used antibacterial drugs.
Material and methods. A retrospective and prospective analysis of the results of urine culture was performed in 14 321 urological patients from 2011 to 2018 with determination of the sensitivity of the flora to antibacterial drugs. A twofold decrease in the proportion of Escherichia coli, previously occupying a leading position in the structure of pathogens of urinary tract infections, was detected (33.5%) and an increase from 5.3% to 17.1% of the share of opportunistic flora. Microorganisms of the genus Staphylococcus occupy the second place of the causative agents of urinary infection. Antibacterial therapy prescribed without taking into account specificity and sensitivity in 4% of cases leads to a relapse of upper urinary tract infections. The resistance of microorganisms to penicillins and cephalosporins of the 2nd generation is noted, the importance of fluoroquinolones and cephalosporins of the 3rd generation decreases as drugs that have a positive antibacterial effect in the treatment of urinary tract infections. High sensitivity of microorganisms to nitrofurantoin remains.
Conclusion. The structure of urinary tract infections has changed. The beginning of antibiotic therapy, before passing a urine test, explains the low degree of positive results detected for bacteriuria. Short-term courses of antibiotic therapy without taking
into account the sensitivity of microorganisms lead to an increase in the proportion of antibiotic-resistant forms. At the outpatient stage, the principles of rational antibiotic therapy are not observed and the results of antibioticograms are not monitored.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.