количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Дисбиоз пищеварительного тракта как фактор риска в сердечно-сосудистом континууме: патофизиология и лечение
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и ангиология" №3 (25)
- Аннотация
- Статья
- Ссылки
- English
В статье приведены данные научной медицинской литературы о связи состояния микробиоты полости рта и желудочно-кишечного тракта с атерогенной дислипидемией и ее роли в развитии сердечно-сосудистых осложнений. Представлены результаты эпидемиологических исследований об уровне ассоциированности воспалительных заболеваний полости рта с атерогенными заболеваниями сердечно-сосудистой системы. Рассмотрены механизмы влияния микрофлоры пародонта на формирование нестабильных атероматозных бляшек в сосудистом русле с возможными клиническими проявлениями. Приведены собственные данные анализа 1000 амбулаторных карт пациентов с пародонтитом различной степени выраженности; показана взаимосвязь тяжести пародонтита с нарушениями углеводного и липидного обмена, активностью системного воспаления и окислительного стресса.
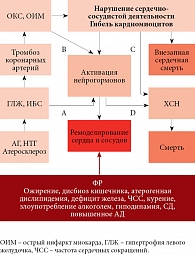
Рис. 1. Континуум сердечно-сосудистых заболеваний при метаболическом синдроме
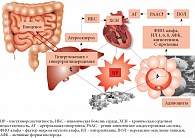
Рис. 2. Взаимосвязь микробиоценоза полости рта и кишечника с метаболическими изменениями при метаболическом синдроме
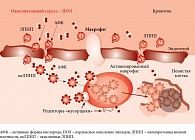
Рис. 3. Схема формирования атеромы
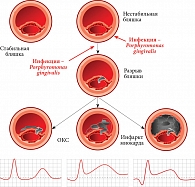
Рис. 4. Формирование нестабильной бляшки и острого коронарного синдрома (ОКС)
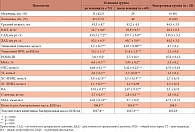
Таблица 1. Состояние углеводно-липидного обмена, провоспалительного, окислительного и бактериального статусов до и после 12-недельной терапии

Таблица 2. Динамика состояния пародонта до и после лечения (24 недели)
Современные достижения в области экспериментальной и клинической медицины на клеточном и молекулярном уровне позволили переосмыслить патофизиологию различных заболеваний внутренних органов и связь между ними (полиморбидность).
Сформулированное в 1991 г. V. Dzau и E. Braunwald понятие единого сердечно-сосудистого континуума прочно закрепилось в научно-медицинской практике. Применительно к практической медицине континуум (от англ. continuous – постоянный, непрерывный) подразумевает непрерывную последовательность этапов развития заболевания – от факторов риска (ФР) до летального исхода (рис. 1).
В современных рекомендациях по диагностике и лечению различных сердечно-сосудистых заболеваний (ССЗ) особое место занимают выявление и коррекция факторов риска развития заболеваний сердечно-сосудистой системы (ССС). Эти ФР во многом универсальны, то есть характерны для большинства ССЗ. В настоящее время ФР подразделяют:
- на немодифицируемые: возраст, пол, расовая принадлежность, отягощенный семейный анамнез;
- модифицируемые: частота сердечных сокращений, ожирение, состояние микробиоты пищеварительного тракта, уровень холестерина, нарушение толерантности к глюкозе (НТГ) или сахарный диабет (СД) 2 типа, высокий уровень артериального давления (АД), курение, дефицит магния;
- «мягкие»: агрегационное состояние плазмы крови, низкий уровень липопротеинов высокой плотности (ЛПВП) и альфа-липопротеина, высокий уровень С-реактивного белка (маркер системного воспаления), воспалительных цитокинов – тканевого активатора плазминогена 1, фактора некроза опухоли альфа (ФНО-альфа), интерлейкинов (ИЛ) 1–10 и др.
Одновременное воздействие нескольких ФР у одного пациента способствует существенному увеличению риска развития сердечно-сосудистых осложнений (ССО) – c 5,5% при одном ФР до 21,8% с восьмью и более ФР.
По мнению экспертов Всемирной организации здравоохранения, метаболический синдром как клиническая модель полиморбидности является неинфекционной пандемией XXI века. В контексте сердечно-сосудистого континуума метаболический синдром – это комплекс метаболических нарушений, ССЗ, патогенетически взаимосвязанных через инсулинорезистентность, на фоне абдоминального ожирения. Метаболические нарушения при метаболическом синдроме достаточно специфичны и включают НТГ или СД 2 типа, атерогенную дислипидемию с преимущественным повышением уровня триглицеридов (ТГ), являющихся факторами риска развития артериальной гипертензии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН). Метаболический синдром в 70–90% случаев сочетается с нарушениями состава аутохтонной (резидентной) микробной флоры пищеварительного тракта – дисбиозом (рис. 2).
Пищеварительный тракт – открытая экосистема человека, входными воротами которой служит полость рта. В течение последних 25 лет исследователи-клиницисты по-новому рассматривают взаимосвязь воспалительных заболеваний различных отделов пищеварительного тракта (пародонтит, дисбиоз кишечника) в качестве факторов риска формирования атеросклероза и ССО – ИБС (острого коронарного синдрома (ОКС), инфаркта миокарда), инсульта головного мозга.
Еще Гиппократ констатировал: «Смерть человека начинается в его толстой кишке». В древних рукописях ассирийцев, иудеев, греков, римлян упоминается: «…крепкие зубы являются признаком хорошего здоровья». На рубеже XIX и XX веков в ряде научных публикаций отмечалось, что причина развития различных патологий организма – сепсис полости рта [1–4]. Согласно теории очаговой инфекции 1912 г. патогенные микроорганизмы из инфицированных тканей полости рта через лимфо- и микрокровотоки распространяются по всему организму и становятся причиной развития различных заболеваний, включая артрит и нефрит [2, 3].
В основе заболеваний пародонта лежит воспаление пародонтальных тканей с образованием биопленки – зубного налета, имеющего сложный полимикробный состав. Образование микробных биопленок начинается с появления возбудителя в очаге инфекции. Возбудитель синтезирует полисахаридный матрикс, увеличивающий адгезию бактерий к поверхности. Одновременно биопленка служит «бронежилетом», защищающим бактерии, находящиеся внутри пленки, от местной (регионарной) иммунной системы и антибактериальных препаратов.
Генерализация воспалительного процесса сопровождается разрушением зубодесневого сочленения и образованием патологического пародонтального кармана (одного из определяющих признаков пародонтита). Данный патологический процесс в полости рта сопряжен со значительным экологическим сдвигом в количественном и качественном составе не только биопленки (внешний матрикс бактериальных колоний), но и всего пищеварительного тракта. Снижение регионарного иммунитета способствует активному размножению патогенных бактерий, биологическая масса (концентрация) которых может достигать 109–10 КОЕ/мл в отдельно взятом пародонтальном кармане.
Поврежденная эндотелиальная выстилка пародонтальных карманов (существенная площадь при распространенном пародонтите) является входными воротами, через которые липополисахариды – продукты жизнедеятельности патогенных микробов и другие антигенные белковые структуры бактериального происхождения (гистамины) проникают в микро- и лимфоциркуляцию. Воздействуя на подлежащие ткани, продукты воспаления дополнительно вызывают прогрессирование процесса с миграцией возбудителей в микрососудистое русло пародонта и системный кровоток, что может сопровождаться транзиторной бактериемией. Провоспалительные цитокины, секретируемые в пародонтальных карманах, попадая в сосудистое русло, провоцируют развитие системной эндотелиальной дисфункции, являющейся одним из начальных факторов формирования атеросклероза сосудистого русла. В исследованиях показано, что атеросклеротическое поражение сосудистого русла при распространенном пародонтите реализуется (с большей степенью вероятности) через циркулирующее влияние провоспалительных цитокинов. Химокины и продукты жизнедеятельности бактерий, воздействуя на поверхностные рецепторы эндотелия, активируют адгезию провоспалительных молекул и моноцитов на эндотелиальной выстилке сосудов. В результате моноциты периферической крови задерживаются на поверхности, мигрируют в субэндотелиально-адвентициальное пространство сосудов и превращаются в макрофаги. Последние в свою очередь захватывают окисленные (на фоне системного воспаления) липопротеины низкой плотности (ЛПНП), превращаются в пенистые клетки, являющиеся основой атеросклеротической бляшки (рис. 3). Процесс формирования атеросклеротической бляшки усугубляется из-за наличия антител, вырабатываемых организмом хозяина в ответ на появление специфических белков бактерий – белков теплового шока. Вырабатываемые антитела эволюционно устойчивы и имеют высокую степень сродства к белкам организма-хозяина. Подобный белковый провоспалительный комплекс – своеобразный агент, провоцирующий апоптоз и разрушение внутреннего эндотелиального слоя сосудов.
В настоящее время убедительно показано, что у пациентов с пародонтитом определяются повышеные уровни провоспалительных цитокинов в крови (ФНО-альфа, ИЛ-1–10, С-реактивный белок и др.). Высокий уровень С-реактивного белка в сыворотке крови свидетельствует о развитии осложнений в ССС через активацию окислительного стресса. В частности, на фоне системного воспаления, спровоцированного пародонтитом различной степени тяжести, происходит ферментативное разрушение внеклеточного матрикса и фиброзной оболочки атеромы (нестабильная бляшка). Это сопровождается разрывом капсулы атеросклеротической бляшки, выбросом протромботических компонентов с формированием тромба с частичной или тотальной окклюзией просвета сосуда. В зависимости от региона сосудистого русла, в котором формируется этот патологический процесс, может развиваться либо инсульт, либо ОКС и инфаркт миокарда (рис. 4). Роль патогенной микрофлоры полости рта в развитии системного атеросклероза была подтверждена результатами иммунобиохимического гистологического исследования образцов атеросклеротических бляшек, полученных при эндартерэктомии: в составе бляшек были идентифицированы ДНК бактерий и жизнеспособные бактерии полости рта. В эксперименте у животных инфицирование специфическими возбудителями пародонтита – Porphiromonas gingivalis ускоряло развитие атеросклероза сосудов.
Накопленные данные клинических наблюдений подтолкнули Американскую ассоциацию кардиологов (American Heart Association – AHA) в апреле 2012 г. к выработке официальной позиции, представленной в публикации «Заболевание пародонта и атеросклероз сосудов: подтверждена ли независимая взаимосвязь доказательствами?» (Periodontal Disease and Atherosclerotic Vascular Disease: Does the Evidence Support an Independent Association?) [6]. На основании обзора всего объема доступных данных эксперты AHA сделали вывод: пародонтит – независимый фактор риска развития атеросклероза сосудов – причины сердечно-сосудистых заболеваний [5]. В 2013 г. на объединенном симпозиуме Европейской федерации пародонтологов и Американской академии пародонтологов было сформулировано аналогичное заключение о наличии статистически значимого более высокого риска возникновения ССЗ у пациентов с пародонтитом [6].
Как уже отмечалось, в течение последних десятилетий исследователи-клиницисты по-новому рассматривают взаимосвязь воспалительных заболеваний различных отделов пищеварительного тракта (пародонтит, дисбиоз кишечника) в качестве факторов риска формирования атеросклероза в сердечно-сосудистом континууме. Клинические исследования продемонстрировали прямую взаимосвязь состояния микробиоценоза полости рта (пародонтит) и кишечника (дисбиоз) с нарушениями углеводного (предиабет – НТГ или СД 2 типа) и липидного (атерогенез) состава крови, функционального состояния печени (жировой гепатоз) на фоне абдоминального ожирения или избыточного веса.
Нормальная микрофлора пищеварительного тракта (полость рта и кишечник) имеет чрезвычайно важное общебиологическое значение: помимо осуществления трофики она ответственна за формирование до 80% общего и регионального иммунного статуса.
Различные патогенные бактерии (дисбиоз) в полости рта и кишечнике, провоцируя развитие системного воспаления с активацией свободнорадикальных перекисных реакций (ПОЛ – перекисное окисление липидов), способствуют формированию инсулинорезистентности и атерогенной дислипидемии.
В настоящее время подтверждена патогенетическая взаимосвязь состояния биоценоза пищеварительного тракта не только с заболеваниями желудочно-кишечного тракта (ЖКТ), но и с атеросклерозом, НТГ, СД 2 типа, АГ, ИБС (компоненты метаболического синдрома), бронхиальной астмой, экземой, пиелонефритом и мочекаменной болезнью, гепатитом и желчнокаменной болезнью – частыми компонентами полиморбидности [1, 7–13].
По данным эпидемиологических исследований, распространенность воспалительных заболеваний полости рта, в частности пародонта, у взрослого населения РФ составляет 81–100% [2, 14, 15]. Патология пародонта редко бывает изолированной и не связанной с другими сопутствующими заболеваниями. В настоящее время в среднем у каждого пациента в возрасте моложе 20 лет с хроническим пародонтитом имеется 2,8 сопутствующих заболеваний, в возрасте 21–40 лет – 2,9, в возрасте 41–60 лет – 4,5 [2, 14, 15].
Как показывает современный клинический опыт, наличие нескольких хронических заболеваний различных отделов пищеварительного тракта (гингивит, пародонтит, дисбиоз ЖКТ) способствует их прогрессированию, хронизации и формированию резистентности к лечению. Накоплено достаточно сведений об этиологических факторах риска и патогенезе воспалительных заболеваний пищеварительного тракта, основными из которых являются нарушения микробного статуса (микробиоза) начиная с полости рта и заканчивая нижними отделами ЖКТ, что сопровождается интенсификацией системного и регионарного воспаления и окислительного стресса, истощением антиоксидантной системы, нарушением общего и местного иммунитета.
В ранних публикациях отмечалось наличие микроорганизмов в полости рта при хронических воспалительных заболеваниях, несвойственных этому биотопу. И напротив, рядом авторов показано, что дисбиоз полости рта, верхних дыхательных путей и пищевода – следствие дисбиоза кишечника через различные механизмы реверсивной транслокации патогенной флоры [2, 3, 10, 15, 16].
Между тем в представленных публикациях не определены четкие механизмы взаимосвязи биоценозов различных отделов ЖКТ. Сочетание различных факторов риска развития хронических воспалительных заболеваний и изменения микрофлоры полости рта могут являться запускающими и прогностически неблагоприятными факторами в отношении качества жизни пациента. Неблагоприятные взаимные влияния биоценозов различных отделов ЖКТ редко учитываются в клинической практике, что может быть причиной низкой эффективности профилактических и лечебных мероприятий в отношении рецидивов и прогрессирования заболеваний.
Материал и методы исследования
Для изучения факторов риска в сердечно-сосудистом континууме, оценки влияния микрофлоры пищеварительного тракта на липидно-углеводный обмен и клинический статус нами был проведен ретроспективный анализ 1000 амбулаторных карт пациентов с пародонтитом различной степени тяжести, с распределением по группам в зависимости от индекса массы тела (ИМТ). ИМТ > 25 кг/м2 как фактор риска был выявлен в 57,2% случаев. В группе пациентов с ИМТ ≥ 35 кг/м2 (16%) генерализованное воспаление пародонта в 74,4% случаев имело тяжелую степень, в 23,6% носило агрессивный характер. В то же время в группе пациентов с ИМТ ≤ 25 кг/м2 генерализованное воспаление пародонта тяжелой степени отмечалось только в 54,9%. Это свидетельствовало о том, что избыточная масса тела – фактор риска дисбиоза пищеварительного тракта.
Исследование в динамике
Для объективизации роли пародонтита и состояния микрофлоры кишечника как факторов риска сердечно-сосудистых заболеваний нами было отобрано 20 пациентов с ИМТ < 25 кг/м2 в контрольную группу и 73 пациентов с ИМТ ≥ 25 кг/м2 – в основную. Всем пациентам в динамике (до и после 12-недельного лечения) помимо исследования гликемического и липидного спектров крови, окислительного статуса проводили оценку биоптатов полости рта и кишечника (кал) с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени.
Пациентов – участников исследования обучали правилам гигиены полости рта, стандартной профессиональной гигиены с устранением местных факторов, способствующих скоплению и активации микробного статуса. Для объективной оценки клинического состояния пародонта определяли гигиенические индексы (Грина – Вермильона (Green – Vermillion) (1964), Силнеса – Лоэ (Silness – Loe) (1962)) и индексы кровоточивости (Мюллемана (Muhlemann) в модификации Коуэлла (Cowell) (1975)). Кроме того, регистрировали степень подвижности зубов по шкале Миллера (Miller) в модификации Флезара (Flezar) и глубину пародонтальных карманов. Микробный статус полости рта оценивали с помощью ПЦР в режиме реального времени [17].
К стандартной программе лечения ССЗ (бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (иАПФ), фенофибраты) и пародонтита у пациентов с ИМТ ≥ 25 кг/м2 для компенсации дисбиоза и купирования окислительного стресса (системное воспаление) были добавлены эубиотик Про-Симбиофлор (10 капель три раза в день), пробиотик Симбиолакт Комп. (один пакетик в сутки) и комплексный катализатор Убихинон композитум (2 мл внутримышечно два раза в неделю). Результаты исследования до и после лечения представлены в табл. 1. Данные в отношении четырех пациентов из основной группы были исключены в связи с несоблюдением режима лечения.
До лечения имелись статистически достоверные специфические межгрупповые различия в параметрах углеводно-липидного обмена и биоценозе (видовая и бактериальная масса) полости рта и нижних отделов кишечника. Выраженность изменений со стороны углеводно-липидного обмена, статуса системного воспаления (С-реактивный пептид), активности окислительного стресса и биоценоза полости рта и кишечника находится в прямой зависимости от ИМТ.
В основной группе относительно низкий уровень тощаковой гликемии 5,2 ± 0,1 ммоль/л на фоне инсулинорезистентности (в этой группе коэффициент инсулинорезистентности HOMA-IR превышал аналогичный показатель в контрольной группе в 5,8 раза, p < 0,001) поддерживался за счет компенсаторной гиперинсулинемии: уровень тощакового иммунореактивного инсулина (ИРИ) в основной группе превышал таковой в контрольной группе в 5,2 раза, p < 0,001.
Интегральный показатель атерогенности плазмы крови (ИА) в группе пациентов с признаками метаболического синдрома (3,55 ± 0,3) превышал аналогичный показатель в контрольной группе (2,1 ± 0,15) в 1,7 раза (p < 0,01), что свидетельствовало о более выраженных нарушениях холестеринового обмена.
Бактериальная масса флоры пищеварительного тракта пациентов основной группы (ИМТ ≥ 25 кг/м2) суммарно составила в полости рта 108,4 КОЕ/мл, в прямой кишке 1017,4 КОЕ/мл и статистически значимо (p < 0,01) превосходила массу флоры в контрольной группе (ИМТ < 25 кг/м2): в полости рта – 104,5 КОЕ/мл, в прямой кишке – 1014,9 КОЕ/мл. Среди изучаемых микроорганизмов лидером роста по мере развития тяжести пародонтита являлись Porphiromonas gingivalis, количественное содержание которых при хроническом генерализованном пародонтите (ХГП) достигало 4 × 106 КОЕ/мл. Состояние и качественный состав микрофлоры полости рта в исследуемой группе находились в прямой зависимости от выраженности (агрессивная форма) воспалительных изменений пародонта с появлением уреазопродуцирующих бактерий (Klebsiella) и грибов (Candida spp.) – до 2 × 102 КОЕ/мл.
Более выраженные провоспалительные и окислительные процессы в основной группе сопровождались в 100% случаев ХГП различной степени тяжести. В контрольной группе аналогичная патология регистрировалась в 73,3% случаев – по количественному составу с более легкой степенью тяжести (табл. 2).
Результаты
После проведенного лечения отмечалась положительная динамика в количественных показателях бактериальной массы пищеварительного тракта: в полости рта бактериальная биомасса статистически достоверно снизилась с 108,4 до 105,4 КОЕ/мл (p < 0,01), в нижних отделах кишечника – с 1017,4 до 1015,1 КОЕ/мл (p < 0,001).
После добавления к терапии микробиологических препаратов и Убихинона композитум (12 недель – контрольная точка) у пациентов основной группы на фоне статистически достоверного снижения ИМТ с 32,7 ± 0,8 до 29,9 ± 0,6 кг/м2 наблюдались статистически значимые изменения показателей системного воспаления и окислительного стресса: концентрация С-белка снизилась с 3,7 ± 0,3 до 2,8 ± 0,1 нг/мл, а уровень малонового диальдегида (МДА) – с 6,41 ± 0,74 до 3,7 ± 0,4 мкмоль/л (p < 0,01).
Статистически достоверная положительная динамика со стороны системного воспаления (снижение концентрации С-белка на 18,7%), активности окисления (уменьшение уровня МДА на 42,3%) сопровождалась статистически достоверной положительной динамикой показателей углеводно-липидного обмена (HOMA-IR, HbA1c, ИА). В основной группе HOMA-IR (показатель ИР) снизился с 3,0 ± 0,2 до 2,5 ± 0,1, одновременно уменьшилась концентрация тощакового ИРИ с 13,1 ± 1,1 до 11,4 ± 0,9 мкМЕ/мл (p < 0,01), что свидетельствовало о восстановлении чувствительности инсулиновых рецепторов. Стабилизация гликемического профиля у пациентов с метаболическим синдромом на фоне проведенного лечения документируется статистически достоверным снижением HbA1c на 9,8% (p < 0,05).
Добавление к гиполипидемической терапии фенофибрата в дозе 145 мг (Трайкор), микробиологических средств и Убихинона композитум способствовало более выраженным антиатерогенным сдвигам липидного спектра крови: уровни общего холестерина, ТГ, ЛПНП снизились на 18,4, 35 и 13,2% соответственно. Одновременно возросла концентрация ЛПВП на 9,1% (разница статистически достоверна, p < 0,05–0,01). Подобная положительная динамика со стороны липидного спектра крови способствовала уменьшению ИА на 24,8% (p < 0,05).
В целом в группе больных с метаболическим синдромом снижение ИМТ на 8,6%, HOMA-IR (показатель ИР) на 18%, компенсаторной гиперинсулинемии (тощаковый ИРИ) на 13% суммарно через уменьшение активности симпатической нервной системы способствовало восстановлению АД до целевого уровня: до лечения САД/ДАД – 155,3 ± 7,2/92,1 ± 4,3 мм рт. ст., после лечения – 137 ± 6,8/80,7 ± 3,2 мм рт. ст. (разница статистически достоверна, p < 0,001).
По окончании терапии при контрольном исследовании микрофлоры полости рта у пациентов с метаболическим синдромом отмечалось практически в 1,5 раза статистически достоверное уменьшение диапазона микробной массы: с 105–108 до 103–105 КОЕ/мл. Это клинически подтверждалось уменьшением тяжести пародонтита в целом по группе (табл. 2).
Состояние микробиоценоза на различных уровнях пищеварительного тракта (полость рта, кишечник) оказывает реверсивное взаимное влияние. Высокая степень положительной корреляции между патогенной и условно патогенной микрофлорой полости рта и кишечника свидетельствует о том, что эти представители микрофлоры способны перемещаться из верхних резервуаров (полость рта) и наоборот (рефлюксогенно) – из кишечника в пищевод и далее в полость рта. Подобные транслокации микроорганизмов оказывают взаимное влияние на локальный биоценоз, системное и региональное воспаление, местный и общий иммунитет [2, 3, 7, 10, 16].
Таким образом, у пациентов с абдоминальным типом ожирения и избыточным весом (ИМТ ≥ 25 кг/м2) в подавляющем большинстве (от 80 до 90%) случаев имеют место нарушения микробиоценоза кишечника (дисбиоз), которые сопровождаются развитием системного воспаления, активацией свободнорадикальных процессов (окислительный стресс), снижением регионального и общего иммунитета. Дисбиоз кишечника, активация провоспалительных цитокинов, ПОЛ, будучи факторами риска на начальном этапе сердечно-сосудистого континуума, способствуют формированию инсулинорезистентности и нарушению углеводного и липидного обмена с развитием НТГ или СД 2 типа, атерогенной дислипидемии.
Контаминация патогенной или условно патогенной микрофлорой кишечника облигатно ведет к изменению аутохтонной микрофлоры ротовой полости с поражением пародонта различной степени тяжести, что реверсивно способствует прогрессированию патологии пищеварительного тракта: хронического генерализованного пародонтита, эзофагита, гастродуоденита, энтероколита, стеатоза, стеатогепатита, неалкогольной жировой болезни печени.
В отличие от людей со здоровым пародонтом у пациентов с пародонтитом определяется более высокий уровень медиаторов системного воспаления в сыворотке крови, включая С-реактивный белок.
Заключение
Закономерности, выявленные в ходе нашего исследования, позволяют сформулировать концепцию рекуррентно-реверсивного соотношения биоценозов различных отделов пищеварительного тракта, определить их влияние на липидно-углеводный обмен у пациентов с ИМТ ≥ 25 кг/м2 как одного из основных звеньев сердечно-сосудистого континуума в патогенезе атеросклероза, НТГ и сердечно-сосудистых осложнений. Патогенетически обоснованное включение в комплексную программу лечения на ранних этапах развития метаболического синдрома микробиологических препаратов (корректоры микрофлоры ЖКТ) и препарата с комплексным действием (Убихинон композитум) позволяет восстановить микрофлору пищеварительного тракта. В свою очередь нормализация микрофлоры пищеварительного тракта способствует восстановлению общего и регионального иммунного статуса, улучшению репаративных процессов в пародонте, купированию окислительных процессов, восстановлению чувствительности инсулиновых рецепторов, нормализации липидно-углеводного спектра крови.
1. Арутюнов Г.П., Кафарская Л.И., Власенко В.К. и др. Биоценоз кишечника и сердечно-сосудистый континуум // Сердечная недостаточность. 2004. Т. 5. № 5. С. 224–229.
2. Папапаноу П.Н. Связь пародонтита и атеросклероза сосудов: актуальные данные и значимость для специалистов и общества // Лечащий врач. 2013. № 7. C. 44–48.
3. Billings F. Chronic focal infections and their etiologic relations to arthritis and nephritis // Arch. Intrn. Med. 1912. № 9. P. 484–498.
4. O'Reilly P.G., Claffey N.M. A history of oral sepsis as a cause of disease // Periodontol. 2000. № 23. P. 13–18.
5. Tonetti M.S., Van Dyke T.E., Working group 1 of the joint EFP/AAP workshop. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases // J. Clin. Periodontol. 2013. Vol. 40. Suppl. 14. P. S24–29.
6. Lockhart P.B., Bolger A.F., Papapanou P.N. et al. Periodontal disease and atherosclerotic vascular disease: does the evidence support an independent association?: a scientific statement from the American Heart Association // Circulation. 2012. Vol. 125. № 20. P. 2520–2544.
7. Голофеевский В.Н. Важнейшие вопросы патоморфогенеза и лечения неалкогольной жировой болезни печени у больных сахарным диабетом // Врач. 2013. № 7. С. 8–11.
8. Звенигородская Л.А., Черкашова Е.А., Нилова Т.В. Некоторые особенности лечения атерогенной дислипидемии у больных с неалкогольной жировой болезнью печени // Consilium Medicum. 2011. Т. 13. № 5. С. 110–116.
9. Конев Ю.В., Лазебник Л.Б., Яковлев М.Ю. Атеросклероз и эндотоксин // Клиническая геронтология. 2004. № 7. С. 36–42.
10. Ткаченко Е.И., Суворова А.Н. Дисбиоз кишечника. Руководство по диагностике и лечению. СПб.: СпецЛит, 2006. С. 3–56.
11. Шилов А.М., Зорина О.А., Петрухина Н.Б. Дисбиоценоз кишечника, пародонтит и метаболически ассоциированные сердечно-сосудистые заболевания // Фарматека. 2013. № 14. С. 85–91.
12. Conraads V.M., Jorens P.G., De Clerck L.S. et al. Selective intestinal decontamination in advanced chronic heart failure: a pilot trial // Eur. J. Heart. Fail. 2004. Vol. 6. № 4. P. 483–491.
13. Gane E.J., Stedman C.A., Hyland R.H. et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C // N. Engl. J. Med. 2013. Vol. 368. № 1. P. 34–44.
14. Микробиология и иммунология для стоматологов / под ред. Р.Дж. Ламонта, М.С. Лантц, Р.А. Берне, Д.Дж. Лебланка. Пер. с англ. под ред. В.К. Леонтьева. М.: Практическая медицина, 2010. С. 3–504.
15. Суворов К.В. Пародонтит и биоценоз пищеварительного тракта: этиопатогенетические взаимосвязи и клиническое значение: автореф. … дис. канд. мед. наук. Тверь, 2013.
16. D'Aiuto F., Orlandi M., Gunsolley J.C. Evidence that periodontal treatment improves biomarkers and CVD outcomes // J. Clin. Periodontol. 2013. Vol. 40. Suppl. 14. P. S85–105.
17. Чучалин А.Г., Синопальников А.И., Страчунский Л.С. Пневмония. М.: МИА, 2006. С. 80–84.
Gastrointestinal Dysbiosis – Risk Factor for Cardiovascular Diseases: Pathophysiology and Treatment
A.M. Shilov, N.B. Petrukhina, O.A. Zorina, A.A. Maryanovsky
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksandr Mikhaylovich Shilov, alexmshilov@mail.ru
The article analyzes medical literature data on the influence of oral and gastrointestinal microbiota on the risk of atherogenic dyslipidemia and cardiovascular events. The authors present the results of epidemiologic studies evaluating the link between inflammatory disorders of oral cavity and atherogenic cardiovascular diseases. The mechanisms of influence of parodontal microflora on the formation of vulnerable atheromatous plaques and on the risk of associated clinical symptoms are discussed. The authors analysed 1000 medical cards of patients with parodontitis; parodontitis severity was correlated with the disorders of carbohydrate and lipid metabolism and activity of systemic inflammation and oxidative stress.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.