Терапия больных рецидивирующей герпетической инфекцией (РГИ) затруднительна вследствие многообразия клинических форм заболевания, пожизненной персистенции вирусов, достаточно высокой стоимости эффективных противогерпетических средств. Противовирусные химиопрепараты подавляют репродукцию вируса простого герпеса (ВПГ), вызывают клиническую ремиссию, но не влияют на частоту рецидивов [1].
Трудно поддается лечению генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением – так называемый менструальный герпес, характеризующийся обострениями инфекционного процесса до, во время или после менструации [2]. Для молодой женщины это сильный психотравмирующий фактор, ограничивающий социальную активность и снижающий качество жизни [3]. Европейские стандарты диагностики и лечения ГГ рекомендуют длительную супрессивную терапию противовирусными химиопрепаратами (аналоги нуклеозидов – ацикловир, валацикловир) [4]. К сожалению, такая тактика не исключает рецидивирования заболевания и бессимптомного вирусовыделения, способствует увеличению риска развития побочных эффектов и формированию устойчивости вирусов герпеса к химиопрепаратам [4, 5]. В связи с этим остается актуальной разработка эффективных способов лечения и профилактики рецидивов ГГ у женщин с монотонным типом рецидивирования.
Цель исследования – оценить эффективность вакцины Витагерпавак для профилактики ГГ у данной категории больных.
Материалы и методы исследования
Под наблюдением находилось 100 молодых женщин с менструальным герпесом, характеризующимся монотонным типом рецидивирования с ежемесячными обострениями (12 и более рецидивов в год). Были сформированы 4 группы по 25 человек в зависимости от применяемой терапии: в 1-й группе больные получали Фамвир, во 2-й – Фамвир и Амиксин, в 3-й – Фамвир и Циклоферон, в 4-й – Фамвир и Виферон (ректальные суппозитории).
После курса подготовительной терапии (1-й этап) при условии, что рецидивы герпеса отсутствовали в течение 1,5–2 месяцев, были отобраны 40 пациенток для противорецидивной вакцинотерапии (2-й этап), которую проводили инактивированной герпетической вакциной (ИГВ) Витагерпавак по аллергометрической методике согласно рекомендациям [6, 7].
Определяли количество клеток CD4+, CD8+, CD16+ периферической крови (ПК) пациенток методом непрямой иммунофлуоресценции с моноклональными антителами [8].
Содержание интерлейкина-4 (ИЛ-4), интерферона-гамма (ИФН-гамма) в сыворотке крови больных определяли с помощью набора реагентов Pro Con (ООО «Протеиновый контур», Санкт-Петербург) методом твердофазного иммуноферментного анализа согласно инструкции. Чувствительность определения – 1,5 пг ИФН-гамма/мл, 2 пг ИЛ-4, средняя воспроизводимость – 91–98%.
При исследовании уровня продукции лейкоцитами ПК пациенток ИФН-альфа/бета, индуцированной вирусом болезни Ньюкасла, а также продукции ИФН-гамма, индуцированного фосфоглицериновым альдегидом, использовали методику, изложенную Ф.И. Ершовым и Е.П. Готовцевой [9, 10].
Диагноз ГГ верифицировали методом полимеразной цепной реакции (ПЦР), исследуя клинический материал (отделяемое из уретры, цервикального канала и шейки матки) на наличие ВПГ 1 и 2 типов. ДНК из материала выделяли с помощью китов компании QAIGEN (Голландия) в соответствии с инструкцией.
Математическую обработку полученных данных осуществляли с использованием компьютерных программ Excel (Microsoft Inc., 1985–1997), STATISTICA for Windows 5.0 (Stat Soft Inc., 1995) [11], рассчитывая среднюю арифметическую, стандартную ошибку средней арифметической, доверительный интервал. Достоверность различий между средними величинами оценивали по t-критерию Стьюдента (уровень значимости р < 0,05). Ряд показателей подвергали дополнительной статистической обработке с помощью программы Prism 4.03 software (GraphPad Prism, www.graphpad.com) и непарного двустороннего t-теста Стьюдента.
Результаты исследования
В процессе лечения рецидивирующего генитального герпеса (РГГ) мы старались быстро купировать острые проявления и стабилизировать течение заболевания для того, чтобы нормализовать показатели иммунограммы, снизить частоту рецидивирования и увеличить длительность периода ремиссии. Включение в комплексную терапию Фамвира в сочетании с ИФН и индукторами ИФН существенно не влияло на нивелирование клинических симптомов заболевания, но способствовало оптимизации клеточного иммунного ответа, нормализации цитокинового профиля (по содержанию ИФН-гамма и ИЛ-4 в плазме крови), что важно для последующей вакцинации.
Из 1-й группы (Фамвир) подготовительного этапа для вакцинации не отобрали никого, из 2-й (Фамвир и Амиксин) включили 7 (17,5%) пациенток, из 3-й (Фамвир и Циклоферон) – 12 (30%), из 4-й (Фамвир и Виферон) – 21 (52,5%) пациентку. Отметим, что все 40 больных ранее имели неудачные попытки вакцинации. Данное лечение рассматривалось как предварительный (1-й) этап, за которым последует специфическая профилактика рецидивов ГГ и впервые будет использована ИГВ Витагерпавак (2-й этап). Цель вакцинации – активация и иммунокоррекция клеточного иммунитета, специфическая десенсибилизация организма.
Наблюдение в течение 6 месяцев после вакцинации 40 пациенток (с частотой обострений до лечения 1 раз в 3–4 недели) показало отсутствие рецидивов ГГ у 23 (57,5%) из них в течение последующих 3 месяцев. Этот клинический эффект расценивали как значительное улучшение (увеличение продолжительности межрецидивного периода в 3 раза). Спустя 5 месяцев обострение герпетической инфекции (абортивная форма) было выявлено у 2 (5%) пациенток: отсутствовали продромальные явления, субъективно отмечался дискомфорт в области высыпаний. Везикулезные элементы были единичными, рецидив проходил самостоятельно в течение суток.
Спустя 2 месяца после вакцинации у 11 (27,5%) пациенток регистрировались повторные герпетические высыпания без субъективной симптоматики, сыпь исчезала самостоятельно, причем намного быстрее, чем до вакцинации. Это позволяет расценивать достигнутый клинический эффект как улучшение. Таким образом, у 34 (85%) больных отмечено явное улучшение течения заболевания с отсутствием рецидивов ГГ на протяжении 3 месяцев после вакцинации. Спустя 6 месяцев после вакцинации улучшение сохранялось у 21 (52,5%) пациентки. Важно, что межрецидивный период увеличился с 2 до 5 месяцев, продолжительность рецидива сократилась до 1–3 суток и он приобрел легкое клиническое (абортивное) течение. И лишь у 6 женщин (15%) эффект отсутствовал.
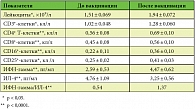
Как известно, CD4+ и CD8+ Т-лимфоциты вместе с CD16+ НК-клетками вносят основной вклад в формирование протективного иммунитета на разных стадиях ВПГ-инфекции, а также при проведении специфической вакцинотерапии. Мы изучали влияние вакцинации ИГВ Витагерпавак на динамику показателей CD4+ и CD8+ Т-лимфоцитов, CD16+ НК-клеток, а также содержание в плазме периферической крови ИФН-гамма и ИЛ-4 (таблица).
Наряду с клиническим эффектом отмечалось выраженное иммуномодулирующее действие с активацией Тh₁-зависимых иммунных реакций. После вакцинации достоверно увеличивались количество лейкоцитов и общих СD3+ Т-лимфоцитов ПК и уровни ИФН-гамма, тогда как содержание ИЛ-4 достоверно снижалось. Концентрация ИФН-гамма в сыворотке крови наблюдаемых больных достоверно повышалась в 1,7 раза, что сопровождалось снижением содержания ИЛ-4 в 1,5 раза (р < 0,05). Данные изменения в содержании двух цитокинов отразились на их соотношении (коэффициент ИФН-гамма/ИЛ-4), которое увеличилось с 0,54 до 1,37 (в 2,5 раза). Вероятно, это обусловлено синергидным повышением продукции ИФН-гамма и одновременным снижением ИЛ-4. Следовательно, имело место не только усиление Тh₁-зависимых иммунных реакций, но и значительное подавление Тh₂-опосредованных иммунных процессов. Последние, как известно, не ассоциированы с протективным иммунитетом при лечении рецидивов ВПГ-инфекции и проведении вакцинотерапии. Вакцинация существенно не отражалась на содержании СD20+-клеток (в основном В-лимфоцитов) в крови (р > 0,05). Это может быть связано с прямым эффектом ИФН-гамма или со снижением их миграционной способности (накопление в периферических тканях). Таким образом, эффективность профилактической вакцинотерапии объясняется не только применением разработанной нами схемы вакцинации, но и правильным выбором комплексной терапии на подготовительном этапе.
Помимо положительной динамики указанных цитокинов в ответ на вакцинотерапию отмечено достоверное (р < 0,05) повышение уровня сывороточных ИФН (ИФН-гамма, ИФН-альфа/бета), что сочеталось с достоверным снижением вирусиндуцированной и митогениндуцированной интерфероновой реакции лейкоцитов.
Содержание CD4+ и CD8+ Т-лимфоцитов в ПК пациенток после вакцинотерапии достоверно повышалось по сравнению с исходными показателями, но не превышало значений, наблюдавшихся у здоровых лиц. У большинства пациенток до вакцинотерапии величины содержания обоих типов лимфоцитов находились в пределах нормы. Вероятно, это объясняется нормализующим эффектом комплексной терапии на подготовительном этапе. Достоверно увеличивалось содержание СD25+ иммунных клеток, что может рассматриваться в качестве маркера неспецифической активации Т- и В-лимфоцитов, а также НК-клеток (р < 0,05). Однако это может свидетельствовать и об увеличении количества СD4+CD25+ регуляторных Т-лимфоцитов, ограничивающих чрезмерные иммунные реакции. Большое значение имеет и повышение после вакцинации содержания СD16+ НК-клеток, поскольку они участвуют в ингибировании репликации латентного ВПГ в ходе вакцинации.
Обсуждение
Важный этап лечения и профилактики РГИ – использование специфических герпетических вакцин. Их обычно применяют в период клинико-иммунологической ремиссии. В разных странах используют живые, инактивированные (цельновирионные и субъединичные) и рекомбинантные вакцины [1, 5, 6, 12]. За последние 40 лет 24 коллектива врачей из пяти европейских стран применили 12 модификаций таких вакцин на десятках тысяч больных РГИ [3, 5].
Вопрос о защите организма от инфицирования патогенными возбудителями занимает центральное место в иммунологии и изучении патогенеза инфекционных заболеваний. Показано, что обеспечение протекции играет существенную роль как при первичном, так и при повторном контакте с антигеном. Помимо этиотропных синтетических препаратов, действие которых направлено на специфическое подавление активности определенного возбудителя, особое место в терапии инфекционных заболеваний занимают вакцины.
Была изучена эффективность вакцин для лечения вирусных инфекций и определены положения, которые можно считать общими для вакцинологии. Установлено, что CD8+ T-клетки с высокой авидностью имеют большое значение для эффективного клиренса вирусных инфекций [13], но они чувствительны к антигензависимому апоптозу [13, 14]. При ряде заболеваний (вирус иммунодефицита человека, вирус гепатита С, рак) из-за клонального истощения или за счет иных механизмов такие клетки могут исчезать. Для оптимизации режима вакцинации мы применили индивидуальный эмпирический подбор дозы коммерческой вакцины Витагерпавак при вакцинации больных ГГ с монотонным рецидивированием.
В 2003 г. сотрудники ЗАО «Фирма “Витафарма”» (Москва) освоили производство и внедрили в медицинскую практику новую вакцину Витагерпавак против простого герпеса, впервые разработанную в России. В мировой практике подобной вакцины нет. Вакцина Витагерпавак представляет собой лиофилизированный инактивированный антиген ВПГ 1 и 2 типов, выращенный на перевиваемой линии клеток почек зеленой мартышки – Vero B, разрешенных Всемирной организацией здравоохранения в качестве субстрата для производства вирусных вакцин. Максимальное сохранение генетической последовательности ДНК вируса в вакцине Витагерпавак обеспечивает ее высокую специфическую активность [6].
Вакцинация больных, хронически инфицированных ВПГ, сопровождается усилением в 3–4 раза специфических реакций Т-клеточного иммунитета. Уровень В-клеточных реакций (титр антител, выявляемый в реакциях нейтрализации и связывания комплемента) не меняется. Вакцина способствует усилению специфической Т-киллерной активности лимфоцитов, стимулирует высокую активность НК-клеток и прекращение вирусемии. Непосредственно после вакцинации и в отдаленном периоде (спустя 6 месяцев) вирусемию не обнаруживали у больных, обследованных методом ПЦР. С помощью метода флуоресцирующих антител в лейкоцитах крови ВПГ выявляли у 6 из 50 больных.
Согласно результатам противорецидивной терапии за период от 3 до 5 лет у 3000 больных с часто рецидивирующими формами герпетической инфекции, рецидивы заболевания полностью прекратились у 1890 (63%) больных, стали возникать значительно реже у 810 (27%), частота рецидивов не изменилась у 240 (8%) больных. При лечении герпетических кератитов, иридоциклитов и кератоиридоциклитов показано, что частота возникновения рецидивов заболевания после вакцинации снижается в 3,2 раза [7].
В ходе исследований Л.А. Марченко (Научный центр акушерства, гинекологии и перинатологии РАМН), в которых участвовало 200 больных РГГ, уже через 6 месяцев после вакцинации у 31,5% пациенток наблюдалось значительное улучшение (увеличение межрецидивного периода в 3 раза – до 7 месяцев), у 58% – улучшение (увеличение продолжительности ремиссий в 1,5–2 раза) и только у 10,5% больных терапевтический эффект был слабо выражен или отсутствовал. Из 200 больных 77 были обследованы через 2 года после регулярной (дважды в год) вакцинации. При этом у 40 (52%) больных клинические симптомы РГГ полностью отсутствовали. Большинство больных прекратили лечение после улучшения в результате вакцинации [15].
В клинике современных технологий «Садко» (Н. Новгород) с 2003 г. в комплексном лечении больных с РГИ использовали вакцину Витагерпавак. Было пролечено 739 больных: 501 пациент с ГГ и 238 пациентов с лабиальной формой инфекции в возрасте от 22 до 46 лет, рецидивы от 5 до 14 в год. Вакцинацию проводили согласно инструкции по применению препарата. Два курса ревакцинации прошли 615 пациентов – через 6 и 12 месяцев. Эффективность вакцинотерапии оценивали по увеличению периода ремиссии после проведенного курса (однократного или с двумя ревакцинациями). У 615 (83%) пациентов после лечения в течение 2 лет не отмечалось рецидивов герпеса. У 73 (9,8%) больных сократилась частота рецидивов до 2–3 в год. После вакцинации рецидивы носили абортивный характер, были менее продолжительными и характеризовались снижением интенсивности субъективных и объективных признаков. Нежелательных побочных реакций сразу после введения вакцины не выявлено. После применения вакцины Витагерпавак был достигнут высокий терапевтический эффект.
Значительный иммунокорригирующий эффект наблюдается уже при первой вакцинации Витагерпаваком: степень иммунных расстройств снижается с 3-й и 2-й до 1-й. Через 6 месяцев после вакцинации иммунные расстройства соответствуют 1-й степени.
Результаты многолетних клинико-вирусологических исследований по разработке и внедрению в практику инактивированной формалином дивакцины против ВПГ 1 и 2 типов показали ее выраженную активность в профилактике рецидивов РГИ, обусловленную активацией реакций клеточного иммунитета и специфической десенсибилизацией.
Большое значение в оценке эффективности противогерпетической вакцины имеет определение содержания в периферической крови пациентов ИФН-гамма и ИЛ-4 как ключевых цитокинов Тh₁- и Тh₂-зависимых иммунных реакций. Подтверждением тому служит ряд работ в области экспериментальной и клинической иммунологии, в которых показано, что защита макроорганизма от внутриклеточных патогенов осуществляется при непосредственном участии клеточного иммунитета, зависящего от активности Тh₁-подтипа CD4+ и/или CD8+ Т-лимфоцитов [3, 5, 10]. В то же время в основе иммунодефицитного состояния при ВПГ-инфекции лежит подавление экспрессии HLA-I и HLA-II (human leucocyte antigens, человеческие лейкоцитарные антигены) клетками организма, что ограничивает активацию CD4+ и CD8+ Т-лимфоцитов [8, 12].
При хронической герпетической инфекции отмечается выраженная вариабельность содержания ИФН-гамма в ПК пациенток, показатели которого в зависимости от тяжести течения заболевания колеблются от очень высоких до низких [3, 5]. Это может свидетельствовать о недостаточности активационных механизмов иммунного ответа. Как известно, ИФН-гамма на ранних сроках после инфицирования ВПГ вырабатывается НК-клетками, на более поздних – активированными Т-лимфоцитами и может индуцировать дендритные клетки, моноциты и макрофаги к продукции провоспалительных цитокинов наряду с повышением экспрессии HLA-I и HLA-II.
Таким образом, роль ИФН-гамма сводится к координации процессинга антигена и его последующей презентации Т-лимфоцитам. Дополнительно провоспалительные цитокины, секретируемые дендритными клетками и макрофагами, по типу обратной связи индуцируют усиление продукции ИФН-гамма НК-клетками. Возможно, снижение уровня ИФН-гамма свидетельствует об уменьшении не только активности НК-клеток, но и функциональной активности Тh₁ и/или CD8+ Т-клеток у больных с ВПГ-инфекцией на раннем этапе развития иммунного ответа [3, 5]. Это способно приводить к ограничению продукции Тh₁ клетками других цитокинов, например ИЛ-2 (стимулирует пролиферацию CD4+ и CD8+ Т-лимфоцитов, НК-клеток) и ИЛ-12 (для продукции ИФН-гамма НК-клетками, Тh₁ и CD8+ Т-лимфоцитами, а также ограничения Тh₂-зависимых иммунных реакций) [3, 5, 6, 9, 10]. В частности, проведенные клинические испытания субъединичных вакцин на основе рекомбинантных гликопротеидов D (gD) и В (gB) оболочки ВПГ-2 (между ВПГ-1 и ВПГ-2 существует высокая степень гомологии по этим двум субъединицам, которые обладают высокой иммуногенностью в организме человека, вызывая активную выработку антител), не выявили их эффективности по сравнению с плацебо [1, 5, 6, 15]. В то же время, как подчеркивает M.A. Alexander-Miller [14] в аналитическом обзоре, посвященном успехам и перспективам использования противогерпетических вакцин, добавление к рекомбинантной субъединичной gD-содержащей вакцине адъюванта инициировало Тh₁-тип иммунного ответа и приводило к тому, что препарат в ходе клинических испытаний демонстрировал профилактический эффект. Именно поэтому в своих исследованиях мы считали важным оценить динамику уровня цитокинов ИФН-гамма и ИЛ-4 при проведении противорецидивной терапии и вакцинотерапии РГГ.
Ранее было показано, что специфическая иммунотерапия ГГ не усиливает выработку лейкоцитами ИФН 1 типа (в частности, ИФН-альфа) [1, 5]. Можно предположить, что повышение уровня ИФН в ПК обусловлено их преимущественным синтезом клетками тканей, а способность in vitro стимулированных клеток крови к их синтезу (резервные возможности) истощена.
Заключение
Анализируя по аллергометрической методике действие вакцины Витагерпавак на главные звенья клеточного иммунитета, ассоциированные с протекцией при ВПГ-инфекции, можно сделать следующие выводы.
Вакцинотерапия индуцирует выраженное повышение содержания CD4+ и CD8+ Т-лимфоцитов в ПК, что может быть обусловлено их антигенспецифической пролиферацией в периферических тканях.
Достоверное увеличение содержания CD16+ НК-клеток сопряжено с усилением их миграции для презентации антигенов вакцины и/или к местам реактивации вируса для неспецифического контроля за его репликацией.
Достоверное повышение уровня ИФН-гамма с одновременным снижением уровня ИЛ-4 в сыворотке крови пациенток после вакцинотерапии указывает на преобладание Тh₁-зависимых иммунных реакций (по соотношению молярных эквивалентов их концентраций в сыворотке ПК).
Клиническая эффективность проведения вакцинотерапии может быть обусловлена преобладанием клеточных реакций иммунитета, что связано с усилением Тh₁- и подавлением Тh₂-зависимых иммунных реакций. Не отмечалось поствакцинальных реакций общего или местного характера сразу после введения вакцины, а также за весь последующий шестимесячный период наблюдений.
Таким образом, противорецидивную вакцинотерапию ИГВ Витагерпавак можно проводить даже у больных ГГ с монотонным типом рецидивирования и тяжелым течением. Рекомендуется применять максимально низкие дозы вводимой противогерпетической вакцины (рабочая доза, снижение вирусной нагрузки) и увеличивать временные интервалы между введениями. Данный вариант противорецидивной вакцинотерапии не создает предпосылок для развития аутоиммунных нарушений. Для повышения эффективности вакцинотерапии необходима предварительная подготовка больных (фармакологическая премедикация вакцинального процесса) с назначением комплексной терапии – сочетанное использование противогерпетических химиопрепаратов с ИФН или индукторами ИФН, то есть препаратов с разнонаправленными механизмами действия. Это обеспечивает синергидный и аддитивный эффекты. Предложенная лечебно-профилактическая тактика для больных РГГ с монотонным типом рецидивирования способствует уменьшению частоты и сроков рецидивов заболевания, улучшению качества жизни и повышению уровня социальной адаптации.