Интегративная программа реабилитации иммунной системы в лечении пациентов с рекуррентными острыми респираторными и рецидивирующими герпесвирусными инфекциями, ассоциированными с круглогодичным аллергическим ринитом
- Аннотация
- Статья
- Ссылки
- English
Цель – выявить нарушения функционирования иммунной системы, определить основные клинические и иммунологические критерии иммунокомпрометированности пациентов с рекуррентными острыми респираторными вирусными инфекциями (рекОРВИ) и рецидивирующими хроническими герпесвирусными инфекциями (рецХГВИ), ассоциированными с круглогодичным аллергическим ринитом (КАР), и на этой основе разработать интегративную программу реабилитации ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы. В группу исследования (ГИ) были включены 102 пациента в возрасте от 23 до 63 лет обоего пола, страдающие рецХГВИ и рекОРВИ, ассоциированными с КАР. Группа сравнения включала 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ. Всем пациентам ГИ было проведено физикальное и клинико-иммунологическое исследование, включавшее применение серологических (иммуноферментный анализ) и молекулярно-генетических (полимеразная цепная реакция в режиме реального времени) методов исследования, а также метода проточной цитофлуориметрии. Проведение исследования было одобрено комиссией по вопросам этики. У всех пациентов получено добровольное информированное согласие.
Результаты. У пациентов ГИ выявлены клинические и иммунологические критерии иммунокомпрометированности, на основании которых выделены два основных патологических клинико-лабораторных иммунофенотипа (ИФ). Для первого ИФ (ГИ1) характерны нарушение индуцированной продукции интерферона α (ИФН-α) – 75% случаев, дефицит естественных киллерных клеток (ЕКК) и снижение количества нейтрофильных гранулоцитов (НГ), частота эпизодов ОРВИ – 7,50 [4,75; 10,50] раза в год, обострений рецХГВИ – 6,5 [5,0; 11,5] раза в год, выраженность симптомов КАР по визуальной аналоговой шкале (ВАШ) – 5,5 [4,0; 6,5] балла. Для второго ИФ (ГИ2А и ГИ2В) характерно снижение количества цитотоксических Т-лимфоцитов (ЦТЛ), дефицит ЕКК, дефицит индуцированной продукции ИФН-α – 100% случаев. Разработанная на основании выделенных ИФ интегративная программа реабилитации ИС пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, показала высокую клинико-иммунологическую эффективность, что выражалось в сокращении частоты эпизодов рекОРВИ в три раза, частоты рецидивов рецХГВИ более чем в два раза, улучшении контроля над симптомами КАР в два раза по шкале ВАШ, восстановлении количества ЕКК и ЦТЛ, тенденции к репарации системы ИФН. Установлено выраженное преимущество использования комбинированной таргетной иммунотерапии гексапептидом (препаратом Имунофан®) и глюкозаминилмурамилдипептидом (препаратом Ликопид®) на фоне базисной интерферонотерапии.
Выводы. Проведение персонифицированных программ реабилитации ИС у пациентов с рецХГВИ и рекОРВИ, ассоциированными с КАР, приводит не только к достоверному снижению частоты рецидивов вирусных инфекций, но и к улучшению контроля над симптомами КАР, что свидетельствует о снижении активности МПВ и способствует уменьшению объема базисной противоаллергической терапии, а также улучшению качества жизни пациентов.
Цель – выявить нарушения функционирования иммунной системы, определить основные клинические и иммунологические критерии иммунокомпрометированности пациентов с рекуррентными острыми респираторными вирусными инфекциями (рекОРВИ) и рецидивирующими хроническими герпесвирусными инфекциями (рецХГВИ), ассоциированными с круглогодичным аллергическим ринитом (КАР), и на этой основе разработать интегративную программу реабилитации ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы. В группу исследования (ГИ) были включены 102 пациента в возрасте от 23 до 63 лет обоего пола, страдающие рецХГВИ и рекОРВИ, ассоциированными с КАР. Группа сравнения включала 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ. Всем пациентам ГИ было проведено физикальное и клинико-иммунологическое исследование, включавшее применение серологических (иммуноферментный анализ) и молекулярно-генетических (полимеразная цепная реакция в режиме реального времени) методов исследования, а также метода проточной цитофлуориметрии. Проведение исследования было одобрено комиссией по вопросам этики. У всех пациентов получено добровольное информированное согласие.
Результаты. У пациентов ГИ выявлены клинические и иммунологические критерии иммунокомпрометированности, на основании которых выделены два основных патологических клинико-лабораторных иммунофенотипа (ИФ). Для первого ИФ (ГИ1) характерны нарушение индуцированной продукции интерферона α (ИФН-α) – 75% случаев, дефицит естественных киллерных клеток (ЕКК) и снижение количества нейтрофильных гранулоцитов (НГ), частота эпизодов ОРВИ – 7,50 [4,75; 10,50] раза в год, обострений рецХГВИ – 6,5 [5,0; 11,5] раза в год, выраженность симптомов КАР по визуальной аналоговой шкале (ВАШ) – 5,5 [4,0; 6,5] балла. Для второго ИФ (ГИ2А и ГИ2В) характерно снижение количества цитотоксических Т-лимфоцитов (ЦТЛ), дефицит ЕКК, дефицит индуцированной продукции ИФН-α – 100% случаев. Разработанная на основании выделенных ИФ интегративная программа реабилитации ИС пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, показала высокую клинико-иммунологическую эффективность, что выражалось в сокращении частоты эпизодов рекОРВИ в три раза, частоты рецидивов рецХГВИ более чем в два раза, улучшении контроля над симптомами КАР в два раза по шкале ВАШ, восстановлении количества ЕКК и ЦТЛ, тенденции к репарации системы ИФН. Установлено выраженное преимущество использования комбинированной таргетной иммунотерапии гексапептидом (препаратом Имунофан®) и глюкозаминилмурамилдипептидом (препаратом Ликопид®) на фоне базисной интерферонотерапии.
Выводы. Проведение персонифицированных программ реабилитации ИС у пациентов с рецХГВИ и рекОРВИ, ассоциированными с КАР, приводит не только к достоверному снижению частоты рецидивов вирусных инфекций, но и к улучшению контроля над симптомами КАР, что свидетельствует о снижении активности МПВ и способствует уменьшению объема базисной противоаллергической терапии, а также улучшению качества жизни пациентов.







Введение
На протяжении последних десятилетий одной из наиболее острых и актуальных проблем современной медицины является проблема минимального персистирующего воспаления (МПВ), лежащая в основе формирования инфекционной, аутоиммунной, онко- и аллергопатологии [1–3], приводящая к нарушению процессов адаптации, формированию длительно существующих «стрессорных локусов» на слизистой оболочке с последующим развитием различных нарушений функционирования клеточного и гуморального звеньев иммунной системы (ИС) (дефициту секреторного иммуноглобулина А (sIgA), естественных киллерных клеток (ЕКК) и цитотоксических Т-лимфоцитов (ЦТЛ), нарушению функционирования системы нейтрофильных гранулоцитов (НГ), снижению индуцированной продукции интерферонов (ИФН) 1 и 2 типов в различных комбинациях [4–6]. Это способствует формированию коинфицированности, основными агентами которой являются возбудители вирусных инфекций, имеющих рецидивирующий характер течения: рекуррентные острые респираторные вирусные инфекции (рекОРВИ) и рецидивирующие хронические герпесвирусные инфекции (рецХГВИ) [7, 8]. Мультифакторность возникновения и поддержания МПВ включает в себя влияние разнообразных факторов окружающей среды (ирританты, поллютанты и т.д.), аэроаллергенов, вирусных и бактериальных патогенов, являющихся коинфицирующими агентами и обладающих сенсибилизирующим действием, что поддерживает персистенцию воспалительного процесса на слизистых оболочках в области «входных ворот» носо- и ротоглотки как аллергического, так и инфекционного генеза [1, 2, 9, 10]. Установлено, что наиболее распространенным заболеванием в структуре аллергопатологии респираторного тракта является аллергический ринит (АР): круглогодичный (КАР) и сезонный (САР) [11, 12]. У пациентов с АР на фоне дисбаланса T1/T2-иммунного ответа возникают различные нарушения функционирования клеточного и гуморального звеньев противовирусной иммунной защиты и системы ИФН. Рецидивирующее течение бактериально-вирусных инфекций респираторного тракта и дисбаланс в работе мукозального и системного иммунитета значительно затрудняют терапию КАР, зачастую обусловливая торпидность к этиотропной и противоаллергической терапии, что приводит к утяжелению течения КАР, необходимости увеличения объема терапии и, как следствие, к снижению качества жизни пациентов [4, 11–14].
Поиск персонифицированных подходов, направленных на выявление и таргетную коррекцию различных нарушений в работе локального и системного иммунитета с включением иммуномодулирующих препаратов, позволяющих повысить эффективность классической этиотропной и противоаллергической терапии, снизить частоту обострений рецХГВИ и эпизодов рекОРВИ, улучшить контроль над симптомами КАР, является приоритетной задачей научного сообщества [7, 11, 15–17]. Интеграция новых комплексных иммунотерапевтических подходов, разработанных на основании алгоритмов диагностики состояния иммунокомпрометированности, станет основой для создания персонифицированных программ реабилитации ИС у этих пациентов [7, 11, 18–20].
Цель исследования
Цель – выявить нарушения функционирования иммунной системы, определить основные клинические и иммунологические критерии иммунокомпрометированности пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, и на этой основе разработать интегративную программу реабилитации ИС и оценить ее клинико-иммунологическую эффективность.
Материал и методы
В группу исследования (ГИ) включены 102 взрослых пациента в возрасте от 23 до 63 лет обоего пола, страдающие рецХГВИ и рекОРВИ, ассоциированными с разными формами АР (КАР – 100% пациентов, КАР и САР – 25%) среднетяжелой/тяжелой степени с длительностью течения более трех лет. Группа сравнения (ГС) включала 50 условно здоровых лиц, сопоставимых по полу и возрасту с пациентами ГИ.
Исследование было проведено согласно разработанному оригинальному дизайну, предполагающему четыре этапа.
Этап 1. Определение критериев включения пациентов в ГИ и исключения из нее.
Критерии включения:
- пациенты с частыми эпизодами рекОРВИ и обострениями рецХГВИ, ассоциированными с АР (КАР и КАР в сочетании с САР);
- отсутствие контроля над симптомами АР на фоне терапии второй и третьей ступени (выраженность симптомов по визуальной аналоговой шкале (ВАШ) более пяти баллов);
- отсутствие в анамнезе хронических заболеваний лор-органов.
Критерии исключения:
- наличие в анамнезе аллергенспецифической иммунотерапии (АСИТ), терапии глюкокортикостероидами (ГКС) системного действия, генно-инженерной биотерапии на основе моноклональных антител в течение года до включения в исследование;
- беременность любого срока гестации;
- детский возраст;
- наличие других аллергических, аутоиммунных, онкологических заболеваний, заболеваний крови, хронических вирусных инфекций (ВИЧ/СПИД, парентеральные вирусные гепатиты).
Этап 2. Сбор анамнеза в соответствии с разработанными картами-опросниками, проведение клинического и физикального обследования пациентов ГИ, а также лабораторных исследований. Обследование и динамическое наблюдение врачом-отоларингологом (согласно клиническим рекомендациям от 13.06.2024, протокол № 32) [9], по показаниям санация очагов бактериальной инфекции лор-органов.
Этап 3. Определение клинических и иммунологических критериев иммунокомпрометированности пациентов ГИ на основе ранее разработанного И.В. Нестеровой и Е.О. Халтуриной критериального подхода к определению этих критериев [18].
Этап 4. На основании выявленных клинических и иммунологических критериев иммунокомпрометированности разработка интегративной программы реабилитации ИС с последующей оценкой ее клинико-иммунологической эффективности.
Для верификации диагноза герпесвирусной инфекции использовали серологический (иммуноферментный анализ (ИФА) крови, Labsystems Multiskan Ascent (Финляндия), тест-система ЗАО «Вектор-Бест» (Россия)) и молекулярно-генетический (полимеразная цепная реакция в режиме реального времени, тест-система «АмплиСенс» (Россия)) методы исследования с детекцией герпесвирусов в различных биологических средах (соскоб с миндалин, слюна и др.). Для оценки основных параметров клеточного звена иммунитета (Т-лимфоциты – CD3+, CD3+CD4+, CD3+CD8+, ЕКК – CD3-CD16+CD56+, В-клетки – CD19+ и др.), а также спонтанной и индуцированной продукции ИФН-α применяли метод ИФА (Labsystems Multiskan Ascent (Финляндия), тест-система ЗАО «Вектор-Бест» (Россия)). С целью уточнения спектра сенсибилизации определен уровень специфических IgE к ингаляционным неинфекционным аллергенам (ImmunоCAP (Thermo Fisher Scientific, США), ИФА (Labsystems Multiskan Ascent, Финляндия), тест-система ЗАО «Вектор-Бест» (Россия)).
Проведение исследования одобрено комиссией по вопросам этики.
Исследование было выполнено на базе клинико-диагностического центра «МЕДСИ на Белорусской» (Москва).
У всех пациентов получено добровольное информированное согласие на участие в исследовании и на обработку персональных данных, согласно Хельсинкской декларации Всемирной медицинской ассоциации (2013 г). Статистическая обработка полученных результатов проведена с использованием стандартных компьютерных программ StatPlus (версия 17.0 для Windows).
Для анализа данных применяли методы непараметрической статистики.
Результаты представлены в виде медианы (Ме) и интерквартильного размаха (Q1; Q3).
Различия считали статистически значимыми при р ≤ 0,05.
Результаты
Исходно все пациенты ГИ отмечали частые эпизоды рекОРВИ и/или частые обострения рецХГВИ, возникающие на фоне проводимой стандартной или пролонгированной противогерпетической супрессивной терапии синтетическими атипичными нуклеозидами, которая не приводила к достижению стойкой, длительной ремиссии в течение года до включения в исследование.
В период проведения исследования пациентам ГИ при рецидивах ХГВИ проводились десятидневные курсы противогерпетической терапии синтетическими нуклеозидами, а при возникновении эпизода ОРВИ назначалась локальная антисептическая терапия.
Согласно действующим клиническим рекомендациям, до включения в исследование и в течение всего периода наблюдения пациенты ГИ получали терапию КАР второй и третьей ступени по системе step up – step down [9]. На фоне проводимой терапии стойкого контроля над симптомами КАР достигнуто не было.
При изучении клинических особенностей у пациентов с рекОРВИ и/или частыми обострениями рецХГВИ, ассоциированными с КАР, были выделены три основных клинических критериальных признака иммунокомпрометированности:
- частота эпизодов рекОРВИ в год;
- частота обострений рецХГВИ в год;
- тяжесть течениям КАР.
У пациентов ГИ частота эпизодов рекОРВИ составила до шести-семи раз в год, частота обострений рецХГВИ – до 10–11 раз в год, тяжесть течения КАР – в среднем 4,75 балла по десятибалльной ВАШ.
При исследовании основных механизмов противовирусной иммунной защиты у пациентов ГИ выявлены разнообразные нарушения функционирования как клеточных, так и гуморальных эффекторов противовирусного иммунитета в различных комбинациях, а также дефекты в системе ИФН, детектированные у 100% пациентов. У пациентов ГИ в качестве иммунологических критериальных признаков иммунокомпрометированности были исследованы лабораторные маркеры, количественно и функционально отражающие нарушения основных параметров функционирования системы противовирусной иммунной защиты организма и системы ИФН, а именно выявлено снижение количества ЦТЛ, ЕКК, лейкоцитов, лимфоцитов, НГ, снижение индуцированной продукции ИФН-α.
На основании выявленных клинических и иммунологических критериев иммунокомпрометированности у пациентов ГИ нами выделены два основных патологических клинико-лабораторных иммунофенотипа (ИФ) – ИФ1 и ИФ2.
Клинико-лабораторный ИФ1 имел место у 32 пациентов, составивших группу исследования 1 (ГИ1). Для ИФ1 характерно нарушение индуцированной продукции ИФН-α, обнаруженное в 75% случаев, наряду с дефицитом ЕКК и снижением количества НГ в периферической крови. При оценке клинических критериев иммунокомпрометированности установлено, что частота эпизодов ОРВИ составляла 7,50 [4,75; 10,50] раза в год, а частота обострений рецХГВИ – 6,5 [5,0; 11,5] раза в год. При этом выраженность симптомов КАР по ВАШ составляла 5,5 [4,0; 6,5] балла (табл. 1). У 36,5% пациентов ГИ1 отмечались повторные ОРВИ, ассоциированные с активацией вируса Эпштейна – Барр (ВЭБ) и вируса человеческого герпеса 6 типа (ВЧГ6), у 35,5% – частые обострения рецХГВИ, вызываемые вирусом простого герпеса (ВПГ) 1 и/или 2 типа, у 28,0% пациентов – сочетание частых эпизодов рецХГВИ и рекОРВИ.
Для ИФ2, детектируемого у 70 пациентов, составивших ГИ2, были характерны разнообразные и разнохарактерные нарушения в системе противовирусной иммунной защиты: тенденция к снижению количества CD3+CD8+ ЦТЛ, дефицит ЕКК, дефекты системы ИФН, установленные в 100% случаев. Обращал на себя внимание факт отсутствия нейтропении.
Учитывая сходное воздействие некоторых иммунотропных препаратов на ЕКК, ЦТЛ, систему ИФН, мы рандомизировали ГИ2 на ГИ2А и ГИ2В для уточнения таргетного влияния таких иммунотропных препаратов, как синтетический аналог гормона тимуса тимопоэтина гексапептид (ГП) (аргинил-α-аспартил-лизил-валил-тирозил-аргинин) (Имунофан®) и глюкозаминилмурамилдипептид (ГМДП) (Ликопид®), на дефицит ЕКК, индуцированную продукцию ИФН-α и ЦТЛ, что должно позволить детально изучить и описать особенности влияния этих иммуномодулирующих препаратов на клинико-лабораторные иммунофенотипы ГИ.
Анализ клинического профиля пациентов ГИ2А показал, что частота рекОРВИ у них достигала 7,5 [4,8; 10,5] раза в год, обострений рецХГВИ – 6,5 [5,3; 11,5] раза в год, в то время как выраженность симптомов КАР по ВАШ – 5,5 [4,0; 6,5] балла (см. табл. 1). Повторные эпизоды ОРВИ фиксировались у 46,6% пациентов ГИ2А. При этом в 28,4% случаев отмечалось частое рецидивирование ХГВИ, а в 24,9% случаев имело место сочетание рецХГВИ и рекОРВИ. При изучении особенностей функционирования системы противовирусной иммунной защиты и системы ИФН у пациентов ГИ2А выявлены снижение или нижняя граница нормы содержания CD3+CD8+ ЦТЛ, дефицит ЕКК, нарушения индуцированной продукции ИФН-α в 100% случаев, при этом нейтропении зафиксировано не было (табл. 2).
В ГИ2В частота эпизодов рецХГВИ составляла 6,50 [3,75; 10,50] раза в год, частота рекОРВИ – 6,5 [5,5; 10,5] раза в год, выраженность симптомов КАР по ВАШ – 3,50 [2,62; 4,50] балла. Рекуррентные ОРВИ отмечены у 42,64% пациентов этой группы, рецХГВИ – у 29,11%, а сочетание рекОРВИ и рецХГВИ – у 28,25% пациентов. При изучении иммунологических критериев иммунокомпрометированности у пациентов ГИ2В установлен дефицит ЕКК, дефицит CD3+CD8+ ЦТЛ, снижение индуцированной продукции ИФН-α в 100% случаев (см. табл. 2).
При изучении профиля сенсибилизации к неинфекционным аэроаллергенам достоверных межгрупповых различий установлено не было. Ведущую позицию в профиле детектируемых аллергенов занимала бытовая сенсибилизация, которая была выявлена у 36% пациентов ГИ. На грибковую сенсибилизацию приходилось 24% случаев, на эпидермальную сенсибилизацию – 23%, на сенсибилизацию к различным пыльцевым аллергенам – 15% случаев. Данные профиля сенсибилизации по группам исследования представлены на рис. 1.
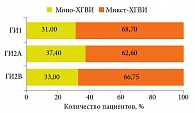
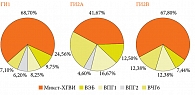
Анализ инфицированности пациентов различными типами герпесвирусов не выявил достоверных статистических различий между ГИ1, ГИ2А и ГИ2В. Во всех анализируемых группах преобладали микст-герпесвирусные инфекции (от 62 до 68% случаев) с доминированием ВЭБ-инфекции (рис. 2 и 3).
Принимая во внимание выявленные в ходе исследования клинико-иммунологические особенности пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, нами разработаны персонифицированные для каждого из выделенных ИФ программы реабилитации иммунной системы, включающие таргетную интерфероно- и иммуномодулирующую терапию, направленную на коррекцию и восстановление дефектов в основных звеньях противовирусной иммунной защиты и системе ИФН (табл. 3).
Установлено, что у всех пациентов ГИ имело место глубокое нарушение индуцированной продукции ИФН-α, в связи с чем в ГИ1, ГИ2А и ГИ2В проводилась интерферонокорригирующая системная и локальная интерферонотерапия рекомбинантным ИФН-α2b (рИФН-α2b) в комплексе с антиоксидантами. Для системной интерферонотерапии применяли рИФН-α2b в комплексе с антиоксидантами в форме суппозиториев в начальной суточной дозе 3 млн МЕ ежедневно на протяжении одного месяца с последующим постепенным ее снижением до полной отмены препарата по интермиттирующей схеме. Длительность курса интерферонотерапии составила три месяца. Локальная интерферонотерапия включала использование рИФН-α2b в форме геля для аппликации на слизистую оболочку носа, заднюю стенку глотки и дужки миндалин.
В интегративную программу реабилитации ИС у пациентов ГИ1 дополнительно к системной и локальной интерферонотерапии был добавлен ГМДП (препарат Ликопид®), действие которого направлено на коррекцию выявленного дефицита НГ и ЕКК. Глюкозаминилмурамилдипептид назначали сроком на десять дней каждого месяца в суточной дозе 3 мг в три приема по 1 мг сублингвально. Пациенты ГИ1 получили три курса ГМДП на протяжении трех месяцев.
Пациентам ГИ2А проведена комплексная реабилитация ИС, включавшая наряду с системной и локальной интерферонотерапией прием ГП (препарата Имунофан®) с целью коррекции нарушений функциональной активности ЦТЛ и ЕКК. Гексапептид в форме назального спрея применялся в суточной дозе 180 мкг, курс – по десять дней каждого месяца. Длительность курса терапии составила три месяца.
Пациенты ГИ2В получали таргетную иммуномодулирующую терапию, включавшую наряду с пролонгированной системной и локальной интерферонотерапией чередующиеся курсы интраназальной терапии ГП (десятидневный курс один раз в месяц) и сублингвальной иммунотерапии ГМДП (десятидневный курс один раз в месяц). Таким образом, пациенты ГИ2В получили три курса терапии в течение трех месяцев с пятидневными перерывами между каждым месячным курсом (см. табл. 3).
Оценка клинической и иммунологической эффективности программ комплексной реабилитации ИС у пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, проводилась с использованием установленных в ходе исследования критериальных признаков иммунокомпрометированности.
Так, при оценке клинической эффективности программ тагретной интерфероно- и иммуномодулирующей терапии, разработанных в соответствии с выявленными клинико-иммунологическими фенотипами, показано достоверное снижение частоты рецидивирования ХГВИ, урежение эпизодов рекОРВИ, улучшение контроля над симптомами КАР во всех трех группах исследования (ГИ1, ГИ2А и ГИ2В) (табл. 4 и рис. 4).
Оценка лабораторных маркеров клинико-иммунологической эффективности программ реабилитации ИС, проводимая на основании описанных ранее иммунологических критериев иммунокомпрометированности, выявила достоверные различия анализируемых показателей до и после терапии, характерные для всех групп исследования (ГИ1, ГИ2А и ГИ2В). Полученные данные представлены в табл. 5.
У пациентов ГИ1, ГИ2А и ГИ2В обнаружено увеличение количества ЕКК – CD3-CD16+CD56+ наряду с позитивным влиянием на индуцированную продукцию ИФН-α. В то же время у пациентов ГИ1 с ИФ1 отмечено восстановление количества НГ, лимфоцитов, увеличение количества лейкоцитов в периферической крови. Для пациентов ГИ2А (ИФ2) было характерно восстановление количества и функциональной активности ЦТЛ, а для пациентов ГИ2В (ИФ2) – наиболее выраженный позитивный эффект в виде восстановления индуцированной продукции ИФН-α, увеличения количества лейкоцитов, НГ, ЕКК – CD3-CD16+CD56+, ЦТЛ – CD3+CD8+.
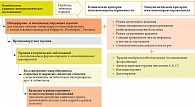
Принимая во внимание результаты собственных исследований и опираясь на опыт других исследователей [19], мы разработали интегративную программу реабилитации ИС у иммунокомпрометированных пациентов с частыми эпизодами рекОРВИ и обострениями рецХГВИ, ассоциированными с КАР, включающую лечебные мероприятия, направленные на достижение контроля над аллергическим воспалением (ступенчатый подход к терапии КАР, предполагающий использование локальной и системной фармакотерапии антигистаминными препаратами, локальное применение интраназальных ГКС, комбинации интраназальных ГКС с одним или более из следующих: интраназальные антигистаминные препараты, антигистаминные препараты системного действия без седативного эффекта, антагонисты лейкотриеновых рецепторов), исключение и элиминацию причинно-значимых аллергенов, противовирусную терапию (использование синтетических аналогов нуклеозидов), коррекцию микробиоценоза открытых (верхние дыхательные пути) и закрытых (желудочно-кишечный и урогенитальный тракты) слизистых оболочек, базисную терапию сопутствующих заболеваний, восстановление дефектного функционирования различных звеньев системы противовирусной иммунной защиты и системы ИФН (рис. 5).
Обсуждение
В результате проведенного исследования были получены данные, свидетельствующие о наличии клинических критериальных признаков иммунокомпрометированности и различных дефектов функционирования врожденного и адаптивного звеньев иммунной системы у пациентов, страдающих рекОРВИ и рецХГВИ, ассоциированными с КАР. Полученные данные позволили выделить два основных патологических иммунофенотипа, характерных для изучаемой когорты пациентов. Для ИФ1 характерно снижение количества НГ в периферической крови, ЕКК – CD3-CD16+CD56+, дефицит индуцированной продукции ИФН-α. Для ИФ2 свойственно снижение количества ЦТЛ – CD3+CD8+ наряду с дефицитом индуцированной продукции ИФН-α, со снижением количества лимфоцитов врожденного иммунитета (ЕКК – CD3-CD16+CD56+), а также со снижением НГ в периферической крови.
Созданные на основании выделенных иммунофенотипов, учитывающих особенности дефектного функционирования системы противовирусной иммунной защиты и системы ИФН, таргетные программы реабилитации ИС включали проведение пролонгированной локальной и системной интерферонотерапии рИФН-α2b в комплексе с антиоксидантами (гель и суппозитории в адекватных дозах), а также применение иммунотропных препаратов (ГП и ГМДП), действие которых направлено на коррекцию выявленных нарушений в системе врожденного и адаптивного звеньев иммунитета. Для пациентов ГИ1 с ИФ1 программа коррекции выявленных нарушений в ИС включала применение ГМДП наряду с системной и локальной интерферонотерапией. Рандомизация пациентов ГИ2, имеющих ИФ2, на ГИ2А и ГИ2В позволила провести сравнительную оценку плейотропных эффектов иммуномодулирующих субстанций на дефектно функционирующие звенья врожденного и адаптивного иммунитета. Пациенты ГИ2А наряду с таргетной интерферонотерапией получали курсы интраназальной терапии ГП, а пациенты ГИ2В – чередующиеся курсы ГП и ГМДП.
Разработанная нами на основании выделенных иммунофенотипов иммунопатогенетически обоснованная программа реабилитации иммунной системы у пациентов с рекОРВИ и рецХГВИ, ассоциированными с КАР, показала высокую клинико-иммунологическую эффективность, что клинически выражалось в уменьшении частоты эпизодов рекОРВИ в три раза и частоты рецидивов рецХГВИ более чем в два раза, в улучшении контроля над симптомами КАР, оцениваемыми по ВАШ, в два раза. Показан позитивный иммунологический эффект интегративной программы реабилитации ИС, который выражался в восстановлении количества лимфоцитов врожденного (ЕКК – CD3-CD16+CD56+) и адаптивного (ЦТЛ – CD3+CD8+) иммунитета. Необходимо отметить, что у пациентов ГИ2В, получавших иммуномодулирующую терапию, включающую чередование ГП и ГМДП, выявлены статистически значимо более выраженный позитивный эффект в отношении количества НГ, лейкоцитов в периферической крови, а также значительная позитивная динамика в отношении восстановления индуцированной продукции ИФН-α наряду с выраженной позитивной клинической динамикой (при p ≤ 0,05).
Выводы
- У пациентов, страдающих рецХГВИ и рекОРВИ, ассоциированными с КАР, имеют место клинические и иммунологические критерии иммунокомпрометированности.
- У пациентов с частыми рецХГВИ и рекОРВИ с сопутствующим КАР возможны различные патологические иммунофенотипы, требующие персонифицированного подхода к интерфероно- и иммуномодулирующей терапии для коррекции дефектов противовирусной иммунной защиты и системы ИФН.
- При оценке клинической эффективности разработанной нами интегративной программы реабилитации ИС у пациентов с рецХГВИ и рекОРВИ, ассоциированными с КАР, отмечено не только достоверное снижение частоты рецидивов ХГВИ и эпизодов ОРВИ, но и улучшение контроля над симптомами КАР, что способствовало снижению объема базисной противоаллергической терапии (step down) и возможности проведения АСИТ.
- Установлено выраженное преимущество использования комбинированной таргетной иммунотерапии ГП (Имунофан®) и ГМДП (Ликопид®) на фоне базисной интерферонотерапии, которое выражалось в лучшей иммунологической эффективности, сопряженной с позитивной клинической динамикой.
- С учетом полученной позитивной клинико-иммунологической эффективности всех трех разработанных нами подходов к проведению таргетной интерфероно- и иммуномодулирующей терапии, базирующихся на проведении иммуно- и аллергодиагностического лабораторного исследования, необходимо применять принцип персонифицированного иммунофенотипирования при разработке интегративных программ реабилитации ИС для иммунокомпрометированных пациентов, страдающих рекОРВИ и рецХГВИ, ассоциированными с КАР.
I.V. Nesterova, MD, PhD, Prof., E.O. Khalturina, MD, PhD, N.V. Garskova
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical-Biological Agency
Sechenov First Moscow State Medical University
Peoples' Friendship University named after Patrice Lumumba
MEDSI Clinical Diagnostic Center at Belorusskaya, Moscow
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Minimal persistent inflammation (MPI), which is the result of a violation of the processes of adaptation of mucosal immunity to the action of various environmental factors, aeroallergens, viral and bacterial pathogens, with the subsequent formation of various disorders of the functioning of the cellular and humoral links of the immune system, underlies the formation of infectious, autoimmune, onco- and allergopathology and is in the focus of attention of modern medicine.
Aim – to identify disorders of the immune system, to determine the main clinical and immunological criteria for immunocompromising patients with recurrent acute respiratory viral infections (recARVI) and recurrent chronic herpesvirus infections (recCHVI) associated with year-round allergic rhinitis (YAR), on this basis to develop an intagrative program for the rehabilitation of the immune system (IS) and assess its clinical and immunological effectiveness.
Material and methods. The study group (SG) included 102 patients aged 23 to 63 years, of both sexes, suffering from recARVI and recCHVI associated with YAR. The comparison group consisted of 50 conditionally healthy individuals, comparable in sex and age with SG patients. All patients SG underwent a physical and clinical immunological examination, which included the use of serological (enzyme immunoassay) and molecular genetic (polymerase chain reaction in real time) research methods, as well as the method of flow cytofluorometry. The study was approved by the Ethics Commission. All patients have received voluntary informed consent.
Results. Immunocompromised clinical and immunological criteria were identified in SG patients, on the basis of which two main pathological clinical and laboratory immunophenotypes (IF) were identified. The first IF (SG1) is characterized by: violation of the induced production of IFN-α –75% of cases, EKK deficiency and a decrease in the number of NG, the frequency of recARVI episodes is 7.50 [4.75; 10.50] times a year, and the frequency of of recCHVI is up to 6.5 [5.0; 11.5] times a year, symptoms of YAR on the VAS 5.5 [4.0; 6.5] points. The second IF (SG 2A and SG 2B) is characterized by a decrease in CTL, EKK, deficiency of induced IFN-α – 100% of cases. The integration program of IS rehabilitation for patients with recARVI and recCHVI developed on the basis of the allocated IF, associated with YAR, showed high clinical and immunological efficacy, which was expressed in a decrease in the frequency of episodes of ARVI by 3 times, relapse rate of recCHVI by more than 2 times, improvement in control of YAR symptoms by 2 times on the VAS, recovery of the number of EKK and CTL, trends towards repair of the IFN system. A pronounced advantage of the use of combined targeted immunotherapy with hexapeptide (Imunofan®) and glucosaminylmuramyl dipeptide (Lycopid®) against the background of basic IFN-therapy has been established.
Conclusions. Conducting personalized programs for the rehabilitation of IS in patients with recARVI and recCHVI associated with YAR leads not only to a significant decrease in the frequency of recurrence of viral infections, but also to an improvement in the control of YAR symptoms, which indicates a decrease in MPI activity and contributes to a decrease in the volume of basic antiallergic therapy, and an improvement in the quality of life of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.