количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Эпидемиология, факторы риска и профилактика рака пищевода
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №6
- Аннотация
- Статья
- Ссылки
Связано это с чрезвычайно злокачественным характером роста опухоли, ранним метастазированием, поздней выявляемостью рака пищевода, что приводит к смерти 95% больных раком пищевода в первые годы после установления диагноза.
На современном этапе существуют достаточно эффективные методы диагностики и лечения предраковых заболеваний пищевода, своевременное применение которых предотвращает развитие рака пищевода.
Рак пищевода, несмотря на сравнительно невысокие показатели заболеваемости, занимает седьмое место в структуре смертности от злокачественных опухолей.
Связано это с чрезвычайно злокачественным характером роста опухоли, ранним метастазированием, поздней выявляемостью рака пищевода, что приводит к смерти 95% больных раком пищевода в первые годы после установления диагноза.
На современном этапе существуют достаточно эффективные методы диагностики и лечения предраковых заболеваний пищевода, своевременное применение которых предотвращает развитие рака пищевода.
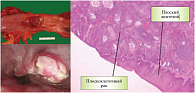
Рис. 1. Плоскоклеточный рак пищевода

Таблица 1. Заболеваемость и смертность от злокачественных новообразований в мире (Международное агентство по изучению рака, 2008 г.)

Таблица 2. Абсолютное число заболевших и умерших от рака пищевода за 2008 г. в мире (Международное агентство по изучению рака)

Таблица 3. Заболеваемость раком пищевода в странах «азиатского ракового пояса»
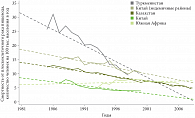
Рис. 2. Динамика смертности от плоскоклеточного рака пищевода в период 1981–2006 гг. (Международное агентство по изучению рака)
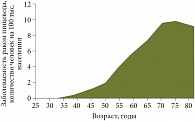
Рис. 3. Заболеваемость раком пищевода в зависимости от возраста
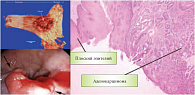
Рис. 4. Аденокарцинома пищевода
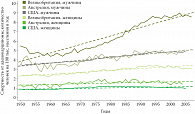
Рис. 5. Рост смертности от аденокарциномы пищевода среди населения развитых стран в период 1950–2005 гг.
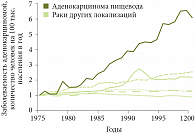
Рис. 6. Темпы роста заболеваемости аденокарциномой пищевода относительно других новообразований в США в период 1975–2000 гг.
Рак органов пищеварения является наиболее частой причиной смерти среди злокачественных новообразований (табл. 1). По данным Международного агентства по изучению рака (International Agency for Research on Cancer, IARC) за 2008 г., заболеваемость раком органов пищеварения составила 49,2 человека на 100 тыс. населения в год, смертность – 34,3 человека на 100 тыс. Несмотря на сравнительно невысокие показатели заболеваемости, рак пищевода является седьмой по распространенности причиной смерти от злокачественных опухолей, уступая место раку легкого, молочной железы, желудка, печени, простаты и толстой кишки. Связано это с чрезвычайно злокачественным характером течения, ранним метастазированием и поздней диагностикой рака пищевода. Индекс агрессивности, вычисляемый как соотношение умерших к вновь заболевшим, при раке пищевода крайне высок и составляет около 95%.
Абсолютное число умерших от рака пищевода за 2008 г. в мире составило 406 тыс. человек. В развивающихся странах заболеваемость и смертность от рака пищевода значительно выше, чем в развитых странах (табл. 2). Наиболее распространены два гистологических типа рака пищевода: плоскоклеточный рак и аденокарцинома пищевода. Несмотря на схожесть клинической картины, диагностической и лечебной тактики, крайне неблагоприятный прогноз при обеих формах рака пищевода, эти злокачественные новообразования имеют различные факторы риска, социогеографические и этнические особенности, знание которых необходимо для своевременного установления диагноза и профилактических мероприятий. Плоскоклеточный рак пищевода (рис. 1) представляет собой чрезвычайно агрессивную эпителиальную злокачественную опухоль из многослойного плоского эпителия, в большинстве случаев локализующуюся между средней и нижней третью пищевода, в шейном отделе пищевода опухоль встречается редко.
Плоскоклеточный рак пищевода. Эпидемиология и факторы риска
Социально-географическая вариабельность распространенности плоскоклеточного рака пищевода заключается в более чем 100-кратной разнице заболеваемости на 100 тыс. населения в год между регионами с наибольшей заболеваемостью (Юго-Восточная Азия) и наименьшей заболеваемостью (Западная Африка). Это позволяет предположить, что в этиологии плоскоклеточного рака пищевода определенную роль играют факторы, связанные с социально-географическими условиями жизни людей, характерными именно для данных регионов.
В целом около 80% всех случаев плоскоклеточного рака пищевода диагностируется в развивающихся странах Азии и Африки, где заболеваемость составляет 22–24 человека на 100 тыс. населения. Для сравнения: заболеваемость плоскоклеточным раком пищевода в США в 2008 г. равнялась 1,8 человек на 100 тыс. населения, в Европе – от 1,6 до 2,5 человек на 100 тыс. населения. Широкое распространение плоскоклеточного рака в странах Азии и Африки связывают с низким уровнем социально-экономического статуса, недостаточным употреблением овощей и фруктов, дефицитом витаминов и микроэлементов в продуктах питания [1]. Для плоскоклеточного рака характерны значительные гендерные и расовые различия в показателях заболеваемости: мужчины болеют в 3–7 раз чаще женщин, причем афроамериканцы страдают плоскоклеточным раком пищевода примерно в 4 раза чаще мужчин белой расы: 13,6 человек на 100 тыс. населения и 2,7 человек на 100 тыс. населения соответственно [2].
Еще одной особенностью эпидемиологии плоскоклеточного рака пищевода является наличие эндемичных регионов, где показатели заболеваемости раком пищевода высокие из года в год. Самая высокая заболеваемость (> 150 заболевших в год на 100 тыс. населения) отмечена в Иране и других странах так называемого Каспийского пояса, а именно: в ряде районов Туркменистана и Казахстана, прилегающих к Каспийскому морю, а также в Каракалпакии. Заболеваемость раком пищевода в Муйнакском районе Каракалпакии составляет 126 человек на 100 тыс. населения среди мужчин и 150 человек – среди женщин [3]. Страны Каспийского бассейна (Казахстан, Узбекистан, Иран, Ирак, Туркменистан, Афганистан) и ряд других регионов Азии, в которых заболеваемость раком пищевода особенно высока (центральные районы и север Китая, Монголия), объединяют под названием «азиатский раковый пояс».
В России также существуют эндемичные по раку пищевода регионы: крайне высока распространенность рака пищевода (более 150 человек на 100 тыс. населения) в Якутии, среди малочисленных народов Севера и Дальнего Востока России [3]. В эндемичных по раку пищевода регионах (табл. 3) заболеваемость среди женщин выше, чем среди мужчин [4], что свидетельствует о наличии определенных факторов внешней среды, оказывающих негативное влияние независимо от половой принадлежности и вредных привычек. Такими факторами являются: высокая солнечная активность; низкое содержание микроэлементов в почве (дефицит цинка в Иране, селена в Китае); национальные традиции употребления очень горячих напитков (чай и мате); жевание табака, бетеля, курение опия; высокое содержание промышленных канцерогенов в почве (кварц в Северном Китае, Иране, Южной Африке); высокое содержание полициклических ароматических гидрокарбонатов (образуются при гниении органических веществ) в продуктах питания (Иран, Китай); загрязнение продуктов питания канцерогенными грибами [3, 5].
В неэндемичных по раку пищевода регионах факторами, повышающими риск развития плоскоклеточного рака пищевода, являются: низкий уровень социально-экономического статуса, употребление в пищу низкокачественных, несвежих продуктов, дефицит витаминов и микроэлементов в продуктах питания, злоупотребление крепкими алкогольными напитками. Тем не менее за последние несколько десятилетий наблюдается динамика снижения заболеваемости и смертности от плоскоклеточного рака пищевода, что связывают с улучшением социально-экономических условий жизни в развивающихся странах (рис. 2). Еще одним общепризнанным фактором риска, имеющим важное значение в развитии рака пищевода в экономически развитых странах, где влияние других факторов практически нивелировано, является курение табака: атрибутивный популяционный риск (доля рака, этиологически связанного с курением) составляет 54% [3]. Риск возникновения рака пищевода прямо пропорционален количеству выкуриваемых сигарет и длительности курения [6].
Известно, что курение табака совместно с употреблением алкогольных напитков повышает риск развития плоскоклеточного рака в 2–7 раз [3]. Менее распространенными, но значимыми в этиологии плоскоклеточного рака пищевода являются заболевания пищевода, приводящие к хроническому раздражению и воспалению слизистой оболочки стенки пищевода, такие как ахалазия кардии и дивертикулы пищевода. Немодифицируемыми факторами риска развития плоскоклеточного рака пищевода являются мужской пол и возраст старше 50 лет (рис. 3).
Скрининг
Относительно низкая частота распространенности рака пищевода, отсутствие ранних проявлений заболевания, редкий характер наследственных форм этого заболевания делают скрининговые программы неэффективными среди популяции в целом. Исключением являются регионы с высокой частотой выявления рака пищевода, а также контингент людей с высоким риском развития этого заболевания (злостные курильщики, алкоголики, мужчины старше 50 лет). Аденокарцинома пищевода представляет собой злокачественную опухоль из железистого эпителия, локализующуюся преимущественно в кардиальном отделе пищевода (рис. 4). Аденокарцинома пищевода развивается из метаплазированной железистой слизистой оболочки при пищеводе Барретта или из желудочного эпителия в месте кардиофундального перехода. Вероятность излечения аденокарциномы пищевода (за исключением опухолей, ограниченных слизистой оболочкой) ничтожно мала.
Аденокарцинома пищевода. Эпидемиологические особенности
Аденокарцинома является доминирующей гистологической формой рака в большинстве развитых стран, независимо от их географической локализации [7]. В отличие от плоскоклеточного рака аденокарцинома пищевода в 5 раз чаще поражает лиц белой расы, заболеваемость которых составляет 3,7 человек на 100 тыс. населения в год, тогда как заболеваемость афроамериканцев значительно ниже – 0,8 человек на 100 тыс. населения в год [2]. За последние 35–50 лет в большинстве экономически развитых стран наблюдаются высокие темпы роста заболеваемости и смертности от аденокарциномы пищевода. Данная проблема затронула на сегодняшний день не только западные страны, но и Японию, Сингапур, Иран. По данным H. Pohl и H.G. Welch (2005), заболеваемость аденокарциномой в США в период с 1975 по 2001 г. возросла в 7 раз (с 5 до 35 случаев на 100 тыс. населения в год) [8]. Причем рост заболеваемости происходит за счет мужской части населения, тогда как заболеваемость среди женщин демонстрирует лишь незначительные колебания (рис. 5). В США темпы роста заболеваемости аденокарциномой пищевода являются одними их самых высоких среди всех онкологических заболеваний (рис. 6) [8].
Факторы риска
Факторами риска возникновения аденокарциномы пищевода являются гастроэзофагеальная рефлюксная болезнь (ГЭРБ) с развитием пищевода Барретта. Частота, тяжесть и продолжительность симптомов рефлюкса коррелируют с риском развития аденокарциномы пищевода. Наличие выраженных и постоянных симптомов гастроэзофагеального рефлюкса увеличивает риск развития аденокарциномы пищевода более чем в 7 раз по сравнению с группой контроля [9]. Согласно современным данным, риск развития аденокарциномы пищевода при наличии пищевода Барретта составляет 0,5–0,7% в год и зависит от длины метаплазированного участка и наличия сопутствующих факторов риска [10, 11, 12].
Однако одна из последних работ S. Wani и соавт. (2011), включавшая наблюдение за 1204 пациентами с пищеводом Барретта (из них 93,7% белой расы, 88% мужчин, средний возраст 59,3 года, средний период наблюдения 5,5 лет), показала, что риск развития дисплазии и аденокарциномы пищевода у больных с недиспластическим пищеводом Барретта в предыдущих исследованиях был значительно преувеличен. Так, за время наблюдения аденокарцинома из пищевода Барретта развилась у 18 из 1204 пациентов (заболеваемость 0,27% в год), дисплазия высокой степени – у 32 больных (0,48%). Через 5 и 10 лет после установления диагноза «пищевод Барретта» малигнизации не произошло у 98,6% (n = 540) и у 97,1% (n = 155) пациентов соответственно. В исследовании была обнаружена статистически значимая связь между длиной сегмента пищевода Барретта и риском его озлокачествления. Так, при длине сегмента пищевода Барретта менее 6 см риск развития аденокарциномы пищевода составил 0,09% в год, при длине от 6 см и более риск малигнизации был равен 0,65% в год (p = 0,001) [13].
Кроме пищевода Барретта к факторам риска развития аденокарциномы пищевода относят ожирение по абдоминальному типу. Согласно данным A. Chak и соавт. [14], при индексе массы тела (ИМТ) более 30 у мужчин риск развития аденокарциномы пищевода возрастает в 16 раз по сравнению с мужчинами, имеющими ИМТ менее 22. Влияние ожирения опосредовано двумя независимыми факторами: повышением внутрибрюшного давления и учащением гастроэзофагеальных рефлюксов кислоты и желчи в просвет пищевода, а также синтезом провоспалительных цитокинов адипоцитами, такими как лептин и другие адиполептины. Лептин, синтезируемый в чрезмерных количествах при абдоминальном ожирении у мужчин, стимулирует пролиферацию клеток аденокарциномы пищевода путем активации эпидермального фактора роста по циклооксигеназа-(ЦОГ)-2-зависимому пути.
Скрининг и профилактика
Согласно рекомендациям Американской гастроэнтерологической ассоциации (The American Gastroenterological Association, AGA), скрининговые мероприятия при обнаружении пищевода Барретта без диспластических изменений ограничиваются регулярными эндоскопическими исследованиями с проведением биопсии пищевода каждые 3–5 лет. Если при гистологическом исследовании обнаруживаются признаки дисплазии, обследование рекомендуется проводить ежегодно. Общие меры профилактики (канцерпревенции) плоскоклеточного рака и аденокарциномы пищевода являются достаточно тривиальными, но очень эффективными. Среди них наиболее важными признаны: отказ от крепких алкогольных напитков и табакокурения, употребление в пищу свежих овощей и фруктов, особенно полезно наличие в рационе таких продуктов, как цветная капуста, кабачки, брокколи [15]. Достаточное содержание витаминов С и Е в рационе снижает риск прогрессирования пищевода Барретта в аденокарциному пищевода [16]. Кроме того, метаанализ, проведенный D.A. Corley и соавт., показал, что систематический прием аспирина и других нестероидных противовоспалительных препаратов (НПВП) может способствовать снижению риска развития и смертности от рака пищевода, однако необходимы дальнейшие исследования по оценке эффективности применения данного класса препаратов для профилактики рака пищевода у пациентов из группы высокого риска [17].
Профилактика аденокарциномы пищевода включает, в первую очередь, своевременную диагностику и лечение ГЭРБ и ее осложнений с помощью антисекреторных, обволакивающих препаратов, секвестрантов и адсорбентов желчных кислот. В случае выявления диспластических изменений слизистой оболочки пищевода необходима своевременная эндоскопическая абляция патологической слизистой пищевода (аргоноплазменная коагуляция, электрокоагуляция, эндоскопическая электрорезекция) в комбинации с антисекреторной терапией, способствующей восстановлению нормальной слизистой оболочки пищевода после проведения процедуры. Больным, страдающим ГЭРБ на фоне повышенной массы тела или ожирения, необходимо рекомендовать мероприятия по снижению веса (диета и динамические физические нагрузки) с достижением целевого ИМТ менее 22.
1. Day N.E. Some aspects of the epidemiology of esophageal cancer // Cancer Res. 1975. Vol. 35. № 11. P. 3304–3307.
2. Cook M.B., Chow W.H., Devesa S.S. Oesophageal cancer incidence in the United States by race, sex, and histologic type, 1977–2005 // Br. J. Cancer. 2009. Vol. 101. № 5. P. 855–859.
3. Давыдов М.И., Стилиди И.С. Рак пищевода. М.: Практическая медицина, 2007. С. 20–25.
4. Munoz N., Day N.E. Esophagus // Ed. by D. Schottenfeld, J.F. Fraumeni. Cancer epidemiology and prevention. New York: Oxford University Press, 1996. P. 681–706.
5. Kmet J., Mahboubi E. Esophageal cancer in the Caspian littoral of Iran: initial studies // Science. 1972. Vol. 175. № 4024. P. 846–853.
6. Castellsagué X., Quintana M.J., Martínez M.C., Nieto A., Sánchez M.J., Juan A., Monner A., Carrera M., Agudo A., Quer M., Muñoz N., Herrero R., Franceschi S., Bosch F.X. The role of type of tobacco and type of alcoholic beverage in oral carcinogenesis // Int. J. Cancer. 2004. Vol. 108. № 5. P. 741–749.
7. Vizcaino A.P., Moreno V., Lambert R., Parkin D.M. Time trends incidence of both major histologic types of esophageal carcinomas in selected countries, 1973–1995 // Int. J. Cancer. 2002. Vol. 99. № 6. P. 860–868.
8. Pohl H., Welch H.G. The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence // J. Natl. Cancer. Inst. 2005. Vol. 97. № 2. P. 142–146.
9. Lagergren J., Bergström R., Lindgren A., Nyrén O. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma // N. Engl. J. Med. 1999. Vol. 340. № 11. P. 825–831.
10. Sikkema M., De Jonge P.J., Steyerberg E.W., Kuipers E.J. Risk of esophageal adenocarcinoma and mortality in patient with Barrett’s esophagus: a systematic review and meta-analysis // Clin. Gastroenterol. Hepatol. 2010. Vol. 8. № 3. P. 235–244.
11. Thomas T., Abrams K.R., De Caestecker J.S., Robinson R.J. Meta analysis: cancer risk in Barrett’s oesophagus // Aliment. Pharmacol. Ther. 2007. Vol. 26. № 11–12. P. 1465–1477.
12. Yousef F., Cardwell C., Cantwell M.M., Galway K., Johnston B.T., Murray L. The incidence of esophageal cancer and high-grade dysplasia in Barrett’s esophagus: a systematic review and meta-analysis // Am. J. Epidemiol. 2008. Vol. 168. № 3. P. 237–249.
13. Wani S., Falk G., Hall M., Gaddam S., Wang A., Gupta N., Singh M., Singh V., Chuang K.Y., Boolchand V., Gavini H., Kuczynski J., Sud P., Reddymasu S., Bansal A., Rastogi A., Mathur S.C., Young P., Cash B., Lieberman D.A., Sampliner R.E., Sharma P. Patients with nondysplastic Barrett’s esophagus have low risks for developing dysplasia or esophageal adenocarcinoma // Clin. Gastroenterol. Hepatol. 2011. Vol. 9. № 3. P. 220–227.
14. Chak A., Falk G., Grady W.M., Kinnard M., Elston R., Mittal S., King J.F., Willis J.E., Kondru A., Brock W., Barnholtz-Sloan J. Assessment of familiality, obesity, and other risk factors for early age of cancer diagnosis in adenocarcinomas of the esophagus and gastroesophageal junction // Am. J. Gastroenterol. 2009. Vol. 104. № 8. P. 1913–1921.
15. Boeing H., Dietrich T., Hoffmann K., Pischon T., Ferrari P., Lahmann P.H., Boutron-Ruault M.C., Clavel-Chapelon F., Allen N., Key T., Skeie G., Lund E., Olsen A., Tjonneland A., Overvad K., Jensen M.K., Rohrmann S., Linseisen J., Trichopoulou A., Bamia C., Psaltopoulou T., Weinehall L., Johansson I., Sánchez M.J., Jakszyn P., Ardanaz E., Amiano P., Chirlaque M.D., Quirós J.R., Wirfalt E., Berglund G., Peeters P.H., van Gils C.H., Bueno-de-Mesquita H.B., Büchner F.L., Berrino F., Palli D., Sacerdote C., Tumino R., Panico S., Bingham S., Khaw K.T., Slimani N., Norat T., Jenab M., Riboli E. Intake of fruits and vegetables and risk of cancer of the upper aero-digestive tract: the prospective EPIC-study // Cancer Causes Control. 2006. Vol. 17. № 7. P. 957–969.
16. Dong L.M., Kristal A.R., Peters U., Schenk J.M., Sanchez C.A., Rabinovitch P.S., Blount P.L., Odze R.D., Ayub K., Reid B.J., Vaughan T.L. Dietary supplement use and risk of neoplastic progression in esophageal adenocarcinoma: a prospective study // Nutr. Cancer. 2008. Vol. 60. № 1. P. 39–48.
17. Corley D.A., Kerlikowske K., Verma R., Buffler P. Protective association of aspirin/NSAIDs and esophageal cancer: a systematic review and meta-analysis // Gastroenterology. 2003. Vol. 124. № 1. P. 47–56.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.