Кардиотоксичность в детской онкологии и гематологии
- Аннотация
- Статья
- Ссылки
- English
Введение
Современные методы лечения злокачественных новообразований у детей обеспечивают выздоровление в 80% случаев [1, 2]. Однако хирургическое вмешательство, химиотерапия и лучевая терапия могут привести к долгосрочным последствиям, помимо тех, которые вызваны первичным заболеванием [3, 4].
Кардиотоксичность – основная причина смерти среди детей, перенесших онкологическое заболевание, в отдаленном периоде [5]. У выживших детей по сравнению с их здоровыми сверстниками в 15 раз выше риск развития сердечной недостаточности, в десять раз – риск развития ишемической болезни сердца и в девять раз – цереброваскулярной патологии [5, 6].
В соответствии с критериями CTCAE Национального института рака США, на основании клинической оценки можно выделить пять степеней сердечной недостаточности. Первая степень отличается бессимптомным повышением уровня биомаркеров или бессимптомной дисфункцией левого желудочка. Для второй и третьей степеней характерны проявления первой степени и симптомы от легких до умеренных при нагрузке. Четвертая степень включает опасные для жизни симптомы, при которых необходима гемодинамическая поддержка. Пятая степень означает смерть [7]. Нежелательные явления со стороны сердечно-сосудистой системы входят в десятку проблем, с которыми сталкиваются пациенты, перенесшие злокачественные заболевания [8–10].
Анатомо-физиологические особенности сердца детей и подростков обусловливают полиморфизм клинической картины [11, 12].
Кардиотоксичность противоопухолевых препаратов
Внедрение в клиническую практику антрациклиновых антибиотиков (АА) в 1970-х гг. существенно расширило возможности химиотерапии онкологических заболеваний. Тем не менее их широкое применение сопровождается развитием серьезного побочного эффекта – кардиотоксичности [13].
Кардиотоксичность АА обусловлена рядом факторов, в частности повреждением ДНК, усилением окислительного стресса и прямым повреждением митохондрий. АА ингибируют топоизомеразу II бета, что приводит к повреждению ДНК и активации процессов апоптоза и некроза кардиомиоцитов. Образование активных форм кислорода под воздействием АА вызывает перекисное окисление липидов, повреждение клеточных мембран. Негативный эффект этих процессов сказывается на эндотелиальных клетках [14]. Прямое взаимодействие АА с железом усиливает образование активных форм кислорода непосредственно в митохондриях, что усугубляет повреждение миокарда. Другие механизмы включают нацеливание на сигнальные молекулы, участвующие в апоптозе, такие как проапоптотический ген P53, ингибирование фактора выживания Т-клеток GATA-4 и деградация регулятора клеточного цикла p300 [15].
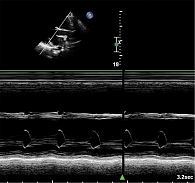
Изначально кардиотоксический эффект АА может проявляться диастолической дисфункцией и рассматривается как предвестник развития в дальнейшем систолической сердечной недостаточности [16]. Не исключено формирование картины дилатационной кардиомиопатии с резкой гипокинезией миокарда и расширением полостей сердца (рисунок).
Апоптоз и некроз миокарда характеризуются дозозависимым эффектом по мере накопления АА в клетках сердца. Как следствие – дисфункция миокарда и СН [17].
АА и их аналоги известны своей кардиотоксичностью и во многих случаях требуют снижения дозы или отмены. Существует прямая корреляция между дозой препарата и частотой кардиотоксичности [16, 18].
По данным литературы, частота сердечной недостаточности составляет 2,8% в первые шесть лет после использования кумулятивной дозы 300 мг/м2. У пациентов, получавших АА, отмечаются снижение систолической функции левого желудочка и недостаточное диастолическое наполнение увеличенного левого желудочка. Такое нарушение вызвано уменьшением количества кардиомиоцитов и стволовых клеток, способных трансформироваться и давать начало новым кардиомиоцитам [19].
У 10–30% выживших пациентов, получавших АА, удлиняется интервал QTc, наблюдаются дисфункция синусового узла, желудочковая экстрасистолия и снижение вольтажа комплекса QRS [1]. При кумулятивной дозе препарата 120 мг/м2 нарушения ритма носят преходящий характер [20]. Имеются также данные об ишемическом поражении сердца.
Чувствительность к АА и плохая переносимость терапии пациентами могут повышаться в силу индивидуальной генетической предрасположенности, артериальной гипертензии, предшествующего или сопутствующего заболевания сердца, а также применения химиотерапии с лучевой терапией, алкилирующими и антимикротубулярными препаратами [21]. Алкилирующие агенты ингибируют транскрипцию ДНК и влияют на синтез белка, в низких дозах не связаны с токсичностью, но в высоких дозах могут ассоциироваться с развитием кардиальной патологии. Сердечно-сосудистые симптомы обычно возникают в течение первой недели или первого месяца терапии.
Применение в терапии молекулярно-направленных антител может отрицательно влиять на функцию сердечно-сосудистой системы, хотя данные о подобном влиянии получены ретроспективно, а объем выборки, в которой получены эти данные, незначителен [22].
Трастузумаб – моноклональное антитело, направленное на рецептор HER2. Препарат вызывает кардиотоксичность примерно у 4–7% взрослых пациентов при изолированном приеме и у 27% – при совместном приеме с антрациклинами [23]. После прекращения лечения эффекты обычно обратимы. Использование моноклональных антител подавляет процессы восстановления повреждений, вызванных антрациклинами [24].
По данным литературы, применение кризотиниба также ассоциировано с развитием аритмии [25]. VEGF играет важную роль в гомеостазе миокарда и сосудов. Анти-VEGF-препараты нарушают метаболизм миокарда, вызывая его дисфункцию. Показано, что бевацизумаб, моноклональное антитело против VEGF, снижает фракцию укорочения миокарда левого желудочка.
Тирозинкиназы катализируют перенос фосфата из аденозинтрифосфата к остаткам тирозина в полипептидах, участвующих в передаче сигнала через рецептор фактора роста. Ингибиторы тирозинкиназы, такие как иматиниб и дазатиниб, часто используют в терапии онкологических заболеваний. Указанные препараты нередко вызывают дисфункцию левого желудочка, ишемию миокарда, окклюзионное заболевание периферических артерий и инсульт [26]. В этом случае у пациентов могут появиться периферические отеки и выпот в плевральных и перикардиальной полостях [14, 27].
Токсичность, связанная с лучевой терапией
Механизмы развития поздней радиационной токсичности являются многоступенчатыми, затрагивают различные структуры облученного органа: паренхиму, сосудистую сеть, соединительную ткань и систему местного иммунитета [28]. Облучение тканей приводит к развитию фиброза, который может развиваться как в остром, так и в отдаленном периоде после облучения. В течение нескольких минут после облучения отмечается вазодилатация, повышаются проницаемость сосудов и экспрессия молекул адгезии и факторов роста [4]. В результате возникает острая воспалительная реакция, повышается уровень цитокинов. Как правило, в патологический процесс вовлекаются фактор некроза опухоли альфа, интерлейкины 1, 6 и 8 [4]. После нескольких часов радиационного воздействия выделяются профиброзные цитокины [29]. Наиболее распространенные из них – фактор роста тромбоцитов, трансформирующий фактор роста бета, основной фактор роста фибробластов, инсулиноподобный фактор роста и фактор роста соединительной ткани [30]. Экспрессия протоонкогенов, включая с-myc и с-jun, способствует фиброзным изменениям. Повреждение эндотелия запускает коагуляционный каскад и приводит к отложению фибрина [29]. Острая фаза радиационно-индуцированного повреждения может длиться несколько дней.
Существуют и другие механизмы развития фиброза. Хроническая гипоксия и хронический окислительный стресс сопровождаются выработкой свободных радикалов. В свою очередь увеличивается количество медиаторов воспаления, протеаз и молекул адгезии, снижается концентрация оксида азота. Это приводит к дальнейшему повреждению эндотелия. Усиление выработки фактора транскрипции NF-kB – ключевое звено между окислительным стрессом и воспалением. Хроническая гипоксия приводит к усилению активности фактора, индуцируемого гипоксией, стимулирующего трансформирующий фактор роста бета и приводящего к фиброзу [30].
Субэндотелиальный фиброз поражает микрососуды в большей степени, чем крупные артерии, которые обычно мало вовлечены в патологический процесс. При поражении коронарных артерий могут развиться эндотелиальное повреждение, васкулопатия и ишемия [4]. Прогрессирующий фиброз миокарда снижает эластичность тканей, в результате чего возникает диастолическая и систолическая дисфункция. Компенсаторное усиление функции бета-адренорецепторов позволяет сохранить и стабилизировать сердечный выброс, но по мере прогрессирования повреждения развивается застойная сердечная недостаточность. Может сформироваться фиброз клапанов, хотя точный механизм таких изменений не до конца понятен. Фиброз перикарда приводит к сдавлению сердца вплоть до тампонады и панкардиту [31]. Нарушения проводимости, вероятно, связаны с повреждением микрососудов, синоатриального и атриовентрикулярного узлов, что обычно проявляется блокадой сердца [31]. Фиброз левого желудочка может привести к желудочковым эктопическим нарушениям ритма, таким как желудочковая экстрасистолия и желудочковая тахикардия.
Взаимодействием факторов, таких как применение АА, возраст пациентов и доза лучевой терапии, объясняется высокая частота развития любых сердечных заболеваний [32].
По данным литературы, риск сердечных заболеваний увеличивается при использовании доз облучения, превышающих 35 Гр [33]. Низкие и умеренные дозы лучевой терапии (5,0–19,9 Гр) связаны с увеличением частоты сердечных заболеваний (в 1,6 раза) [34]. Применение доз радиации, превышающих 20 Гр, ассоциируется с повышением вероятности развития сердечных заболеваний [35]. Лучевое поражение сердца является серьезной проблемой, приводящей к высокой смертности. Необходимо более глубоко изучить патофизиологические механизмы этого процесса для разработки новых методов профилактики повреждения микрососудов, воспаления и фиброза в отдаленном периоде [36].
Мониторинг кардиотоксичности
Научно обоснованные протоколы мониторинга сердечно-сосудистой системы, которые можно было бы использовать как стандартные при лечении различных заболеваний, не разработаны. Такой мониторинг необходим, но нет единого мнения о способах или частоте его использования. По имеющимся данным, удлинение интервала QТ может указывать на поражение сердца [37, 38]. Нарушения проводимости и гипертрофия сердца связаны с лекарственной или лучевой терапией онкологического заболевания [36].
Эхокардиография (эхоКГ) – необходимый инструмент оценки дисфункции сердца во время лечения пациентов онкологического профиля. Протоколы эхоКГ включают оценку диастолической дисфункции и деформации миокарда, поскольку нарушение этих параметров регистрируется до заметного снижения систолической функции. Прямой результат нарушения диастолической функции – повышение значений индексированного объема левого предсердия, что обычно наблюдается у пациентов с ранним развитием кардиомиопатии, вызванной химиотерапией [39].
ЭхоКГ следует выполнять до начала терапии (для установления исходного уровня), периодически во время терапии и по ее завершении.
Допплеровское исследование диастолического кровотока, оценивающее трансмитральный кровоток и деформацию миокарда, позволяет прогнозировать развитие систолической сердечной недостаточности у пациентов, получающих химиотерапию [39]. Особое внимание уделяется оценке деформации миокарда. Наибольшую прогностическую значимость имеет снижение общей продольной деформации, коррелирующее с ухудшением сердечной функции [40].
Ввиду известной кардиотоксичности антрациклинов и лучевого облучения области грудной клетки регулярная эхоКГ стала обязательным компонентом лечебных протоколов.
Накапливаются данные о развитии гемодинамических нарушений после трансплантации гемопоэтических стволовых клеток [41]. Сердечная дисфункция в этом случае рассматривается как прямое осложнение трансплантации, что подчеркивает необходимость регулярного эхоКГ-мониторирования [42].
Магнитно-резонансная томография (МРТ) сердца обладает более широкими возможностями для визуализации структуры миокарда по сравнению с эхоКГ и считается золотым стандартом оценки объемов и функции желудочков [39]. МРТ обеспечивает лучшую диагностику отека миокарда, воспаления и фиброза и по сравнению с эхоКГ позволяет более надежно идентифицировать кардиомиопатию.
Наличие в сыворотке крови повышенных уровней тропонинов I и C в первые 90 дней онкологического лечения ассоциируется с развитием долгосрочной дисфункции левого желудочка [38]. Отсутствие динамики уровня тропонина служит надежным маркером благоприятного прогноза. В то же время повышение уровня тропонина связано с высоким риском развития диастолической дисфункции, что подчеркивает важность мониторирования кардиальных биомаркеров у данной категории пациентов. Повышение уровня тропонина по окончании терапии считается прогностическим признаком последующей дисфункции левого желудочка. Концентрации BNP и N-концевого фрагмента его предшественника (NT-proBNP) повышаются при напряжении стенок сердца из-за повышения давления или при перегрузке объемом. Они резко увеличиваются при сердечной дисфункции, но также являются предикторами ремоделирования левого желудочка. Концентрации этих ферментов повышаются при перегрузке миокарда и необязательно указывают на повреждение кардиомиоцитов [38].
Методы и способы диспансерного наблюдения
На сегодняшний день как отечественными, так и зарубежными специалистами разработан ряд рекомендаций [43, 44]. Согласно последним рекомендациям Европейского общества кардиологов, всем взрослым пациентам, перенесшим онкологическое заболевание в детстве, рекомендована ежегодная клиническая оценка сердечно-сосудистого статуса, включая выполнение электрокардиографии, определение уровней натрийуретических пептидов, оценку риска сердечно-сосудистых заболеваний (SCORE2, SCORE2-OP), модификацию факторов риска и коррекцию сердечно-сосудистых заболеваний [44].
Лицам, перенесшим лучевую терапию, показаны дополнительные методы обследования. Так, следует рассмотреть неинвазивный скрининг на наличие патологии коронарных артерий (стресс-эхоКГ, КТ-ангиография, МРТ сердца и др.) каждые 5–10 лет у асимптомных пациентов, которые подверглись лучевой нагрузке дозой более 15 Гр, начиная с пятого года после завершения лечения [44]. Для педиатрических пациентов, перенесших онкологическое заболевание, методы оценки включают выполнение эхоКГ, электрокардиографию с оценкой интервала QTс, оценку уровня глюкозы и липидного профиля с учетом возраста, кумулятивной дозы АА и дозы лучевой терапии [45–48].
Для пациентов, у которых суммарная доза АА была больше 100 мг/м2, но меньше 250 мг/м2 и которые получили лучевую нагрузку более 15 Гр, рекомендовано проведение эхоКГ каждые пять лет. Пациентам, у которых суммарная доза АА превысила 250 мг/м2, а лучевая нагрузка – 15 Гр, целесообразно выполнять эхоКГ каждые два года [49–51].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Гранты, благодарности – неприменимо.
M.Ye. Prokofyev, V.M. Delyagin, PhD, Prof., A.V. Popa, PhD, Prof.
Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology
Contact person: Vasily M. Delyagin, delyagin-doktor@yandex.ru
The authors analyze in detail the remote consequences of chemotherapy and radiotherapy of oncological and oncohematological diseases in children and adolescents. The influence of various chemical and biological drugs, the spectrum of possible cardiac disorders, their clinical and instrumental manifestations are considered. Options for dispensary observation are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.