Эволюция развития криобаллонной аблации фибрилляции предсердий у коморбидных пациентов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование были включены 59 пациентов с ФП и отягощенным коморбидным фоном, которых распределили на две группы. Первую группу составили 39 пациентов с пароксизмальной ФП, вторую – 20 пациентов с персистирующей ФП. Исходно, через три и шесть месяцев наблюдения анализировали параметры трансторакальной эхокардиографии, лабораторные показатели крови, уровни NT-proBNP, оценивали функциональный класс по шкале mEHRA, количество пароксизмов ФП по данным холтеровского мониторирования электрокардиограммы.
Заключение. Криобаллонная аблация в сочетании с антиаритмической терапией демонстрирует достаточную эффективность при долгосрочном наблюдении у пациентов с пароксизмальной и персистирующей формами ФП, в том числе с сопутствующими патологиями.
Материал и методы. В исследование были включены 59 пациентов с ФП и отягощенным коморбидным фоном, которых распределили на две группы. Первую группу составили 39 пациентов с пароксизмальной ФП, вторую – 20 пациентов с персистирующей ФП. Исходно, через три и шесть месяцев наблюдения анализировали параметры трансторакальной эхокардиографии, лабораторные показатели крови, уровни NT-proBNP, оценивали функциональный класс по шкале mEHRA, количество пароксизмов ФП по данным холтеровского мониторирования электрокардиограммы.
Заключение. Криобаллонная аблация в сочетании с антиаритмической терапией демонстрирует достаточную эффективность при долгосрочном наблюдении у пациентов с пароксизмальной и персистирующей формами ФП, в том числе с сопутствующими патологиями.
![Таблица 1. Характеристика пациентов, Me [Q1; Q3]; абс. (%)](/upload/resize_cache/iblock/6da/195_350_1/Korchazhkina1.jpg)
Введение
Фибрилляция предсердий (ФП) является широко распространенной формой наджелудочковой аритмии, частота которой увеличивается в связи со старением населения и растущим бременем факторов риска, таких как ожирение, артериальная гипертония, метаболический синдром, ишемическая болезнь сердца, обструктивное апноэ сна, злоупотребление алкоголем, курение, гиподинамия, сахарный диабет. В настоящее время распространенность ФП составляет 1–2% в целом. Значительное увеличение частоты встречаемости отмечается с возрастом и при наличии сопутствующей патологии. Так, в возрасте 50 лет данный показатель составляет < 1,0%, в 65 лет – до 4%, в 80 лет – 12% [1].
Современная электрофизиология свидетельствует о значительных достижениях в понимании механизмов, лежащих в основе сложных моделей распространения волн во время ФП. На первичных стадиях фибрилляция представляет собой изолированное электрическое нарушение и обычно вызывается повторяющимися быстрыми импульсами, которые исходят из легочных вен и поддерживаются микроциркуляторными каналами вокруг соединения легочной вены с левым предсердием. Кумулятивный эффект рецидивов фибрилляции может приводить к электрическому, сократительному и структурному ремоделированию предсердий, что служит предпосылкой развития постоянной формы ФП [2].
Прогрессирование от пароксизмальной формы ФП к персистирующей и затем постоянной форме сопровождается значительным увеличением частоты сердечно-сосудистых осложнений. С этим также связано пятикратное увеличение риска тромбоэмболических осложнений и четырехкратное – риска летального исхода [3]. Определение ключевых механизмов развития ФП у конкретных пациентов – сложная задача, а эффективность существующих методов лечения далека от идеала. В результате уровень заболеваемости ФП стабильно возрастает, что требует разработки новых подходов к лечению [4].
Как известно, повторный пароксизм ФП регистрируется у 75% больных в течение года после первого эпизода. В ряде крупных исследований – PIAF, AF CHF, AFFIRM сравнивали концепцию контроля ритма и контроля частоты желудочковых сокращений при ФП. Результаты не показали преимуществ контроля ритма, не отмечалось статистически значимого снижения смертности, эффективности профилактики тромбоэмболических осложнений в долгосрочной перспективе [5–7]. Следует отметить, что в указанных работах для контроля ритма применялась антиаритмическая терапия (ААТ). Тем не менее медикаментозная терапия, направленная на восстановление синусового ритма и профилактику пароксизмов, малоэффективна. Кроме того, она характеризуется побочными эффектами в краткосрочной и долгосрочной перспективе, что ограничивает ее применение. Поддержание синусового ритма – задача непростая и не всегда безопасная. Несмотря на это, клиницисты в большинстве случаев предпочитают тактику медикаментозного контроля ритма.
В настоящее время для профилактики и лечения ФП доступны методы, включающие модификацию образа жизни, фармацевтическую и нутрицевтическую терапию, катетерную аблацию, нейромодуляцию [3].
Исследования последних десятилетий демонстрируют, что для наилучшего лечения ФП требуется участие нескольких сторон, заинтересованных в предоставлении комплексной медицинской высокотехнологичной помощи, ориентированной на пациента [8].
По мнению M. Haïssaguerre и соавт., подавляющее большинство преждевременных ударов предсердий, инициирующих частые пароксизмы ФП, возникает в легочных венах. Несомненно, это новая страница в истории лечения ФП с помощью катетерных методик [9].
Многочисленные наблюдательные и рандомизированные контролируемые исследования продемонстрировали преимущество катетерной аблации посредством электрической изоляции устьев легочных вен перед ААТ для поддержания стойкого синусового ритма, улучшения клинических симптомов и повышения качества жизни [10]. По мнению K.H. Kuck и соавт., катетерная аблация путем модификации патогенетического механизма, обусловливающего возникновение и поддержание аритмии, может менять траекторию развития ФП и тем самым тормозить прогрессирование ФП от пароксизмальной до персистирующей или постоянной формы [11].
K.R.J. Chun и соавт. показали преимущество криобаллонной аблации (КБА) в хирургическом лечении ФП перед радиочастотной аблацией (РЧА). Такое преимущество заключается не только в более быстрой технике выполнения процедуры и меньшей частоте осложнений, но и в снижении частоты повторных госпитализаций при возобновлении ФП и соответственно меньшей частоте выполнения электрических кардиоверсий [12].
Сегодня перед практикующими врачами стоит сложная задача по выбору оптимальной стратегии эффективного лечения ФП. Дело в том, что этиология и патогенез ФП до конца не изучены, единые эффективные протоколы лечения отсутствуют.
В одноцентровом проспективном исследовании проанализированы эффективность и ближайший результат КБА устьев легочных вен в сочетании с ААТ на тяжесть симптомов аритмии с помощью оценки функционального класса по модифицированной шкале mEHRA, а также влияние КБА на систолическую функцию левого желудочка (ЛЖ), динамику уровня NT-proВNР.
Материал и методы
В исследовании участвовали 59 пациентов (26 женщин и 33 мужчины) в возрасте 45–75 лет (средний возраст – 63,3 года), прооперированных в период с октября 2022 г. по ноябрь 2023 г., с высокосимптомной пароксизмальной и персистирующей формами ФП без существенного клинического результата от ААТ, с отягощенным коморбидным фоном. Все участники исследования получали оптимальную лекарственную терапию с учетом сопутствующей патологии и принимали антикоагулянтную терапию. На предоперационном обследовании проводились общеклинические исследования, в том числе за 48 часов до проведения КБА выполнялась чреспищеводная эхокардиография (ЭхоКГ) для исключения внутрисердечного тромбоза. Пациенты были разделены на две группы. В первую группу вошли 39 пациентов с пароксизмальной формой ФП, во вторую – 20 пациентов с персистирующей формой. Всем больным проводилось хирургическое лечение ФП с использованием КБА. Длительность наблюдения составила шесть месяцев после процедуры КБА (контрольные точки – три и шесть месяцев). Клиническое состояние оценивали изначально, через три и через шесть месяцев после КБА по шкале mEHRA, параметрам трансторакальной ЭхоКГ, уровням сердечного биомаркера NT-proBNP. Кроме того, была проанализирована частота повторных госпитализаций после оперативного вмешательства, количество повторных пароксизмов ФП по результатам холтеровского мониторирования электрокардиограммы (ХМ ЭКГ).
Обработку статистических данных осуществляли с использованием программного обеспечения Python v. 3.11. Значение вероятности (p) менее 0,05 (двусторонний анализ значимости) свидетельствовало о статистически значимых различиях. Все участники исследования дали информированное согласие на участие в исследовании. Все этапы исследования утверждены локальным этическим комитетом учреждения.
Результаты
Все пациенты имели сходные начальные характеристики по полу, возрасту, индексу массы тела и частоте встречаемости сопутствующих заболеваний (табл. 1).
У большинства пациентов отмечались избыточный вес и ожирение 1-й степени: 74,4% – в первой группе, 95% – во второй. Наиболее распространенной сопутствующей патологией была гипертоническая болезнь – 95%. Постинфарктный кардиосклероз зарегистрирован у 18,6% пациентов, сахарный диабет 2-го типа – у 20,3%, хроническая сердечная недостаточность – у 74,6% пациентов. По результатам ЭхоКГ, на момент включения в исследование у 13 (22%) больных фракция выброса ЛЖ составляла менее 50%. По mEHRA для оценки тяжести симптомов аритмии 50 (84,7%) пациентов были отнесены к классу IIb, 9 (15,3%) – к классу III.
Всем пациентам после КБА назначали ААТ: 4 (6,8%) больным – антиаритмические препараты класса IС, 13 (22%) – бета-блокаторы, 41 (69,5%) – препараты класса III, 1 (1,7%) – комбинированную терапию – препараты класса IС и класса III.
По данным биохимического анализа крови, средний уровень NT-proBNP составил 837 [21; 6547] пг/мл, содержание общего холестерина – 4,9 [2,5; 9,5] ммоль/л, липопротеинов низкой плотности – 2,7 [0,9; 6,4] ммоль/л, липопротеинов высокой плотности – 1,3 [0,6; 2,3] ммоль/л, триглицеридов – 1,2 [0,4; 7,4] ммоль/л, креатинина – 83 [44,2; 156] мкмоль/л, тиреотропный гормон – 2,1 [0,3; 4,0] мМЕ/л, С-реактивного белка – 3,5 [0,2; 5,5] мг/л, гемоглобина – 138 [102; 164] г/л, эритроцитов – 4,7 [0,2; 5,5] 1012/л, лейкоцитов –7,8 [4,3; 11,9] 103/мкл.
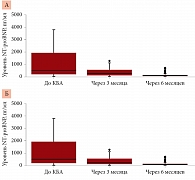
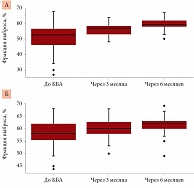
Через три и шесть месяцев после вмешательства в обеих группах наблюдалось статистически достоверное снижение объема левого предсердия и уровня NT-proBNP. Через шесть месяцев отмечалось нарастание фракции выброса ЛЖ по сравнению с данными до операции (рис. 1–3).
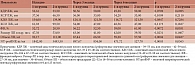
При сравнении параметров трансторакального ЭхоКГ и лабораторных показателей в первой группе через три и шесть месяцев после процедуры достоверные отличия зафиксированы по показателям фракции выброса ЛЖ, объема и размера левого предсердия, уровня NT-proBNP. Во второй группе достоверные различия зарегистрированы по показателям объема левого предсердия, фракции выброса ЛЖ и уровня NT-proBNP (табл. 2).
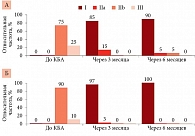
Исходно в первой группе 89,7% пациентов относились к классу IIb по mEHRA, 10,3% – к классу III. Во второй – 75% пациентов – к классу IIb по mEHRA, 25% – к классу III. За период наблюдения зафиксировано значимое снижение функционального класса по mEHRA, что свидетельствует об отсутствии симптомов аритмии, снижении ее бремени. В первой группе через три месяца после КБА 97,4% пациентов соответствовали классу I по mEHRA, 2,6% – классу II, во второй – 85% пациентов соответствовали классу I, остальные 15% – классу IIa. Через шесть месяцев после вмешательства все пациенты первой группы относились к классу I. Во второй группе большинство (90%) пациентов остались в классе I, 5% – в классе IIа, 5% – в классе IIb (рис. 4).
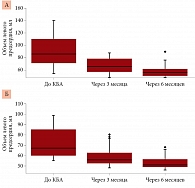
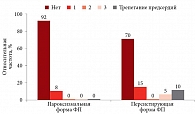
В течение года до операции в первой группе дважды госпитализировались 51,3% пациентов, три раза и более – 48,7%. Среди пациентов второй группы за последний год до КБА 15% были госпитализированы дважды, 85% – три раза и более. После КБА в течение шести месяцев мониторинга частота повторных госпитализаций в обеих группах статистически не отличалась. В первой группе однократно с целью проведения электрической кардиоверсии по поводу рецидива ФП были госпитализированы 3 (8%) пациента. Во второй группе однократно подвергались госпитализации 3 (15%) пациента, 1 (5%) был госпитализирован за период наблюдения трижды. Однократно три пациента группы персистирующей ФП были госпитализированы по поводу развития пароксизма трепетания предсердий (рис. 5). Необходимо отметить, что повторные пароксизмы ФП преимущественно наблюдались у пациентов с метаболическим синдромом, не приверженных терапии и игнорировавших рекомендации по модификации образа жизни.
Обсуждение
Уровень заболеваемости ФП год от года увеличивается. Несмотря на то что ФП редко представляет острую опасность для жизни, она влияет на качество жизни и ассоциируется со значительными рисками развития сердечно-сосудистых патологий, приводящих к летальному исходу. Этому дополнительно способствует прогрессирование ФП от пароксизмальной к персистирующей форме. Именно поэтому необходим поиск новых стратегий управления данным заболеванием.
Современная медицина преследует также цели снижения общей заболеваемости и последующей нагрузки на систему здравоохранения за счет сокращения срока госпитализации, количества амбулаторных обращений и случаев оказания неотложной помощи.
Последние годы внимание кардиологического сообщества направлено на изучение хирургических методик лечения наджелудочковых аритмий. Опубликованные результаты рандомизированных исследований демонстрируют эффективность КБА в целях восстановления и удержания синусового ритма у пациентов с ФП, в том числе в качестве терапии первой линии [13]. Еще одним важным фактором является доступность использования аблации.
В целом аблация ФП может быть ответственна за снижение смертности в некоторых подгруппах пациентов, тем не менее она вряд ли объясняет тенденцию летальных исходов среди всех пациентов с ФП. Важной составляющей лечения ФП является модификация образа жизни. Речь, в частности, идет о снижении индекса массы тела, отказе от курения, употребления алкоголя, о регулярной физической активности и повышении приверженности лечению, контроле сердечно-сосудистых заболеваний. Особого внимания требует лечение мультиморбидности, которая часто встречается у таких пациентов и ассоциируется с неблагоприятным исходом. Следование указанным рекомендациям способствует улучшению клинического течения ФП. Немаловажную роль играет персонализация немедикаментозного и медикаментозного лечения, а также профилактика осложнений. Такой подход становится все более приоритетным в мире для пациентов с ФП.
Результаты нашего исследования демонстрируют, что выбор КБА в качестве основной стратегии лечения ФП значительно улучшает клинические исходы аритмии за счет повышения качества жизни, снижения долгосрочного использования медицинских ресурсов.
На наш взгляд, криобаллонная изоляция устьев легочных вен в сочетании с ААТ – наиболее эффективная схема контроля ритма сердца в отдаленном периоде у пациентов с сопутствующей сердечно-сосудистой патологией не только при пароксизмальной, но и при персистирующей форме ФП.
Заключение
В настоящее время КБА в сочетании с ААТ у пациентов с пароксизмальной и персистирующей формами ФП, в том числе с осложненным коморбидным фоном, считается эффективной альтернативой медикаментозному ритм-контролю и лечению для удержания синусового ритма при долгосрочном наблюдении. На наш взгляд, аблация должна выполняться не только пациентам без серьезных сопутствующих заболеваний и структурной патологии сердца. Целесообразно пересмотреть и расширить показания для проведения КБА пациентам любого возраста и пола с полиморбидной патологией. Безусловно, для решения этой непростой задачи необходимы исследования по разработке персонифицированного протокола для отбора пациентов на проведение КБА с целью реализации стратегии контроля ритма.
Авторы заявляют об отсутствии потенциального конфликта интересов.
I.G. Polozkova, N.B. Korchazhkina, M.S. Rybachenko, A.A. Mikhailova, O.I. Polozkov, Yu.V. Frolova
B.V. Petrovsky Russian Research Centre of Surgery
L.A. Vorokhobov City Clinical Hospital № 67
Contact person: Irina G. Polozkova, dr.irinapolozkova@gmail.com
Purpose to analyze the effectiveness of cryoballoon ablation combined with antiarrhythmic therapy in comorbid patients with paroxysmal and persistent atrial fibrillation (AF).
Material and methods. The study included 59 patients with AF and a burdened comorbid background, who were divided into two groups. The first group consisted of 39 patients with paroxysmal AF, the second – 20 patients with persistent AF. Initially, after three and six months of follow-up, the parameters of transthoracic echocardiography, laboratory blood parameters, the level of NT-proBNP were analyzed, the functional class was assessed on the mEHRA scale, the number of AF paroxysms according to Holter electrocardiogram monitoring.
Conclusion. Cryoballoon ablation combined with antiarrhythmic therapy demonstrates sufficient effectiveness during long-term follow-up in patients with paroxysmal and persistent atrial fibrillation, including those with concomitant pathologies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.