Антиаритмический эффект эндоваскулярной окклюзии патентного овального окна после радиочастотной аблации фибрилляции предсердий (серия случаев)
- Аннотация
- Статья
- Ссылки
- English
Описаны клинические случаи семи пациентов (три женщины, четверо мужчин) в возрасте 47,71 ± 14,04 года (от 29 до 73 лет) с пароксизмальной (три случая) и персистирующей (четыре случая) ФП, у которых антиаритмическая медикаментозная терапия оказалась неэффективной и была выполнена изоляция легочных вен с использованием радиочастотной энергии. Диагноз ООО установлен у двух пациентов перед аблацией. Ни у одного из пациентов в анамнезе не было инсульта или транзиторной ишемической атаки. Риск ишемического инсульта по шкале CHA2DS2-VASC составил 1,70 ± 0,69.
Во время процедуры аблации проводилась катетеризация левого предсердия через ООО. Аблацию ФП проводили с использованием нефлюороскопической системы CARTO. Через три месяца наблюдения у двух пациентов рецидивы аритмий сохранялись, они получали постоянную антиаритмическую терапию (ААТ).
В период от трех до 12 месяцев после аблации пациентам проводилась чреспищеводная эхокардиография с пузырьковой пробой для оценки риска эмболических осложнений. У двух больных выявлено шунтирование из левого предсердия в правое. Положительный пузырьковый тест получен у шести пациентов. У трех пациентов длина тоннеля ООО превышала 4 мм.
Шести пациентам выполнена эндоваскулярная окклюзия ООО, одному – окклюзия дефекта межпредсердной перегородки в срок от четырех до 12 месяцев после аблации.
Через 26,9 ± 9,6 месяца наблюдения после закрытия ООО 1 (14%) пациент продолжал прием ААТ из-за рецидивов ФП. Через год после закрытия статистически значимых различий эхокардиографических показателей до и после лечения не выявлено. Однако наблюдалась тенденция к уменьшению размеров камер сердца: у 5 (71%) больных с ООО отмечалось уменьшение размеров правого предсердия, у 6 (85%) – правого желудочка (р = 0,26), а у 5 (71%) – левого предсердия (р = 0,12).
Комплексное лечение пациентов с ФП и ООО, включающее назначение антиаритмических препаратов, аблацию субстрата ФП и интервенционное закрытие ООО, позволило снизить тяжесть ФП в течение двух лет наблюдения.
Описаны клинические случаи семи пациентов (три женщины, четверо мужчин) в возрасте 47,71 ± 14,04 года (от 29 до 73 лет) с пароксизмальной (три случая) и персистирующей (четыре случая) ФП, у которых антиаритмическая медикаментозная терапия оказалась неэффективной и была выполнена изоляция легочных вен с использованием радиочастотной энергии. Диагноз ООО установлен у двух пациентов перед аблацией. Ни у одного из пациентов в анамнезе не было инсульта или транзиторной ишемической атаки. Риск ишемического инсульта по шкале CHA2DS2-VASC составил 1,70 ± 0,69.
Во время процедуры аблации проводилась катетеризация левого предсердия через ООО. Аблацию ФП проводили с использованием нефлюороскопической системы CARTO. Через три месяца наблюдения у двух пациентов рецидивы аритмий сохранялись, они получали постоянную антиаритмическую терапию (ААТ).
В период от трех до 12 месяцев после аблации пациентам проводилась чреспищеводная эхокардиография с пузырьковой пробой для оценки риска эмболических осложнений. У двух больных выявлено шунтирование из левого предсердия в правое. Положительный пузырьковый тест получен у шести пациентов. У трех пациентов длина тоннеля ООО превышала 4 мм.
Шести пациентам выполнена эндоваскулярная окклюзия ООО, одному – окклюзия дефекта межпредсердной перегородки в срок от четырех до 12 месяцев после аблации.
Через 26,9 ± 9,6 месяца наблюдения после закрытия ООО 1 (14%) пациент продолжал прием ААТ из-за рецидивов ФП. Через год после закрытия статистически значимых различий эхокардиографических показателей до и после лечения не выявлено. Однако наблюдалась тенденция к уменьшению размеров камер сердца: у 5 (71%) больных с ООО отмечалось уменьшение размеров правого предсердия, у 6 (85%) – правого желудочка (р = 0,26), а у 5 (71%) – левого предсердия (р = 0,12).
Комплексное лечение пациентов с ФП и ООО, включающее назначение антиаритмических препаратов, аблацию субстрата ФП и интервенционное закрытие ООО, позволило снизить тяжесть ФП в течение двух лет наблюдения.
Введение
Фибрилляция предсердий (ФП) является наиболее распространенной аритмией, частота развития которой в популяции может достигать 1–2% [1]. Патогенез ФП складывается из взаимодействия компонентов так называемого треугольника Coumel, вершины которого составляют триггер, субстрат и катализатор аритмии. ФП возникает в результате активации триггеров (эктопическая активность в легочных венах), которые приводят к реализации механизма re-entry при наличии субстрата (зоны негомогенного фиброза в миокарде предсердий) и так называемого катализатора (дисфункция вегетативной нервной системы, уровни гормонов щитовидной железы, сопутствующие заболевания и факторы риска ФП) [2]. При этом триггер, субстрат и катализатор не являются статичными, вклад каждого из них в патогенез ФП со временем меняется.
Определение приоритетной стратегии лечения пациентов с ФП (контроль ритма или частоты сердечных сокращений на фоне ФП) долгое время остается предметом дискуссии в аспекте влияния того или иного подхода к снижению частоты неплановой госпитализации, смертности и повышению качества жизни [3]. В последние годы появились публикации, свидетельствующие о положительной корреляции между стратегией, направленной на поддержание синусового ритма, и выживаемостью пациентов с ФП [4]. Сегодня наиболее эффективным методом реализации этой стратегии считается катетерная радиочастотная аблация (РЧА) [5]. Долгосрочный успех процедуры определяется в том числе адекватной коррекцией сопутствующей патологии и модификацией факторов риска ФП (сердечная недостаточность, артериальная гипертензия, дисфункция щитовидной железы, апноэ/гипопноэ, ожирение) [6].
Имеются данные о том, что открытое овальное окно (ООО) может служить патогенетическим фактором, вносящим вклад в прогрессирование аритмического синдрома [7–9]. ООО формируется в результате нарушения слияния (адгезии) septum primum и septum secundum в межпредсердной перегородке, что приводит к формированию так называемого клапана, через который может происходить шунтирование справа налево (обычно транзиторное), когда давление в правом предсердии превышает давление в левом. ООО, выявляемое в популяции в 17–57% случаев [10], может являться причиной парадоксальной эмболии [11, 12].
В связи с этим вопрос о коррекции (модификации) данного фактора риска в программе лечения пациентов с ФП остается крайне актуальным.
Представляем семь клинических случаев поэтапного лечения пациентов с ФП, которым выполнение РЧА и последующее интервенционное закрытие ООО позволило эффективно контролировать аритмический синдром и нормализовать эхокардиографические показатели.
Клинические случаи
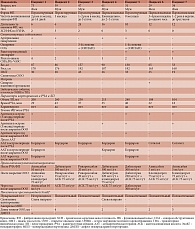
В исследовании участвовали семь пациентов (три женщины, четверо мужчин) в возрасте от 29 до 73 лет с пароксизмальной (три случая) и персистирующей (четыре случая) формой ФП с длительностью аритмического анамнеза 6–36 месяцев (таблица).
Из коморбидных состояний, связанных с патогенезом ФП, у четырех пациентов диагностировалась артериальная гипертензия, у двух – ожирение, у двух – синдром обструктивного апноэ (СОА). Ранее перенесенный миокардит (верифицированный по данным магнитно-резонансной томографии сердца) отмечался в двух случаях. У двух пациентов с персистирующим характером течения аритмического синдрома на фоне тахисистолической формы ФП наблюдалось снижение систолической функции левого желудочка по данным трансторакальной эхокардиографии (ЭхоКГ).
На этапе подготовки к проведению РЧА, по результатам ЭхоКГ, данные о наличии ООО были получены в двух случаях. Из симптомов, характерных для ООО, только у одной пациентки диагностирован синдром платипноэ/ортодоксии. Ни у кого из участников исследования в анамнезе не было перенесенного острого нарушения мозгового кровообращения (ОНМК) или транзиторной ишемической атаки (ТИА). Риск ишемических инсультов по шкале CHA2DS2-VASC в одном случае составил 4 балла, в двух – 2 балла, в четырех – 1 балл.
При выполнении РЧА ФП катетеризация левого предсердия была осуществлена без пункции межпредсердной перегородки (МПП) через ООО. Таким образом, у пяти пациентов диагноз ООО был установлен впервые в ходе интервенционного вмешательства. РЧА ФП выполнялась с использованием нефлюороскопической системы CARTO и включала антральную изоляцию всех легочных вен, линейные РЧ-воздействия в области митрального истмуса и свода левого предсердия (ЛП), а также модификацию субстрата аритмии по задней стенке (общее время РЧА – от 18 до 40 минут, мощность – 40 Вт, температура – 45 °С, скорость орошения – 17 мл/мин). На заключительном этапе процедуры методом электроимпульсной терапии (250 Дж) у двух пациентов с персистирующим течением аритмического синдрома был восстановлен синусовый ритм.
В остром периоде (три месяца) после проведения РЧА пациенты продолжали получать антиаритмическую терапию (ААТ) (в пяти случаях – Кордарон, в двух – соталол). Через три месяца два пациента продолжали прием ААТ из-за сохранявшихся редких рецидивов ФП.
Терапия антикоагулянтами (апиксабан – три случая, дабигатран – три случая и ривароксабан – один случай) проводилась в течение не менее десяти суток перед РЧА и не менее трех месяцев после нее. Через шесть месяцев после РЧА антикоагулянты были отменены у пяти из семи пациентов. После закрытия ООО первые полгода проводилась комбинированная терапия (антикоагулянт + антиагрегант и двойная антиагрегантная терапия у двух пациентов). Через год после закрытия ООО два пациента не получали какой-либо терапии, два пациента принимали антикоагулянты, три – продолжают прием аспирина.
В период от трех до 12 месяцев после РЧА пациентам выполнялась чреспищеводная (ЧП) ЭхоКГ с целью оценки риска развития эмболических осложнений. У шести пациентов выявлено ООО, в одном случае – дефект межпредсердной перегородки (ДМПП). У двух пациентов отмечалось шунтирование крови из левого предсердия в правое. При проведении пузырькового теста во время выполнения ЧП ЭхоКГ у шести пациентов получен положительный результат. Оценка морфологических характеристик ООО показала, что у трех пациентов длина тоннеля превысила 4 мм.
В соответствии с рекомендациями Общества сердечно-сосудистой ангиографии и вмешательств (Society for Cardiovascular Angiography and Interventions – SCAI), у пациентов с положительным пузырьковым тестом имеются показания 2-го класса к проведению интервенционного закрытия ООО в целях первичной профилактики инсультов [11]. В период от четырех до 12 месяцев после РЧА ФП пациентам была выполнена эндоваскулярная окклюзия ООО (шесть случаев) и ДМПП (один случай). Во всех случаях процедура прошла без осложнений, пациенты были выписаны из стационара на следующие сутки.
По данным ЭхоКГ через год после закрытия у 5 (71%) пациентов с ООО отмечалось уменьшение размеров правого предсердия, у 6 (85%) – правого желудочка и у 5 (71%) – левого предсердия. Размеры ЛП не изменились у двух пациентов с верифицированным лево-правым сбросом.
Интересно, что наиболее выраженные изменения, свидетельствовавшие об обратном ремоделировании камер сердца, отмечались у пациентов с избыточной массой тела и ожирением, также получавших СИПАП-терапию по поводу СОА.
Никто из пациентов не имел эпизодов ОНМК, ТИА и иных системных эмболических событий в течение года наблюдений.
У двух пациентов с исходной систолической дисфункцией на фоне персистирующей формы ФП комбинированное лечение, включавшее РЧА и закрытие ООО, привело к восстановлению систолической функции левого желудочка.
Нельзя исключить, что положительный антиаритмический эффект, процессы обратного ремоделирования камер сердца могут быть связаны именно с комбинированным подходом, который заключается в проведении РЧА и устранении ООО как субстрата для реализации ФП.
Обсуждение
ООО как фактор патогенеза ФП
Еще в 2000 г. были опубликованы данные о том, что среди пациентов, перенесших криптогенный инсульт или ТИА с верифицированным по данным ЧП ЭхоКГ ООО, при выполнении эндокардиального электрофизиологического исследования достоверно чаще индуцируется ФП, а параметры рефрактерности и скорости проведения в обоих предсердиях ниже (это свидетельствует о высокой уязвимости предсердий), чем у пациентов без ООО [8].
Тем не менее ранее ООО не рассматривалось как фактор, связанный с прогрессированием ФП. Так, в 2008 г. S. Knecht и соавт. продемонстрировали в группе из 203 пациентов с пароксизмальной формой ФП, что наличие ООО не влияет на результаты РЧ-изоляции легочных вен в отношении поддержания устойчивого синусового ритма в течение 50 месяцев наблюдения [13].
Относительно недавно были опубликованы данные о том, что ООО является одним из независимых предикторов рецидивов аритмии после криоаблации персистирующей формы ФП [9]. Авторы предположили, что ООО служит триггером предсердных экстрасистол, запускающих ФП, а функционирование право-левого шунта в предсердиях приводит к попаданию в ЛП биологически активных веществ (например, серотонина) и агрегатов тромбоцитов, которые при обычных условиях проходят «детоксикацию» в легких, а при попадании в ЛП могут приводить к развитию фиброза, атриопатии и прогрессированию ФП [9, 14].
Влияние закрытия ООО на течение аритмического синдрома
Данные о влиянии закрытия ООО на течение ФП противоречивы. Так, согласно результатам исследования CLOSURE-1 с участием 860 пациентов с ООО, частота развития ФП в первый год после интервенционного вмешательства составляла 5,7%, в то время как в группе пациентов, которым проводилась медикаментозная профилактика, эпизодов ФП не было. Авторы предположили, что развитие ФП в раннем послеоперационном периоде связано с воспалительными процессами в миокарде предсердий, обусловленными интервенционным вмешательством. Эта гипотеза косвенно подтверждается тем фактом, что при последующем наблюдении частота развития ФП снижалась до 3,9% [12].
В то же время существует предположение, что закрытие ООО обладает антиаритмическим эффектом в отношении ФП. В этой связи заслуживают внимания результаты нескольких метаанализов исследований с участием свыше 5000 пациентов, которым выполнялось интервенционное или хирургическое закрытие ООО либо ДМПП. Эти данные свидетельствуют о достоверном снижении частоты развития ФП после проведенного вмешательства в периоде наблюдения до пяти лет [15, 16].
В 2019 г. A. Carpenter и соавт. опубликовали результаты длительного динамического наблюдения за 384 пациентами с ДМПП, которым проводилось его интервенционное закрытие. У 74 (20%) пациентов выявлялась ФП, 15 из них выполнялась РЧА в ЛП до установки окклюдера в МПП. Результаты динамического наблюдения показали, что у 36% пациентов с ФП, которым не выполнялась РЧА, ФП не рецидивировала в течение года после закрытия, а у 289 (80%) пациентов без ранее существовавшей ФП частота возникновения аритмии в течение года наблюдения была удивительно низкой (0,3%) [17].
Первичная профилактика инсультов при ООО
К настоящему моменту накоплена большая доказательная база по вторичной профилактике криптогенных инсультов у пациентов с ООО. В крупных рандомизированных международных исследованиях RESPECT, REDUCE, DEFENCE-PFO и CLOSE показано преимущество эндоваскулярной изоляции ООО перед медикаментозной терапией у пациентов с ранее перенесенными криптогенными инсультами [18–21].
С помощью шкалы риска парадоксальной эмболии (Risk of Paradoxical Embolism score – RoPE), разработанной в 2013 г. [22], можно выявить пациентов, у которых высока вероятность связи между произошедшим криптогенным инсультом и ООО: 7, 8 и 9 баллов соответствуют 72, 84 и 88% вероятности развития эмболического события и служат показанием к эндоваскулярному закрытию ООО. Основание – рекомендации Американского общества кардиологов [11].
Кроме оценки риска по шкале RoPE при отборе пациентов для проведения вторичной профилактики криптогенного инсульта также необходимо обращать внимание на морфологические характеристики ООО, МПП и результаты пузырьковой пробы. Так, в исследовании S. Homma и соавт. показано, что размер ООО значительно больше у пациентов с криптогенным инсультом по сравнению с пациентами с выявленной причиной инсульта (2,1 ± 1,7 против 0,57 ± 0,78 мм; p < 0,01) [23].
В исследовании J.-Y. Lee и соавт. из 1014 пациентов с ишемическим инсультом, направленных на ЧП ЭхоКГ, у 184 больных была уставлена связь ООО с криптогенным инсультом. За время наблюдения (медиана – 3,5 года) у 14 (7,7%) пациентов случился рецидив инсульта. Многофакторный анализ продемонстрировал, что аневризма или гипермобильность МПП (отношение рисков (ОР) 6,04; 95%-ный доверительный интервал (ДИ) 1,84–19,86; р = 0,003) и размер ООО (ОР 3,00; 95% ДИ 1,96–4,60; р < 0,0001) служат независимыми предикторами повторного инсульта. Пороговое значение размера ООО для прогнозирования повторного инсульта в течение трех лет составляет 3,0 мм (95% ДИ 2,1–3,7, площадь под кривой – 0,889; р < 0,001) с чувствительностью 90% и специфичностью 79,4% [24]. Количество микропузырьков при проведении пузырьковой пробы также больше у пациентов с криптогенным инсультом по сравнению с пациентами с идентифицируемой причиной инсульта (13,9 ± 10,7 против 1,6 ± 0,8 [среднее ± SD]; p < 0,0005) [24].
Таким образом, выявлены критерии «высокорискового» ООО, которые являются независимыми предикторами развития инсульта. Согласно рекомендациям Американского общества кардиологов, пациентам показано закрытие ООО только в качестве вторичной профилактики криптогенного инсульта. В настоящее время проблема связана с определением роли первичной профилактики криптогенного инсульта у этой категории пациентов.
Одно из немногих упоминаний о первичной профилактике криптогенных инсультов у пациентов с ООО встречается в рекомендациях Общества специалистов по рентгенэндоваскулярной диагностике и лечению (Society for Cardiovascular Angiography and Interventions) – Management of Patent Foramen Ovale [11]. В документе говорится, что у пациентов с системной эмболией и без инсульта, связанного с ООО в анамнезе, у которых исключены другие эмболические этиологии, рекомендации SCAI предлагают его закрытие, а не только медикаментозную терапию. Рекомендация имеет низкую доказательную базу, необходимо проведение дополнительных крупных исследований для выделения пациентов с показаниями к первичной профилактике различных эмболических осложнений, включая развитие инсульта на фоне патентного овального окна. С учетом того, что во всех случаях выявлен положительный пузырьковый тест, а следовательно, имелись все признаки «высокорискового» ООО, пациентам были проведены интервенционные вмешательства окклюзии ООО в рамках первичной профилактики инсульта.
Эхокардиографические изменения после закрытия ООО
В исследовании M. Aslan и соавт. оценивались эхокардиографические показатели до и через шесть месяцев после интервенционного закрытия ДМПП с верифицированным лево-правым шунтом у 41 пациента. После интервенционного закрытия ДМПП отмечалось достоверное уменьшение конечного диастолического размера правого и левого желудочков, размеров правого предсердия, снижались показатели предсердной электромеханической задержки, хотя сами размеры ЛП достоверно не менялись [25]. Динамическая оценка эхокардиографических параметров в динамике у наших пациентов согласуется с этими данными и по сути свидетельствует об обратном ремоделировании предсердий и желудочков, модифицируя тем самым субстрат для развития и прогрессирования ФП.
Мы предположили, что интервенционное закрытие ООО будет иметь ключевое значение в улучшении клинического статуса и качества жизни пациентов, позволит обеспечить длительное поддержание синусового ритма, а также будет оправданным в отношении первичной профилактики ОНМК в связи со «злокачественными» морфологическими характеристиками ООО.
На наш взгляд, полученные результаты позволяют предположить, что ООО является значимым фактором риска развития и поддержания ФП. Полученные нами результаты дают основание предположить, что модификация этого фактора риска методом интервенционной окклюзии ООО служит эффективным и, вероятно, необходимым инструментом в программе лечения ФП. Полученные данные могут стать основанием для инициации рандомизированных исследований оценки роли закрытия ООО у пациентов с ФП.
Заключение
Комбинированная терапия у пациентов с ФП и верифицированным ООО, включающая назначение антиаритмических препаратов, выполнение РЧА субстрата ФП и интервенционное закрытие ООО, позволила обеспечить эффективный контроль синусового ритма в течение двух лет наблюдения, а также обеспечила первичную профилактику эмболических нарушений.
G.E. Roytberg, PhD, Prof., Academician of RAS, A.V. Ardashev, PhD, Prof., A.S. Tereshchenko, PhD, O.V. Strunin, PhD, I.V. Smirnov, D.V. Puzenko, PhD, N.V. Kondratova, PhD, E.V. Merkulov, PhD, D.V. Sokolov, PhD, E.G. Zhelyakov, PhD
Medicine, JSC, Moscow
Feinberg Medical School, Chicago, USA
Northwestern University, Chicago, USA
Ye.I. Chazov National Medical Research Center of cardiology
Peoples' Friendship University of Russia
N.I. Pirogov Russian National Research Medical University
Contact person: Yevgeny G. Zhelyakov, zheleu@rambler.ru
Atrial fibrillation (AF) is the most common arrhythmia, the incidence of which in the population can reach 1–2%. There has been evidence that patent foramen ovale (PFO) may be a pathogenic factor contributing to the progression of AF. In this regard, the question of the need for modification of this risk factor in the treatment program for patients with AF is relevant.
The case series involved 7 patients (3 women) aged 47.71 ± 14.04 years (from 29 to 73) with paroxysmal (3 cases) and persistent (4 cases) AF who failed antiarrhythmic drug therapy and underwent pulmonary vein isolation using RF energy. Diagnosis of PFO was obtained in 2 patients before ablation. None of the patients had a history of stroke or TIA. The risk of ischemic stroke on the CHA2DS2-VASC scale was 1.70 ± 0.69.
During ablation procedure, catheterization of the left atrium was performed through the PFO. Ablation of AF was performed using a non-fluoroscopic CARTO system. After 3 months of follow up, AAT has persisted in 2 patients due to recurrences of PAF.
In the period from 3 to 12 months after ablation patients underwent transesophageal echocardiography with bubble test to assess the risk of embolic complications. In 2 patients shunting from the left atrium to the right was revealed. A positive bubble test was detected in 6 patients. Three patients had the length of the PFO tunnel exceeded 4 mm.
All patients underwent endovascular occlusion of the PFO (6 patients) and ASD (1 patient) in the period from 4 to 12 months after ablation.
At the 26.9 ± 9.6 months of follow up after PFO closure AAT persisted in 1 (14%) patient due to recurrences of PAF. One year after closure there were no statistically significant differences of echocardiographic parameters before and after treatment in the case group. However, there was a trend towards a decrease in the size of the chambers of the heart – 5 (71%) patients with PFO showed a decrease in the size of the right atrium, 6 (85%) – the right ventricle (p = 0.26), and 5 (71%) – the left atrium (p = 0.12).
Complex treatment in patients with AF and PFO, including the prescription of antiarrhythmic drugs, ablation of the AF substrate, and interventional closure of the PFO, decreased AF burden during 2 years of follow-up, and may led to the development of reverse remodeling of the heart chambers.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.