количество статей
7032
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
16-й Международный Славяно-Балтийский научный форум «Санкт-Петербург – Гастро-2014». Бускопан в алгоритмах ведения пациентов с синдромом раздраженного кишечника
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №2 (28)
- Аннотация
- Статья
- Ссылки
Рассмотрению современных представлений о патогенезе синдрома раздраженного кишечника был посвящен симпозиум «Приближаемся ли мы к пониманию патогенеза синдрома раздраженного кишечника?», организованный при поддержке компании «Берингер Ингельхайм» и состоявшийся в рамках 16-го Международного Славяно-Балтийского научного форума (Санкт-Петербург, 19–21 мая 2014 г.). На симпозиуме обсуждались вопросы взаимосвязи между микробиотой и моторикой желудочно-кишечного тракта, значение билиарной составляющей в формировании микробно-тканевого комплекса, роль нарушений микробиоты в патофизиологических механизмах развития синдрома раздраженного кишечника, а также способность препарата Бускопан воздействовать на основные звенья патогенеза заболевания.

Профессор Э. Квигли

Рис. 1. Спазмолитики в лечении боли при СРК
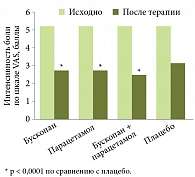
Рис. 2. Эффективность Бускопана в уменьшении интенсивности боли в животе
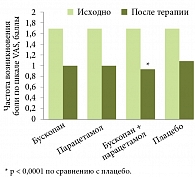
Рис. 3. Эффективность Бускопана в уменьшении частоты возникновения боли в животе

Рис. 4. Эффективность Бускопана в снижении абдоминальной боли

Профессор В.Б. Гриневич
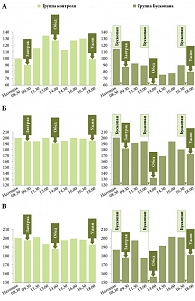
Рис. 5. Влияние бускопана на миоэлектрическую активность желудка (А), двенадцатиперстной кишки (Б), тощей кишки (В)

Профессор Е.И. Сас
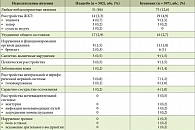
Таблица. Анализ результатов двух плацебоконтролируемых исследований в отношении частоты возникновения побочных эффектов
Влияние кишечной микробиоты на моторику желудочно-кишечного тракта. Ведущие клинические проявления и их коррекци
По мнению профессора Методистской больницы Хьюстона, США (Houston Methodist Hospital), д-ра Эмона Квигли (Eamonn QUIGLEY), симбиотические и патогенные взаимодействия микробиоты кишечника с хозяином – одна из самых интересных областей медицинской науки. В последнее время появляется все больше данных о многоплановой роли микробиоты в развитии и течении заболеваний в различных отделах желудочно-кишечного тракта (ЖКТ). Например, установлено, что выраженное изменение процессов ферментации в толстой кишке способно провоцировать возникновение транзиторных расслаблений нижнего пищеводного сфинктера и гастроэзофагеального рефлюкса. В ходе исследований выявлены специфические типы микробиома дистальных отделов пищевода, ассоциированные с кишечной метаплазией и эзофагитом1.
Как известно, моторика ЖКТ влияет на микробиоту кишечника, а ее нарушения часто сопровождаются синдромом избыточного бактериального роста в тонкой кишке. Существует определенная взаимосвязь между микробиотой и моторикой кишечника: нарушения моторики вызывают изменения микробиоты, которые в свою очередь оказывают выраженное действие на развитие сенсорно-моторной дисфункции кишки. Наглядный пример взаимодействия микробиоты и моторики кишечника – такое распространенное заболевание, как синдром раздраженного кишечника (СРК).
СРК рассматривается как функциональное заболевание, в клинической картине которого боль в животе или эквивалентный ей дискомфорт связаны с дефекацией или изменением стула. В мире симптомы СРК отмечаются у 11% людей в возрасте младше 50 лет. Причем женщины страдают СРК в два раза чаще мужчин2.
Изменения моторики, висцеральная гиперчувствительность, нарушения психики, характерные для СРК, свидетельствуют о взаимодействии между головным мозгом и ЖКТ на сенсорном, моторном и нейроэндокринном уровнях. В результате взаимодействия между микробиотой и иммунной системой кишечника выделяются нейроактивные вещества, вызывающие локальные и системные мышечные расстройства, которые лежат в основе проявлений СРК.
Роль микробиоты в патогенезе СРК не вызывает сомнений. И подтверждение тому – развитие СРК после эпизодов гастроэнтерита. Риск развития СРК после гастроэнтерита возрастает в пять раз, особенно когда гастроэнтерит сопровождется тревогой и депрессией.
По мнению докладчика, диагностика СРК требует дифференцированного подхода. Диагноз СРК считается диагнозом исключения. Зачастую СРК сочетается с абдоминальной болью, пищевой непереносимостью. Последнее, по словам д-ра Э. Квигли, является хорошим диагностическим симптомом заболевания: «Мы в нашей клинике провели исследование, в ходе которого 90% больных СРК отмечали ухудшение самочувствия в связи с употреблением фруктов, овощей, острой пищи, молока».
Действительно, существует определенная группа пациентов, у которых на фоне развития СРК формируется пищевая непереносимость. Доказано, что потребление пациентами с СРК FODMAP-содержащих продуктов (Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols – олигосахариды, дисахариды, моносахариды и близкие по строению сахароспирты – полиолы) приводит к усилению газообразования, абдоминальной боли, а FODMAP-диета благоприятно влияет на выраженность симптоматики, уменьшая боль и способствуя нормализации стула3. Нивелировать симптоматику у больных с СРК в определенной степени помогает и антиглютеновая диета4.
В настоящее время развитие СРК рассматривается как результат взаимодействия многих биологических и психосоциальных факторов. Поэтому подход к его лечению должен быть комплексным, при котором особая роль отводится спазмолитической терапии. По словам д-ра Э. Квигли, предпочтение следует отдавать эффективным, быстро купирующим боль современным спазмолитикам, например Бускопану (рис. 15, 6). Он относится к высокоселективным холиноблокаторам и способен быстро устранять спазм, боль, дискомфорт в области ЖКТ. Согласно данным рандомизированного плацебоконтролируемого исследования, 80% пациентов с СРК отвечают на терапию Бускопаном (рис. 2–4)7.
Завершая выступление, д-р Э. Квингли подчеркнул, что СРК, являясь широко распространенным заболеванием, требует дифференцированной диагностики и комплексного подхода к лечению. Способность Бускопана быстро купировать спастическую абдоминальную боль делает его препаратом выбора в лечении СРК.
Роль билиарной недостаточности в формировании нарушений микробно-тканевого комплекса кишечника
По словам заведующего 2-й кафедрой терапии Военно-медицинской академии им. С.М. Кирова, д.м.н., профессора Владимира Борисовича ГРИНЕВИЧА, микробно-тканевый комплекс (МТК) кишечника является своеобразной плацентой. По его словам, вполне закономерно, что нарушение функционирования клеток диффузионной нейроэндокринной системы МТК кишечника, особенно на фоне гиперсекреции соляной кислоты, сопровождается дисбалансом эндокринной регуляции холереза и холекинеза. Он также отметил, что на современном этапе желчные кислоты (ЖК) расцениваются как гормоны, роль которых не ограничивается солюбилизацией холестерина в желчном пузыре, активацией панкреатических липаз, стимуляцией абсорбции холестерина, жирорастворимых витаминов, липидов и жирных кислот в тонкой кишке.
ЖК регулируют все виды обмена веществ, контролируют эпителиальную тканевую составляющую МТК кишечника, формируют и модулируют воспалительный ответ, определяют резистентность к росту патогенных бактерий. Системные сигнальные функции ЖК основаны на их химических превращениях в кишечнике и напрямую модулируются активностью кишечной микробиоты.
Давно доказано, что МТК здорового человека формирует в полном объеме весь спектр ЖК. Именно поэтому первостепенное значение имеет соотношение ЖК, определяемое МТК кишечника. В связи с этим стойкое улучшение реологических свойств желчи и оптимизация спектра ЖК возможны только при восстановлении функционирования МТК кишечника.
Негативное влияние на состояние МТК кишечника оказывают заболевания билиарной системы, нарушение которой начинается с длительных функциональных расстройств с формированием дискинезии, дисхолии, холелитиаза или снижения бактерицидных свойств желчи с последующим инфицированием и развитием хронического холецистита. Прогрессирование нарушений сопровождается билиарной гипертензией, что чревато сокращением секреции желчи. Так, при повышении давления в билиарной системе до 280–300 мм водн. ст. секреция желчи печенью прекращается8. Между тем ЖК участвуют в секреции глюкагоноподобного пептида-1 (ГПП-1) в энтероэндокринных клетках двенадцатиперстной кишки (ДПК), а ГПП-1 способствует ослаблению сфинктера Одди и снижению давления в ДПК9.
Комплексное медикаментозное лечение больных с билиарной патологией и болевым абдоминальным синдромом предполагает назначение секретолитических и спазмолитических препаратов, проведение коррекции билиарной дисфункции, полиферментной заместительной терапии и коррекции МТК кишечника. Профессор В.Б. Гриневич акцентировал внимание участников симпозиума на неоднократно апробированном терапевтическом подходе, который заключается в использовании М3-холинолитика Бускопана (гиосцина бутилбромида) в качестве спазмолитического средства и для коррекции билиарного сладжа и билиарной недостаточности.
Что касается миоэлектрической активности ЖКТ, назначение Бускопана три раза в день способствует статистически значимому снижению тонуса желудка, ДПК и тощей кишки. Как следствие – увеличение функционального объема желудка и тощей кишки (рис. 5).
Бускопан существенно уменьшает симптомы дисфункции сфинктера Одди, причем частота и амплитуда сокращений значимо снижаются уже через 30 секунд после его приема.
Кроме того, Бускопан, обладая одновременным ганглиоблокирующим эффектом за счет связывания с никотиновыми рецепторами, оказывает физиологическое воздействие на секреторную функцию ЖКТ и селективно устраняет моторные нарушения его верхних отделов – ДПК и тощей кишки.
«Результаты наших исследований демонстрируют, что Бускопан работает на всем протяжении ЖКТ, оказывая секретолитическое и спазмолитическое воздействие, приводя к коррекции билиарного сладжа и билиарной недостаточности. Назначение Бускопана позволяет нормализовать микробно-тканевый комплекс кишечника», – пояснил профессор В.Б. Гриневич.
Билиарная недостаточность приводит к существенному качественному и количественному изменению кишечной микробиоты. В свою очередь нарушения функционального состояния МТК кишечника способствуют развитию и прогрессии билиарной недостаточности. По словам профессора В.Б. Гриневича, это означает, что практикующий врач должен использовать те методы воздействия на организм человека, которые «оптимально дружат» с микробно-тканевым комплексом ЖКТ.
Приближаемся ли мы к пониманию патогенеза СРК?
Как отметил профессор 2-й кафедры терапии Военно-медицинской академии им. С.М. Кирова, д.м.н. Евгений Иванович САС, ДНК клеток нашего организма на 90% совпадает с микробной ДНК, а количество генетического кода микробной ДНК в 200 раз превышает таковое в человеческой ДНК. Поэтому нельзя исключать влияние микробиоты на формирование и течение патологических процессов в организме.
Согласно современным представлениям СРК – биопсихосоциальное заболевание, в основе развития которого лежат центральные и периферические патофизиологические механизмы, где одна из ключевых ролей принадлежит изменению кишечного микробиома. В центре внимания исследователей находятся выраженные нейроэндокринно-иммунные повреждения, которые возникают после инфекционных заболеваний и приводят к развитию рецепторно-двигательной дисфункции. Как известно, СРК начинает формироваться еще в детском возрасте. У детей, перенесших какие-либо кишечные инфекции, СРК развивается в два раза чаще, чем у тех, кто подобными заболеваниями не страдал.
По словам докладчика, у пациентов с СРК микробиота отличается от микробиоты здорового человека прежде всего функциональной активностью. Изменение кишечного микробиома реализуется повышенной проницаемостью слизистой оболочки кишечника, повышением уровня провоспалительных цитокинов и развитием хронического системного воспаления в собственной пластине слизистой оболочки толстой кишки.
Изменение кишечной микробиоты приводит к изменению спектра ЖК: повышается уровень первичных ЖК (коррелирующих с частотой стула) и снижается уровень вторичных ЖК. Таким образом, дисбиотические изменения способствуют нарушению гепатоэнтеральной циркуляции ЖК, что в свою очередь усиливает выраженность дисбиотических нарушений.
Профессор Е.И. Сас привел последние данные о влиянии изменений кишечной микробиоты на сенсибилизацию энтеральной нервной системы, пищевую непереносимость и пищевые отравления. В целом изменение кишечного микробиома, повышение проницаемости слизистой оболочки кишечника, изменение спектра ЖК в кале, сенсибилизация энтеральной нервной системы, пищевая непереносимость и пищевые отравления формируют комплекс периферических патофизиологических механизмов развития СРК.
Основу центральных механизмов развития СРК составляет хрониостресс. Его следует рассматривать не как совокупность исключительно внешних воздействий, а как значимое нарушение гомеостаза организма. В то же время СРК считается независимым фактором риска, существенно повышающим вероятность развития состояния тревожности и депрессии. В настоящее время расшифрованы механизмы реализации церебральной морфокинетической функции микрофлоры кишечника: участие в метаболизме триптофана и синтезе нейротрансмиттеров, выработка нейротоксинов патогенной микрофлорой, воздействие метаболитов микрофлоры на развитие головного мозга.
Таким образом, изменение кишечного микробиома играет одну из значимых ролей в периферических и центральных патофизиологических механизмах формирования СРК.
Какими должны быть наиболее оптимальные подходы к ведению больных с СРК? Согласно методу так называемой терапевтической пирамиды (Treatment Pyramid) воздействие на периферические звенья с помощью спазмолитической терапии позволяет добиться положительного ответа у 40% пациентов с СРК, а в комбинации с антидепрессантами или поведенческими подходами – у 95%.
В соответствии с рекомендациями Национального института здравоохранения и клинического мастерства Великобритании 2008 г. (National Institute for Clinical Excellence – NICE) препарат Бускопан, эффективность которого в уменьшении симптомов боли доказана в ходе многочисленных исследований, считается препаратом первой линии в контроле симптомов у больных с СРК.
Лечение пациентов с СРК предусматривает длительный прием лекарственных средств. Именно поэтому важен их профиль безопасности. Бускопан характеризуется высоким профилем безопасности: частота побочных эффектов при терапии Бускопаном в рекомендованной дозе не превышает частоту побочных эффектов при приеме плацебо (таблица)10. По данным профессора Е.И. Саса, с 1992 г. в периодически обновляемых отчетах по безопасности (Periodic Safety Update Reporte) зафиксировано 194 млн эпизодов приема таблетированного Бускопана (в среднем в течение трех дней) и только в 48 случаях имели место побочные эффекты антихолинергической природы10. Высокая эффективность и безопасность делают Бускопан препаратом выбора при лечении СРК.
В свете детализации патогенеза СРК изменение кишечного микробиома является новой мишенью для традиционных групп препаратов. Коррекция нарушений микробиома предусматривает помимо гармонизации эмоционально-волевой сферы нивелирование секреторных и моторно-эвакуаторных расстройств всех органов пищеварения и воздействие на микрофлору кишечника, то есть комплексный подход к лечению пациентов с СРК. «В настоящее время в значительной степени необходимо пересмотреть традиционные терапевтические подходы к лечению пациентов с СРК. Предпочтение следует отдавать препаратам, обладающим доказанной эффективностью воздействия на все основные звенья патогенеза, в частности селективному М3-холинолитику Бускопану. Необходимо использовать и пребиотические средства», – пояснил профессор Е.И. Сас, завершая выступление.
Заключение
Согласно современным представлениям о патогенезе СРК в основе патофизиологических механизмов его развития лежит изменение кишечной микробиоты. В свете детализации патогенеза СРК предпочтение следует отдавать препаратам, обладающим доказанной эффективностью воздействия на все основные звенья патогенеза. К таким препаратам относится селективный М3-холинолитик Бускопан. Докладчики с позиции доказательной медицины продемонстрировали способность Бускопана статистически значимо снижать тонус желудка, ДПК и тощей кишки, быстро уменьшать симптомы дисфункции сфинктера Одди. Препарат характеризуется не только выраженным спазмолитическим, но и секретолитическим действием. Высокая эффективность и безопасность Бускопана делают его препаратом выбора в лечении пациентов с СРК.
1. Yang L., Lu X., Nossa C.W. et al. Inflammation and intestinal metaplasia of the distal esophagus are associated with alterations in the microbiome // Gastroenterology. 2009. Vol. 137. № 2. P. 588–597.
2. Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis // Clin. Gastroenterol. Hepatol. 2012. Vol. 10. № 7. P. 712–721.
3. Halmos E.P., Power V.A., Shepherd S.J. et al. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome // Gastroenterology. 2014. Vol. 146. № 1. P. 67–75.
4. Biesiekierski J.R., Newnham E.D., Irving P.M. et al. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial // Am. J. Gastroenterol. 2011. Vol. 106. № 3. P. 508–514.
5. Ford A.C., Talley N.J., Spiegel B.M. et al. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: systematic review and meta-analysis // BMJ. 2008. № 337. P. a2313.
6. Brandt L.J., Chey W.D., Foxx-Orenstein A.E. et al. Аn evidence-based position statement on the management of irritable bowel syndrome // Am. J. Gastroenterol. 2009. Vol. 104. Suppl. 1. P. S1–35.
7. Mueller-Lissner S., Tytgat G.N., Paulo L.G. et al. Placebo- and paracetamol-controlled study on the efficacy and tolerability of hyoscine butylbromide in the treatment of patients with recurrent crampy abdominal pain // Aliment. Pharmacol. Ther. 2006. Vol. 23. № 12. P. 1741–1748.
8. Corazziari E., Shaffer E.A., Hogan W.J. et al. Functional disorders of the biliary tract and pancreas // Gut. 1999. Vol. 45. Suppl. 2. P. II48–54.
9. Gribble F., Habib A., Parker H. et al. Stimulus-secretion Coupling Mechanisms in Intestinal Enteroendocrine Cells. Cambridge Institute for Medical Research, UK Digestive Disease Week 2012.
10. Tytgat G.N. Hyoscine butylbromide: a review of its use in the treatment of abdominal cramping and pain // Drugs. 2007. Vol. 67. № 9. P. 1343–1357.
Новости на тему
09.09.2022 01:00:00
29.03.2022 12:04:00
09.03.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.