Острое отравление парацетамолом (Ацетаминофеном) у детей
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – изучить клинические проявления и лабораторные показатели при остром отравлении парацетамолом у детей.
Материал и методы. Проведена клиническая оценка состояния больных, проанализированы анамнестические данные. Лабораторные методы исследования включали общий и биохимический анализы крови. Изучались кислотно-щелочное состояние, международное нормализованное отношение. Химико-токсикологическое исследование мочи выполнено методом тонкослойной хроматографии.
Результаты. Острое отравление парацетамолом у детей развивается при одномоментном приеме препарата в дозе свыше 3 г. В первой фазе заболевания (10–11 часов после применения парацетамола) у больных имеют место нейросенсорные и общесоматические нарушения. Во второй фазе (12–24 часа) преобладают нарушения желудочно-кишечного тракта и поражения печени в виде острого гепатита легкой степени активности.
Цель исследования – изучить клинические проявления и лабораторные показатели при остром отравлении парацетамолом у детей.
Материал и методы. Проведена клиническая оценка состояния больных, проанализированы анамнестические данные. Лабораторные методы исследования включали общий и биохимический анализы крови. Изучались кислотно-щелочное состояние, международное нормализованное отношение. Химико-токсикологическое исследование мочи выполнено методом тонкослойной хроматографии.
Результаты. Острое отравление парацетамолом у детей развивается при одномоментном приеме препарата в дозе свыше 3 г. В первой фазе заболевания (10–11 часов после применения парацетамола) у больных имеют место нейросенсорные и общесоматические нарушения. Во второй фазе (12–24 часа) преобладают нарушения желудочно-кишечного тракта и поражения печени в виде острого гепатита легкой степени активности.
Гепатотоксичность лекарственных средств остается ведущей причиной развития острой печеночной недостаточности (ОПН) во многих странах мира. По данным регистра исследовательской группы, на отравление парацетамолом приходится почти 50% всех случаев ОПН в США и Великобритании [1, 2]. В США передозировка парацетамолом является основной причиной обращения в токсикологические центры (до 100 000 в год), более 56 000 вызовов неотложной помощи, 26 000 госпитализаций и ежегодной причиной почти 450 летальных исходов в результате ОПН [3–5].
Парацетамол (Ацетаминофен) относится к ненаркотическим обезболивающим/жаропонижающим средствам, выпускается отдельно или входит в состав комбинированных лекарственных препаратов [6]. Впервые парацетамол синтезирован в 1893 г. В 1955 г. препарат был представлен для клинического применения и стал широко использоваться практически во всем мире. Сведения о гепатотоксичности парацетамола впервые появились в 1960-х гг. В силу легкой доступности и отсутствия необходимости в предписании врача парацетамол стал одним из самых распространенных препаратов, используемых в суицидальных целях. Возможно и случайное отравление при передозировке препарата вследствие неконтролируемого самолечения или медицинской ошибки [7].
К факторам риска возникновения токсических эффектов при приеме парацетамола относятся хронические заболевания печени, сердечно-сосудистая недостаточность, прием алкоголя, беременность, белково-энергетическая недостаточность, голодание, прием препаратов-индукторов микросомальных печеночных ферментов (барбитураты, аминазин, карбамазепин, изониазид и др.). В результате индукции микросомальных ферментов печени ускоряется метаболизм парацетамола, что способствует увеличению общего количества токсических метаболитов. Если от передозировки парацетамолом смертность от ОПН составляет 60%, то при предшествующем приеме препаратов-индукторов она может достигать 98% [8]. Голодание замедляет образование различных антиоксидантов, прежде всего глутатиона, уменьшает запасы гликогена, индуцирует CYP2E1, снижает интенсивность образования глюкуронилтрансферазы, что приводит к нарушению связывания препарата, его окислению и детоксикации [9].
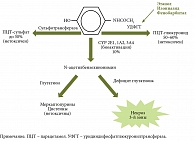
Парацетамол метаболизируется в печени за счет глюкуронидной и сульфатной конъюгации (до 80%). В незначительном объеме парацетамол посредством микросомальных ферментов системы цитохрома Р450 превращается в высокореактивное производное N-ацетил-р-бензохинонимин (N-acetyl-p-benzoquinoneimine – NAPQI) (рис. 1). Глутатион быстро обезвреживает это вещество, преобразуя его в цистеиновый или меркаптуриновый конъюгат. Прием высокой дозы препарата вызывает насыщение сульфатного и глюкуронидного путей метаболизации и повышение количества его токсичного производного – NAPQI. При уменьшении содержания глутатиона ниже критического уровня (примерно 30% нормального запаса) NAPQI ковалентно связывается с макромолекулами гепатоцитов, митохондриальными белками, обусловливая некроз ткани печени.
Для взрослых пациентов рекомендуемая максимально безопасная доза парацетамола ≤ 4 г в день, для детей – 60 мг/кг. Парацетамол характеризуется прямым дозозависимым гепатотоксичным эффектом. Поэтому разовые дозы свыше 7–10 г у взрослых и 150 мг/кг у детей способны вызвать выраженный гепатоцеллюлярный некроз. Показано. что дозы 15 г/сут у взрослых и 200 мг/кг у детей приводят к летальному исходу в 80% случаев [10]. В свою очередь у пациентов с алкогольной зависимостью суточная доза 2–6 г ассоциирована с летальной гепатотоксичностью [11].
По данным литературы, значительное повреждение гепатоцитов парацетамолом у детей встречается сравнительно реже, чем у взрослых, и возникает в 10% случаев при приеме потенциально токсичных доз препарата [12].
Клинические признаки гепатотоксичности парацетамола можно разделить на четыре фазы [8, 13]. Первая фаза наступает в течение нескольких часов после приема препарата. Для нее характерны общие симптомы (недомогание, повышенное потоотделение, тахикардия, иногда сосудистый коллапс, сонливость) и гастроинтестинальные (боль в животе, тошнота, рвота). Функциональные тесты печени показывают слабое повышение уровня аминотрансфераз – аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) примерно через 12 часов после применения препарата. Вторая фаза – от 24 до 48 часов после приема парацетамола. В течение этого периода пациенты могут чувствовать себя удовлетворительно, симптомы нередко отсутствуют. У ряда пациентов уровень трансаминаз продолжает повышаться. Третья фаза развивается через два – пять дней при тяжелом поражении печени. Помимо гастроинтестинальных симптомов для нее характерны печеночная энцефалопатия, летаргия, желтуха, темный цвет мочи, коагулопатия, метаболический ацидоз с развитием полиорганной недостаточности, приводящей к летальному исходу. Четвертая фаза – восстановление, которое наступает на пятый – десятый день после приема парацетамола.
Цель исследования – изучить клинические проявления и лабораторные показатели при остром отравлении парацетамолом у детей.
Материал и методы
Для решения поставленной задачи нами проведен анализ историй болезни (форма № 003/у) 20 детей (12 девочек и 8 мальчиков) в возрасте от 11 до 17 лет 11 месяцев с острым отравлением парацетамолом (Т39.1 по Международной классификации болезней 10-го пересмотра), находившихся на лечении в отделении токсикологии Детской городской клинической больницы № 13 им. Н.Ф. Филатова. При поступлении в отделение выполнялись клиническая оценка состояния больных, анализ анамнестических данных и лабораторные исследования. Клинический анализ крови проводили на гематологическом анализаторе ADVIA-2120 Bayer HealthCare LLC. При исследовании биохимических показателей крови и международного нормализованного отношения (МНО) использовали биохимический автоматический анализатор AU680. Кислотно-основное состояние оценивали с помощью анализатора кислотно-щелочного и газового состава крови ABL 800 FLEX. У всех пострадавших диагноз отравления был подтвержден результатами химико-токсикологического исследования мочи методом тонкослойной хроматографии. При статистической обработке данных применяли пакет программ STATISTICA 7.0. Количественные показатели представлены в виде медианы, 25-го и 75-го процентиля.
Результаты исследования
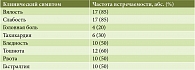
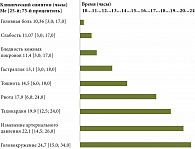
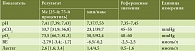
При анализе анамнестических данных, полученных при осмотре пострадавших в результате отравления парацетамолом, установлено, что экспозиция яда в организме в среднем составила 11,0 [3,0; 17,0] часа. В 60% случаев состояние детей при поступлении в отделение оценивалось как среднетяжелое, в 20% случаев – тяжелое. При этом у детей, поступивших в отделение в тяжелом состоянии, отмечалась более длительная экспозиция яда (от 20 до 45 часов). Доза принятого парацетамола составила от 5 до 20 г. Частота встречаемости клинических симптомов отравления парацетамолом представлена в табл. 1. Как видим, у 85% больных имели место жалобы на слабость, общее недомогание, вялость. В 60% случаев регистрировались тошнота, позывы на рвоту, в 50% – бледность кожных покровов, болезненность при пальпации в эпигастральной области, рвота. Динамика основных токсических эффектов парацетамола показана на рис. 2.
В начальной стадии отравления (спустя 10–11 часов от момента приема парацетамола) у больных отмечались первые клинические проявления заболевания в виде нейросенсорных и общесоматических нарушений (головная боль, слабость, бледность кожных покровов). Через 12–17 часов в клинической картине заболевания доминировали признаки повреждения желудочно-кишечного тракта: тошнота, многократная рвота, болевой синдром в правом подреберье и эпигастральной области.
При более длительной экспозиции яда (19–45 часов) у тяжелых больных отмечались тахикардия от 90 до 122 ударов в минуту и снижение артериального давления (систолического с 80 до 50 мм рт. ст.).
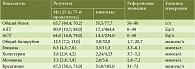
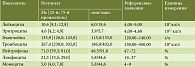
В таблице 2 приведены результаты исследования биохимических показателей крови в первые 12–24 часа от момента поступления больных в отделение токсикологии. Как видно из табл. 2, в отделении у детей отмечалось повышение уровня печеночных трансаминаз. Содержание АЛТ в плазме крови в среднем достигало 80,9 [10,7; 98,0] Ед/л. В 15% случаев уровень АЛТ в сыворотке крови превышал нормальные значения в 6–8 раз, достигая максимального значения 464,4 Ед/л. Уровень АСТ также превышал нормальные значения и в среднем составлял 64,4 [16,0; 78,0] Ед/л, максимальные значения при этом отмечались на уровне 234 Ед/л.
У 15% пациентов отмечалось увеличение уровня общего билирубина свыше 26 мкмоль/л. При этом необходимо отметить, что в анамнезе у таких детей имело место наследственное заболевание, связанное с дефектом гена, участвующего в обмене билирубина (синдром Жильбера). Кроме того, у 25% детей с острым отравлением парацетамолом наблюдались умеренная гипергликемия (не более 12 ммоль/л) и снижение уровня холестерина от 3 до 2,2 ммоль/л. Уровень МНО у всех детей находился в пределах референсных значений и в среднем составлял 1,05.
При исследовании кислотно-основного состояния у 55% пострадавших отмечалось увеличение уровня лактата свыше 1,9 ммоль/л (табл. 3). У тяжелых больных с выраженными клиническими проявлениями заболевания наблюдался метаболический ацидоз.
При исследовании клинического анализа крови в первые сутки заболевания существенных изменений в показателях не выявлено (табл. 4). Однако у 30% больных уже в первые 24 часа заболевания регистрировалась активация неспецифических механизмов фагоцитарной защиты в виде нейтрофильного лейкоцитоза.
На фоне комплексной терапии, предусматривавшей промывание желудка, очищение кишечника (очистительные клизмы), гастроэнтеросорбцию (прием активированного угля за 30–40 минут до начала проведения специфической антидотной терапии), специфическую антидотную терапию N-ацетилцистеином, форсированный диурез с ощелачиванием плазмы крови, отмечались купирование симптомов интоксикации и нормализация биохимических показателей к пятому – седьмому дню после острого отравления парацетамолом. Дети выписаны домой под наблюдение педиатра и гастроэнтеролога по месту жительства.
Заключение
Результаты проведенного нами исследования показали, что у детей старше 11 лет острое отравление парацетамолом развивается при одномоментном приеме препарата в дозе свыше 3 г. В зависимости от клинического течения можно выделить две фазы заболевания. Первая развивается в течение 10–11 часов с момента приема парацетамола. Как правило, у больных выявляются нейросенсорные и общесоматические нарушения. В ряде случаев клинические проявления интоксикации впоследствии не развиваются. Во второй фазе заболевания (12–24 часа) имеют место нарушения желудочно-кишечного тракта в виде болевого синдрома, тошноты, рвоты и поражения печени с развитием гепатоцеллюлярного гепатита.
Таким образом, все пациенты после приема токсических доз парацетамола нуждаются в экстренной госпитализации для проведения специфической детоксикационной терапии под контролем биохимических показателей крови независимо от степени выраженности клинических проявлений.
Конфликт интересов: авторы статьи подтвердили отсутствие конфликта интересов и финансовой поддержки исследования, о которых необходимо сообщить.
L.A. Kovalenko, M.G. Ipatova, D.M. Dolginov, I.I. Afukov
Russian Medical Academy of Continuing Professional Education
N.F. Filatov Children’s City Clinical Hospital № 13
Pirogov Russian National Research Medical University
Contact person: Liliya Anatolyevna Kovalenko, lyla72@mail.ru
Drug liver damage is a rare but life-threatening phenomenon. Paracetamol belongs to the category of drugs with direct dose-dependent hepatotoxic effect is paracetamol.
The purpose of the study. To study the clinical manifestations and laboratory parameters in acute paracetamol poisoning in children.
Material and methods. Clinical assessment of patients' condition was carried out, anamnestic data were analyzed. Laboratory methods included general and biochemical blood tests. Studied the acid-base state, international normalized ratio. Chemical-toxicological examination of urine was performed by thin-layer chromatography method.
Results. Acute paracetamol poisoning in children develops when a single drug administration at a dose more than 3 g. In the first phase of the disease (10–11 hours after using of paracetamol) patients have the somatic and neurosensory disorders. In the second phase (12–24 hours), the gastrointestinal tract disorders and liver damage in the form of acute hepatitis of mild activity predominate.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.