Гиперпаратиреоз при хронической болезни почек
- Аннотация
- Статья
- Ссылки
- English
Введение
Постоянное совершенствование нефропротективной стратегии и методов диализной терапии позволило существенно улучшить прогноз при хронической болезни почек (ХБП). Однако прогрессирование осложнений ХБП – артериальной гипертонии и связанных с ней сердечно-сосудистых заболеваний, анемии, минерально-костных нарушений – продолжает существенно влиять на медико-социальную реабилитацию и выживаемость больных. Следует отметить, что в лечении таких серьезных осложнений ХБП, как анемия и артериальная гипертония, уже достигнуты определенные успехи, в связи с чем клиницисты сосредоточились на решении другой проблемы – минерально-костные нарушения при ХБП.
Понятие минерально-костной болезни, сопутствующей ХБП, было введено в 2006 г. в Инициативе по улучшению глобальных исходов заболеваний почек (Kidney Disease Improving Global Outcomes, KDIGO). Эта патология представляет собой системное нарушение минерального и костного обмена, которое проявляется одним или комбинацией следующих отклонений:
- изменением концентрации в крови паратиреоидного гормона (ПТГ), кальция, фосфора или витамина D;
- нарушением обновления и минерализации костной ткани;
- развитием кальциноза сосудов или других мягких тканей.
Минерально-костная болезнь, сопутствующая ХБП, – это многофакторное и прогрессирующее заболевание, наиболее ярким, распространенным и тяжелым вариантом течения которого является вторичный гиперпаратиреоз.
Эпидемиология
Судить о распространенности вторичного гиперпаратиреоза в диализных центрах, в том числе отечественных, достаточно сложно. Во-первых, это связано с тем, что ведущие в этой области мировые эксперты рекомендуют для больных с ХБП различные целевые уровни в крови ПТГ, кальция и фосфора (табл. 1) (Инициатива качественного контроля последствий заболевания почек (Kidney Disease Outcomes Quality Initiative, KDOQI, и KDIGO) [1–3]. Во-вторых, в России в отдельных диализных центрах динамическое определение этих биохимических маркеров минерально-костных нарушений (главным образом ПТГ) затруднено.
Согласно рекомендациям KDIGO [2], распространенность вторичного гиперпаратиреоза среди пациентов с ХБП III–V стадий составляет 32%, среди пациентов, получающих лечение программным гемодиализом, – 34%, среди пациентов, получающих лечение перитонеальным диализом, – 18%. Проведенный нами анализ частоты и тяжести вторичного гиперпаратиреоза в популяции больных, получающих заместительную почечную терапию гемодиализом и перитонеальным диализом в нескольких центрах Московской области, свидетельствует о достаточно высокой распространенности заболевания – до половины всех больных нуждаются в профилактике развития и лечении гиперпаратиреоза, из них 6–21% страдают тяжелым вторичным гиперпаратиреозом (табл. 2).
В последнее десятилетие появились сообщения о снижении распространенности вторичного гиперпаратиреоза. Это представляется вполне обоснованным и может быть связано с несколькими моментами. Во-первых, как известно, плазменная концентрация ПТГ находится в обратной зависимости от возраста больных (по нашим данным, r = -0,235, р = 0,016). В настоящее время наблюдается «постарение» диализной популяции (медиана возраста больных, начинающих диализ в Европе, составляет 65–71 год, медиана возраста больных, получающих гемодиализ и перитонеальный диализ в нашем центре, – 48–53 года). Во-вторых, важную роль сыграло совершенствование диализной терапии, которая приближается к выполнению все большего объема функций нативных почек. Наконец, в-третьих, немаловажным стало появление новых лекарственных препаратов, воздействующих на различные звенья патогенеза вторичного гиперпаратиреоза.
Патогенез
Состояние околощитовидных желез тесно связано с функцией почек – и те и другие принимают участие в метаболизме кальция и фосфора. Секретируемый в околощитовидных железах ПТГ имеет несколько органов-мишеней:
- почки – уменьшает экскрецию кальция с мочой, оказывает фосфатурический эффект и увеличивает продукцию кальцитриола;
- костная система – участвует в ее обновлении путем высвобождения необходимого количества кальция и фосфора;
- тонкий кишечник – способствует усвоению диетарного кальция, поддерживая его гомеостаз.
Согласно классическому представлению, патогенетическими механизмами вторичного гиперпаратиреоза при ХБП являются:
- снижение синтеза активной формы витамина D (кальцитриола);
- гипокальциемия;
- задержка в организме неорганического фосфата;
- аномальный кальциемический ответ кости на действие ПТГ.
Развитие ХБП (уменьшение массы функционирующих нефронов) и некоторые другие причины (нутриционный дефицит и потеря с мочой витамина D, метаболический ацидоз и др.) приводят к возникновению дефицита образующегося в проксимальных канальцах нефрона активной формы витамина D (кальцитриола). Дефицит кальцитриола, в свою очередь, с одной стороны, ограничивает активацию специфических рецепторов (витамин-D-чувствительных), расположенных на мембранах главных клеток (паратироцитов) околощитовидных желез, а с другой – индуцирует гипокальциемию за счет снижения всасывания кальция в кишечнике. И недостаточная активация витамин-D-чувствительных рецепторов, и гипокальциемия стимулируют секрецию ПТГ, а также вызывают развитие гиперплазии паратироцитов и гипертрофии околощитовидных желез. Снижение функции почек приводит к положительному балансу в обмене фосфора, но повышение синтеза ПТГ какое-то время обеспечивает нормальный уровень фосфора в крови. Прогрессирование ХБП сопровождается гиперфосфатемией, которая стимулирует секрецию ПТГ как напрямую, так и опосредованно – через реципрокно развивающуюся гипокальциемию. Существует еще один патогенетический механизм вторичного гиперпаратиреоза – нечувствительность костей скелета к кальциемическому действию ПТГ, которая может быть следствием все той же гиперфосфатемии, а также дефицита кальцитриола и накопления свойственных ХБП токсических метаболитов. Высказывается предположение, что при ХБП V стадии скорость костной резорбции уже максимальна, в силу чего воздействие на скелет даже очень высоких концентраций ПТГ ослаблено, или наоборот – функциональная активность остеоцитов при ХБП V стадии подавлена. Таким образом, дефицит кальцитриола, снижение в крови уровня кальция, гиперфосфатемия и аномальный кальциемический ответ кости на действие ПТГ – вот хорошо известные факторы, ответственные за развитие вторичного гиперпаратиреоза при ХБП [4, 5].
Однако классическая схема патогенеза вторичного гиперпаратиреоза оставляла некоторые неясные моменты. Так, например, оказалось, что экскреция большей, чем в норме, фракции профильтрованного в почках фосфата – характерная черта почечной недостаточности, возникающая главным образом из-за высокого уровня ПТГ, – может иметь место и в отсутствие околощитовидных желез. При умеренно выраженной ХБП содержание в плазме кальцитриола было в пределах нормы, а у детей с легким тубулоинтерстициальным поражением почек определялся значительный его дефицит, характерный для тяжелого течения ХБП. Наконец, увеличение уровня в крови ПТГ выявляется намного раньше (ХБП II стадии), чем развивающаяся гиперфосфатемия (ХБП IV и V стадии). По-видимому, этиологические механизмы развития вторичного гиперпаратиреоза при ХБП могут быть неодинаковы у разных больных [4].
Дальнейшие исследования в области вторичного гиперпаратиреоза привели к новым открытиям – фактора роста фибробластов 23 (fibroblast growth factor-23, FGF-23) и трансмембранного протеина Клото. FGF-23 – гормональный пептид, синтезируемый в костных клетках; его эффекты реализуются через связывание с корецептором Kлото. Точкой приложения FGF-23 являются, прежде всего, почки, где он уменьшает реабсорбцию фосфора, увеличивая его мочевую экскрецию, и ингибирует фермент 1-альфа-гидроксилазу, подавляя синтез кальцитриола. Кроме того, FGF-23 напрямую участвует в регуляции синтеза ПТГ через рецепторы в околощитовидных железах. Увеличение продукции FGF-23 начинается на ранних стадиях ХБП в ответ на положительный баланс фосфора и длительно препятствует развитию гиперфосфатемии. При этом развивающийся дефицит кальцитриола, индуцируемый гиперпродукцией FGF-23, способствует развитию гиперпаратиреоза за счет ослабления геномных механизмов контроля синтеза ПТГ. Прогрессирование ХБП, приводящее к дефициту почечной экспрессии трансмембранной формы белка Клото, способствует формированию резистентности к действию FGF-23 и возникновению стойкой гиперфосфатемии.
Гиперсекреция ПТГ, пролиферация, диффузная и поликлональная гиперплазия клеток околощитовидных желез, развивающиеся у больных с ХБП, на начальном этапе выполняют компенсаторную функцию, направленную на поддержание гомеостаза минерального и костного метаболизма. Со временем формируется моноклонально-нодулярная гиперплазия околощитовидных желез и развивается неконтролируемый вторичный гиперпаратиреоз. Однако нодулярная гиперплазия возникает не во всех околощитовидных железах и не у всех больных с ХБП, поэтому предположение об участии генетических механизмов в патогенезе вторичного гиперпаратиреоза представляется вполне закономерным [6].
Клинические проявления
В соответствии с современной точкой зрения, ПТГ, секретируясь в повышенном количестве, становится «универсальным уремическим гормоном», вызывающим каскад системных эффектов при ХБП (табл. 3). Таким образом, у больных с ХБП развитие вторичного гиперпаратиреоза вызывает полиорганную дисфункцию. Однако следует помнить, что и сама ХБП создает сложную биохимическую ситуацию, поэтому вполне возможно, что не один, а несколько факторов могут оказаться ответственными за возникновение того или иного клинического симптома.
Наиболее серьезные проявления вторичного гиперпаратиреоза – поражение костей и сосудистая кальцификация. Классическое поражение костной ткани представлено фиброзно-кистозным остеитом. Повышенный в крови уровень ПТГ активизирует остеокласты, приводя к кортикальной и лакунарной резорбции. Образующиеся костные полости заполняются остеобластами, синтезирующими коллаген. В результате нарушенного костного метаболизма формируется неорганизованная кость со сниженной механической плотностью.
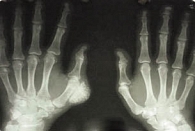
К рентгенологическим признакам фиброзно-кистозного остеита относятся повышение прозрачности костной ткани (остеопороз), диффузная матовость поверхности (симптом «матового стекла»), неравномерная плотность костной ткани (чередующиеся участки повышенной резорбции и склероза – симптом «соль и перец») в плоских костях (например, черепа), истончение, субпериостальная резорбция, продольная исчерченность кортикального слоя («разволокненность»), остеолиз ногтевых бугристостей, кистовидные просветления, кисты («коричневые» опухоли), деформация тел позвонков, патологические костные переломы (рис. 1). В таблице 4 представлены результаты анализа рентгенографии кистей и позвоночника 54 больных на перитонеальном диализе, отражающие распространенность указанных признаков.
Еще одним характерным проявлением костной патологии при вторичном гиперпаратиреозе является снижение минеральной плотности костной ткани, определяемое методом двухэнергетической рентгеновской абсорбциометрии. Следует подчеркнуть, что информативность данного метода существенно возрастает в рамках динамического наблюдения. Наш опыт показывает, что формирование остеопенического синдрома чаще и в большей степени наблюдается в дистальном отделе предплечья и проксимальном отделе бедра, то есть в костях с кортикальной структурой (табл. 5). Снижение минеральной костной массы при вторичном гиперпаратиреозе – важнейший фактор риска возникновения костных переломов (по нашим данным, относительный риск составил 3,8).
Другим серьезным проявлением вторичного гиперпаратиреоза является артериальная кальцификация. Характерная особенность этого вида кальцификации – отложение солей кальция в средней оболочке (медии) артерий различного калибра. Исследования убедительно демонстрируют тесную связь между уровнем в крови ПТГ и выраженностью артериальной кальцификации. Так, средний индекс кальцификации коронарных артерий у гемодиализных больных составил 625, 866, 1203 и 1873 ед. Хаунсфилда соответственно при уровне ПТГ у них 0–150, 150–300, 300–600 и > 600 пг/мл [7]. Кальцификация медии артерий (медиакальциноз, склероз Менкеберга) чреват развитием сосудистой ригидности, увеличением скорости распространения пульсовой волны, коронарной гипоперфузией и сердечной патологией (гипертрофия миокарда левого желудочка, диастолическая дисфункция, сердечная недостаточность), а как известно, сердечно-сосудистые причины занимают ведущее место (40–50%) среди причин смерти диализных пациентов. К редкой, но тяжелой форме кальцификации медии мелких артерий и артериол кожи и подкожной клетчатки относится феномен кальцифилаксии. Окклюзирующая пролиферация медии мелких артерий и артериол кожи, связанная с развитием в них тромбоза, приводит к ишемическому поражению кожи.
Кроме артерий кальцификаты могут образовываться в коже, сердце, легких, суставах и других органах (висцеральная кальцификация), вызывая разнообразную клинико-лабораторную симптоматику (рис. 2). Например, кальцификация сердечных клапанов опасна развитием пороков сердца и сердечной недостаточности, нарушением сердечного ритма и проводимости, а также повышает риск инфекционного эндокардита. У наблюдаемых нами больных с тяжелым вторичным гиперпаратиреозом, подвергшихся паратиреоидэктомии (ПТЭ), частота обнаружения кальцификатов в стенке аорты, подклапанных структурах и фиброзном кольце митрального и/или аортального клапанов сердца, по данным эхокардиографии, составила 75%.
Диагностика
Информативным диагностическим критерием вторичного гиперпаратиреоза следует считать повышенный уровень в крови ПТГ. У больных с ХБП для обеспечения нормального процесса ремоделирования кости требуется более высокий уровень ПТГ, чем в физиологических условиях, поэтому целевые значения гормона были установлены в зависимости от состояния функции почек (табл. 1).
Как показали наши исследования, колебания показателей кальций-фосфорного обмена при вторичном гиперпаратиреозе носят разнонаправленный характер (табл. 6). Уровень сывороточного кальция либо находится в пределах целевых значений, либо имеет тенденцию к снижению. Гиперкальциемия – облигатный критерий первичного гиперпаратиреоза – даже при тяжелом течении вторичного гиперпаратиреоза встречается довольно редко. Так, из наблюдаемых нами 48 больных с тяжелым течением гиперпаратиреоза, подвергшихся ПТЭ, гиперкальциемию (сывороточная концентрация кальция 2,6–2,7 ммоль/л) имели всего лишь 7. Важно помнить, что гиперкальциемия у больных с ХБП может быть обусловлена не только вторичным гиперпаратиреозом, но и приемом кальцийсодержащих фосфатсвязывающих препаратов, синтетических аналогов активной формы витамина D, а также онкологическими заболеваниями. Напротив, гиперфосфатемия при вторичном гиперпаратиреозе наблюдается часто. Гиперфосфатемия обусловлена либо недостаточной коррекцией обмена фосфора при снижении функции почек или проведении диализа, тогда она инициирует развитие и прогрессирование вторичного гиперпаратиреоза, либо, при далеко зашедшем вторичном гиперпаратиреозе, причиной гиперфосфатемии является поступление фосфора из костной ткани.
Определение биохимических маркеров костного метаболизма у больных с вторичным гиперпаратиреозом в широкой клинической практике сегодня не проводится из-за сложности и дороговизны методов исследования. Но динамическая регистрация активности общей щелочной фосфатазы является информативным критерием присоединения расстройства костного метаболизма, а также тяжести вторичного гиперпаратиреоза (табл. 7). Об этом свидетельствует обнаруженная нами высокодостоверная прямая корреляционная зависимость между активностью общей щелочной фосфатазы и уровнем ПТГ (по нашим данным, r = 0,497, р = 0,0001), хотя известно, что источником повышения активности общей щелочной фосфатазы могут быть не только костная, но и другие ткани.
Важным этапом диагностического подтверждения вторичного гиперпаратиреоза является установление точной локализации патологически измененных (одной или нескольких) околощитовидных желез – так называемая топическая диагностика. По результатам нашего исследования, которые совпадают с данными и других специалистов, проводивших подобные исследования, информативность инструментальных методов визуализации околощитовидных желез, таких как ультразвуковое исследование (УЗИ), мультиспиральная компьютерная томография, радиоизотопная сцинтиграфия (99мТс-технетрил), однофотонная эмиссионная компьютерная томография, неоднозначна [8].
В действительности УЗИ околощитовидных желез при вторичном гиперпаратиреозе обладает высокой разрешающей способностью, которая может приближаться к абсолютной, при условии:
1) типичного расположения околощитовидных желез;
2) отсутствия сопутствующих заболеваний щитовидной железы;
3) выполнения исследования опытным, направленно подготовленным специалистом;
4) проведения цитологического анализа ткани, полученной в результате тонкоигольной аспирационной биопсии узлового образования.
Цитологический метод в диагностике вторичного гиперпаратиреоза информативен (структура клеток околощитовидных желез во время окраски и фиксации материала не изменяется, позволяет верифицировать пролиферативный процесс и определить функциональное состояние околощитовидных желез), экономичен и прост в выполнении (не требует специального оборудования, доступен в поликлинических условиях), малотравматичен (хорошо воспроизводим). Ткань гиперплазированной околощитовидной железы имеет строго очерченные цитологические особенности, которые четко контрастируют с таковыми ткани щитовидной железы. Основными цитоморфологическими отличиями околощитовидных желез являются полигональная форма и базофильная окраска цитоплазмы главных клеток эпителия (главные паратироциты), которые либо сгруппированы в розеткообразные структуры, либо образуют тяжи или компактные скопления (рис. 3). К частым цитологическим находкам относятся цитоплазматические грануляции в главных паратироцитах, представляющие, по-видимому, секреторные гранулы с ПТГ, к редким – обнаружение оксифильных паратироцитов и элементов жировой ткани.
Чувствительность и специфичность мультиспиральной компьютерной томографии околощитовидных желез часто сопоставимы с таковыми при УЗИ желез. Однако диагностическая ценность мультиспиральной компьютерной томографии возрастает при атипичном расположении околощитовидных желез.
По мнению многих исследователей, радиоизотопная сцинтиграфия (99мТс-технетрил), в том числе с однофотонной эмиссионной компьютерной томографией, является наиболее чувствительным методом топической диагностики околощитовидных желез. Однако анализ собственных данных не позволяет полностью согласиться с данной точкой зрения. При использовании этих методик, как правило, визуализируется одна, редко 2–3, по-видимому, наиболее функционально активные околощитовидные железы. Кроме того, радиоизотопная сцинтиграфия (99мТс-технетрил) и однофотонная эмиссионная компьютерная томография относятся к высокозатратным и сложно воспроизводимым диагностическим манипуляциям. Следовательно, на этапе подготовки к ПТЭ ни радиоизотопная сцинтиграфия (99мТс-технетрил), ни однофотонная эмиссионная компьютерная томография не являются обязательными визуализирующими методами обследования больных с ХБП. Показаниями для их выполнения могут быть:
1) отсутствие визуализации околощитовидных желез по данным УЗИ и/или мультиспиральной компьютерной томографии при наличии клинико-лабораторной симптоматики вторичного гиперпаратиреоза тяжелого течения, требующего выполнения ПТЭ (такая ситуация практически не встречается);
2) персистирующий или рецидивирующий вторичный гиперпаратиреоз после ПТЭ.
Однако даже в случае рецидива вторичного гиперпаратиреоза, как об этом свидетельствуют наши наблюдения, радиоизотопная сцинтиграфия (99мТс-технетрил) не всегда результативна.
При интраоперационной ревизии может обнаруживаться большее количество околощитовидных желез, чем при любом из описанных методов визуализации. Даже отсутствие визуализации околощитовидных желез не исключает необходимости проведения ПТЭ, показания к которой основываются на результатах клинико-лабораторно-инструментального обследования. Интраоперационная ревизия всех околощитовидных желез в зоне типичного и атипичного их расположения должна проводиться независимо от данных предоперационной топической диагностики.
В диагностическом плане определенный интерес представляет дифференциация аденомы (так называемый третичный гиперпаратиреоз) и гиперплазии околощитовидных желез при вторичном гиперпаратиреозе. Это связано с тем, что тактика лечения при этих двух состояниях принципиально различная: хирургическое лечение в первом случае и медикаментозное – во втором. Результаты проведенного нами ретроспективного исследования свидетельствуют о том, что до операции точная верификация третичного гиперпаратиреоза у больных с ХБП практически невозможна [9]. Специфические клинические и лабораторные критерии третичного гиперпаратиреоза весьма неопределенны. Косвенными, но необязательными факторами, определяющими развитие аденом околощитовидных желез, могут служить длительный почечный анамнез (наличие врожденной или наследственной нефропатии, длительное течение ХБП на додиализном этапе) и продолжительное проведение диализной терапии. Следует обращать особое внимание на гиперкальциемию, особенно если она стабильна и/или продолжает нарастать (с учетом приема кальцийсодержащих фосфатсвязывающих препаратов и аналогов активной формы витамина D). Необходим обязательный динамический анализ состояния костной системы (структуры и плотности костей) по данным рентгенографии и определение минеральной костной массы по данным двухэнергетической рентгеновской абсорбциометрии. В то же время при решении вопроса о хирургическом лечении вторичного гиперпаратиреоза точная дооперационная верификация аденомы околощитовидных желез не является обязательной.
Лечение
Терапевтическая тактика при вторичном гиперпаратиреозе – это комплексное воздействие на основные патогенетические механизмы заболевания:
а) снижение сывороточной концентрации фосфора путем ограничения поступления фосфора с продуктами питания, выбора адекватной диализной программы и использование фосфатсвязывающих препаратов;
б) коррекция гипокальциемии;
в) назначение медикаментозных средств, подавляющих синтез ПТГ в околощитовидных железах.
Поддержание целевой сывороточной концентрации фосфора является обязательным условием в программе профилактики развития и предупреждении прогрессирования вторичного гиперпаратиреоза. Однако соблюдение больными ХБП малофосфатной диеты, особенно на этапе диализной терапии, затруднено – во-первых, из-за необходимости приема достаточно высокой (не менее 1 г/кг) квоты белка в суточном рационе (а большая часть фосфора попадает в организм именно с белком), во-вторых, из-за низкой мотивации многих пациентов и, в третьих, из-за отсутствия реальной информации о содержании фосфора в тех или иных продуктах и напитках. Возможности диализной терапии в удалении фосфора из организма также оказались ограниченными. В процессе гемодиализа фосфор удаляется из крови в первые два часа процедуры, затем его сывороточная концентрация нарастает за счет поступления аниона из внутриклеточного пространства.
Для достижения целевого уровня фосфора в крови у больных с ХБП используют фосфатсвязывающие препараты. В диализной популяции доля пациентов, нуждающихся в постоянном приеме этих препаратов, высока и составляет в среднем 80%. Существует несколько классов фосфатсвязывающих препаратов, каждый из которых обладает как преимуществами, так и недостатками (табл. 8).
До недавнего времени российские пациенты имели возможность получать исключительно кальцийсодержащий фосфатсвязывающий препарат – кальция карбонат. В последние несколько лет ситуация существенно изменилась – появился отечественный кальция ацетат (Нефродин) и зарегистрировано лекарственное средство – севеламера гидрохлорид (Ренагель).
Фосфатсвязывающая способность кальция ацетата в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната. По мнению одних исследователей, эпизоды гиперкальциемии при использовании кальция ацетата встречаются реже, по мнению других – с той же частотой, что и при использовании кальция карбоната. Определенные надежды в вопросе коррекции гиперфосфатемии клиницисты связывают с появлением на российском фармацевтическом рынке севеламера гидрохлорида. Севеламер – это синтетический фосфатсвязывающий препарат, не содержащий кальция, который действует в тонком кишечнике, не всасывается и обладает высоким индексом связывания фосфатов, поступающих с пищей.
Важное место в лечебном процессе вторичного гиперпаратиреоза принадлежит современным лекарственным средствам, подавляющим гиперфункцию околощитовидных желез. К ним относятся:
- препараты активной формы витамина D – нативный витамин D (кальцитриол) и синтетические аналоги неселективного (альфакальцидол) и селективного (парикальцитол) действия, вызывающие активацию специфических рецепторов, расположенных на поверхности клеток околощитовидных желез (главных паратироцитов);
- кальцимиметик, оказывающий аллостерическую модуляцию кальцийчувствительных рецепторов, расположенных также на поверхности клеток околощитовидных желез (главных паратироцитов).
К настоящему времени накоплен большой опыт применения препаратов активной формы витамина D неселективного действия для лечения вторичного гиперпаратиреоза; этот опыт свидетельствует об обратном развитии под действием терапии как лабораторных, так и костных нарушений. Однако кроме околощитовидных желез органами-мишенями этих лекарственных средств являются тонкий кишечник, где увеличивается абсорбция потребляемых с пищей кальция и фосфора, и кости, в которых усиливаются резорбтивные процессы, поэтому риск возникновения гиперкальциемии и гиперфосфатемии при лечении препаратами активной формы витамина D неселективного действия достаточно высок. Кроме того, бесконтрольное их применение опасно развитием низкообменного заболевания костей – адинамической костной болезни [10–12].
Наши данные совпадают с наблюдениями других исследователей (табл. 9). У диализных больных неселективные аналоги активной формы витамина D эффективны для профилактики развития, а также лечения и предупреждения прогрессирования легкого и умеренно выраженного гиперпаратиреоза, не сопровождающегося гиперкальциемией и гиперфосфатемией. Регулярный прием этих препаратов приводит к нормализации кальциевого баланса, снижению и достижению целевого уровня ПТГ в крови, то есть оказывает патогенетическое воздействие. На этом фоне улучшается костный метаболизм, минимизируется потеря и происходит увеличение костной минеральной массы. Однако данному классу препаратов присущи побочные эффекты: гиперфосфатемия (встречается достаточно часто), гиперкальциемия и избыточное подавление функции околощитовидных желез (встречается реже) [13].
Стремление нивелировать нежелательные явления, свойственные неселективным препаратам активной формы витамина D, привело к созданию новой группы лекарственных средств, обладающих селективной активацией витамин-D-рецепторов, расположенных на поверхности главных клеток околощитовидных желез. Доклинические и клинические испытания показали: насколько эти препараты активны в отношении подавления секреции ПТГ, настолько они неактивны в отношении всасывания кальция и фосфора в кишечнике и резорбции их из костей. Среди селективных активаторов витамин-D-рецепторов наиболее широкое клиническое применение в лечении вторичного гиперпаратиреоза приобрел парикальцитол [14, 15].
Наш первый опыт по использованию парикальцитола сопоставим с данными опубликованных исследований. Он свидетельствует о перспективности применения парикальцитола для предупреждения прогрессирования и лечения вторичного гиперпаратиреоза у пациентов с целевыми параметрами кальций-фосфорного обмена. В отношении снижения ПТГ препарат не уступает по эффективности неселективным активаторам витамин-D-рецепторов, однако в отдельных случаях вызывает гиперфосфатемию и гиперкальциемию (табл. 9).
Несколько лет назад в арсенале клиницистов появился новый препарат с принципиально иным антигиперпаратиреоидным механизмом действия – цинакалцет. На сегодняшний день цинакалцет является первым и единственным кальцимиметиком, оказывающим универсальное воздействие на околощитовидные железы. Он вызывает аллостерическую модуляцию кальцийчувствительных рецепторов, расположенных на поверхности главных клеток, и тем самым снижает порог реакции этих рецепторов на внеклеточный кальций. Это обеспечивает регуляцию и точный контроль над секрецией ПТГ, что приводит к подавлению и обратному развитию гиперплазии околощитовидных желез. Первые исследования убедительно продемонстрировали способность цинакалцета не только снижать и длительно удерживать в целевом диапазоне уровень ПТГ в крови и параллельно контролировать состояние кальций-фосфорного обмена, но также улучшать прочность костной ткани и предупреждать развитие сосудистого и сердечного кальциноза [16–20].
Большой интерес в плане создания лечебного алгоритма вторичного гиперпаратиреоза представляют результаты двух крупных рандомизированных контролируемых исследований – EVOLVE (Evaluation of cinacalcet therapy to lower cardiovascular events – Оценка влияния терапии цинакалцетом на снижение риска сердечно-сосудистых осложнений) и BONAFIDE (Bone Histomorphometry Assessment For Dialysis Patients With Secondary Hyperparathyroidism of End Stage Renal Disease – Гистоморфометрическая оценка кости у пациентов на диализе с вторичным гиперапаратиреозом вследствие терминальной стадии болезни почек), полученные совсем недавно. Исследование EVOLVE доказало, что включение цинакалцета в лечебный алгоритм вторичного гиперпаратиреоза у диализных пациентов препятствует прогрессированию этого серьезного осложнения и уменьшает потребность в хирургическом лечении [21–23]. В исследование EVOLVE были включены 3883 пациента на гемодиализе со среднетяжелым и тяжелым вторичным гиперпаратиреозом, рандомизированных на прием цинакалцета/плацебо. Большинство пациентов принимали препараты активной формы витамина D и фосфатсвязывающие лекарственные средства, длительность наблюдения составила 64 месяца. За время наблюдения ПТЭ была выполнена 278 (14,4%) пациентам в плацебо-группе и 140 (7%) – в основной группе. Прогрессирование вторичного гиперпаратиреоза отмечено соответственно у 470 (24%) и у 240 (12%) пациентов; в плацебо-группе 443 (22,9%) пациента перешли на прием коммерческого цинакалцета. Таким образом, в группе цинакалцета по сравнению с плацебо-группой относительный риск ПТЭ составил 0,44 (95% 0,36–0,54), относительный риск перехода на прием коммерческого цинакалцета – 0,41 (95% 0,35–0,48), относительный риск прогрессирования вторичного гиперпаратиреоза с развитием гиперкальциемии – 0,43 (95% 0,37–0,50). Отсроченный статистический анализ показал, что в последующие 6 месяцев у пациентов, принимавших цинакалцет, потребность в ПТЭ была также на 10% меньше, чем в плацебо-группе (р = 0,03).
В другом многоцентровом открытом дескриптивном исследовании BONAFIDE, включившем больных с вторичным гиперпаратиреозом, получавших лечение диализом, через 1 год лечения цинакалцетом установлено уменьшение скорости костеобразования, выраженности остеофиброза, а также улучшение в целом гистологической картины костной ткани с нормализацией последней в 26% случаев [24].
Наши данные сопоставимы с результатами проведенных исследований. Они свидетельствуют о высокой эффективности и безопасности цинакалцета для лечения вторичного гиперпаратиреоза у больных ХБП V стадии, получающих заместительную почечную терапию (табл. 9) [25]. Препарат обеспечивает хороший и длительный контроль целевых уровней в крови ПТГ и фосфора, назначение же синтетических аналогов активной формы витамина D и карбоната кальция практически исключает развитие гипокальциемии. Удовлетворительный ответ на терапию цинакалцетом с минимальной встречаемостью нежелательных явлений надежнее при легком и среднетяжелом течении вторичного гиперпаратиреоза. Как показывает наше наблюдение, прогнозирование и достижение хорошего результата при тяжелых нарушениях костного и кальций-фосфорного метаболизма представляет определенные трудности. Таким пациентам требуется длительное титрование дозы препарата с установлением поддерживающей дозы и постоянная коррекция нежелательных явлений.
К отдельной, на наш взгляд важной, категории, демонстрирующей высокую эффективность цинакалцета, следует отнести пациентов с персистирующим и рецидивирующим вторичным гиперпаратиреозом после проведенной ПТЭ, у которых выполнение повторной операции может оказаться невозможным. Мы наблюдаем нескольких таких пациентов на протяжении 4 лет [26]. Наконец, наш первый опыт показывает, что цинакалцет обеспечивает длительное эффективное лечение третичного гиперпаратиреоза у реципиентов с удовлетворительно функционирующим почечным трансплантатом. Это позволяет избежать хирургического вмешательства, хотя у отдельных больных с нодулярной гиперплазией околощитовидных желез, по мнению авторов, клиническим эквивалентом которой при УЗИ служит диаметр железы более 1 см, может возникнуть резистентность к проводимой терапии цинакалцетом [27].
Таким образом, оба класса препаратов оказывают влияние на тот или иной патогенетический механизм вторичного гиперпаратиреоза при ХБП (табл. 10). Однако накопленные к настоящему времени клинические данные и собственная клиническая практика лечения вторичного гиперпаратиреоза у диализных больных и реципиентов почечного трансплантата, а также «широта» патогенетического воздействия позволяют прогнозировать более высокую потребность в цинакалцете.
Следует подчеркнуть, что основными принципами современной медикаментозной терапии вторичного гиперпаратиреоза являются:
- индивидуализация подхода к выбору алгоритма лечения;
- использование комбинированной терапии с включением лекарственных препаратов с различным механизмом действия и профилем безопасности.
При планировании схемы лечения вторичного гиперпаратиреоза у конкретного больного следует учитывать многие факторы. Среди них важную роль играют качество и адекватность диализа, уровень в крови маркеров костного метаболизма и кальций-фосфорного обмена, эффективность и стоимость лекарственных препаратов и др. Несмотря на выраженный антигиперпаратиреоидный эффект обоих классов лекарственных средств (активные метаболиты витамина D и кальцимиметики), реальное применение их представителей в виде монотерапии будет все-таки ограниченным.
Лекарственные средства активной формы витамина D неселективного и селективного действия могут быть использованы:
- для профилактики развития вторичного гиперпаратиреоза (при целевых или ниже целевых уровнях в крови кальция и фосфора);
- для лечения легкого и умеренно тяжелого вторичного гиперпаратиреоза (при целевом уровне в крови фосфора);
- для лечения третичного гиперпаратиреоза после успешной трансплантации почки в отсутствие гиперкальциемии;
- для проведения комбинированной терапии с цинакалцетом.
Показаниями для назначения цинакалцета служат:
- легкий, умеренно тяжелый и тяжелый вторичный гиперпаратиреоз на этапе диализной терапии;
- третичный гиперпаратиреоз после успешной трансплантации почки при наличии гиперкальциемии;
- планирование комбинированной терапии с лекарственными средствами активной формы витамина D.
Современный алгоритм лечения вторичного гиперпаратиреоза в диализной популяции в соответствии с целевыми значениями KDOQI и KDIGO диктует использование комбинации препаратов с различным механизмом действия. Проведение комбинированной терапии оптимально с точки зрения и клинической, и экономической эффективности, потому что обеспечит:
- усиление антигиперпаратиреоидного эффекта за счет различного лечебного действия препаратов;
- нивелирование нежелательных явлений каждого из препаратов;
- достижение максимального соотношения «эффективность/стоимость».
Последовательность назначения комбинации препаратов может быть разнообразной в зависимости от тяжести вторичного гиперпаратиреоза и расстройства кальций-фосфорного обмена. При отсутствии гиперфосфатемии лечение может начинаться с неселективных или селективных активаторов витамин-D-рецепторов, а при развитии гиперфосфатемии и/или гиперкальциемии дополняться цинакалцетом. Или, наоборот, при исходной не поддающейся коррекции гиперфосфатемии лечение начинают с цинакалцета; в случае развития стойкой гипокальциемии при условии достижения целевого значения фосфора назначаются активные формы витамина D (неселективные или селективные).
У некоторых больных современная патогенетическая медикаментозная терапия вторичного гиперпаратиреоза не позволяет полностью нормализовать кальций-фосфорный обмен и костный метаболизм. Такая ситуация наблюдается в случае трансформации диффузной гиперплазии околощитовидных желез в диффузно-узловую или узловую, и эти больные нуждаются в выполнении ПТЭ. К факторам риска выполнения ПТЭ относят длительность диализной терапии, молодой возраст, женский пол, принадлежность к белой расе, отсутствие диабета, внутривенное применение препаратов витамина D, некоторые сопутствующие заболевания, перенесенную пересадку почки и плазменный уровень ПТГ [28]. По данным этой же группы авторов, частота ПТЭ среди гемодиализных больных США на протяжении 10 лет (1992–2002) имела двухфазный характер изменения: она составила 11,6 на 1000 паценто-лет в 1992 г., уменьшилась до 6,8 на 1000 пациенто-лет в 1998 г. и вновь вернулась к первоначальному уровню – 11,8 на 1000 пациенто-лет – в 2002 г.
Единого мнения об абсолютных показаниях к ПТЭ при вторичном гиперпаратиреозе, в отличие от первичного, не сложилось. Специалисты обсуждают формирование третичного гиперпаратиреоза, прогрессирующее поражение скелета, развитие сосудистой и висцеральной кальцификации, возникновение кальцифилаксии. Наш опыт свидетельствует, что показания к хирургическому лечению при вторичном гиперпаратиреозе определяются при динамическом наблюдении и комплексной оценке клинической и лабораторной симптоматики. Клиническими критериями могут быть усиление костно-суставных болей, изменение походки, признаки сосудистой кальцификации («глазные» симптомы). Среди лабораторных критериев необходимо выделить стабильное повышение уровня ПТГ более 1000 пг/мл, гиперфосфатемию и стойкое повышение произведения «кальций × фосфор», нарастание активности щелочной фосфатазы в 2–3 раза, появление и прогрессирование костных нарушений по данным рентгенографии и двухэнергетической рентгеновской абсорбциометрии, а также неэффективность медикаментозной терапии.
В настоящее время используется несколько методов ПТЭ:
- субтотальная;
- тотальная;
- тотальная с аутотрансплантацией фрагмента наименьшей из околощитовидных желез в мышечную ткань;
- с билатеральной шейной тимэктомией.
К серьезным осложнениям послеоперационного периода относятся персистенция и рецидивирование вторичного гиперпаратиреоза. Причиной персистенции, то есть сохранения вторичного гиперпаратиреоза после выполненной ПТЭ, является как эктопическое в средостении или в другом месте расположение околощитовидных желез, так и не полный объем операции при типичной анатомической локализации желез. Возможность развития рецидива вторичного гиперпаратиреоза в отдаленные после ПТЭ сроки связана с продолжением диализной терапии и сохранением факторов риска возникновения данного осложнения ХБП. Основой – «субстратом» – рецидива вторичного гиперпаратиреоза могут быть оставленный после субтотальной ПТЭ или аутотрансплантированный в мышцу предплечья фрагмент околощитовидных желез, а также обнаруживаемые у некоторых диализных больных в жировой клетчатке, окружающей трахею, мелкие островки паратиреоидной ткани [29].
Встречаемость этих осложнений, согласно опубликованной информации, очень различается и зависит от методики ПТЭ. Так, по данным Эндокринологического научного центра, в целом частота рецидива гиперпаратиреоза после оперативного лечения составила 55,9%: после тотальной ПТЭ – 16,7%, тотальной ПТЭ с аутотрансплантацией фрагмента околощитовидных желез в мышцу предплечья (противоположного расположению артериовенозной фистулы) – 37,5%, субтотальной ПТЭ – 50% и неполной ПТЭ – 75–88,9% [30]. В то же время группа немецких авторов, проанализировавшая 606 ПТЭ, выполненных в период с 1976 по 2009 г. при вторичном гиперпаратиреозе, представила следующие данные: рецидив гиперпаратиреоза имел место после тотальной ПТЭ в 0%, тотальной ПТЭ с аутотрансплантацией фрагмента околощитовидных желез в мышцу предплечья (противоположного расположению артериовенозной фистулы) – в 5,4%, субтотальной ПТЭ – в 9,5% и неполной ПТЭ – в 6,1% случаев. Небольшая частота данного осложнения связана с особенностью хирургической тактики – авторы выполняли билатеральную шейную тимэктомию в случае тотальной ПТЭ с аутотрансплантацией фрагмента околощитовидных желез и в случае субтотальной ПТЭ. Ранее же проведенный анализ 461 ПТЭ, дополненных билатеральной шейной тимэктомией, показал, что почти у половины больных (44,5%) в ткани вилочковой железы обнаруживались околощитовидные железы: эктопированные – 38%, добавочные – 5,2% и сочетание тех и других – 1,3% [31, 32].
Лечебная тактика при персистирующем и рецидивирующем вторичном гиперпаратиреозе может быть различной. При сохранении тяжелого вторичного гиперпаратиреоза, определении точной локализации оставшейся околощитовидной железы и согласии пациента целесообразна повторная ПТЭ. В остальных случаях эффективна медикаментозная терапия с использованием неселективных и селективных активаторов витамин-D-чувствительных рецепторов (синтетических аналогов активной формы витамина D) и кальцимиметиков (цинакалцет).
Заключение
Таким образом, вторичный гиперпаратиреоз представляет собой серьезное с прогрессирующим течением осложнение ХБП, требующее постоянной настороженности врача, регулярного обследования пациентов в этом направлении и проведения профилактических и лечебных мероприятий с использованием современных средств для предупреждения развития и торможения прогрессирования данного заболевания.
Hyperparathyroidism in chronic kidney disease
O.N. Vetchinnikova
Moscow Regional Research Clinical Institute named after M.F. Vladimirsky
Contact person: Olga Nikolayevna Vetchinnikova, olg-vetchinnikova@yandex.ru
Mineral and bone disorder (MBD) associated with chronic kidney disease is a multifactorial progressive disease; secondary hyperparathyroidism is a most common and severe variant of MBD. The article addresses etiology, pathogenesis and clinical signs of secondary hyperparathyroidism. Advantages and limitations of instrumental diagnostic methods are discussed. Pathogenetic therapy of secondary hyperparathyroidism is aimed at the correction of calcium/phosphorus and bone metabolism and inhibition of hyperfunctioning of parathyroid glands.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.