Инфекция мочевой системы у детей: актуальные вопросы
- Аннотация
- Статья
- Ссылки
- English


Введение
Проблема инфекции мочевой системы (ИМС) у детей остается актуальной, несмотря на большое количество работ, посвященных изучению данного вопроса. Интерес к обозначенной проблеме связан прежде всего с высокой распространенностью заболевания и развитием тяжелых осложнений вплоть до сморщивания почек и формирования хронической почечной недостаточности, приводящих к инвалидизации детей [1, 2].
Ежегодные популяционные исследования свидетельствуют о неуклонном росте частоты ИМС в детской популяции. По данным Росстата, последние десять лет заболеваемость нефропатией у детей до 14 лет возросла в 1,6 раза, у подростков – в 2 раза [3]. У детей первых трех лет жизни указанная патология встречается чаще, чем острая респираторная инфекция [4–7]. У доношенных новорожденных с лихорадкой и нарушениями общего состояния ИМС наблюдается в 1,1–7% случаев [8].
Развитию заболеваний органов мочевой системы (ОМС) у детей раннего возраста способствует морфофункциональная незрелость почек, особенно на фоне обструктивной уропатии, инфекции, гипоксических состояний, предшествующих реанимационных мероприятий [9, 10].
Малосимптомность и неспецифичность клинических проявлений заболеваний почек и мочевыводящих путей у новорожденных и детей первых трех лет жизни затрудняют своевременную диагностику. Как следствие – хронизация процесса из-за позднего проведения адекватной терапевтической коррекции [11–13].
Трудности определения локализации патологического процесса, особенно у новорожденных и детей раннего возраста, стали причиной появления в отечественной и зарубежной литературе термина «инфекция органов мочевой системы» (ИОМС). Под ним понимается инфицированность и воспалительные изменения любых отделов мочевой системы без специального указания на ее уровень (мочевыделительный тракт или почечная паренхима) [9].
ИОМС – пиелонефрит, цистит, уретрит и асимптоматическая бактериурия – наиболее распространенные из всех нефропатий [6, 9, 14].
Пиелонефрит – инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, канальцев и интерстиция, характеризующееся лейкоцитурией и бактериурией и обязательным нарушением функционального состояния почек. Согласно результатам исследования J. Winberg [15], среди наиболее значимых заболеваний почек в индустриально развитых странах пиелонефрит занимает первое место и встречается у детей первого года жизни с частотой 1:100. В последние годы пиелонефрит относят к инфекционному (бактериальному) варианту тубулоинтерстициального нефрита.
Исходя из Международной классификации болезней 10-го пересмотра заболевания, относящиеся к группе «Инфекции мочевой системы», имеют следующие коды:
-
N10. Острый тубулоинтерстициальный нефрит (включает острый инфекционный интерстициальный нефрит – пиелонефрит).
-
N11. Хронический тубулоинтерстициальный нефрит (включает хронический инфекционный интерстициальный нефрит – пиелонефрит).
-
N11.0. Необструктивный хронический пиелонефрит, связанный с рефлюксом.
-
N11.1. Хронический обструктивный пиелонефрит (включает хронический пиелонефрит, связанный с аномалией, перегибом, обструкцией, стриктурой лоханочно-мочеточникового соединения, тазового сегмента мочеточника).
-
N11.8. Другие хронические тубулоинтерстициальные нефриты (включает необструктивный хронический пиелонефрит).
-
N12. Тубулоинтерстициальный нефрит неуточненный, как острый, так и хронический (включает пиелонефрит БДУ).
-
N30. Цистит.
-
N30.0. Острый цистит.
-
N30.1. Интерстициальный цистит (хронический).
-
N30.2. Другой хронический цистит.
-
N30.8. Другие циститы.
-
N30.9. Цистит неуточненный.
-
N39.0. Инфекция мочевыводящих путей без установленной локализации.
-
Р39.3. Инфекция мочевых путей новорожденного.
-
Р00.1. Поражения плода и новорожденного, обусловленные болезнями почек и мочевых путей матери.
Цистит – воспалительное заболевание мочевого пузыря.
Асимптоматическая бактериурия – инфекционно-воспалительный процесс в нижних отделах мочевой системы, преимущественно у новорожденных, проявляющийся бактериурией без лейкоцитурии и протекающий без выраженной клиники. Асимптоматическая бактериурия является фактором риска формирования пиелонефрита и др. [16]. Рекомендации по лечению при асимптоматической бактериурии одинаковы для большинства пациентов. Имеется потенциальный риск повторного лечения асимтоматической бактериурии и выработки более вирулентного штамма микроорганизма или резистентного патогена. Подобное лечение оправдано только у беременных. Для остальных групп пациентов лечение не требуется [17, 18].
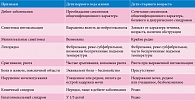
В настоящее время ни за рубежом, ни в России единой классификации ИМС нет. Это обусловлено различными подходами к классификации ИМС (табл. 1) [2].
Как правило, сохраняющаяся бактериурия – результат неадекватного лечения инфекции. Наиболее частой причиной является антимикробная устойчивость к примененному препарату. С данной разновидностью ИМС легче бороться, зная чувствительность к антибиотику.
Персистенция бактерий или реинфекция – инфекции, выявленные после задокументированных отрицательных посевов мочи. Реинфекция в отличие от персистенции вызвана другим микроорганизмом. Персистенция означает, что новый эпизод ИМС связан с тем же микроорганизмом. Персистенция обычно встречается у детей с анатомическими нарушениями мочевой системы.
За рубежом распространена также классификация ИМС J. Winberg 1987 г. [19, 20]:
1. Уровень поражения:
-
инфекция верхних мочевых путей (пиелонефрит);
-
инфекция нижних мочевых путей (цистит, уретрит).
2. Клинические проявления:
-
симптоматическая;
-
бессимптомная (изолированная бактериурия).
3. Наличие факторов, осложняющих течение и способствующих рецидивированию ИМС:
-
осложненная;
-
неосложненная.
4. Течение:
-
острое;
-
хроническое:
а) редко рецидивирующее;
б) часто рецидивирующее;
в) непрерывно рецидивирующее.
ИМС занимают лидирующие позиции в структуре заболеваний детского возраста и составляют 18:1000 детского населения [9]. Распределение по полу зависит от возраста пациентов. У новорожденных мальчиков ИМС встречается приблизительно в 4 раза чаще, чем у девочек. В последующих возрастных группах девочки доминируют (у дошкольников соотношение «мальчики : девочки» – 1:15, у школьников – 1:30). У девочек три пика заболеваемости: на первом году жизни, на втором-третьем, что связано со становлением навыков гигиены и приучения к горшку, а также в подростковом возрасте, что в большинстве случаев обусловлено началом половой жизни [9, 16, 21].
Этиология
Наиболее частыми возбудителями ИМС являются представители семейства Enterobacteriaceae. В 2000–2001 гг. в восьми лечебно-профилактических учреждениях семи городов России было проведено исследование АРМИД-1, посвященное выявлению и изучению резистентности основных уропатогенов [22]. В исследовании участвовали 607 детей в возрасте от одного месяца до 18 лет с внебольничными инфекциями верхних и нижних отделов мочевой системы, у которых при бактериологическом исследовании мочи был выделен возбудитель в диагностическом титре (> 105 КОЕ/мл). Анализ полученных данных показал, что основными возбудителями внебольничных ИМС в России являются представители семейства Enterobacteriaceae (80,6%), главным образом Escherichia coli – 53% случаев (с региональными колебаниями от 41,3 до 83,3% в разных центрах). Другие уропатогены выделялись значительно реже: Proteus spp. – 8,5%, Enterococcus spp. – 8,5%, Klebsiella pneumoniae – 8%, Enterobacter spp. – 5,7%, Pseudomonas spp. – 5,4%, Staphylococcus aureus – 3,7%. У 7,2% больных выявлены микроорганизмы, редко встречающиеся в клинической практике: Morganella morganii – 2%, Klebsiella oxytoca – 1,7%, Citrobacter freundii – 1,1%, Serratia marcescens – 0,8%, Acinetobacter lwoffii – 0,5%, Acinetobacter baumannii – 0,3%, Citrobacter diversus – 0,2%, Streptococcus pyogenes – 0,2%, Flavobacter spp. – 0,2%, Candida krusei – 0,2% и др.
Нозокомиальные ИМС, вызванные разнообразными микроорганизмами, например Pseudomonas aeruginosa, тяжело лечить. Candida spp. может присутствовать у иммунокомпрометированных или катетеризированных пациентов. В то же время у здоровых детей выявление Lactobacillus, коагулазонегативных стафилококков и Corynebacterium редко подтверждается клинически. Роль Mycoplasma hominis и Chlamidia trachomatis в настоящее время дискутируется, поскольку данные возбудители, как правило, сочетаются с иной грамотрицательной микрофлорой и могут встречаться при воспалительном процессе другой локализации.
Надо отметить, что развитие пиелонефрита определяется не только количественными характеристиками бактериурии, но и особенностями микро- и макроорганизма. Уропатогенные штаммы микробов отличаются способностью к адгезии (прилипанию) к эпителию мочевыводящих путей. Для них характерны высокие темпы роста. Затяжное и рецидивирующее течение пиелонефрита может быть связано с воздействием микоплазм, хламидий, грибов рода Candida. У детей раннего возраста пиелонефрит развивается, как правило, при нарушении уродинамики или нестабильности цитомембран. Дисрегуляция системы кишечного микробиоценоза со снижением колонизационной резистентности кишечника и увеличением условно патогенной флоры считается одним из научно обоснованных механизмов инфицирования мочевого тракта у детей первых трех лет жизни [1, 9, 14, 16, 22–24]. Особенности макроорганизма в некоторой степени предопределяют высокий риск инфекционно-воспалительных заболеваний мочевой системы. Прежде всего это малые или большие врожденные аномалии ОМС, нарушения уродинамики. Установлено, что в 90,3% случаев в основе развития пиелонефрита лежат морфологические аномалии развития мочевого тракта. Этим объясняется повышенный интерес исследователей к изучению врожденных пороков развития ОМС, на долю которых приходится от 1/10 до 1/3 всех аномалий органов в популяции [9, 16]. Однако наличие обструкций в мочевой системе не всегда реализуется в пиелонефрите, а только в условиях неблагоприятных внешних воздействий [25].
Доказана роль вирусов в возникновении острого цистита. При хроническом цистите вирусы провоцируют обострение воспалительного процесса в мочевом пузыре с последующей бактериальной инвазией.
Пути проникновения инфекции
В большинстве случаев бактерии проникают в мочевой тракт восходящим путем из промежностной и уретральной областей, контаминированных кишечной микрофлорой. Этот путь инфицирования обычно имеет место у детей с анатомической или функциональной патологией, препятствующей нарушению оттока мочи. Лимфогематогенный путь инфицирования мочевой системы возможен при системных инфекционных процессах, протекающих с бактериемией. Убедительных данных о наличии лимфогенного пути передачи инфекции до сих пор не получено. С максимальной частотой выделяют грамположительные бактерии и грибы. Предположительно, гематогенное инфицирование свойственно новорожденным и детям первых месяцев жизни со сниженным иммунитетом. Дисфункции желудочно-кишечного тракта (диарея, запор, дисбактериоз) способствуют инфицированию мочевых путей через лимфатическую систему от легких и едва уловимых (транзиторная бактериурия) до выраженных клинических форм поражения мочевой системы [26].
Патогенез
Важным фактором, способствующим развитию инфекции мочевой системы, является периуретральная колонизация. Периуретральная флора, представленная в основном грамотрицательными бактериями, включает микроорганизмы, преимущественно вызывающие инфекцию мочевыводящей системы у детей раннего возраста: Escherichia coli – 40–90%, Klebsiella – 7–20%, Proteus mirabilis – 9–16%. Грамположительная кокковая флора (энтерококки, стафилококки, стрептококки) при симптоматической бактериурии определяется в 10–20% случаев. Нередко встречаются ассоциации микроорганизмов (Escherichia coli + Proteus, Escherichia coli + Klebsiella, Escherichia coli + Entеrococcus), вирусная инфекция (аденовирусы, энтеровирусы, в частности вирусы Коксаки (Coxsackievirus), особенно группы В, и др.) [16, 23]. Микроорганизмы также способны проникать в мочевой пузырь, минуя уретру, путем так называемой транслокации из кишечника [2]. Исследования последних лет свидетельствуют о генетической предрасположенности к воспалительным заболеваниям органов мочевой системы. Мутации генов Рах2 и АТ2 приводят к формированию врожденных аномалий мочевой системы как на органном, так и на тканевом уровне, что в свою очередь снижает местную резистентность к инфекции и способствует развитию воспаления [2, 27–29]. Тем не менее первостепенное значение в развитии микробно-воспалительного процесса в почках имеют нарушения уродинамики, прежде всего пузырно-мочеточниковый рефлюкс [30–32].
Клиническая картина
Обычно пиелонефрит у детей раннего возраста протекает латентно, без явных клинических проявлений или малосимптомно, что приводит к поздней диагностике, когда уже имеют место тяжелые повреждения почечной паренхимы и формируется хроническая почечная недостаточность [9, 14, 33, 34].
Латентное течение пиелонефрита во многом объясняется снижением иммунных сил детского организма, способствующим скрытому развитию болезненного процесса. В раннем возрасте ребенок склонен к генерализации инфекции. Быстрая и значительная деструкция ткани у новорожденных является следствием даже острого воспалительного пиелонефритического процесса. ИМС в неонатальном периоде редко протекает изолированно.
Клиническая картина у новорожденных в большинстве случаев обусловлена сопутствующей патологией. У таких пациентов нередко отсутствуют симптомы, характерные для инфекционно-воспалительных заболеваний ОМС у детей старшего возраста. Как правило, у новорожденных доминируют неспецифические признаки: симптомы интоксикации, субфебрилитет, слабое сосание, недостаточная прибавка массы, дисфункция кишечника.
Клиническая картина пиелонефрита у детей раннего возраста достаточно полиморфна (табл. 2). Могут наблюдаться затянувшаяся желтуха, признаки общего инфекционного токсикоза: лихорадка, беспокойство, нарушение сна, снижение массы тела. Дети в возрасте до пяти лет с ИМС страдают отсутствием аппетита, у них могут возникать рвота, диспепсические расстройства, распространенные боли в животе без определенной локализации и т.д. Только после пятилетнего возраста появляются специфические симптомы поражения ОМС – симптомы интоксикации, повышение температуры без катаральных явлений, боль в поясничной области [2, 9].
Диагностика
Основными лабораторными анализами, подтверждающими пиелонефрит, являются:
1) общий анализ мочи: выявляются лейкоцитурия – от 15–20 в поле зрения (наиболее характерна при патологии дистальных отделов мочевой системы) до сплошь все поля зрения (чаще встречается при пиелонефрите), бактериурия, а также нейтральная или щелочная реакция мочи, мутность мочи, наличие солей, умеренная протеинурия от следовой до 0,06 г/л (однако при пороках развития почек, наличии пузырно-мочеточникового рефлюкса протеинурия может быть более выраженной). Это означает, что в общем анализе мочи необходимо обращать внимание на такие показатели, как лейкоцитурия, бактериурия, нитриты в моче и лейкоцитарная эстераза. Другие показатели могут изменяться при ИМС, но не являются диагностически значимыми. Маркеры, такие как лейкоцитарная эстераза и нитриты, могут быть сразу определены мочевыми стрипами. Фермент эстераза лейкоцитов расщепляется эстеркарбоксиловой кислотой, в результате чего образуется компонент, который вступает в реакцию с диазониевой солью с образованием фиолетового окрашивания. Чувствительность теста – 10–20 лейкоцитов/мкл мочи. Содержащиеся в норме нитраты грамотрицательные бактерии восстанавливают до нитритов, но это занимает несколько часов. Оба теста косвенно указывают на наличие инфекции. Чувствительность определения лейкоцитарной эстеразы – 50–85%, предсказательная ценность положительного результата (PPV) – 89%. Однако при наличии симптомов ИМС PPV повышается до 94%. Уровень специфичности – 63–92%. Специфичность выявления нитритов выше – 90–100%. Однако чувствительность достаточно низкая, существенно отличается по данным разных авторов (от 16 до 82%); уровень PPV – 90%. При положительном тесте на лейкоцитарную эстеразу и нитриты специфичность и чувствительность увеличиваются до 70 и 90% соответственно; уровень PPV – 72% [35].
Уровень чувствительности и специфичности при наличии лейкоцитурии (> 5 в поле зрения) и бактериурии колеблется в пределах 54–85% и 70–81% соответственно [36];
2) посев мочи. Наиболее часто высеваемым возбудителем является кишечная палочка, реже встречаются Klebsiella, Pseudomonas aeruginosa, Proteus;
3) общий анализ крови. Подтверждается воспалительный характер патологического процесса: лейкоцитоз и увеличение скорости оседания эритроцитов.
Для ИОМС прежде всего характерна бактериурия. Рост более 100 000 КОЕ в свежевыделенной моче – основное отличие истинной бактериурии от простой контаминации.
Результаты посева мочи у детей оценивают следующим образом. За рубежом у детей первого года жизни распространено исследование мочи, полученной путем надлобковой пункции мочевого пузыря. Любой рост бактерий, выявляемый при данном методе забора мочи, считается значимым в плане развития инфекции мочевой системы. В России данный метод не нашел широкого распространения.
Диагностически значимо выделение 1000 КОЕ/мл мочи, полученной при катетеризации мочевого пузыря.
При выделении микроорганизма в монокультуре из свежевыделенной мочи (собранной в стерильную емкость при свободном мочеиспускании) в титре > 105 КОЕ/мл этот возбудитель может считаться этиологически значимым, даже в отсутствие характерной клинической картины ИМС.
Если образец взят у ребенка, имеющего симптомы ИОМС или принимающего антибактериальные препараты, выделение возбудителя даже в титре > 102 КОЕ/мл может считаться этиологически значимым.
У новорожденных этот уровень не достигается из-за более короткого периода присутствия бактерий в моче. Именно поэтому повторный высев одного и того же возбудителя у детей первых трех месяцев жизни независимо от количества должен рассматриваться как бактериурия, особенно при наличии других симптомов ИОМС [36–38].
Необходимым условием достоверности результатов бактериологического исследования мочи является сбор анализов до начала антибактериальной терапии. Отсутствие бактериурии при проведении посевов может быть обусловлено влиянием антибактериальной терапии, образованием L-форм, наличием микроорганизмов, не выявляемых при обычном микробиологическом исследовании [1, 22].
В таблице 3 приведены общие рекомендации Всемирной организации здравоохранения по оценке результатов количественных тестов [39].
К дополнительным методам обследования детей относят выявление более редких возбудителей инфекции (хламидии, микоплазма, уреаплазма, грибы, микобактерии туберкулеза), исследование гуморального и клеточного иммунитета. К дополнительным исследованиям, позволяющим определить пиелонефритический процесс, относятся также:
-
биохимическое исследование мочи – выявление нарушения канальцевых функций почек (снижение ацидоаммониогенеза, оксалурия, уратурия, фосфатурия и кальциурия);
-
биохимический анализ крови – определение степени активности воспалительного процесса и функции почек (белок, фракции, мочевина, С-реактивный белок);
-
ультразвуковое исследование почек – установление аномалий развития почек.
Данные ультразвукового исследования показывают также увеличение почек, снижение (в острую фазу) или повышение эхогенности паренхимы почек. На основании результатов дуплексного допплеровского сканирования и допплерографии почечных сосудов оценивают интраренальную гемодинамику. Высокая чувствительность метода позволяет выявить инфильтративно-склеротические процессы в почечной паренхиме на ранних этапах и обеспечивает возможность длительного динамического наблюдения за больными с пиелонефритом [2, 40, 41]. При цистографии устанавливается наличие пузырно-мочеточникового рефлюкса и клапана задней уретры. По данным урографии и реносцинтиграфии почек определяется нарушение функции почек [1, 36–38, 42]. В частности, результаты исследования A. Hoberman и соавт. [43] подтвердили высокую распространенность уродинамических нарушений у детей раннего возраста: у 39% детей с ИОМС был обнаружен пузырно-мочеточниковый рефлюкс. Динамическая нефросцинтиграфия проводится для визуализации и оценки функционального состояния почек (степени перфузии органа, скорости клубочковой фильтрации, выделительной функции). Статическую сцинтиграфию рекомендуют проводить для определения количества функционирующей паренхимы, обнаружения очаговых образований (рубцов) в почке, позволяющих диагностировать рефлюкс-нефропатию [43, 44].
Последние годы исследователи обращают внимание на значительное повышение уровня прокальцитонина в плазме у детей с ИМС [45]. При этом специфичность определения прокальцитонина для инфекции мочевой системы составила 89,7%. Аналогичный показатель в отношении С-реактивного белка – 18,5%. Прокальцитонин также может использоваться как высокочувствительный маркер формирования нефросклероза. У детей с нефросклерозом концентрация прокальцитонина в плазме в 1,5 раза превышает таковую у больных без структурных изменений в почках.
Следовательно, инфекцию мочевыводящих путей – инфекционно-воспалительное заболевание нижних отделов мочевой системы, не затрагивающее почки, можно предположить при выявлении только мочевого синдрома в виде лейкоцитурии, протеинурии и бактериурии у детей, у которых не установлено изменений по данным рентгенологических и ультразвуковых методов исследования, метаболических нарушений, изменений воспалительного характера в анализе крови. Нарушения уродинамики, аномалии развития почек, мочевой синдром, бактериурия, метаболические изменения, воспалительные изменения в крови, снижение концентрационной функции почек могут свидетельствовать о развитии вторичного (обструктивного) пиелонефрита.
Лечение
Лечение ИМС, в том числе пиелонефрита, проводится по нескольким направлениям: общие принципы (режим, диета, лечебная физическая культура, массаж, гигиенические мероприятия), антибактериальная терапия и дополнительные методы лечения. От того, насколько правильно выбрана стартовая антимикробная терапия ИМС, зависят эффективность лечения и прогноз болезни.
В качестве этиотропной терапии ИМС предпочтительны цефалоспорины второго и третьего поколения и защищенные пенициллины, то есть антибактериальные препараты широкого спектра действия, способные подавлять как грамотрицательную, так и грамположительную флору [1, 22, 36–38, 46].
Аминогликозиды назначают значительно реже из-за нефротоксичности и проапоптозного действия [47, 48].
У подростков терапию можно начинать с фторхинолонов. Не исключена ступенчатая схема лечения (один препарат назначается сначала парентерально, а затем перорально) [1, 4]. Пероральные цефалоспорины можно применять в амбулаторных и стационарных условиях, а парентеральные, как правило, в условиях стационара [22].
Решая вопрос о выборе антибиотиков, необходимо учитывать возможный спектр возбудителей, их эмпирическую чувствительность к назначаемому антибиотику, а также возможность развития аллергических реакций и дисфункции кишечника на фоне приема препаратов пенициллинового ряда. Из-за снижения чувствительности микроорганизмов к цефалоспоринам второй генерации предпочтение отдают цефалоспориновым антибиотикам третьего поколения.
В рамках проспективного эпидемиологического исследования ДАРМИС (2010–2011 гг.), проведенного в 26 центрах в 18 городах России, были проанализированы 903 штамма, полученные у детей и взрослых обоего пола всех возрастных групп с острыми (и обострением хронических) внебольничными ИМП [49]. В субполяции детей и подростков до 18 лет было собрано 233 штамма уропатогенов. В этой категории пациентов общая доля представителей семейства Enterobacteriaceae и частота выделения Escherichia coli были несколько выше, чем в среднем в субпопуляции взрослых, – 94 и 68,2% соответственно.
При анализе нозологических форм у детей и подростков до 18 лет наиболее часто встречался острый пиелонефрит – 42,1% случаев. Доля обострений хронического пиелонефрита, острого и рецидивирующего цистита составила 37,8, 12,4 и 7,7% соответственно. В ходе исследования ДАРМИС у детей и подростков до 18 лет отмечалась высокая частота выделения резистентных штаммов Escherichia coli к ампициллину (38,4%), пиперациллину (34%) и триметоприму/сульфаметоксазолу (17%). При интерпретировании результатов по критериям CLSI и МУК 4.2.1890 04 процент резистентных к амоксициллину/клавуланату штаммов Escherichia coli был на уровне 10,1%. Уровень резистентности к фторхинолонам у детей составил 5% для ципрофлоксацина и 3,9% для левофлоксацина. По критериям EUCAST чувствительность к различным цефалоспоринам варьировала в диапазоне 85,8–91,8% для штаммов семейства Enterobacteriaceae и 91,8–96,2% для штаммов Escherichia coli. Формальные показатели чувствительности к цефалоспоринам третьего и четвертого поколения составили 90,4–96,4% при осложненных ИМС и 93,6–97,8% при неосложненных.
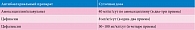
К наиболее часто используемым пероральным цефалоспоринам третьего поколения относится цефиксим. Препарат характеризуется высоким проникновением в ткань почек, создает в ткани почек и моче концентрации, во много раз превышающие минимальную подавляющую концентрацию в отношении Escherichia coli. Цефиксим обладает широким спектром активности и выпускается в виде диспергируемых таблеток (Супракс® Солютаб®), гранул для приготовления суспензии и капсул (Супракс®). Он является первым антибиотиком среди цефалоспоринов третьего поколения, который можно принимать перорально. Бактерицидный механизм действия препарата реализуется за счет угнетения образования основного компонента клеточной стенки возбудителей болезни. В отличие от цефалоспоринов первого поколения Супракс® устойчив к действию бета-лактамаз (ферментам бактерий, разрушающим антибиотик, в результате чего его действие становится неэффективным). Согласно инструкции Супракс® угнетает жизнедеятельность грамотрицательных (гемофильная и кишечная палочка, Klebsiella, Proteus, Salmonella, Shigella, Serratia, Citrobacter, гонококки) бактерий и ряда грамположительных (различные стрептококки). Биодоступность препарата Супракс® составляет 40–50% и не зависит от приема пищи. Препарат имеет большой период полувыведения, благодаря чему может применяться один раз в сутки. С мочой из организма выводится 50% препарата в неизмененном виде, что обеспечивает высокую эффективность в лечении инфекций мочевых путей. Супракс® по сравнению с аналогами оказывает незначительное угнетающее влияние на микрофлору кишечника. У детей старше шестимесячного возраста возможно применение в виде гранул для приготовления суспензии, а при достижении массы 25 кг – в виде диспергируемых таблеток (Супракс® Солютаб®). У детей старше 12 лет и массой более 50 кг можно применять капсулы. Таким образом, у детей шестимесячного возраста и старше лечение ИМС можно начинать (до получения результатов посева мочи) с препарата Супракс® – один раз в день независимо от приема пищи. Рекомендуемая доза – 8 мг/кг/сут. Дозы пероральных антибактериальных препаратов для лечения ИОМС у детей представлены в табл. 4.
Результаты последних исследований показали отсутствие достоверной разницы между внутривенным введением антибиотика в течение трех дней, переходом на его пероральный прием в последующие 11 дней и применением антибиотика перорально в течение 14 дней. Эти данные были получены после проведения контролируемого рандомизированного исследования с участием 306 детей в возрасте от одного до 24 месяцев жизни. Не обнаружено никаких различий в ранние и отдаленные периоды (стихание клинических проявлений, реинфекция, сморщивание почек через шесть месяцев). Полученные данные позволяют рекомендовать детям с фебрильной ИМС сразу прием цефалоспоринов второго и третьего поколения или амоксициллина/клавуланата [50].
Антибактериальную терапию пиелонефрита следует продолжать до полного санирования мочевых путей. Неотъемлемой частью рациональной терапии ИМС является определение чувствительности выделенного возбудителя к антибактериальным препаратам. При необходимости проводится смена антибактериального препарата. Курс лечения при пиелонефрите – 10–14 дней, при цистите – семь дней [1, 37, 42]. При цистите целесообразно использовать пероральные антимикробные препараты, которые выводятся преимущественно через почки и создают максимальную концентрацию в мочевом пузыре.
Нормализации уродинамики способствуют такие рутинные мероприятия, как устранение расстройств мочеиспускания, принудительные мочеиспускания, регулярное опорожнение мочевого пузыря, в том числе двойное на ночь.
Профилактика рецидивов ИМС предусматривает контроль за анализами мочи, достаточный питьевой режим, принудительные мочеиспускания, нормализацию уродинамики, медицинский отвод от бассейна, занятия зимними видами спорта, прием растительных препаратов.
Вопрос об антимикробной профилактике рецидивов в настоящее время решается неоднозначно. Эффективность ранее общепринятой профилактики обострений с помощью антибактериальных средств сегодня подвергается сомнению [51]. В частности, согласно результатам рандомизированного контролируемого исследования, длительная антибиотикопрофилактика неэффективна в отношении рецидивов пиелонефрита и развития почечной недостаточности у детей младше 30 месяцев с пузырно-мочеточниковым рефлюксом 2–4-й степени [52].
Дискуссия по поводу длительной антибиотикопрофилактики ИМС развернулась также на страницах журнала Pediatric Nephrology [53]. Профилактически антибиотики не следует назначать рутинно после первой ИМС. В то же время профилактическое применение антибиотиков может снизить риск положительных высевов из мочи, однако не сокращает риск развития симптоматической ИМС или новых поражений паренхимы.
Кроме того, существует мнение, что длительное использование низких доз антибиотиков способно привести к развитию резистентности микроорганизмов. Именно поэтому многие исследователи сходятся во мнении о необходимости применения иммуномодулирующих препаратов, в частности Уро-Ваксома, представляющего лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата 18 уропатогенных штаммов Escherichia coli, в качестве профилактики рецидивов ИМС [54–56].
После окончания антибактериальной терапии и санации мочи рекомендуется назначение уроантисептиков или проведение обозначенной выше иммунопрофилактики.
Необходимо учитывать, что почти в 70% случаев начало болезни связано с хроническим циститом, нередко с латентным течением, в 49% случаев – с нейрогенной дисфункцией мочевого пузыря по гипо- или гиперрефлекторному типу. В 45% случаев пиелонефрит развивается при пузырно-мочеточниковом рефлюксе и имеет затяжное или хроническое течение. При длительном или хроническом течении пиелонефрита в раннем возрасте рекомендуется проведение полного нефро-урологического обследования с целью выявления признаков функциональной или органической обструкции.
Диспансерное наблюдение
Диспансерное наблюдение детей с ИМС предусматривает:
-
прохождение осмотров (педиатром – один раз в один-два месяца, нефрологом – один раз в три месяца);
-
сдачу анализа мочи (клинического – один раз в месяц и при интеркуррентных заболеваниях);
-
лечение вульвита, уретрита и др.
Длительность наблюдения – один год.
Примерная схема диспансерного наблюдения детей с пиелонефритом предполагает:
-
прохождение осмотров (педиатром – один раз в месяц в течение первого года, далее – один раз в три месяца, нефрологом – один раз в три месяца в течение первого года, далее – один раз в полгода (при снижении почечных функций – один раз в три месяца), окулистом – один раз в полгода);
-
сдачу анализа мочи (клинического – один раз в 10–14 дней в течение первых шести месяцев, затем – один раз в месяц и при интеркуррентных заболеваниях);
-
выполнение посева мочи (один раз в три – шесть месяцев);
-
проведение биохимического исследования мочи (один раз в 6–12 месяцев);
-
сдачу анализа крови (клинического – один раз в полгода и при интеркуррентных инфекциях, биохимического – один раз в год);
-
выполнение ультразвукового исследования почек и мочевого пузыря (по показаниям от одного раза в месяц до одного раза в три – шесть месяцев);
-
проведение рентгеноурологического обследования (по показаниям).
Основные пути оздоровления: режим, диета, этапный метод лечения, при интеркуррентных заболеваниях – курс уросептиков в течение пяти – семи дней.
Снятие с учета осуществляется не ранее чем через пять лет полной клинико-лабораторной ремиссии после обследования в нефрологическом стационаре.
Заключение
Несмотря на многолетнюю историю изучения данного вопроса, проблема инфекции мочевой системы у детей остается не до конца изученной. Основной дискуссионный вопрос: должны ли дети, перенесшие пиелонефрит, но имеющие нормальные показатели цистографии и реносцинтиграфии, получать длительно профилактические дозы антимикробных препаратов? Вместе с тем большинство исследователей сходятся во мнении, что ранняя диагностика ИМС у детей, особенно раннего возраста, своевременная антимикробная терапия и ликвидация обструкции позволяют остановить инфекционно-воспалительный процесс в органах мочевой системы и предотвратить развитие осложнений.
O.L. Chugunova, M.V. Shumikhina
Russian National Research Medical University named after N.I. Pirogov
Contact person: Olga Leonidovna Chugunova, ol_chugunova@mail.ru
The paper is dedicated to the urinary tract infection in children and discusses its etiology, pathogenesis, features of age-related clinical picture, early disgnostics, timely treatment strategy as well as debatable issues of prophylaxis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.