Коллагенозный гастрит у 26-летней пациентки: обзор литературы и клинический случай
- Аннотация
- Статья
- Ссылки
- English

Эпидемиология
Хронический гастрит представляет собой одну из наиболее часто встречаемых патологий в практике врачей гастроэнтерологов, терапевтов, эндоскопистов. До 90–95% случаев хронического гастрита представлены Helicobacter pylori – ассоциированным, аутоиммунным, лекарственным (НПВП-ассоциированным) и рефлюкс-гастритом, на остальные 5–10% приходятся более редкие варианты этиологии (гранулематозный, вирусный, радиационный, эозинофильный гастрит и другие) [1]. К числу последних относится коллагенозный гастрит.
Коллагенозный гастрит (КГ) – редкое заболевание, характеризующееся субэпителиальным отложением коллагеновых волокон общей толщиной более 10 мкм и воспалительной инфильтрацией мононуклеарами в собственную пластинку [2]. Впервые патология была описана в 1989 г. [3], к 2015 г. в англоязычной литературе было зарегистрировано всего 60 клинических случаев КГ [2], а к 2022 – как минимум 86 случаев [4]. На момент написания данной статьи сообщений о пациентах с КГ в русскоязычных публикациях найти не удалось.
Для оценки эпидемиологических особенностей КГ R.M. Genta и соавт. провели анализ базы данных специализированной патологоанатомической лаборатории США за период с 2009 по 2018 г. В анализ вошли 168 пациентов с гистологически верифицированным КГ и 1 286 165 пациентов без данных о КГ. Распространенность КГ составила 13 случаев на 100 000 выполненных эзофагогастродуоденоскопий (ЭГДС). Чаще КГ встречался среди лиц женского пола и характеризовался бимодальным распределением по возрасту (первый пик у пациентов – в возрасте 10–19 лет, второй пик – в основном у женщин в возрасте > 60 лет) [5]. По данным шведского исследования, частота возникновения КГ в детском возрасте составила 0,25/100 000 человеко-лет, а распространенность КГ – 2,1 на 100 000 детей в возрасте до 18 лет [6].
КГ у взрослых ассоциирован с рядом аутоиммунных заболеваний, таких как синдром Шегрена, лимфоцитарный гастрит, лимфоцитарный колит и язвенный колит. По данным K. Kamimura, из 60 пациентов с КГ у десяти взрослых был также диагностирован коллагенозный дуоденит (коллагеновая спру), а у девяти – коллагенозный колит [2]. По данным анализа R.M. Genta, КГ был тесно связан с лимфоцитарными поражениями верхнего отдела желудочно-кишечного тракта (ЖКТ), включая целиакию, дуоденальный интраэпителиальный лимфоцитоз и лимфоцитарный гастрит [5]. В исследовании В.С. Beinvogl среди 40 пациентов изолированный КГ присутствовал у 66,7%, сопутствующий коллагенозный дуоденит – у 17,5%, коллагенозный колит – у 7,5% и коллагенозный илеит – у 2,5%. Атопические сопутствующие заболевания были обнаружены у 25%, аутоиммунные сопутствующие заболевания – у 12,5% пациентов [7]. По результатам шведского исследования, не выявлено сопутствующих аутоиммунных заболеваний среди детей с КГ, однако многие пациенты имели наследственность по аутоиммунным заболеваниям (47%) и/или имели положительный результат на аутоантитела (40%) или HLA DQ2/DQ8 (53%) [6].
Клиническая картина
С. Lagorce-Pages и соавт. отметили, что клиническая картина КГ различается у детей и взрослых в зависимости от тяжести заболевания и вовлеченности органов ЖКТ в патологический процесс. Детский фенотип представлен поражением только желудка, может протекать бессимптомно или с развитием боли в животе, в ряде случаев выявляется железодефицитная анемия (ЖДА). При взрослом фенотипе патологическое отложение коллагеновых волокон выявляется не только в желудке, но и в тонкой и/или толстой кишке (коллагеновая спру и коллагенозный колит), а в клинической картине на первый план выходит хроническая водянистая диарея [8]. Распространенность клинических проявлений при КГ, по данным разных авторов, представлена в таблице (табл. 1).
Эндоскопическая картина
Наиболее характерной эндоскопической картиной для КГ является узловатый вид слизистой оболочки желудка, выявляемый в 53–77,5% случаев [2, 4, 7]. По данным В.С. Beinvogl, у пациентов с КГ при проведении ЭГДС отмечаются также видимая кровь (20%), эрозии/поверхностные язвы (10%) и язвы (7,5%), а L. Kozai сообщил об эритематозной или эрозивной гастропатии у 26,1% и даже о нормальной эндоскопической картине слизистой желудка у 12,5% пациентов с КГ [4, 7]. Y.J. Lee описал случай КГ у 15-летней бессимптомной пациентки с рецидивирующей ЖДА неясной этиологии. По результатам первой ЭГДС выявлены отечная слизистая оболочка и множественные язвы с белесой слизью по всему антральному отделу желудка, гистологически – хронический активный гастрит без данных об инфекции Helicobacter pylori (H. pylori), цитомегаловирусе или наличии гранулем. На контрольной ЭГДС через семь месяцев обнаружена выраженная узловатость в антральном отделе и несколько полиповидных очагов в теле желудка. Множественная биопсия слизистой оболочки между возвышающимися участками позволила установить диагноз КГ [9].
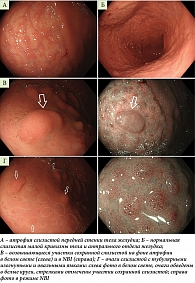
Выявляемые узелки слизистой оболочки могут быть неравномерными по размеру и располагаться диффузно как в теле, так и в антральном отделе желудка, при этом размер и количество узелков зависят от тяжести воспаления [10]. Интересен факт, что данные узелки представляют собой не утолщение слизистой оболочки, а, наоборот, относительно сохранную слизистую с менее выраженным воспалением. Узловатый вид формируется за счет участков атрофии и отложения коллагена, которые на макроскопическом уровне представляют собой зоны вдавления слизистой вокруг возвышающихся узелков [2]. Осмотр в режиме NBI с увеличением позволяет выявить аморфный или отсутствующий рисунок желез и аномальные капиллярные сосуды (включая слепые окончания и нерегулярное изменение их калибра) в области вдавленной слизистой оболочки [10, 11].
Морфология
Патоморфологические признаки КГ характеризуются хронической воспалительной инфильтрацией (представлена лимфоцитами, плазматическими клетками и эозинофилами) в субэпителиальном слое, особенно в собственной пластинке, и отложением коллагеновых волокон общей толщиной более 10 мкм (во многих опубликованных случаях значимо больше – до 100 мкм) [2]. Воспаление приводит к атрофии желез желудка и возникновению западающих участков слизистой, выявляемых при ЭГДС [10]. Патологические изменения менее выражены в возвышающихся участках слизистой оболочки [10]. Отложение коллагена можно четко визуализировать с помощью трихромной окраски по Массону [2]. По данным T. Arnason и соавт., распределение субэпителиального коллагена более выражено в области тела/дна желудка у детей и в области антрального отдела желудка у взрослых [12].
В некоторых исследованиях проводили типирование коллагенов с неоднозначными результатами. В части клинических случаев были идентифицированы коллаген III и VI типа. Известно, что коллаген III типа высвобождается из субэпителиальных фибробластов для восстановления повреждений, вызванных воспалением, из чего было сделано предположение, что синтез коллагена при КГ является не первичной патологией, а репаративной реакцией [2]. Однако интересно, что в некоторых исследованиях коллагены II, III, IV, VI типов в зоне патологических депозитов не были выявлены [13].
Согласно современным представлениям, КГ является иммунопатологическим процессом, сопровождающимся внутриэпителиальным лимфоцитозом и патологической воспалительной инфильтрацией собственной пластинки слизистой. Данные признаки также характерны и для аутоиммунных процессов, часто ассоциированных с КГ [12]. К сожалению, детали иммунных механизмов, лежащих в основе КГ, не изучены.
Терапия
В настоящее время стандартной терапии КГ не разработано. Экспериментально применяли различные группы препаратов для достижения противовоспалительного эффекта и в качестве симптоматического лечения. У некоторых пациентов наблюдалось улучшение клинической картины, однако рандомизированных контролируемых исследований не проводилось, что не позволяет судить об эффективности той или иной схемы терапии.
В уже упомянутом обзоре K. Kamimura приведены варианты лечения 60 пациентов с КГ, представляющие собой как монотерапию одним препаратом, так и сочетание нескольких лекарственных средств [2]. Среди них ингибиторы протонной помпы (ИПП) принимали 19 человек, стероиды – 15 человек, препараты железа – 10, H2-блокаторы гистаминовых рецепторов – шесть, месалазин – четыре, сукральфат – четыре, сульфасалазин – два, висмута субсалицилат и фуразолидон – по одному человеку. Аглютеновой диеты придерживались шесть пациентов, парентеральное питание получали трое больных. Кроме того, 14 человек не проходили какой-либо терапии, а по трем случаям информация о лечении недоступна. На фоне терапии 28 пациентов отмечали улучшение или полное разрешение симптоматики, восемь человек не отмечали каких-либо изменений. По данным повторного гистологического исследования, уменьшение выраженности воспаления на фоне проводимой терапии наблюдалось у семи пациентов (принимали ИПП, железо, стероиды, сукральфат); уменьшение толщины коллагенозных отложений – у двух пациентов (первый принимал ИПП, гистологический контроль через шесть лет; второй – стероиды, сульфасалазин, парентеральное питание, контроль через два года). Прогрессирование гистологических изменений на фоне терапии выявлено у трех пациентов: первый получал ИПП, сукральфат, Н2-блокаторы гистаминовых рецепторов; второй – стероиды и парентеральное питание; третий – стероиды и аглютеновую диету. Стоит отметить, что у первых двух пациентов с прогрессированием КГ контрольную биопсию выполняли через 12 и 14 лет соответственно; у третьего – через девять месяцев [2]. Хотя в большинстве случаев КГ не ассоциирован с инфекцией H. pylori, ряд авторов предполагают потенциальный вклад данной бактерии в отложение коллагена в слизистой оболочке желудка и отмечают улучшение эндоскопической картины КГ после проведения эрадикационной терапии [14, 15]. В настоящее время предпринимаются попытки применения биологической терапии у пациентов с КГ, в частности, имеется публикация об опыте применения ведолизумаба [16].
Клинический случай
Пациентка Д., 26 лет, на момент осмотра (ноябрь 2024 г.) жалоб активно не предъявляет, при расспросе сообщает о наличии запаха изо рта натощак, о редкой отрыжке воздухом или кислым, склонности к послаблениям стула (периодически стул кашеобразной консистенции 2–3 раза в день без патологических примесей; в настоящее время – оформленный). Аппетит сохранен, боль в животе, тошноту, рвоту, вздутие живота на момент осмотра отрицает. При физикальном обследовании значимые отклонения от нормы не выявлены, индекс массы тела также соответствует норме (19,8 кг/м2). Наследственность, со слов пациентки, не отягощена. Оперативных вмешательств не было. Аллергологический анамнез отягощен: имеется сенсибилизация к бытовым, пыльцевым и пищевым аллергенам. Вредные привычки: курение – одна сигарета два-три раза в месяц, алкоголь – один бокал вина один раз в две-три недели. Эпидемиологический анамнез без особенностей.
При уточнении анамнеза заболевания стало известно, что в возрасте 15 лет у пациентки впервые выявили ЖДА легкой степени тяжести, жалоб со стороны ЖКТ на тот момент не предъявляла. Проходила лечение у гастроэнтеролога с диагнозами кишечной формы лямблиоза и дискинезии желчевыводящих путей. Также наблюдалась у дерматолога в связи с папуло-пустулезной формой Acne vulgaris и атопическим дерматитом. По данным УЗИ щитовидной железы, было подозрение на аутоиммунный тиреоидит (АИТ), лабораторно выявлено незначительное повышение тиреотропного гормона, однако антитела к тиреоглобулину и тиреопероксидазе оказались отрицательными, в связи с чем диагноз был снят, дальнейшее наблюдение не проводилось.
В 2017 г. в связи с рецидивирующей ЖДА выполнена первая ЭГДС, выявлены признаки дуоденита, слизистая желудка – без изменений. В последующем получала периодические курсы препаратов железа, уровень гемоглобина удавалось сохранять в пределах референтных значений.
В 2021 г. в возрасте 23 лет пациентку впервые начали беспокоить боли в эпигастральной области, изжога. Обратилась к гастроэнтерологу, рекомендовано эндоскопическое обследование.
ЭГДС от мая 2021 г.: слизистая оболочка в теле желудка гиперемирована; в верхней трети тела желудка на передней и задней стенках определяются два участка гиперплазии слизистой по 0,4 см, биопсию не выполняли.
Гастроэнтерологом назначено дообследование, курс ИПП. На фоне антисекреторной терапии самочувствие улучшилось, в связи с чем дальнейшее обследование не проходила.
На протяжении около двух лет периодически беспокоила боль в эпигастрии, самостоятельно купировала ее приемом ИПП. В декабре 2022 г. пациентка решила повторить ЭГДС и сдать анализы на инфекцию H. pylori (что было рекомендовано в мае 2021). По результатам анализов, антитела к H. pylori класса IgG от декабря 2022 – отрицательные; антиген H. pylori в кале от декабря 2022 – не обнаружен.
ЭГДС от декабря 2022 г.: слизистая оболочка в теле желудка гиперемирована, в теле желудка определяются множественные участки гиперплазии до 15 штук и до 0,8 см в диаметре (выполнена биопсия); слизистая оболочка в антральном отделе желудка очагово гиперемирована; слизистая луковицы двенадцатиперстной кишки (ДПК) бледно-розового цвета, очагово атрофирована.
Результат гистологического исследования: хронический фундальный гастрит со слабой активностью, эрозиями.
Повторно консультирована гастроэнтерологом, назначены омепразол, итоприд, ребамипид. В результате терапии жалоб со стороны ЖКТ больше не предъявляла.
В 2024 г. на фоне удовлетворительного самочувствия пациентка обратилась для проведения контрольной ЭГДС в связи с ранее выявляемыми очагами гиперплазии слизистой желудка.
ЭГДС от августа 2024 г.: слизистая оболочка в теле желудка с обширными полями атрофии, с «островками» сохранной слизистой без атрофии, с мелкими очагами гиперплазии. Выполнена биопсия по протоколу OLGA с дополнительными биоптатами из тела желудка (два биоптата из малой и большой кривизны антрального отдела, один биоптат из угла желудка, два биоптата из передней и задней стенок тела желудка + четыре дополнительных биоптата из передней стенки и большой кривизны тела желудка, как из западающих, так и из возвышающихся участков).
Результат гистологического исследования: морфологическая картина коллагенозного гастрита с преимущественным поражением слизистой тела желудка, с очагами атрофии слизистой (степень I, стадия II по OLGA, стадия 0 по OLGIM, Н. рylori – не выявлен).
В связи с установленным диагнозом КГ было принято решение о проведении ВКС с биопсией из всех отделов (для исключения коллагенозного илеита, коллагенозного колита) и повторной ЭГДС с биопсией:
- прицельно из возвышающихся (сохранная слизистая по данным литературы) и западающих участков (зоны атрофии с отложением коллагена) слизистой оболочки желудка – по запросу морфолога для сравнения выраженности воспалительных изменений;
- из пищевода (ввиду отсутствия статистики изменений в пищеводе у пациентов с КГ в мировой литературе, а также в связи с жалобами на изжогу у пациентки в анамнезе);
- из ДПК (для исключения коллагенозного дуоденита и целиакии – атрофия двенадцатиперстной кишки в анамнезе).
Для проведения исследования на оборудовании экспертного уровня пациентка была направлена в эндоскопическое отделение Северо-Западного окружного научно-клинического центра им. Л.Г. Соколова.
ЭГДС от 12.11.2024 г.: слизистая пищевода светло-розовая, блестящая (биопсия, по два фрагмента из проксимальной, средней и дистальной трети). В теле желудка по всем стенкам, кроме малой кривизны, определяется обширный участок атрофии слизистой в виде отсутствия желудочных полей и наличия многочисленных очагов фиброза, с извитыми, расширенными микрососудами (биопсия трех фрагментов (рис. 1 А)); в теле желудка по малой кривизне до уровня кардии и в антральном отделе желудка слизистая розовая, блестящая (биопсия двух фрагментов из малой и большой кривизны антрального отдела (рис. 1 Б)). На участке атрофии во всех отделах определяются многочисленные полиповидные очаги диаметром до 12 мм с неизмененным рисунком микроповерхности и микрососудов – «островки» сохранной слизистой (биопсия двух фрагментов из разных «островков» (рис. 1 В)). Также на фоне атрофии выявляются очаги диаметром 2–6 мм с тубулярными изогнутыми и овальными ямками (тотальная биопсия трех очагов (рис. 1 Г). Слизистая луковицы и нисходящего отдела ДПК бархатистая, белесоватая (биопсия по два фрагмента из нисходящей и нижней горизонтальной части ДПК, один биоптат из луковицы ДПК).
ВКС от 12.11.2024 г.: нормальная эндоскопическая картина толстой кишки и терминального отдела подвздошной кишки. Биопсия по протоколу воспалительных заболеваний кишечника (по два биоптата из терминального отдела подвздошной кишки, из правого и левого фланка, из поперечно-ободочной и прямой кишки).
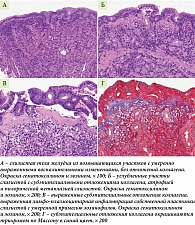
Результаты гистологического исследования: из пищевода – катаральный эзофагит; из желудка – в слизистой оболочке антрального отдела желудка значимых изменений не выявлено; в слизистой оболочке тела желудка в зоне полиповидных возвышающихся участков нормального эндоскопического строения отмечалась только повышенная лимфо-плазмоцитарная инфильтрация в поверхностных отделах собственной пластинки слизистой, патологических отложений коллагена выявлено не было (рис. 2 А).
В зоне углубленных участков слизистой выявлялись субэпителиальные отложения коллагена толщиной от 10 до 25 мкм. Количество главных и париетальных клеток было резко снижено, наблюдалось замещение их эпителием антрального типа – так называемая антрализация, или пилорическая метаплазия желез слизистой тела желудка. В собственной пластинке слизистой отмечалась слабовыраженная лимфо-плазмоцитарная инфильтрация с небольшой примесью эозинофилов. Выявлялась выраженная гипертрофия мышечной пластинки, а также разрастание мышечных волокон в собственной пластинке слизистой (рис. 2 Б).
В зонах возвышающихся очагов слизистой тела желудка с удлиненным ямочным рисунком и дилатированными капиллярами по данным эндоскопии были выявлены более выраженные отложения коллагена под поверхностным эпителием (толщиной до 50 мкм), выраженная лимфо-плазмоцитарная инфильтрация с умеренной примесью эозинофилов в собственной пластинке, межэпителиальные лимфоциты в умеренном количестве (рис. 2 В). Депозиты коллагена окрашивались трихромом по Массону в синий цвет (рис. 2 Г).
Необходимо отметить, что ключевой признак КГ – субэпителиальные отложения коллагена – выявлялся неравномерно, что подчеркивает необходимость мультифокальной биопсии при данной патологии.
Признаков кишечной метаплазии, дисплазии выявлено не было. Обсеменение H. pylori слизистой оболочки также не определялось.
Было проведено иммуногистохимическое исследование с использованием системы детекции Праймбиомед (Россия) с меткой DAB антител к коллагену I типа (клон Col1a, Abcam), III типа (клон 1E7-D7/Col3, Abcam), IV типа (клон CIV22, Dako), к CD4 (клон EP204, DBS), CD8 (клон 144В, DBS).
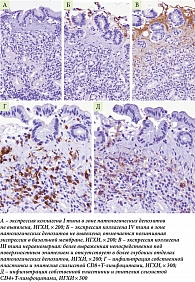
В зоне патологических депозитов коллагены I типа и IV типа (позитивно окрашивается базальная мембрана, расположенная под поверхностным эпителием) не выявлены (рис. 3 А, Б). Экспрессия коллагена III типа неравномерная: выявлялось позитивное окрашивание в зоне непосредственно под поверхностным эпителием и негативные участки, расположенные в более глубоких отделах патологических депозитов (рис. 3 В). В окружающей слизистой оболочке подобных изменений выявлено не было.
Полученные результаты, по-видимому, свидетельствуют о том, что патологические депозиты представляют собой не столько какой-то определенный тип коллагена, сколько имеют более сложный состав, включающий иные белки, что нуждается в дальнейшем изучении.
Согласно результатам имммуногистохимического исследования, была выявлена инфильтрация собственной пластинки слизистой и эпителия желез преимущественно CD8+Т-лимфоцитами и в меньшей степени CD4+Т-лимфоцитами (рис. 3 Г, Д). Полученные данные говорят о преимущественно Т-клеточном характере иммунопатологического процесса при КГ, однако необходимы дальнейшие исследования в этой области.
Из ДПК: хронический умеренно выраженный неактивный дуоденит с очаговой гиперплазией бруннеровых желез, без атрофии слизистой, тип 0 по Marsh-Oberhuber. Морфологических признаков иммунопатологического процесса в представленном материале не выявлено.
Из терминального отдела подвздошной и толстой кишки: хронический умеренно выраженный илеит с низкой активностью, с реактивной гиперплазией лимфоидных фолликулов слизистой. Слизистая толстой кишки – без значимой патологии. Признаков коллагенозного колита, амилоидоза, ВЗК в представленном материале не выявлено.
Таким образом, на основании данных анамнеза (эпигастральные боли и ЖДА), результатов эндоскопического и гистологического исследований у пациентки Д. имеет место детский фенотип КГ. Также обращает на себя внимание наличие сопутствующего атопического заболевания (атопический дерматит), подозрение на сопутствующую аутоиммунную патологию (АИТ), что описывалось в литературе [7].
Было проведено дополнительное лабораторное обследование (30.11.24 г.), по результатам которого: пепсиноген I и II, а также их соотношение в пределах референтных значений, антитела к H. pylori класса IgG отрицательные, незначительно повышен уровень гастрина-17 (8,2 пмоль/л при норме до 7,6 пмоль/л). Уровни гемоглобина, ферритина, витамина В12, тиреотропного гормона соответствуют норме. Антитела к париетальным клеткам желудка и к внутреннему фактору Кастла IgG не выявлены.
Пациентке рекомендовано чередование курсов ИПП в стандартной дозе две недели с ребамипидом восемь недель в течение одного года; препараты железа, витамин В12 – при необходимости. По данным просмотренной литературы ИПП могут оказывать положительное влияние на течение КГ, при этом имеют меньшее число потенциальных нежелательных явлений чем, например, стероиды. Ребамипид продемонстрировал свое положительное влияние на течение хронических атрофических гастритов, в т.ч. аутоиммунного гастрита, с высоким уровнем безопасности длительного приема [17, 18], поэтому в настоящее время рассматривается нами как один из потенциальных препаратов для курсового приема при КГ. Планируется контроль клинического анализа крови один раз в три месяца, ферритина и витамина В12 – один раз в шесть месяцев, контроль ЭГДС через один год.
Заключение
КГ представляет собой крайне редкую патологию неизвестной этиологии, которая может сочетаться с коллагенозным поражением тонкой и толстой кишок, а также с аутоиммунными и атопическими заболеваниями. Клиническая картина неспецифична и зависит от тяжести КГ и вовлеченности других органов ЖКТ в патологический процесс. По данным ЭГДС наиболее характерен узловатый вид слизистой оболочки желудка, однако возможно и отсутствие изменений. Для подтверждения диагноза КГ необходимо взятие мультифокальной биопсии из «западающих» (атрофированных) участков слизистой желудка с последующей их трихромной окраской по Массону. Терапия КГ в настоящее время не разработана.
Авторы заявляют об отсутствии конфликта интересов.
Авторы выражают слова благодарности Владе Феликсовне Поповой – первому учителю и наставнику в мире эндоскопии: «Спасибо, что учили не сдаваться при столкновении с трудностями и не отказываться от сложных случаев, спасибо за теплое отношение и веру в своих учеников».
O.M. Berko, I.A. Karabak, PhD, I.A. Red’ka, S.M. Lobach, PhD, N.Yu. Semenova, PhD
North-Western Bistrict Scientific and Clinical Center Named after L. G. Sokolov Federal, St. Petersburg
Morpholab LLC, St. Petersburg
Contact person: Olesya M. Berko, berkoolesya@yandex.ru
Collagenous gastritis is a rare disease of unknown etiology, which can be verified only by the results of histological examination, provided that a biopsy of the gastric mucosa is performed correctly. There are no more than 100 clinical cases describing patients with collagenous gastritis have been published. For this reason, treatment regimens have not been developed, and the prognosis of the disease is unclear. This article is a literature review and a description of a clinical case of a patient with collagenous gastritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.