Комплексный подход к лечению возрастной макулярной дегенерации в России. Диагностика и клиническая практика ведения пациентов с ВМД. Вебинар «Взгляд через океан: Россия – США. Актуальные вопросы офтальмологии: в фокусе – ВМД»
- Аннотация
- Статья
- Ссылки
Возрастная макулярная дегенерация (ВМД) – распространенное инвалидизирующее состояние, которое начинается с незначительных нарушений зрения и может прогрессировать до полной потери центрального зрения. Это гетерогенное состояние возникает из-за сложного взаимодействия между возрастом, генетикой и факторами окружающей среды, включая курение, инсоляцию и диету. ВМД – основная причина слепоты в промышленно развитых странах. Прогнозируется, что во всем мире число людей с ВМД увеличится с 196 млн в 2020 г. до 288 млн к 2040 г. При этом максимальное количество людей с этим заболеванием будет отмечаться в Азии1. Между географическими областями наблюдаются четкие закономерности распространенности различных фенотипов ВМД, которые не полностью объясняются различиями в популяциях.
Согласно принятой международной классификации AREDS, выделяют четыре стадии ВМД: отсутствие ВМД (категория 1 AREDS), ранняя стадия (категория 2), промежуточная стадия (категория 3) и поздняя стадия (категория 4), которую в свою очередь подразделяют на атрофическую (сухую) и неоваскулярную (влажную) форму ВМД. В ряде случаев атрофическая и неоваскулярная формы могут сочетаться.
Ранние и промежуточные стадии, когда визуальные симптомы обычно отсутствуют или слабо выражены, характеризуются ретинальными отложениями (друзами) и пигментными аномалиями. Первыми клиническими симптомами ВМД являются друзы – продукты метаболизма клеток пигментного эпителия сетчатки, расположенные между базальной пластинкой пигментного эпителия и эластическим слоем мембраны Бруха. Они могут быть представлены в виде кутикулярных (твердых мелких – 50–75 мкм), мягких друз (63–1000 мкм) и пахидруз – мягких друз на фоне «толстой» хориоидеи. Кроме того, выделяют особый вид ретинальных отложений – псевдодрузы, или субретинальный друзеноидный материал, который располагается над ретинальным пигментным эпителием (РПЭ) и внедряется в слои нейроэпителия. Как правило, эти отложения быстрее приводят к прогрессированию ВМД. И друзы, и псевдодрузеноидный материал считаются проявлениями хронической ишемии и воспалительного процесса на уровне мембраны Бруха и РПЭ, но скорость и риски прогрессирования ВМД неодинаковы при выявлении различных видов друз.
Оценка риска прогрессирования ВМД из ранних стадий в поздние крайне важна для выбора адекватной тактики ведения и мониторирования больных. В 2018 г. R.F. Spaide предложил классификацию оценки риска прогрессирования ВМД, основанную на типах экстрацеллюлярных депозитов2. Согласно этой классификации, наличие пахидруз определяет более вероятное развитие на поздних стадиях хориоидальной неоваскуляризации (ХНВ) с высоким риском развития ангиоматозной формы ХНВ 1-го типа – полипоидной хориоидальной васкулопатии (ПХВ), наличие единичных субретинальных друзеноидных депозитов предполагает в большей степени вероятности развитие ХНВ 2-го и 3-го типов. При сливных субретинальных друзеноидных депозитах высок риск развития географической атрофии (ГА). Мягкие друзы на фоне прогрессирования заболевания могут приводить в равной степени к развитию как ГА, так и ХНВ всех трех типов.
Постановка диагноза ВМД начинается с правильной дифференциации вида друз. Это позволяет оценить риски прогрессирования ВМД и в ряде случаев установить диагноз вида ХНВ только по данным оптической когерентной томографии (ОКТ) без использования дополнительных методик (ОКТ-ангиография (ОКТ-А), флуоресцентная ангиография (ФАГ), индоцианиновая ангиография (ИАГ)).
М.М. Архипова привела несколько примеров. Выявление пахидруз на одном глазу указывает, что развившаяся неоваскулярная ВМД на парном глазу скорее всего является ХНВ 1-го типа и имеет подтип ПХВ. Быстрый и точный диагноз поможет врачу сделать правильный выбор терапии.
Следующая стадия – промежуточная, когда присутствуют сливные друзы более 125 мкм, друзеноидные или серозные аваскулярные отслойки пигментного эпителия (ОПЭ) либо географическая атрофия, не затрагивающая фовеа. Наибольшую диагностическую трудность в реальной практике российского врача представляют высокие ОПЭ, которые могут быть как аваскулярными, так и васкулярными. Международным золотым стандартом при таких формах ВМД является ИАГ, позволяющая определить наличие или отсутствие неоваскуляризации. В нашей стране на текущий момент это исследование недоступно, чем обусловлены определенные трудности при постановке диагноза. В такой ситуации трудно переоценить диагностическую значимость структурной ОКТ, ОКТ-А и внимательное динамическое наблюдение за больным, которые помогают своевременно выявить неоваскуляризацию и назначить адекватную терапию.
Как быстро серозная аваскулярная ОПЭ переходит в неоваскулярную форму ВМД? М.М. Архипова представила собственные клинические данные различных вариантов течения ВМД. У одного пациента без лечения прогрессирование друз с развитием серозной аваскулярной ОПЭ заняло год, а последующее прогрессирование ОПЭ в неоваскулярную стадию ХНВ с потерей зрения – еще семь лет. У другого пациента (70-летняя женщина) с ВМД без лечения в течение четырех-пяти лет аваскулярная ОПЭ на одном глазу трансформировалась в ГА, на другом глазу ГА перешла в активную неоваскулярную стадию, а спустя еще пять лет на глазу с ГА развилась неоваскулярная форма. Таким образом, сформировалась смешанная поздняя форма ВМД.
Далее М.М. Архипова акцентировала внимание коллег на важности мультимодальной диагностики ВМД, включающей помимо стандартного офтальмологического обследования ОКТ, ОКТ-А, ФАГ, ИАГ.
ФАГ глазного дна, применяемая с 1961 г., позволяет установить диагноз классической, скрытой или смешанной формы ХНВ. ИАГ, которая используется в офтальмологии с 1992 г., имеет наибольшее диагностическое значение при выявлении пахихориоидальных состояний, ХНВ, ПХВ, ретинальной ангиоматозной пролиферации.
Международный консенсус по номенклатуре неоваскулярной ВМД (2020) содержит новую терминологию3. Вместо ХНВ введен термин макулярной неоваскуляризации (МНВ), вместо ПХВ – аневризматический тип МНВ 1-го типа. В консенсусе также обозначены все ОКТ-термины, которые используются в рутинной практике: субретинальная жидкость, интраретинальная жидкость, интраретинальные кисты, субретинальный друзеноидный депозит, макулярная атрофия, гиперрефлективный материал и др.
Макулярная неоваскуляризация 1-го типа располагается под пигментным эпителием и, как правило, сопровождается развитием ОПЭ. Золотым стандартом диагностики аневризматического типа МНВ 1-го типа, или ПХВ, признана ИАГ. ФАГ позволяет верифицировать ПХВ в 30–50% случаев, ОКТ-А – в 50–70% случаев.
МНВ 2-го типа, или ХНВ 2-го типа (классическая), располагается над пигментным эпителием. Она хорошо диагностируется с помощью ФАГ или ОКТ-А. МНВ 3-го типа, или ретинальная ангиоматозная пролиферация, начинается в глубоких слоях плексиформного сплетения, то есть в нейроэпителии. ФАГ и ОКТ-А позволяют установить диагноз на ранней стадии. Однако на стадии ретино-хориоидального анастомоза при прогрессировании МНВ 3-го типа более эффективным методом диагностики считается ИАГ.
В настоящее время принята новая классификация географической атрофии. В ней представлены следующие четыре стадии:
- полная атрофия РПЭ и наружных слоев сетчатки (cRORA);
- неполная атрофия РПЭ и наружных слоев сетчатки (iRORA);
- полная атрофия наружных слоев сетчатки (cORA);
- неполная атрофия наружных слоев сетчатки (iORA).
Знание стадий ГА позволяет оценить риски прогрессирования ГА и прогноза по остроте зрения4.
Следующим важным моментом в ведении пациентов является выяснение управляемых и неуправляемых факторов развития и прогрессирования ВМД. Согласно отечественным и международным клиническим рекомендациям (2020), для возникновения и прогрессирования ВМД имеет значение целый комплекс факторов: неуправляемые факторы риска, на которые невозможно повлиять (возраст, семейный анамнез, генетика, расовая принадлежность), и управляемые факторы риска, которые можно устранить (курение, избыточная инсоляция, артериальная гипертензия, нарушение липидного обмена, низкая концентрация антиоксидантов в крови и др). Начинать лечение любой формы и стадии ВМД надо по возможности с устранения управляемых факторов: защищать глаза от ультрафиолетового излучения, обращать внимание пациентов на важность прекращения курения, направлять пациентов на консультацию к терапевту, эндокринологу для коррекции системных нарушений и конечно же восполнять дефицит антиоксидантов.
Консервативное лечение предусматривает применение витаминно-минеральных антиоксидантных комплексов с содержанием лютеина и зеаксантина (AREDS-формула). М.М. Архипова подчеркнула, что назначение нутрицевтиков AREDS-формулы прописано во всех международных рекомендациях и является неотъемлемой частью врачебных рекомендаций для пациентов с ВМД во всем мире.
Исследованию нутрицевтиков у больных ВМД посвящен ряд международных исследований – AREDS, LUNA, CARMA, AREDS 25–7. Субстанции для исследований были предоставлены компанией Bausch & Lomb и позднее вошли в состав биологически активной добавки (БАД) к пище Окувайт Форте. В исследованиях CARMA показано, что пациенты с ВМД имеют сниженную плотность макулярного пигмента в связи с недостатком потребления лютеинов и зеаксантина. В исследовании LUNA дополнительный прием лютеина и зеаксантина в сочетании с антиоксидантами приводил к повышению оптической плотности макулярного пигмента (ОПМК) в центральной зоне сетчатки. В ходе исследований была определена оптимальная продолжительность курса терапии нутрицевтиков с лютеином и зеаксантином, по данным ОПМК, – четыре месяца непрерывного приема.
Сегодня на отечественном фармацевтическом рынке представлены три нутрицевтика компании Bausch Health: Окувайт Форте, Окувайт Макс, Визлея. Разные формы выпуска (капсулы, саше) и разный состав витаминов и минералов позволяют осуществлять персонифицированный подход к лечению пациентов с ВМД.
Установлено, что не все каротиноиды одинаково усваиваются и достигают сетчатки. У пожилых пациентов с хроническими заболеваниями печени, при недостаточности печеночной липазы8, с заболеваниями поджелудочной железы, желудка, у больных дислипидемией, сахарным диабетом, принимающих статины, у людей, перенесших инфекционные и вирусные заболевания, может развиваться синдром мальабсорбции. При этом резко снижается усвояемость каротиноидов и развивается хронический дефицит антиоксидантов и лютеина/зеаксантина.
Технология микрокапсулирования в Окувайт Форте позволяет увеличить биодоступность каротиноидов и преодолеть барьер нарушения усвояемости каротиноидов при различных нарушениях. Микрокапсулы, содержащиеся в таблетке Окувайт Форте (6 мг лютеина, 0,5 мг зеаксантина, 60 мг витамина C, 8,8 мг витамина E, 5 мг цинка, 20 мкг селена), обеспечивают контролируемое и постепенное высвобождение, повышая биодоступность и снижая риск негативного влияния на желудочно-кишечный тракт (ЖКТ). Окувайт Форте показан всем пациентам с любой формой и стадией ВМД, особенно пожилым лицам с нарушением функции печени, ЖКТ, дислипидемией, сахарным диабетом, синдромом мальабсорбции.
Окувайт Макс выпускается в форме стика (порошок, не требующий растворения) и включает 10 мг лютеина, 2 мг зеаксантина, 180 мг витамина C, 30 мг витамина E, 15 мг цинка и 150 мг омега-3 жирных кислот. Оптимальное содержание биологически активных веществ, способствующее быстрой коррекции дефицита витаминов и микроэлементов, и форма выпуска позволяют назначать Окувайт Макс более молодым пациентам с ВМД, миопией, компьютерным синдромом, синдромом сухого глаза и блефаритом, особенно при сниженном иммунитете и нарушении функции глотания.
Витаминно-минеральный комплекс Визлея – это уникальный комплексный препарат с дополнительными компонентами для укрепления сосудистой стенки эндотелия и дополнительной нейропротекции. Препаратов, состав которых соответствовал бы составу Визлея, в нашей стране нет. Витаминно-минеральный комплекс Визлея предназначен для восполнения дефицита биологически активных веществ в качестве источника каротиноидов (лютеина, зеаксантина), троксерутина, дополнительного источника витаминов группы B (В1, В2, ниацина (B3), В6, фолиевой кислоты (В9), В12), витаминов C и E, микроэлементов (цинка, меди, селена), омега-3 жирных кислот (докозагексаеновой и эйкозапентаеновой кислот). Это уникальная поливитаминная капсула с нейропротекторным и ангиопротекторным действием. Именно поэтому витаминно-минеральный комплекс Визлея может быть рекомендован в качестве БАД к пище не только при ВМД, но также при сочетанной офтальмологической патологии и сопутствующих заболеваниях, таких как диабетическая ретинопатия, окклюзии вен сетчатки, глаукома, наследственные формы патологии сетчатки, повреждение зрительного нерва, атрофия зрительного нерва различного генеза, осложненная миопия.
Окувайт Форте, Окувайт Макс и Визлея удобны в использовании, принимаются один раз в день. Поскольку каждый из препаратов имеет свои особенности и преимущества, М.М. Архипова предложила комбинировать курсы различных нутрицевтиков. Например, пациентам с ВМД и сахарным диабетом вначале назначают Окувайт Форте по одной таблетке в сутки четыре месяца с перерывом в течение трех-четырех месяцев и последующим назначением препарата Визлея по одной капсуле в сутки на протяжении четырех месяцев. У пациентов с миопией можно начинать курс с Окувайт Макс по одному саше в день в течение двух месяцев с четырехмесячным перерывом. Курс повторять с использованием комплекса Визлея по одной капсуле в день на протяжении двух месяцев.
Эффективность нутрицевтиков при ВМД М.М. Архипова продемонстрировала на клинических примерах.
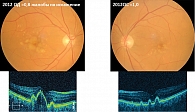
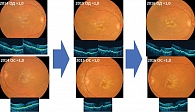
Клинический случай 1. Пациентка в 2012 г. обратилась в клинику с жалобами на снижение зрения на правом глазу и искажение изображения. При обследовании: ВМД на правом глазу (OD 0,8) с промежуточной стадией прогрессирования (ОПЭ) и ранней стадией (друзы) на левом глазу (OS 1,0) (рис. 1). Пациентка принимала Окувайт Форте по одной таблетке в день курсами по четыре месяца два раза в год в течение восьми лет. Динамическое наблюдение в 2013 г. показало замедление прогрессирования ВМД на правом глазу и сохранение остроты зрения после года лечения (OD 0,8) с последующим снижением зрения и неполной атрофией пигментного эпителия наружных слоев сетчатки через три года (OD 0,5) вплоть до полной атрофии в фовеа еще через четыре года и снижением зрения до 0,2 (OD 0,2) (рис. 2).
На фоне приема Окувайт Форте отмечалось более выраженное замедление прогрессирования ВМД с ранней стадией на левом глазу и менее значимым снижением зрения. За восемь лет острота зрения левого глаза снизилась на 0,2 – с 1,0 в 2012 г. до 0,8 в 2019 г. (рис. 3). С помощью нутрицевтиков нельзя вылечить больных с уже имеющимися клиническими проявлениями заболевания, но можно отсрочить возникновение более поздних форм и продлить работоспособность и способность видеть. Естественно, более раннее назначение лютеинсодержащих нутрицевтиков дает более выраженный эффект отсрочки развития осложнений. Данный клинический случай наглядно показывает, что применение нутрицевтиков существенно замедлило риск прогрессирования заболевания на глазу с более ранней стадией ВМД (друзы) и сохранило высокие зрительные функции на протяжении восьми лет.
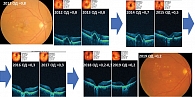
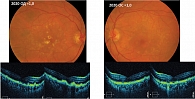
Клинический случай 2. Пациентка с ВМД промежуточной стадии (сливные друзы) на обоих глазах с 2013 г. в течение семи лет ежедневно принимала Окувайт Форте по одной таблетке в сутки (рис. 4). На фоне ежедневного приема Окувайт Форте к 2020 г. удалось добиться полного регресса друз на левом глазу и их значительного уменьшения на правом глазу с сохранением остроты зрения (ОD 1,0, OS 1,0) (рис. 5).
Таким образом, применение Окувайт Форте ассоциируется со снижением риска прогрессирования ВМД с сохранением более высоких зрительных функций, особенно на раннем этапе лечения (рис. 6).
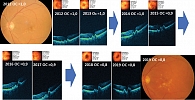
Клинический случай 3. Пациент 65 лет обратился к специалисту в мае 2011 г. по поводу ВМД с поздней неоваскулярной стадией (активная ХНВ), несмотря на проведенную в 2010 г. лазеркоагуляцию ХНВ. Данные ФАГ: OD 0,9, OS 0,01 (низкое зрение парного глаза с умеренным риском прогрессирования). Пациенту назначены анти-VEGF-терапия и нутрицевтик Окувайт Лютеин Форте (впоследствии Окувайт Форте) на постоянной основе.
В течение двух с половиной лет пациент получил 16 инъекций анти-VEGF-препаратами на фоне постоянного приема Окувайт Форте один раз в сутки. С 2014 г. анти-VEGF-терапии не получает, продолжает принимать Окувайт Форте по одной таблетке ежедневно. По состоянию на 2021 г.: максимально корригированная острота зрения (МКОЗ) 1,0, активности ХНВ нет, факичный глаз.
Интересна одна закономерность: во всех приведенных клинических случаях у пациентов, принимавших на регулярной основе Окувайт Форте, не наблюдалось прогрессирования катарактогенеза, все пациенты оставались факичными. Этот дополнительный бонус очень важен для данной группы пациентов, поскольку собственно хирургическое вмешательство по удалению катаракты служит фактором риска активации неоваскулярной ВМД (нВМД) и прогрессирования ГА.
Далее М.М. Архипова коснулась вопросов лечения пациентов с нВМД. Согласно отечественным и международным клиническим рекомендациям, при нВМД первой линией терапии активной ХНВ считаются интравитреальные инъекции ингибиторов ангиогенеза. Лазерное лечение проводится только при экстрафовеолярной локализации активной формы ХНВ. При особых формах ВМД (ПХВ) можно проводить фотодинамическую терапию (ФДТ) в сочетании с ингибиторами ангиогенеза с использованием контрастных методов исследования (ФАГ, ИАГ, ОКТ). Однако, учитывая сложившуюся ситуацию с контрастными методиками и отсутствием качественных фотосенсибилизаторов, проведение эффективной ФДТ в нашей стране на сегодняшний день невозможно.
Основные принципы ведения пациентов с нВМД включают правильную постановку диагноза, своевременное начало терапии, регулярное лечение на основе мониторинга, следование проактивным режимам дозирования. Об активной форме нВМД свидетельствуют наличие субретинальной, интраретинальной жидкости, жидкости под пигментным эпителием, увеличение толщины сетчатки, появление свежих кровоизлияний, а также ликеджа по данным ФАГ, ИАГ, ОКТ-А9, 10.
Все типы жидкости патологические11, 12. Жидкость появляется последовательно – сначала под пигментным эпителием, затем под нейроэпителием и, наконец, в интраретинальных слоях. При такой последовательности все типы жидкости в сетчатке могут рассматриваться как проявление заболевания, что указывает на необходимость контроля с помощью соответствующих терапевтических стратегий.
В post-hoc-анализе исследований CATT и IVAN оценивали взаимосвязь между флуктуацией толщины сетчатки и развитием субретинального фиброза и макулярной атрофии, а также остротой зрения12. Показано, что группа с колебаниями центральной толщины сетчатки менее 34 мкм имела лучшую конечную остроту зрения и меньше проявлений фиброза и макулярной атрофии. Повышение флуктуации толщины сетчатки при нВМД связано с худшей МКОЗ, развитием субретинального фиброза и макулярной атрофии.
В подтверждение того, что пациенты с сухой макулой на ОКТ демонстрируют лучшие результаты, М.М. Архипова привела данные собственного клинического наблюдения.
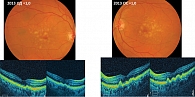
Клинический случай 4. Пациентка В. 70 лет длительно страдает ВМД, но в течение нескольких лет лечения не получала. По состоянию на 2008 г.: OD 0,5, OS 0,7. По состоянию на 2012 г.: OD 0,1, OS 0,6. С 2012 г. по 2014 г. в рамках протокола рандомизированного клинического исследования (РКИ) ей проводилась анти-VEGF-терапия ВМД на левом глазу, что позволяло поддерживать хороший функциональный результат без прогрессирования и снижения остроты зрения. С 2015 г. пациентка вышла из РКИ и попала в реальную клиническую практику, в рамках которой получала инъекции анти-VEGF-препаратами нерегулярно – от двух до четырех инъекций в год. Результатом нерегулярной анти-VEGF-терапии при наличии субретинальной жидкости (СРЖ) в сетчатке (80–100 мкм) стало прогрессивное снижение остроты зрения до 0,1 на левом глазу в 2021 г., а также нарастание фиброза и макулярной атрофии. Таким образом, нВМД с хронической СРЖ даже в небольших объемах в течение десяти лет привела к полной потере зрения.
В европейских консенсусных рекомендациях 2021 г. жидкость признана критическим биомаркером, диагноз нВМД устанавливается на основании определяемых на ОКТ морфологических параметров, включающих субретинальную и интраретинальную жидкость, с последующим проведением ОКТ-А, а при ее недоступности – ФАГ или ангиографии с индоцианином зеленым. Для констатации клинических проявлений нВМД выполняют стереоскопию и фоторегистрацию.
Анти-VEGF-терапия назначается в течение первой недели с момента постановки диагноза нВМД и начинается с загрузочной фазы в виде не менее двух интравитреальных инъекций с месячным интервалом (фаза загрузки определяется индивидуально в зависимости от ответа на терапию), с последующим проактивным лечением (режим Treat & Еxtend) и оценкой активности заболевания по данным ОКТ. При наличии признаков активности интервал между инъекциями сокращается до минимального – четырех недель, при отсутствии признаков активности интервал увеличивается на 2–4 недели до максимального – 16 недель. При неэффективности 3–6 инъекций одного анти-VEGF-препарата врач может принять решение о переключении на другой анти-VEGF-препарат. Прекращение терапии возможно при отсутствии активности заболевания на протяжении трех последовательных инъекций при 12-недельном интервале, а также в случае возникновения осложнений в виде обширных ретинальных, субретинальных кровоизлияний в макулярной области, формирования грубого обширного фиброваскулярного рубца, когда прогноз по зрению становится сомнительным, а проведение анти-VEGF-терапии – нецелесообразным.
Важность соблюдения режимов и внимательного отношения к признакам активности нВМД, особенно к СРЖ, М.М. Архипова продемонстрировала на клиническом примере.
Клинический случай 5. Пациент З. 65 лет страдал нВМД в течение пяти лет. Анти-VEGF-терапии не получал. На правом глазу – большая мембрана с активностью (OD 0,3), на левом глазу – фиброз (OS 0,05). Пациенту назначили анти-VEGF-терапию в режиме Treat & Еxtend, на фоне которой отмечалось улучшение остроты зрения до 0,6. Наличие небольшой СРЖ не позволяло увеличить интервал между процедурами. При очередном осмотре в ноябре 2019 г. наличие активности с возможным переходом в ПХВ дало основание назначить следующий укол через восемь недель (в декабре 2019 г.). Однако пациент не пришел на очередную инъекцию через восемь недель, сославшись на занятость, и ровно через месяц (через 12 недель от последнего укола), в январе 2019 г., обратился к специалисту по поводу резкого снижения зрения. Подобное нарушение схемы лечения привело к необратимым последствиям (Visus 0,1) и высокой геморрагической активности.
Анти-VEGF-терапия не показана при отсутствии признаков активности заболевания, а также при наличии друзеноидной, псевдовителлиформной ОПЭ или фиброзной ОПЭ, табулляции, дегенеративных кист нейроэпителия как проявления нейродегенеративного процесса, а не активности мембраны, а также при наличии крупных стволов хориоидальной неоваскуляризации по данным ОКТ-А без других признаков активности процесса.
Резюмируя сказанное, М.М. Архипова констатировала, что ВМД – заболевание, не до конца изученное. Тем не менее современные научные достижения меняют устоявшиеся представления о его патогенезе и способствуют появлению новых методов диагностики и лечения. При этом нутрицевтики с лютеином и зеаксантином остаются неотъемлемой составляющей лечения пациентов с ВМД на любой стадии и при любой форме заболевания.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.