Эволюция применения ингибиторов ангиогенеза в офтальмологии
- Аннотация
- Статья
- Ссылки
- English
Цель данного обзора – проанализировать эволюцию анти-VEGF-терапии по данным многочисленных публикаций с акцентом на ближайшую перспективу в аспекте достижений в области искусственного интеллекта, а также персонализированного подхода к лечению. Особого внимания заслуживают применение препаратов длительного действия и поиск новых терапевтических мишеней для лекарственных средств, что станет доступно в течение следующего десятилетия.
Цель данного обзора – проанализировать эволюцию анти-VEGF-терапии по данным многочисленных публикаций с акцентом на ближайшую перспективу в аспекте достижений в области искусственного интеллекта, а также персонализированного подхода к лечению. Особого внимания заслуживают применение препаратов длительного действия и поиск новых терапевтических мишеней для лекарственных средств, что станет доступно в течение следующего десятилетия.

В 2004 г. в офтальмологии произошло важное событие – началась новая эра в лечении заболеваний сетчатки. Этому способствовало одобрение для применения в клинической практике первого ингибитора сосудистого эндотелиального фактора роста (VEGF) для лечения неоваскулярной возрастной макулярной дегенерации (нВМД). До того момента у пациентов с данной патологией использовались в основном методы лазерной фотокоагуляции и фотодинамической терапии (ФДТ), а при диабетическом макулярном отеке (ДМО) – лазерная коагуляция сетчатки. Указанные методы в ряде случаев вызывали побочные явления и в лучшем случае лишь замедляли скорость потери зрения [1–5].
С внедрением анти-VEGF-терапии появилась возможность восстановить функционально значимое зрение у пациентов с данной патологией [1], повысить качество их жизни и сменить парадигму лечения от сохранения зрительных функций к его восстановлению. Вместе с тем указанные виды патологии сетчатки остаются ведущими причинами зрительных нарушений [6] и связанных с ними высоких социально-экономических затрат [7].
Цель данного обзора – проанализировать эволюцию анти-VEGF-терапии по данным многочисленных публикаций с акцентом на ближайшую перспективу, связанную как с достижениями в области искусственного интеллекта, так и персонализированным подходом к лечению. Особого внимания заслуживают применение препаратов длительного действия и поиск новых терапевтических мишеней для лекарств, что станет доступно в течение следующего десятилетия.
Ангиогенез и его патофизиологическое значение
Ангиогенез является ключевым процессом развития и функционирования тканей как в нормальных, так и в патологических условиях. Многочисленные факторы и системы, такие как сосудистый эндотелиальный фактор роста (vascular endothelium growth factor, VEGF) и его рецепторы (VEGF-VEGFRs), рецепторная ось ангиопоэтина, рецепторный путь эфрина-Eph, инсулиноподобный фактор роста 1, интерлейкин 8, фактор роста тромбоцитов, путь Delta-Notch и путь Netrins UNC5R, участвуют в процессе ангиогенеза [8, 9]. Его реализация происходит, как правило, за счет взаимодействия VEGF с соответствующим рецептором.
VEGF – важный фактор глазного гомеостаза [9]. Он может вырабатываться не только эндотелиальными клетками сосудов или перицитами, но также нейронами и астроцитами сетчатки, клетками Мюллера, пигментным эпителием сетчатки и даже непигментированным ресничным эпителием [9, 10].
К семейству VEGF у человека относятся пять молекул: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PlGF). Они связываются с рецепторами VEGFR1, VEGFR2 и VEGFR3 [11].
Именно при связывании указанных молекул с рецепторами VEGFR2 активизируется процесс роста эндотелиальных клеток, усиливаются их миграция, способность к выживанию, запускается процесс неоангиогенеза и происходит формирование сосудов. PlGF, VEGF-B и VEGF-A могут активировать и VEGFR1. Рецепторы VEGFR1 участвуют в поддержании хемотаксиса моноцитов и ингибировании созревания дендритных клеток. [12]. Молекулы VEGF-C и VEGF-D способны активировать VEGFR3, участвующий в лимфоангиогенезе [11].
Кроме того, VEGF-C и его рецептор VEGFR3 необходимы для развития шлеммова канала [9]. На экспериментальной модели показано, что пролиферация и рост эндотелиальных клеток шлеммова канала приводят к снижению внутриглазного давления (ВГД) [9, 13].
VEGFA является основным фактором физиологического и патологического ангиогенеза [9]. Изоформы VEGF-A, такие как VEGF-A121, VEGF-A145, VEGF-A165, VEGF-A189 и VEGF-A206, классифицируются по количеству аминокислот [14]. Среди них VEGF-A165 считается наиболее мощным и распространенным [9]. Он действует за счет связывания как с VEGFR1, так и с VEGFR2, индуцирует ангиогенез, миграцию клеток и проницаемость сосудов [9]. VEGF-A121 способствует пролиферации эндотелиальных клеток, но, как и VEGF-A189, характеризуется способностью индуцировать пролиферацию фибробластов [9].
Разработка интравитреальных ингибиторов VEGF
Начиная с 1948 г. стали появляться данные, подтверждающие, что диффундирующий химический фактор, исходящий из сетчатки, управляет развитием ее сосудистой сети [1]. Фактор X, как его назвал Д. Уайз, оказался непосредственно связан с гипоксией сетчатки. Доказано, что гипоксия – главный стимул повышения VEGF [7].
Таким образом, 50-летний поиск фактора X завершился открытием VEGF и определением его центральной роли в диабетической ретинопатии (ДР), ДМО и развитии макулярного отека при окклюзиях вен сетчатки [1]. Кроме того, было показано, что VEGF играет ключевую роль в неишемических заболеваниях сетчатки, таких как нВМД и миопическая хориоидальная неоваскуляризация [1].
Первым препаратом, зарегистрированным FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) в декабре 2004 г. для лечения возрастной макулярной дегенерации в офтальмологии, стал пегаптаниб (Макуген) – адаптомер (олигонуклеотид), который специфически связывается с изоформой VEGF-A165.
В исследовании было продемонстрировано, что пегаптаниб снижает потерю букв при нВМД на 50% через 54 недели [1]. В отличие от стандартного лечения того времени вертепорфином пегаптаниб был эффективен при всех формах нВМД [1]. Однако новые препараты, способные блокировать большее число изоформ VEGF-A и соответственно более эффективные, постепенно вытеснили Макуген. На смену ему пришел бевацизумаб (Авастин).
Бевацизумаб (Авастин) – гуманизированное рекомбинантное моноклональное антитело. Препарат селективно связывает все изоформы VEGF-А и нейтрализует его. Кроме того, препарат блокирует связывание VEGF с рецепторами 1-го и 2-го типа (VEGFR1 и VEGFR2), расположенными на поверхности эндотелиальных клеток. Бевацизумаб не был одобрен FDA для применения в офтальмологии. Бевацизумаб, молекулярная масса которого составляет около 149 кДА (табл. 1), не предназначен для интравитреального введения. Ранее высказывались предположения о способности проникновения препарата в сетчатку глаза и хориоидею, а также об ухудшении работы трабекулярной сети на фоне его применения. В конечном итоге эти предположения не подтвердились, но послужили толчком к разработке более мелких молекул анти-VEGF-препаратов [15–17].
В 2006 г. компания Genentech вывела на рынок лекарственный препарат ранибизумаб – гуманизированное моноклональное антитело – антигенсвязывающий фрагмент (Fab) против VEGF-A и всех его изоформ [9, 18] молекулярной массой 48 кДа (табл. 1).
Ранибизумаб стал первым препаратом, который восстанавливал функционально значимое зрение у многих пациентов с нВМД и значительно снижал риск прогрессирования слепоты [1].
В рандомизированном контролируемом исследовании нВМД процент пациентов с показателем остроты зрения по Снеллену ≥ 20/40 увеличился с 4 в начале исследования до 39 после 12 месяцев ежемесячного использования ранибизумаба 0,5 мг [1]. Частота необратимой слепоты (≤ 20/200) в пораженном глазу снизилась с 23% в начале исследования до 16% через 12 месяцев ежемесячного приема ранибизумаба 0,5 мг. В то же время в группе вертепорфина этот показатель почти удвоился (с 32 до 60%) [1]. Ранибизумаб – первый анти-VEGF-препарат, одобренный для лечения ДМО – основной причины потери зрения при ДР. Впоследствии он был одобрен для лечения пациентов с собственно ДР [1]. В глазах с потерей зрения из-за ДМО процент пациентов с показателем остроты зрения 20/40 в двух регистрационных исследованиях возрос с 14–19 в начале исследования до 54–60 после 12 месяцев ежемесячного использования ранибизумаба 0,3 мг [1]. Улучшение зрения сопровождалось значительным уменьшением тяжести ДР. Многие глаза с пролиферативной ДР вернулись к непролиферативной ДР – форме заболевания, менее угрожающей зрению [1].
Ранибизумаб эффективен при миопической хориоидальной неоваскуляризации. В исследовании свыше 37% пациентов, получавших ранибизумаб, могли прочесть ≥ 15 букв через три месяца его применения. В группе фотодинамической терапии такой результат наблюдался менее чем у 15% пациентов [1].
Два знаковых исследования BRAVO (тромбоз ветви центральной вены сетчатки (ЦВС)) и CRUISE (окклюзия ЦВС) в 2010 г. показали эффективность ранибизумаба в аспекте улучшения остроты зрения у пациентов с макулярным отеком на фоне ретинальных венозных окклюзий [19–21].
Следующим препаратом в эволюции анти-VTGF-терапии стал афлиберцепт. Афлиберцепт (Эйлеа), разработанный в 2011 г. как VEGF-ловушка, представляет собой рекомбинантный слитый белок-приманку молекулярной массой 115 кДа, состоящий из VEGF-связывающих доменов VEGFR1 и VEGFR2 человека, объединенных с Fc-доменом иммуноглобулина G1 человека [1]. Препарат связывает не только все формы VEGF-A, но и плацентарный фактор роста с более высокой аффинностью по сравнению с ранибизумабом [9, 22].
Эффективность данного препарата в повышении остроты зрения при нВМД сопоставима с таковой ранибизумаба [22]. Тем не менее при нВМД и ДМО/ДР используется однократная инъекция каждые восемь недель (после трех ежемесячных загрузочных доз) [22].
Афлиберцепт превосходит ранибизумаб и бевацизумаб у пациентов с исходным показателем остроты зрения по Снеллену при ДМО 20/50 или хуже. Но при исходной остроте зрения 20/40 существенной разницы между ранибизумабом и бевацизумабом нет [23, 24].
Результаты исследований VIBRANT (интравитреальное введение афлиберцепта при макулярном отеке после окклюзии ветви ЦВС) 2015 г., COPERNICUS (интравитреальное введение афлиберцепта при макулярном отеке) и GALILEO 2012–2013 гг. продемонстрировали эффективность афлиберцепта при макулярном отеке на фоне ретинальных венозных окклюзий [25–27].
Попытки повысить эффективность анти-VEGF-терапии и увеличить интервалы между повторными интравитреальными введениями привели к поиску препаратов с еще более низкой молекулярной массой. Так, бролуцизумаб (Беову, Beovu), одобренный FDA для лечения нВМД и введенный в клиническую практику в ноябре 2019 г., представляет собой гуманизированный одноцепочечный фрагмент антитела, способный связывать все изоформы VEGF-A, молекулярной массой всего 26 кДа. Благодаря низкому молекулярному весу концентрация бролуцизумаба при его разведении может быть увеличена до 120 мг/мл, то есть при одной интравитреальной инъекции можно ввести 6 мг бролуцизумаба в 0,05 мл раствора. По молекулярной массе 6 мг бролуцизумаба соответствуют примерно 12 дозам афлиберцепта 2 мг и 22 дозам ранибизумаба 0,5 мг. Интравитреальное введение препарата в более высокой концентрации потенциально может сопровождаться большей продолжительностью его действия [28].
Исследования сравнительной эффективности афлиберцепта и бролуцизумаба (HAWK & HARRIER) продемонстрировали схожую клиническую эффективность в первые 48 недель лечения. В дальнейшем вплоть до 96-й недели лечения у пациентов, получавших бролуцизумаб, активность заболевания была статистически значимо ниже, чем у больных, получавших афлиберцепт [29, 30].
В настоящее время предпринимаются попытки применять анти-VEGF-препараты и при других заболеваниях сетчатки, например ретинопатии недоношенных и неоваскуляризации хориоидеи, вызванной иными формами офтальмопатологии, такими как ангиоидные полосы, травматический разрыв хориоидеи, полипоидная васкулопатия и глазной гистоплазмоз [9]. При всех этих заболеваниях указанные препараты не имеют прямого назначения, но их применение сопровождается должным эффектом [31].
Кроме того, анти-VEGF-терапия используется при неоваскуляризации роговицы [9]. Подобная терапия может применяться в качестве мощного адъюванта при операциях по поводу неоваскулярной глаукомы [9, 32, 33].
Cинтез VEGF может быть изменен путем блокирования экспрессии гена VEGF [9]. Предпринимаются попытки использовать РНК с малой интерференцией. Речь идет о последовательностях РНК-сайленсинга (siRNA), которые способны подавлять исходный ген из-за взаимной гомологии и тем самым ингибировать синтез и секрецию VEGF [9]. Эти частицы проникают через клеточные мембраны и индуцируют ингибирование посттранскрипционной обработки РНК, а следовательно, снижают как внутриклеточные, так и внеклеточные эффекты VEGF [9]. В настоящее время терапевтические агенты siRNA бевасираниб и SIRNA-027 тестируются при неоваскулярной ВМД и неоваскуляризации роговицы [9].
Еще один вариант ослабления функции VEGF – ингибирование передачи сигналов VEGF, например, путем блокирования рецепторов. Поскольку все формы VEGF действуют за счет стимуляции специфических рецепторов тирозинкиназы, ингибирование этих киназ может привести к подавлению их активности [9]. Ингибиторы мультикиназы, такие как сорафениб и сунитиниб, одобрены для лечения рака почек и гепатоцеллюлярного рака. Предпринимаются попытки внедрить данные препараты и в офтальмологию [9]. Еще один ингибитор тирозинкиназы пазопаниб (Вотриент) тестируется для лечения заболеваний сетчатки [9]. Установлено также, что агонисты гамма-рецептора, активируемого пролифераторами пероксисом (PPAR-гамма), способны ингибировать передачу сигналов VEGF [9]. Росиглитазон и пиоглитазон (агонисты PPAR-гамма) уже использовались в клинической практике при диабетической ретинопатии. Росиглитазон задерживал манифестацию ее пролиферативной стадии [9].
Местные и системные осложнения анти-VEGF-терапии
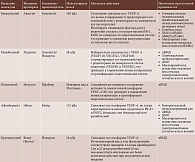
Спектр глазных заболеваний, при которых возможно применение анти-VEGF-терапии, продолжает расширяться. К счастью, побочные эффекты, возникающие на фоне частого введения анти-VEGF-препаратов, достаточно редки [9, 34]. Подобные осложнения разделяют на местные, системные и обусловленные собственно процедурой введения препарата (табл. 2).
Местные неблагоприятные последствия
Повышение ВГД. Возможно как кратковременное, так и устойчивое повышение ВГД после внутриглазного применения анти-VEGF-агентов [35].
Кратковременное повышение ВГД после интравитреальной инъекции длится не более часа [9, 36, 37], обусловлено увеличением объема стекловидного тела и компенсируется за счет увеличения оттока водянистой влаги [9].
Устойчивое повышение ВГД чаще наблюдается у пациентов с уже существующей глаукомой [38] и характеризуется подъемом ВГД > 21–25 мм рт. ст. или его повышением по сравнению с исходным уровнем ≥ 5 мм рт. ст., что требует назначения медикаментозной терапии либо проведения в ряде случаев хирургической операции [9, 35, 37].
К причинам офтальмогипертензии относится закупорка трабекулярной сетки частицами лекарственного средства [39], каплями силиконового масла с игл и шприцев, используемых производителями для смазки этих устройств [9, 35], а также трабекулит или субклинический увеит, вызванный анти-VEGF-препаратами [9, 36, 39].
Системные побочные эффекты
Поскольку концентрация анти-VEGF-препаратов в сыворотке крови после интравитреальных инъекций значительно ниже, чем после внутривенного введения, риск системных побочных эффектов, в частности острого повышения артериального давления, инфаркта миокарда, нарушения мозгового кровообращения и даже летального исхода, весьма незначителен [9].
Частота всех сердечно-сосудистых осложнений, транзиторных ишемических атак, инсультов и других случаев ишемии головного мозга составляет 2,2% у пациентов, получающих инъекции ранибизумаба (по сравнению с 0,7% у тех, кто получает фиктивное лечение). Связь между инъекциями ранибизумаба и развитием инфаркта миокарда не установлена [9].
Риск сосудистых осложнений со стороны глаз после инъекции анти-VEGF-препаратов составляет 0,108% в общей исследуемой популяции, что существенно ниже, чем в популяции больных диабетом (2,61%) [34].
Тяжелым осложнением интравитреального введения анти-VEGF-препаратов считается ретинохориоидальная васкулопатия (включая окклюзирующий васкулит), которая может возникнуть как при первой, так и при последующих инъекциях. Предположительной причиной развития данного осложнения является формирование локальных антител к анти- VEGF-препаратам.
Осложнения, связанные с процедурой инравитреального введения анти-VEGF-препаратов
Колебания ВГД и деформация глазного яблока во время инъекции могут привести к витреоретинальной тракции [9, 18], а следовательно, к кровоизлиянию в стекловидное тело, разрыву сетчатки, тракционной отслойке сетчатки, образованию макулярного отверстия.
Частота возникновения бактериального эндофтальмита [9, 18, 40], неинфекционного увеита и прогрессирования катаракты [9] невелика (табл. 2).
Способы повышения эффективности анти-VEGF-терапии
Реальные исследования в ряде стран показали, что принятие интравитреальной терапии против VEGF в качестве стандарта лечения способствовало снижению примерно на 50% числа людей, официально ослепших из-за нВМД [1]. Кроме того, подсчитано, что анти-VEGF-терапия может снизить двухлетнюю частоту нарушений зрения или необратимой слепоты из-за ДMO на 45 и 75% соответственно [6].
Согласно результатам ирландского эпидемиологического исследования, уровень слепоты из-за ДР снизился примерно на 50% с 2011 г. (30,9 на 100 тыс. пациентов с диабетом) по 2013 г. (14,9 на 100 тыс. пациентов с диабетом), что подтверждает важность программ скрининга диабетических заболеваний глаз и своевременного проведения анти-VEGF-терапии [41].
Необходимо отметить, что, несмотря на впечатляющие успехи данной терапии, в реальной практике миллионы людей с нВМД не достигают результатов, наблюдаемых в регистрационных исследованиях, и все еще страдают умеренным или тяжелым нарушением зрения или слепотой [6].
С какими проблемами это связано?
Проблема 1: гиподиагностика. Подсчитано, что до половины всех пациентов с ДР [1] и 25% пациентов с нВМД [21] могут оставаться недиагностированными, что лишает их возможности получить своевременное лечение и увеличивает риск необратимой потери зрения [1]. Вероятно, причина в том, что многие пациенты не посещают врача регулярно. Кроме того, стоимость программ скрининга по месту жительства остается высокой или подобные программы отсутствуют вовсе. Современные системы скрининга хотя и эффективны в некоторых странах, нередко ограничиваются ДМО/ДР или глаукомой и не охватывают другие заболевания сетчатки, такие как нВМД.
Возможное решение данной проблемы – удаленная диагностика с применением искусственного интеллекта (ИИ). Точные и простые в использовании диагностические инструменты обеспечивают быстрый и экономичный скрининг большого количества людей за пределами врачебных кабинетов на предмет любого заболевания сетчатки. Недавние достижения в области ИИ делают такой скрининг вполне реальным.
DL – deep learning (углубленное обучение) – компьютерная технология, одно из направлений в области машинного обучения, посредством которого анализируются обширные базы данных и сравниваются с условным эталоном. Поскольку большинство диагностических технологий в офтальмологии предоставляют клиницисту дополнительную информацию посредством цифрового анализа структур глаза, это делает область офтальмологии идеально подходящей для использования алгоритмов DL.
DL как составляющая ИИ использует компьютерную нейронную сеть, которая может обучаться на большой базе данных для обнаружения конкретной патологии. Этот подход все чаще используют в здравоохранении в целях диагностики и понимания патогенеза заболевания [27].
DL наиболее развито в области компьютерного зрения (оценка изображений). Алгоритмы способны оценить мельчайшие детали миллионов изображений с высоким разрешением для точной диагностики заболеваний и прогнозирования результатов. Применяемые в DL алгоритмы распознают особенности, которые не выявляются экспертами и/или которые не удается заподозрить из-за поиска иного результата. В результате не только повышается точность диагностики, но и появляется возможность лучше понять ранее неизвестные патофизиологические процессы [42].
Так, по цветной фотографии глазного дна алгоритмы визуализации в процессе DL позволяют точно предсказать возраст, пол, статус курения и систолическое артериальное давление [43]. При заболеваниях сетчатки обширные базы данных изображений оптической когерентной томографии (ОКТ) и фотографий глазного дна вместе с многолетними данными о зрительной функции и методах лечения представляют богатый ресурс для обучения таких алгоритмов.
В апреле 2018 г. FDA одобрило первый «облачный» алгоритм DL вместе с автономной камерой, снимающей изображение сетчатки, для автоматической идентификации глаз пациентов с ДР, требующих направления к офтальмологу [44]. В установленном тремя сертифицированными специалистами США по сетчатке алгоритме использовались общедоступный набор изображений глазного дна и согласованный эталонный стандарт. Его чувствительность составила 96,8%, специфичность – 87,0%. Из 874 выданных алгоритмом результатов только шесть оказались ложноотрицательными [44].
Сделав еще один шаг в этом направлении, F. Arcadu и соавт. [21] недавно разработали DL-алгоритм, прогнозирующий результаты ОКТ-измерений при ДМО по двумерным цветным фотографиям глазного дна. В ближайшей перспективе данный алгоритм ляжет в основу программ скрининга на ДМО.
Проблема 2: недостаточные результаты лечения в реальной практике. Данные нескольких исследований показали, что реальные результаты анти-VEGF-терапии неизменно уступают тем, которые наблюдались в клинических испытаниях анти-VEGF фазы III. Это связано прежде всего с недостаточной частотой проведения анти-VEGF-терапии [1, 45]. Необходимость систематического наблюдения за пациентами и повторяющихся интравитреальных инъекций может стать тяжелым бременем для больных, лиц, осуществляющих за ними уход, и медицинских работников [1, 46], что может повлиять на результаты лечения.
Возможное решение проблемы – использование препаратов длительного действия.
В настоящее время исследуются несколько стратегий лечения, в том числе с использованием больших молекул с медленным высвобождением, технологии комбинирования лекарственного средства с устройством непрерывной доставки и генная терапия [47, 48]. Большинство технологий пока находятся на стадии доклинических или ранних клинических испытаний. Тем не менее система доставки портов с ранибизумабом (port delivery system, PDS) в настоящее время оценивается в рамках фазы III клинических исследований [47]. PDS представляет собой постоянный многоразовый интравитреальный имплантат для введения ранибизумаба в течение длительного времени.
В фазе II исследования при использовании PDS, наполненных ранибизумабом 100 мг/мл, отмечалось повышение зрительных функций. Эффективность подобной процедуры сравнима с ежемесячными инъекциями ранибизумаба, но бремя лечения ниже: около 80% пациентов не нуждались в повторном введении препарата в течение более полугода [47]. Среднее время до первого повторного заполнения системы порта составило 15 месяцев [47].
Другой подход, недавно одобренный FDA, представляет собой инъекцию значительно меньшей молекулярной массы и большей молярной концентрации ингибитора VEGF бролуцизумаба.
Проблема 3: недостаточно учитывается неоднородность пациентов по потребности в лечении. Клинические исследования HARBOR [49] и CATT продемонстрировали, что потребность пациентов с нВМД в инъекциях анти-VEGF существенно различается. Одни пациенты достигают стабилизации болезни после нескольких инъекций, другие нуждаются в ежемесячных инъекциях более года и при этом у них сохраняются признаки активности заболевания [49]. Большинству пациентов требуется от семи до восьми инъекций в год. Потребности в лечении также могут меняться со временем у одного и того же пациента с учетом тахифилаксии [50]. Сказанное означает, что пациенты должны часто посещать офтальмолога.
Доступные на сегодняшний день базы данных и традиционные статистические методы не позволяют выявить факторы, надежно прогнозирующие потребность в лечении и/или ответ на него у конкретного пациента. Текущий стандарт лечения включает частую проверку остроты зрения и ОКТ-мониторинг активности заболевания в кабинете специалиста по сетчатке. Это ложится тяжелым бременем как на пациентов, так и на здравоохранение и социальные службы, особенно с учетом того, что большинству пациентов лечение при каждом посещении не требуется. Однако, если график посещений недостаточно плотный, обнаружение реактивации заболевания может быть поздним, а зрение – навсегда потерянным. Между тем способность прогнозировать оптимальную частоту инъекций на исходном уровне и/или удаленно определять реактивацию заболевания играет ключевую роль в обеспечении наилучших потенциальных результатов лечения. Сказанное правомерно для существующих анти-VEGF-препаратов и препаратов длительного действия.
Возможное решение – удаленный мониторинг заболевания. Он должен быть точным, экономичным и удобным. В настоящее время разрабатываются способы, предусматривающие использование дистанционного тестирования зрения [1, 51] и проведение удаленной недорогой ОКТ. Предложенная домашняя система мониторинга зрения продемонстрировала, что ежедневное тестирование способно обеспечить раннее обнаружение нВМД или реактивации существующей нВМД, что значительно снизит риск потери зрения [1].
Еще одно возможное решение – прогнозирование частоты необходимого лечения с помощью ИИ. Показано, что пациенты, которым требуется ≥ 16 инъекций в течение двух лет (высокая потребность), потенциально могут быть идентифицированы с помощью алгоритма DL [29, 51]. При дальнейшей доработке и проверке этот алгоритм позволит пациентам с высокой потребностью в препаратах назначить терапию длительного действия на раннем этапе и избежать необходимости частых обследований и инъекций. Кроме того, алгоритм DL может выявлять пациентов с низкой потребностью в лечении. В этом случае также снижается частота посещения лечебного учреждения и значительно уменьшаются общая нагрузка и стоимость лечения.
Проблема 4: наличие потолка эффективности анти-VEGF-препаратов. Многочисленные исследования показали, что анти-VEGF-терапия со временем достигает потолка эффективности. В частности, острота зрения не может быть дополнительно улучшена за счет увеличения активности анти-VEGF-A и/или использования их в более высоких дозах. Например, в исследовании HARBOR не зафиксировано повышения остроты зрения у пациентов с нВМД при увеличении дозы ранибизумаба с 0,5 до 2,0 мг [49].
Аналогичный эффект «потолка» наблюдался на фоне применения других анти-VEGF-препаратов при нВМД, например афлиберцепта или бролуцизумаба. Максимально возможное улучшение зрения одинаково для всех одобренных в настоящее время препаратов независимо от увеличения дозы [1, 52]. Это требует дальнейшего изучения механизмов, лежащих в основе патологического ангиогенеза.
Возможное решение – применение препаратов с одновременным действием на VEGF-A и иные механизмы ангиогенеза. С момента разработки анти-VEGF-препаратов для лечения заболеваний сетчатки в начале 2000-х гг. ни один препарат, воздействующий на иной патофизиологический механизм, не получил разрешения к применению. Между тем указанный подход к лечению имеет большой потенциал. Препарат, который в настоящее время находится на самой продвинутой стадии клинической разработки (фаза III), представляет собой би-специфическое антитело – анти-VEGF-Ang2, фарицимаб. Подобно VEGF фактор роста Ang-2-Tie2 (ангиопоэтин 2) необходим для нормального развития сосудов сетчатки [1] и повышения проницаемости сосудов при воспалении и ДР [1]. Таким образом, в здоровой сетчатке связывание Ang-1 с рецептором Tie2 способствует стабилизации сосудистой стенки. При патологии сетчатки происходит переключение на продукцию Ang-2, что способствует дестабилизации сосудистой сети, субклиническому воспалению, просачиванию сосудов и/или неоваскуляризации [53].
В фазе II клинического исследования при ДМО одновременное воздействие на VEGF и Ang-2 с помощью фарицимаба привело к значительному улучшению МКОЗ, снижению тяжести и продолжительности ДР по сравнению с ранибизумабом 0,3 мг [54].
Клинические испытания фазы II при нВМД показали, что исходы в отношении остроты зрения при использовании фарицимаба каждые 12–16 недель аналогичны таковым при ежемесячном применении ранибизумаба 0,5 мг [55]. В рамках программы фазы III будут оценены конечные результаты по остроте зрения и продолжительности действия.
Проблема 5: каким пациентам показана монотерапия анти-VEGF, а каким – препарат двойного действия? После клинической регистрации эффективного препарата с двойным механизмом действия и/или большой продолжительностью действия может остаться вопрос о целесообразности его применения в качестве первой или второй линии терапии.
Многие пациенты на фоне монотерапии анти-VEGF достигают хороших результатов при небольшом количестве инъекций. И наоборот, у некоторых пациентов сохраняются признаки активности заболевания и низкие зрительные функции, несмотря на частые инъекции (неполный ответ на лечение). У таких пациентов результаты могут быть лучше, если в качестве первой линии терапии выбрать би-специфические антитела. К сожалению, в настоящее время это лишь предположение.
Возможное решение – разработка алгоритмов глубокого обучения для прогнозирования ответа на лечение. Концепция DL применима также для прогнозирования ответа на анти-VEGF-терапию [56]. Вероятно, таким образом удастся выявлять пациентов с недостаточным ответом на лечение, у которых целесообразно сразу начинать би-специфическую терапию. И наоборот, такой алгоритм поможет идентифицировать пациентов, у которых будет эффективна традиционная монотерапия анти-VEGF.
Проблема 6: необратимая потеря зрения. Гиподиагностика, несвоевременная диагностика и несвоевременное начало лечения могут привести к необратимой потере зрения. Дистанционный скрининг активного заболевания способен улучшить ситуацию, но скорее всего не охватит всех пациентов до наступления необратимой потери зрения.
Возможное решение – применение ИИ для выявления пациентов с высокими зрительными функциями и повышенным риском развития нВМД для своевременного раннего начала лечения, до потери зрительных функций.
Алгоритм DL прогнозирует переход заболевания в парном глазу от промежуточной формы ВМД к клинически значимой нВМД в течение года [40]. После клинической апробации этот алгоритм можно будет использовать вместе с препаратами длительного действия для предотвращения развития двусторонней нВМД у пациентов, у которых уже имеется нВМД одного глаза. Доклинические и клинические исследования показали, что постоянная монотерапия анти-VEGF может предотвратить рост новой [15] и уже существующей хориоидальной неоваскуляризации [1]. Если глаза с промежуточной ВМД высокого риска могут быть точно идентифицированы с помощью ИИ, использование анти-VEGF длительного действия поможет предотвратить переход в угрожающую зрению нВМД.
Заключение
За 15 лет, прошедших с момента разработки первой интравитреальной терапии против VEGF, произошли существенные изменения в способах лечения заболеваний сетчатки и хориоидеи. Благодаря новым инструментам и платформам, таким как дистанционный скрининг и мониторинг с помощью ИИ, прогностическим алгоритмам, позволяющим разрабатывать персонализированные стратегии лечения, терапевтическим средствам длительного действия и новым двунаправленным препаратам, возможно, в следующем десятилетии удастся существенно снизить слепоту из-за нВМД и ДР.
N.I. Kurysheva, S.G. Sergushev, V.I. Naumova, A.A. Ivanova
The Department of Eye Diseases at the Medical Biological University of Innovations and Continuing Education of the Federal Biophysical Center named after A.I. Burnazyan
Contact person: Albina A. Ivanova, albina2145@yandex.com
The introduction of anti-VEGF therapy into clinical practice has given new opportunities to restore functionally significant vision in patients with retinal diseases, improving their quality of life and changing the treatment paradigm from maintaining visual functions to restoring them. However, such diseases as neovascular age-related macular degeneration and diabetic macular edema still remain the leading causes of visual impairment and high socioeconomic costs associated with them.
The purpose of this review is to analyze the development of anti-VEGF therapy based on numerous publications with an emphasis on the immediate prospects. The latter may be associated with both advances in artificial intelligence and a personalized approach to treatment. A particular attention should be paid to the use of long-acting drugs and the search for new therapeutic targets that will be available over the next decade.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.