Молчащие неоваскулярные мембраны. Обзор литературы
- Аннотация
- Статья
- Ссылки
- English



Введение
С внедрением в клиническую офтальмологическую практику новых современных оптических когерентных томографов, позволяющих выполнять исследования в ангиорежиме, выявляемость неоваскулярных мембран без признаков экссудации резко возросла [1, 2].
Термин «молчащие хориоидальные неоваскулярные мембраны» включает в себя как наивные неоваскулярные мембраны с отсутствием любого типа жидкости на оптической когерентной томографии (ОКТ) и экссудации на флуоресцентной ангиографии (ФАГ), так и леченые хориоидальные неоваскулярные мембраны с отсутствием любого типа жидкости на спектральной (SD) ОКТ и ликиджа по ФАГ не менее шести месяцев [3]. Для последних чаще используется термин «неактивная неоваскулярная мембрана». Наибольший интерес у офтальмологов вызывают именно наивные, или неэкссудативные, неоваскулярные мембраны. В настоящее время активно изучается вопрос, касающийся сроков перехода из неэкссудативного состояния молчащей неоваскулярной мембраны в экссудативную стадию, проводятся изыскания предикторов перехода в эту стадию заболевания по данным ОКТ и ОКТ-ангиографии (ОКТ-А) и необходимости профилактического лечения данных мембран [1, 2].
История изучения молчащих макулярных неоваскулярных мембран
Термин «неоваскуляризация хориоидеи в состоянии покоя» впервые применил G. Querques в 2013 г., определив ее как разновидность макулярной неоваскуляризации (МНВ) 1-го типа c отсутствием интра- и субретинальной жидкости на повторных структурных исследованиях SD-ОКТ в течение как минимум шести месяцев у пациентов, ранее не получавших лечения, с подтвержденной мембраной по данным ФАГ и индоцианин-зеленой ангиографии (ИАГ) [3]. Однако необходимо отметить, что еще в 1970-х гг. S. Sarks и W. Green в двух исследованиях, посвященных гистопатологическому анализу трупных глаз, показали, что субретинальная неоваскулярная мембрана может существовать в глазах с неэкссудативной возрастной макулярной дегенерацией (ВМД) [4, 5].
В 1990-х гг. F. Bottoni и P. Hanutsaha при проведении in situ ИАГ обнаружили «бляшки» в глазах с сухой ВМД и сочли их ангиографической особенностью [4, 5].
В большом исследовании (432 глаза) P. Hanutsaha и соавт. проводили ИАГ у пациентов с сухой ВМД на одном глазу и экссудативной ВМД – на парном. Такие ангиографические особенности были обнаружены в 11% глаз с сухой ВМД [6]. Кроме того, скорость прогрессирования в экссудативную форму у пациентов с сухой ВМД составила от 3 до 28% в год, но при наличии «бляшек» вероятность перехода в экссудативную форму в течение 21 месяца была в 2,6 раза выше, чем в их отсутствие [6–8].
В 2013 г. G. Querques не только дал определение молчащим мембранам, но и отметил, что со временем (двухлетнее наблюдение) происходит их рост. При этом увеличение мембраны по площади приводит к появлению жалоб со стороны пациента в отношении метаморфопсий, несмотря на отсутствие экссудации [3].
Выявление наивных молчащих неоваскулярных мембран с помощью ОКТ-А
Несмотря на то что ИАГ позволяет выявлять неэкссудативные МНВ, данное обследование широко не применяется в клинической практике ввиду его инвазивности и потенциальной опасности развития аллергической реакции и анафилактического шока. Из-за этих ограничений метод так и не стал скрининговым. С внедрением ОКТ-А началась новая эра в диагностике неэкссудативной макулярной неоваскуляризации до появления симптоматической экссудации. Клиническое значение имеет ее использование в качестве альтернативы традиционной ангиографии с применением красителей.
На данный момент опубликовано множество работ, посвященных обнаружению молчащих неоваскулярных мембран методом ОКТ-А. Наибольший интерес представляют статьи, в которых сообщается о чувствительности и специфичности данного метода в диагностике неэкссудативной хориоидальной неоваскуляризации, а также те, в которых сравнивались морфологические данные с ангиографией на основе красителей. Так, исследование J.R. de Oliveira Dias и соавт. выявило субклиническую МНВ (термин, предложенный авторами для описания неэкссудативной хориоидальной неоваскуляризации) с помощью ОКТ-А в 14,4% глаз из 160 глаз с экссудативной формой ВМД на парном глазу [1]. Y. Yanagi и соавт. обнаружили неэкссудативную хориоидальную неоваскуляризацию в 18% глаз. В 60% из них отмечалась полипоидная хориоидопатия, в 40% – типичная ВМД [10]. Распространенность неэкссудативной хориоидальной неоваскуляризации в исследовании S. Bailey составила 7,9% (63 глаза) [2] (таблица).
Скорость прогрессирования неэкссудативной неоваскуляризации в экссудативную
Вопросы прогрессирования неэкссудативной МНВ в экссудативную, ее скорости и прогностических маркеров активно изучаются. Это важно в аспекте выбора тактики мониторинга и алгоритма лечения.
В ряде небольших исследований с применением ОКТ-А сообщается о достаточно благоприятном течении неэкссудативной хориоидальной неоваскуляризации [11–14]. A. Carnevali и соавт., а также V. Capuano и соавт. определили следующую скорость биологической активации (роста) молчащих хориоидальных неоваскуляризаций: в отсутствие клинической активности – 6,6% за год наблюдения, 26,3% – в глазах с географической атрофией в течение 20 месяцев [15, 16].
Другие, более крупные исследования показывают, что неэкссудативная неоваскуляризация несет в себе более высокий риск развития экссудации. В частности, по данным Y. Yanagi, он составляет 22,2% через шесть месяцев. Автор определил коэффициент риска прогрессирования в экссудативную форму – 10,3 (p = 0,01) [17].
J.R. De Oliveira Dias и соавт. на протяжении 12-месячного наблюдения отмечали развитие экссудации в 21,1% глаз с субклинической неоваскуляризацией [8]. Через два года наблюдения частота экссудации достигла 34,5%.
S. Bailey и соавт., проводя ОКТ-А регулярно через фиксированные промежутки времени, выявили 18-кратный риск (p < 0,0001) перехода неэкссудативной неоваскуляризации в экссудативную. При этом скорость прогрессирования мембраны из одной формы в другую за два года наблюдения составила 80% со средним темпом роста площади хориоидальной неоваскуляризации 20% в месяц. Установлено, что более быстрый рост хориоидальной неоваскуляризации обусловливает более раннее начало экссудации [10]. Различия в частоте неэкссудативных МНВ в этих исследованиях можно объяснить разными популяциями, количеством участников, тяжестью и продолжительностью ВМД, а также разным периодом наблюдения [18].
Диагностика молчащих неоваскулярных мембран
Типичными находками на глазном дне у пациентов с неэкссудативной МНВ являются макулярные друзы и пигментные аномалии [13] в области вен. На ОКТ молчащая МНВ визуализируется как элевация пигментного эпителия сетчатки (ПЭС) и интраретинальных гиперрефлективных очагов без признаков интраретинальной или субретинальной жидкости [10, 17]. G. Querques описал аналогичные изменения на SD-ОКТ в глазах с неэкссудативной МНВ. Он отметил приподнятость ретинального пигментного эпителия, имевшую большую протяженность в горизонтальной плоскости со скоплением умеренно светоотражающего материала в субретинальном пространстве [3].
Вместе с тем наиболее важным маркером для выявления неэкссудативной МНВ следует считать признак двойного слоя на структурных ОКТ-сканах [19].
В 2007 г. T. Sato и соавт. на SD-OКТ обнаружили два слоя с высокой отражающей способностью, состоявших из ретинального пигментного эпителия и еще одного слоя под ним. Данный признак связали с ветвлением сосудистой сети при полипоидной хориоидальной васкулопатии и назвали признаком двойного слоя [20].
Y. Shi и соавт. в 2019 г. продемонстрировали применение признака двойного слоя как прогностического при выявлении неэкссудативных МНВ при рутинной структурной ОКТ-визуализации на 100 снимках [19]. Однако в своей работе авторы не привели количественных параметров, характеризующих признак двойного слоя.
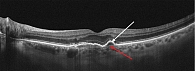
В 2020 г. N. Callum и соавт. определили количественные показатели, общие для признака двойного слоя (рис. 1), позволяющие отличить свойственную для него субклиническую неоваскуляризацию от других, не неоваскулярных причин отслоения ретинального пигментного эпителия, таких как друзы, друзеноидная отслойка пигментного эпителия и неваскулярные серозные отслойки пигментного эпителия. Совокупность характеристик назвали SIRE (Shallow Irregular RPE Elevation). Они включают максимальную протяженность элевации ретинального пигментного эпителия > 1000 мкм, максимальную высоту элевации ретинального пигментного эпителия < 100 мкм, содержимое с неоднородной рефлективностью между двумя гиперрефлективными линиями, соответствующими ретинальному пигментному эпителию и мембране Бруха [21].
Однако при ОКТ-А-визуализации неоваскулярные комплексы могут быть определены напрямую (рис. 2), что обеспечивает более высокие значения чувствительности и специфичности для идентификации указанных поражений. Эти результаты показывают, что неэкссудативная МНВ, как правило, является неоваскулярным поражением 1-го типа без признаков интраретинальной или субретинальной жидкости. Примечательно, что ряд авторов таким же образом описывали неэкссудативные МНВ 3-го типа. Возникновение неэкссудативной МНВ 3-го типа – частое явление в парном глазу у пациентов с впервые диагностированной односторонней экссудативной МНВ 3-го типа, предшествующее развитию экссудации в течение трех лет (распространенность – 37%, кумулятивная частота – 79%) [22].
Чувствительность OКT-A для обнаружения МНВ варьируется в пределах 50–100% [23]. SS-ОКТ-A позволяет визуализировать большие площади МНВ с лучшим качеством изображения по сравнению с SD-ОКТ-А [24, 25].
Маркеры активации неэкссудативных МНВ
Для неэкссудативных неоваскулярных мембран помимо перехода в экссудативную форму характерен рост с течением времени, что носит название биологической активации молчащих мембран. Для биологической активации свойственно увеличение мембраны по площади со временем при сохранении показателей плотности сосудов. Рост мембраны может сопровождаться усилением метаморфопсий, что не свидетельствует о появлении экссудации [3]. При этом интенсивный рост мембраны может служить маркером развития экссудации [15, 16].
R. Serra и соавт. на основании данных SD-ОКТ рассматривали в качестве биомаркера активации неоваскуляризации линейный рост высоты отслойки ПЭС, превращающий так называемую морщинистую отслойку пигментного эпителия в куполообразную [26].
L. von der Emde и соавт. в исследовании данных ОКТ-А установили, что количественные (средняя длина сосудов, сосудистая плотность, индекс ветвистости) и качественные (множество ветвящихся мелких капилляров, развитые анастомозы и петли на периферии неоваскулярной мембраны, оформленные сосудистые аркады на периферии неоваскулярной мембраны, гипорефлективное гало вокруг неоваскулярной мембраны) характеристики неспецифичны для развития экссудации [27].
A.D. Treister и соавт. [28] провели количественную оценку отсутствия перфузии хориокапилляров при сканировании SD-ОКТ-А и не обнаружили существенной разницы в площади глаз без перфузии с экссудативной МНВ по сравнению с парными глазами с субклинической неэкссудативной МНВ. Впоследствии авторы подтвердили этот результат и не обнаружили корреляции между исходной площадью хориокапиллярной неперфузии и развитием экссудации в глазах с субклинической неэкссудативной МНВ [29]. Тем не менее указанное исследование имеет несколько ограничений. Как уже отмечалось, при SD-ОКТ-А используется более короткая длина волны, которая не проникает через ПЭС, как SS-OCTA, что приводит к снижению вероятности обнаружения более слабых сигналов из-под ПЭС [30]. Кроме того, авторы использовали неподтвержденный алгоритм для визуализации хориокапилляров. В будущем предстоит изучить взаимосвязь между дефицитом хориокапиллярного кровотока и наличием субклинической неэкссудативной МНВ, чтобы определить, существует ли связь между степенью дефицита окружающего кровотока и экссудацией [18].
В исследовании А.Н. Куликов и соавт. установили, что для молчащей МНВ характерны более высокие показатели сосудистой плотности по сравнению с активной мембраной. Авторы связывают это с артефактом исследования: сканирующий луч подвергается большему рассеиванию при сканировании через неповрежденный ПЭС при молчащей мембране по сравнению с активной [31]. Однако отличия строения неэкссудативной мембраны подтверждены гистологически. В исследовании были проанализированы данные пациентки с неэкссудативной МНВ за девять лет наблюдения на основании гистопатологического анализа после ее смерти. Основной вывод: в глазу с типичными патологическими признаками ВМД МНВ оставалась стабильной в пределах неглубокой нерегулярной отслойки ПЭС в течение девяти лет, морфологически напоминая нативный хориокапилляр по плотности сосудов и ультраструктурным механизмам транспорта и поддерживая внешнюю целостность сетчатки и конечный результат. Максимально корригированная острота зрения – 20/30. Эти данные свидетельствуют в пользу тех, согласно которым неэкссудативная МНВ относится ко второму фенотипу ВМД. Если для первого риск потери зрения связан с экссудацией, то при втором зрение сохраняется за счет суррогатного хориокапилляра.
Идея о том, что МНВ 1-го типа является бессимптомной или даже полезной, развивалась на протяжении многих лет. В серийных парафиновых срезах 150 нормальных глаз пациентов в возрасте от 62 до 96 лет S.H. Sarks [32] обнаружил клинически невыявленные сосуды, прорывающиеся через BrM и разветвляющиеся под BLamD, в 11,3% глаз. Эти данные в совокупности свидетельствуют о том, что нативные хориокапилляры и МНВ 1-го типа играют роль в поддержании здоровья фоторецепторов [33].
Неэкссудативная неоваскуляризация замедляет рост географической атрофии
Как упоминалось ранее, неэкссудативные МНВ могут существовать не только в глазах с промежуточной ВМД, но и в глазах с географической атрофией (ГА). V. Capuano и соавт. [16] наблюдали за 19 глазами с ГА и неэкссудативной МНВ в течение 27–65 месяцев. Средний рост атрофии от исходного уровня до последнего обследования составил 5,08 ± 3,51 мм2, что означало скорость роста поражения 1,38 ± 0,93 мм2 в год. При этом в 92% случаев неэкссудативная МНВ располагалась в прилежащей области, в которой не было прогрессирования атрофии, а в 85% глаз на структурных SD-ОКТ-изображениях имела место резкая демаркация между участками атрофичной и неатрофичной сетчатки, что было видно по усиленному хориоидальному сигналу из-за потери ПЭС при ГА. Интересно, что у пяти из 19 (26,3%) пациентов развилась экссудация.
M.J. Heiferman и соавт. [29] наблюдали увеличение ГА со скоростью 0,82–1,20 мм2 в год в четырех глазах без неэкссудативной МНВ и 0,02 мм2 в год в одном глазу с неэкссудативной MНВ.
W. Choi и соавт. [34] описали двух пациентов с неэкссудативной ВМД и ГА, у которых МНВ существовала под уцелевшим ПЭС. Исследователи предположили, что неэкссудативная МНВ может быть связана с улучшением выживаемости ПЭС.
Необходимы более масштабные продолжительные исследования, чтобы подтвердить, замедляется ли рост ГА при наличии субклинических неэкссудативных МНВ [18, 35].
Неэкссудативная МНВ при хронической центральной хориоретинопатии
По данным M. Moussa и соавт., ОКТ-А позволяет определить образование хориоидальной неоваскуляризации 1-го типа в 5 (8,3%) из 60 глаз с хронической центральной хориоретинопатией. В одном из этих глаз наблюдалась полипоидная хориоидальная васкулопатия как вариант МНВ 1-го типа. Авторы выявили три статистически значимых предиктора на изображениях SS-ОКТ для прогрессирования неоваскуляризации: истончение фовеолы, наличие непрозрачного материала под неравномерной плоской отслойкой ПЭС и увеличение толщины хориоидеи [36].
Лечение
Несмотря на то что к настоящему времени не проведено ни одного контролируемого клинического исследования, на основании результатов которого можно было бы сформулировать окончательные рекомендации, во всех исследованиях указывается на необходимость тщательно контролировать неэкссудативную МНВ, воздерживаться от проведения анти-VEGF-терапии, даже если мембрана растет, до тех пор, пока не появятся признаки экссудативного процесса. I.R. de Oliveira Dias и соавт. [1] предлагают тщательное наблюдение для выявления ранних признаков экссудации, которые способны повлиять на зрительную функцию. Установлено, что неэкссудативная МНВ может сохраняться в течение двух лет или более без развития экссудации и нарушения зрения. Кроме того, предполагается, что неоваскулярные поражения 1-го типа можно рассматривать как компенсаторную реакцию глаза, направленную на воссоздание хориокапилляров и обеспечение полезной трофической поддержки вышележащих ПЭС и фоторецепторов [1, 37].
Заключение
Идентификация неэкссудативной неоваскулярной мембраны по-прежнему сложна. Кроме своевременного выявления важно определить риск ее прогрессирования в экссудативную неоваскуляризацию. Вопрос о природе данных мембран, тактике их мониторинга и лечения остается открытым.
N.I. Kurysheva, S.G. Kapkova, V.I. Naumova, O.A. Yevdokimova
Ophthalmological Center of FMBA of Russia, Federal Medical Biophysical Center named after A.I. Burnazyan
Medical Biological University of Innovations and Continuing Education of the Federal Biophysical Center named after A.I. Burnazyan
Academy of Postgraduate Education of FMBA of Russia
Contact person: Oksana A. Yevdokimova, oxana.pererva@yandex.ru
Non-exudative (silent) macular neovascurarization usually refers to the entity of treatment-naive type 1 neovascularization in the absence of associated signs of exudation. There is no consensus on the pathophysiology of non-exudative MNV. Some authors suggest that long-term non-exudative MNV is morphologically similar in to native choriocapillary by ultrastructural transport mechanisms and may preserve the outer retina. Until now, the issue of predisposing factors to the occurrence of exudation of silent membranes, the indication and timing of antiVEGF therapy remains debatable.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.