количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Коррекция нарушений микробиоценоза кишечника
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" № 4 (34)
- Аннотация
- Статья
- Ссылки
- English
Нарушение состава микрофлоры кишечника при различных заболеваниях способно усугубить их течение. Эффективным методом коррекции измененного состава микрофлоры считается применение пробиотиков, то есть живых микроорганизмов, нормализующих количественные и качественные показатели микробиоты. Пробиотики используют при диареях, в том числе антибиотик-ассоциированных, синдроме раздраженного кишечника и других заболеваниях. В статье приведены данные о применении комплексного пробиотика Линекс® для профилактики антибиотик-ассоциированного дисбактериоза кишечника.
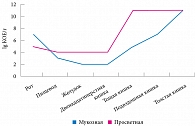
Рисунок. Современные представления о распределении кишечной микрофлоры в отделах желудочно-кишечного тракта

Таблица. Микроорганизмы, обладающие пробиотическими свойствами
Современные представления о кишечной микрофлоре
За последние десятилетия представления о роли кишечной микрофлоры существенно изменились. Ее метаболическая роль сегодня не вызывает сомнений. Вместе с тем взаимодействие между макроорганизмом и микробиотой до конца не изучено.
Микрофлора желудочно-кишечного тракта (ЖКТ) – чрезвычайно многочисленное сообщество. Общая масса микрофлоры кишечника взрослого человека составляет около 2,5–3 кг. Только популяция Escherichia coli насчитывает около 6 × 10⁹ клеток, а из всех клеток макро- и микроорганизмов 90% приходится на микроорганизмы [1]. При этом в сумме генетического материала 75% принадлежит именно микроорганизмам [2].
Результаты культуральных методов исследования свидетельствуют о том, что микробное сообщество кишечника человека состоит из 10¹²–10¹⁴ клеток, относящихся к 17 семействам, 45 родам, 500 видам из 12 таксономических групп. Соотношение анаэробов к аэробам – 1000:1. Основные функции этих микроорганизмов – питание эпителия толстой кишки (продукция бутирата), регуляция всасывания минеральных веществ и воды, липидного и азотистого обмена, нормализация перистальтики кишечника, синтез витаминов группы B и K, повышение иммунитета.
Внедрение новых методов исследования микрофлоры позволило получить принципиально новые данные о ее численности, видовом составе и функциональном значении. Так, благодаря методу секвенирования гена 16S рибосомальной РНК установлено, что нормальная кишечная микрофлора включает 395 филогенетических групп [3], 244 (62%) из которых ранее не были известны. Более того, 195 групп представлены некультивируемыми на данный момент микроорганизмами.
Говоря о кишечной микрофлоре, нельзя не затронуть вопрос о соотношении просветной и мукозной микрофлоры в разных отделах ЖКТ. Cогласно данным В.В. Чернина и соавт., в верхних отделах ЖКТ просветная микрофлора преобладает, в то время как в толстой кишке и та и другая присутствуют примерно в равных количествах (см. рисунок) [4].
В последние годы активно развивается учение о биопленках как особом уровне организации пристеночных микроорганизмов. Биопленка представляет собой клетки в матрице полимерных структур, продуцируемых микробами. Популяция микроорганизмов в биопленке регулируется сложной системой их взаимодействия, которая получила название «чувство кворума» (Quorum Sensing – QS). Организованные в биопленке микроорганизмы определяют симбионтное пищеварение, резистентность, функциональную активность, взаимодействие с клетками макроорганизма.
Относительно новым является и представление о симбионтном пищеварении: кишечная микрофлора рассматривается как один из компонентов процесса пищеварения. При этом в большей степени данный тип пищеварения присутствует в тонкой кишке [4].
Важнейшая функция кишечной микрофлоры заключается в продукции летучих жирных кислот (в том числе ацетата, бутирата, пропионата). Эти кислоты поддерживают колонизационную резистентность, обеспечивают оптимальный уровень кислотности в толстой кишке, опосредованно участвуют в снижении осмотического давления в ее просвете, а также в регуляции кишечного транзита, способствуют росту эпителия.
Формирование кишечного микробиоценоза
Кишечный микробиоценоз формируется с первых дней жизни ребенка. И этот процесс продолжается еще два-три года. Однако для формирования нормальной микрофлоры наиболее важны первые месяцы жизни.
Факторы становления кишечного микробиоценоза:
- здоровье матери;
- зрелость, доношенность плода;
- особенности родов;
- время первого кормления;
- характер вскармливания;
- состав питания;
- здоровье ребенка, лечение;
- факторы окружающей среды.
В случае нормального течения беременности ЖКТ плода до момента родов остается стерильным. Его заселение микроорганизмами начинается в процессе рождения. Источниками таких микроорганизмов служат родовые пути матери, ее кожа и кишечник, среда, окружающая новорожденного, и, возможно, грудное молоко.
Становление кишечного микробиоценоза происходит в несколько этапов.
Первый этап (первые 24 часа жизни) – условно-асептическая фаза, когда продолжается процесс контаминации. В это время начинается пероральное питание ребенка, и в его кишечник с молозивом попадают определенные вещества – так называемые бифидогенные факторы, регулирующие процесс заселения. В этот момент в кишечнике ребенка преобладает E. coli.
Второй этап (2–5-й день) – фаза неустойчивой флоры, когда снижается численность E. coli и повышается численность бифидобактерий, бактероидов и лактобактерий.
Третий этап (до окончания первого месяца жизни) – фаза стабилизации состава микрофлоры. Анаэробная микрофлора начинает преобладать.
Нередко при нарушении качественного или количественного состава микрофлоры развивается дисбактериоз (дисбиоз) кишечника. Причин тому несколько: нерациональное питание, проводимая антибиотикотерапия, заболевания ЖКТ, иммунодефицитные состояния. Дисбиоз кишечника не является собственно заболеванием, но может сыграть ключевую роль в патогенезе многих заболеваний ЖКТ, а также стать причиной снижения работы иммунной системы, нарушения липидного обмена и других метаболических процессов.
Про- и пребиотики в коррекции кишечной микрофлоры
Коррекция состава микрофлоры – задача сложная. Из-за недостатка знаний о роли кишечных микроорганизмов целенаправленное воздействие на микробиоту практически невозможно. В то же время существуют эффективные методы неспецифической коррекции пре- и пробиотиками, позволяющие создавать благоприятные условия для роста нормальной кишечной микрофлоры.
Одним из первых исследователей, обративших внимание на взаимосвязь и взаимозависимость макроорганизма и микроорганизмов, был A. Döderlein [5]. Он предположил, что вагинальные бактерии, сбраживая сахара, продуцируют молочную кислоту, предотвращая тем самым рост патогенных бактерий. И.И. Мечников, подробно изучив роль молочнокислых бактерий в кишечном переваривании и всасывании (при употреблении кисломолочных продуктов), обосновал возможность их применения для укрепления здоровья и продления жизни [6]. В 1926 г. A. Nissle показал, что перенос кишечной микрофлоры здорового человека здоровым носителям Salmonella typhimurium приводит к эрадикации патогенного микроорганизма [7]. Так впервые была отмечена защитная функция кишечной микрофлоры.
В 1917 г. во время Первой мировой войны для профилактики развития шигеллеза A. Nissle изолировал непатогенный штамм кишечной палочки из фекалий солдата. Этот штамм получил название Escherichia coli Nissle 1917. В 1965 г. D.M. Lilly и R.H. Stillwell ввели термин «пробиотик» [8].
Согласно определению Всемирной организации по вопросам здравоохранения (World Health Organisation – WHO) и Организации ООН по продовольствию и сельскому хозяйству (Food and Agriculture Organisation of the United Nations – FAO) пробиотики – это живые микроорганизмы, которые при назначении в адекватных количествах способствуют здоровью организма хозяина [9].
Несмотря на то что пробиотическое действие показано для большого числа микроорганизмов (см. таблицу) [10, 11], двойные слепые плацебоконтролируемые исследования проведены только в отношении некоторых из них (Bifidobacterium bifidum, Lactobacillus acidophilus, L. rhamnosus GG, L. fermentum, Streptococcus faecium SF68, S. thermophilus и др.). Особое значение среди пробиотических микроорганизмов придается молочнокислым бактериям, в первую очередь представителям рода Lactobacillus (L. acidophilus, L. casei, L. rhamnosus), которые используются в производстве кисломолочных продуктов и/или входят в состав лекарственных препаратов.
Роль пробиотиков в коррекции нарушений состава микрофлоры
Пробиотические микроорганизмы в основном являются представителями родов Lactobacillus, Bifidobacterium, Streptococcus. Эти бактерии обладают высокой ферментативной активностью, являются облигатными или факультативными анаэробами, обычно малоподвижны и имеют разную форму [12].
Влияние пробиотических микроорганизмов на организм заключается в следующем [13]:
- прямое воздействие на кишечный эпителий. Пробиотики могут повышать продукцию муцина бокаловидными клетками, а повышение продукции дефензинов регулирует пролиферацию микрофлоры. Пробиотики также способны определять плотность контакта эпителиальных клеток и снижать проницаемость для патогенов и их продуктов;
- действие на мукозный иммунитет. Пробиотики повышают число клеток, продуцирующих иммуноглобулин (Ig) A в собственной пластинке, и содержание секреторного IgA в составе слизи;
- влияние на кишечную микрофлору;
- подавление роста отдельных микробов путем продуцирования бактериоцинов;
- конкуренция с другими микроорганизмами за места адгезии на эпителиальных клетках.
В 2009 г. на Совете экспертов по пробиотикам в Лондоне были определены ключевые положения по применению пробиотиков у детей.
В настоящее время имеются данные, доказывающие эффективность пробиотиков при лечении диареи различного происхождения, включая инфекционную и связанную с приемом антибиотиков, синдрома раздраженного кишечника и некротизирующего колита у недоношенных детей; показано благоприятное влияние пробиотиков на иммунный ответ со снижением риска инфекционных заболеваний. Несмотря на имеющийся положительный опыт применения пробиотиков при лечении воспалительных болезней кишечника (неспецифического язвенного колита и болезни Крона), эксперты сочли его недостаточным и рекомендовали проведение дальнейших исследований в данном направлении. В итоговом документе была отмечена эффективность отдельных штаммов микроорганизмов для эрадикации Helicobacter pylori, при лечении ряда вагинальных инфекций и для профилактики рака толстой кишки. Однако, чтобы получить более убедительные данные, необходимы дальнейшие исследования.
Эксперты подчеркнули необходимость достижения высокой выживаемости пробиотических микроорганизмов в кишечнике, отметив, что даже отдельные компоненты погибших микробов положительно влияют на состояние кишечного микробиоценоза [14]. Коммерческие препараты пробиотиков в целом были признаны безопасными, однако их не следует применять без указания врача [15].
Изучение эффективности препарата Линекс®
Примером пробиотического препарата является Линекс®, в состав которого входит не менее 1,2 × 10⁷ живых лиофилизированных бактерий Bifidobacterium infantis v. liberorum, L. acidophilus и Enterococcus faecium. Отличительной особенностью входящих в состав Линекса штаммов является устойчивость к антибиотикам и химиотерапевтическим средствам [16]. Это позволяет применять препарат на фоне приема антибиотиков, тем самым обеспечивается профилактика антибиотик-ассоциированного дисбактериоза кишечника.
Установлено, что пробиотики, в состав которых входит сразу несколько штаммов, при условии их сбалансированного соотношения оказывают более выраженный эффект по сравнению с однокомпонентными препаратами [17].
Научно доказано, что лиофилизированные бактерии обладают большей выживаемостью по сравнению с жидкими формами препаратов при прохождении через агрессивную среду желудка, поскольку матрикс молочнокислых бактерий, входящих в состав препарата Линекс®, устойчив к действию соляной кислоты. Матрикс растворяется в тонкой кишке, где в благоприятной среде активируются живые пробиотические бактерии.
Кислотоустойчивость для бактерий в составе пробиотических препаратов имеет большее значение, чем их количество [18].
В наших исследованиях [19] оценивалась эффективность препарата Линекс® для профилактики антибиотик-ассоциированного дисбактериоза кишечника у детей при антихеликобактерной терапии. С одной стороны, хеликобактерная инфекция, а также вызванные ею заболевания (например, гастрит, язвенная болезнь двенадцатиперстной кишки) способствуют нарушению кишечной микрофлоры, с другой – назначаемая при этих заболеваниях терапия, включающая высокоэффективные антисекреторные препараты и антибактериальные средства, усугубляет имеющиеся нарушения кишечной микрофлоры.
Участников исследования разделили на две группы. Пациенты первой группы получали только антихеликобактерные препараты, пациенты второй одновременно с этими препаратами принимали Линекс®. Анализ кала брали до начала и после лечения.
Первый анализ показал в обеих группах снижение численности бифидо- и лактобактерий относительно нормы. При этом численность E. coli в среднем была завышена.
Результаты второго анализа в первой группе свидетельствовали о продолжавшемся снижении численности бифидо- и лактобактерий и увеличении численности E. coli на фоне проводимой терапии. У обследованных детей выявлялись также E. coli лактозонегативная, гемолизирующая и со слабо выраженными ферментирующими свойствами, негемолитический и коагулазонегативный стафилококк, энтерококки, протей, цитробактер, энтеробактер, клебсиелла и другие неферментирующие грамотрицательные микроорганизмы, а также дрожжеподобные грибы у части детей. При этом достаточно стабильно как до лечения, так и после него высевалась E. coli гемолизирующая (в 23,81 и 33,33% соответственно). Была снижена и метаболическая активность кишечных микроорганизмов, о чем свидетельствовало изменение спектра летучих жирных кислот в кале.
У пациентов второй группы отмечалось увеличение числа как бифидо-, так и лактобактерий. Численность E.coli на фоне комбинированной терапии несколько снизилась. Наметилась тенденция к нормализации спектра летучих жирных кислот в стуле.
Как показали результаты исследования, антихеликобактерная терапия сопровождается усугублением имеющихся нарушений кишечного микробиоценоза у большинства пациентов. Назначение пробиотиков (Линекс®) снижает риск развития антибиотик-ассоциированного дисбактериоза кишечника и степень его выраженности. Прием препарата Линекс® способствует улучшению клинической картины заболевания, нормализации состава микрофлоры кишечника, восстановлению ее метаболической активности.
Еще один важный практический аспект – коррекция микробиоценоза у детей первого года жизни. Нарушения микрофлоры в этом возрасте обычно связаны с нерациональным или искусственным вскармливанием, особенно с использованием смесей, не содержащих пребиотических компонентов, инфекционными заболеваниями и применением антибиотиков, болезнями матери и самого ребенка.
Для коррекции микробиоценоза кишечника у детей первого года жизни в России зарегистрирован пробиотик Линекс для детей® (SANDOZ d.d., Словения). Этот БАД выпускается в виде порошка, в одном пакетике-саше содержится 1,5 г. В состав препарата входят лиофилизированные бифидобактерии (Bifidobacterium animalis subsp. Lactis (штамм DSM 15954) или Bifidobacterium lactis ВВ12) не менее 1,0 × 10⁸ КОЕ/г, что соответствует 1,5 × 10⁸ КОЕ/саше. Детям в возрасте до двух лет БАД назначают по одному пакетику в течение 30 дней, смешивая его содержимое с молоком, смесью, соком или другим жидким питанием.
А.И. Хавкин и соавт. изучали влияние пробиотика на функциональное состояние ЖКТ и состояние микрофлоры, а также его индивидуальную переносимость по данным клинико-лабораторного исследования и путем регистрации побочных эффектов. Дизайн исследования предполагал два посещения врача для оценки клинических признаков заболевания, выполнения микробиологического посева фекалий, определения концентрации лизоцима и уровня секреторного IgA в копрофильтратах методом иммуноферментного анализа. Исследование продолжалось четыре недели.
Было обследовано 60 детей в возрасте от нуля до двух лет во время и после приема антибиотиков при инфекционных заболеваниях. Пациенты были разделены на две группы – основную и контрольную. Основная группа помимо антибиотиков получала Линекс для детей®.
Применение пробиотика Линекс для детей® в стандартной дозе в течение четырех недель привело к нормализации частоты и консистенции стула, уменьшению выраженности срыгиваний, метеоризмов, частоты и интенсивности колик, а также нормализации микрофлоры. Было показано, что пробиотический штамм DSM 15954 способствует значительному увеличению в копрофильтратах концентрации секреторного IgA и лизоцима. Так, в основной группе концентрация секреторного IgA до лечения составляла 54,2 ± 7,51 мг/100 г, после лечения – 142,1 ± 5,49 мг/100 г (p < 0,001), в контрольной группе – 62,2 ± 8,61 и 107,1 ± 10,5 мг/100 г соответственно. Концентрация лизоцима в копрофильтратах в основной группе до лечения составляла 5,1 ± 0,27 мкг/г, после лечения – 33,8 ± 2,3 мкг/г (p < 0,001), в контрольной группе – 6,4 ± 0,71 и 6,5 ± 0,3 мкг/г соответственно. Авторы показали, что прием пробиотика Линекс для детей® способствует усилению иммунологических реакций при вирусно-бактериальных заболеваниях за счет повышения в кишечнике уровня защитных факторов – секреторного IgA и лизоцима. Был сделан вывод о возможности использования препарата в качестве агента, способствующего нормализации иммунитета ребенка. Препарат также защищает кишечный микробиоценоз от негативного воздействия антибиотиков.
Следовательно, данный пробиотик можно рекомендовать для использования в раннем детском возрасте при функциональных нарушениях ЖКТ и состояниях, сопряженных с риском нарушения микробиоценоза и иммунологической толерантности кишечника [20].
Пробиотики в профилактике атопического дерматита
Иммунологические эффекты нормальной кишечной микрофлоры ЖКТ в значительной степени обусловлены иммуномодулирующим действием компонентов клеточной стенки микроорганизмов. Основным иммуномодулирующим компонентом клеточной стенки многих пробиотических микроорганизмов (в первую очередь бифидо- и лактобактерий) являются пептидогликаны (30–70% ее состава) [21]. Они представляют собой гликопептиды, которые высвобождаются из клеточной стенки бактерий под воздействием лизоцима, продуцируемого клетками Панета. Вместе с пептидогликанами высвобождаются мурамилдипептиды, их низкомолекулярные компоненты. Последние способны стимулировать макрофаги и выход из них интерлейкина 1, который в свою очередь активирует Т-лимфоциты [22], а также NK-клетки (natural killers – естественные киллеры), продуцирующие гамма-интерферон. Кроме того, мурамилдипептиды стимулируют продукцию интерлейкинов 1 и 6, фактора некроза опухоли альфа моноцитами, а также интерлейкина 4 и гамма-интерферона Т-лимфоцитами [23].
В исследованиях in vitro показано, что пробиотики стимулируют секрецию цитокинов Th₁-типа моноцитами, макрофагами и дендритными клетками [24]. Результаты исследования A. Oksaharju и соавт. подтверждают, что пробиотические штаммы сдвигают иммунный ответ с Th₂-типа к Th₁-типу, снижая выраженность гуморальных реакций и повышая выраженность клеточных [25]. Это свойство пробиотических микроорганизмов, так же как и нормальной (индигенной) флоры кишечника, позволяет снизить риск развития аллергических реакций. Таким образом, пробиотики, с одной стороны, восстанавливают кишечный микробиоценоз, обеспечивая его иммуномодулирующие функции, с другой – корригируют иммунный статус человека.
В ряде метаанализов показано, что пробиотики можно использовать для профилактики атопических дерматитов у детей. Так, в метаанализе, включавшем пять исследований (1477 детей), было доказано положительное влияние приема пробиотиков на течение экземы у детей [26].
E. Isolauri и соавт. провели двухмесячное исследование. В него было включено 27 детей (средний возраст 4,6 месяца), у которых атопический дерматит проявился в период естественного вскармливания, после чего они были переведены на гидролизованную сывороточную смесь. Одна группа детей получала обычную смесь, две другие – смесь с добавлением пробиотиков Bifidobacterium lactis BВ12 или Lactobacillus GG.
Если в начале исследования индекс SCORAD (SCORing Atopic Dermatitis – шкала атопического дерматита) в среднем составлял 16 (7–25), то через два месяца у детей, получавших смеси, дополненные пробиотиками, он значительно снизился. В группе детей, получавших Bifidobacterium lactis BВ12, индекс SCORAD снизился практически до 0 (0–3,8), а в группе детей, получавших Lactobacillus GG, – до 1 (0,1–8,7). У детей, получавших обычную смесь, средний индекс SCORAD был равен 13,4 (4,5–18,2). Приведенное клиническое исследование продемонстрировало способность пробиотических штаммов влиять на аллергический процесс [27].
Было проведено проспективное рандомизированное двойное слепое контролируемое клиническое исследование с участием 172 здоровых доношенных детей в возрасте до шести месяцев. Пациенты основной группы в течение шести недель получали частично гидролизованную сывороточную смесь с добавлением 10⁶ КОЕ/г Bifidobacterium lactis ВВ12, пациенты контрольной группы – аналогичную смесь, но без пробиотиков.
В основной группе уровень секреторного IgA и антиполиовирусных IgA был выше, чем в контрольной. Авторы сделали вывод: влияние на иммунную систему ребенка таких негативных факторов, как искусственное вскармливание и оперативные роды, может быть снижено за счет добавления в пищу Bifidobacterium lactis ВВ12 [28].
Таким образом, пробиотические микроорганизмы, в том числе штамм Bifidobacterium lactis ВВ12, входящий в состав пробиотика Линекс для детей®, обладают отчетливым иммуномодулирующим действием и могут быть использованы для профилактики и лечения атопического дерматита у детей всех возрастов.
Иммуномодулирующий эффект пробиотиков может быть усилен за счет введения ряда микроэлементов. Так, в состав пробиотика Линекс Иммуно®, зарегистрированного для применения у детей старше 14 лет и взрослых, входит пробиотик Lactobacillus casei spp. rhamnosus Lcr35, а также цинк и селен – микроэлементы, необходимые для адекватной работы иммунной системы.
Заключение
Поддержание нормальной кишечной микрофлоры, ее устойчивость к внешним воздействиям, а также ее восстановительный потенциал во многом зависят от питания. Наличие достаточного количества пробиотиков в ежедневном рационе не только снижает риск нарушений кишечной микрофлоры, но и способствует ее скорейшему восстановлению.
1. Ардатская М.Д., Минушкин О.Н., Дубинин А.В. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения // Терапевтический архив. 2001. № 2. С. 67–72.
2. Qin J., Li R., Raes J. et al. A human gut microbial gene catalogue established by metagenomic sequencing // Nature. 2010. Vol. 464. № 7285. P. 59–65.
3. Eckburg P.B.1., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora // Science. 2005. Vol. 308. № 5728. P. 1635–1638.
4. Чернин В.В., Парфенов А.И., Бондаренко В.М. и др. Симбионтное пищеварение человека. Физиология, клиника, диагностика и лечение его нарушений. Тверь: Триада, 2013.
5. Döderlein A. Das Scheidensekret und seine Bedeutung für das Puerperalfieber (The vaginal transsudate and its significance for childbed fever) // Centralblatt für Bacteriologie. 1892. Vol. 11. P. 699–700.
6. Metchnikoff E. Prolongation of life. New York: Putnam, 1908.
7. Nissle A. Uber die Grundlagen einer neuen ursaechlichen Bekaempfung der pathologischen Darmflora // Deutsch. Med. Woch. 1916. Vol. 42. P. 1181–1184.
8. Lilly D.M., Stillwell R.H. Probiotics: growth-promoting factors produced by microorganisms // Science. 1965. Vol. 147. № 3659. P. 747–748.
9. FAO/WHO. Evaluation of health and nutritional properties of powder milk and live lactic acid bacteria. Food and Agriculture Organization of the United Nations and World Health Organization Expert Consultation, Geneva, Switzerland, 2001.
10. Holzapfel W.H., Haberer P., Geisen R. et al. Taxonomy and important features of probiotic microorganisms in food and nutrition // Am. J. Clin. Nutr. 2001. Vol. 73. Suppl. 2. P. 365S–373S.
11. Holzapfel W.H., Haberer P., Snel J. et al. Overview of gut flora and probiotics // Int. J. Food Microbiol. 1998. Vol. 41. № 2. P. 85–101.
12. Thomas D.W., Greer F.R., American Academy of Pediatrics Committee on Nutrition et al. Probiotics and prebiotics in pediatrics // Pediatrics. 2010. Vol. 126. № 6. P. 1217–1231.
13. Ohland C.L.1., Macnaughton W.K. Probiotic bacteria and intestinal epithelial barrier function // Am. J. Physiol. Gastrointest. Liver Physiol. 2010. Vol. 298. № 6. P. G807–819.
14. Rowland I., Capurso L., Collins K. et al. Current level of consensus on probiotic science – report of an expert meeting – London, 23 November 2009 // Gut. Microbes. 2010. Vol. 1. № 6. P. 436–439.
15. Ciorba M.A. A gastroenterologist's guide to probiotics // Clin/ Gastroenterol. Hepatol. 2012. Vol. 10. № 9. P. 960–968.
16. Сухорукова М.В., Тимохова А.В., Эйдельштейн М.В., Козлов Р.С. Чувствительность к антибиотикам штаммов бактерий, входящих в состав пробиотика «Линекс» / Клиническая микробиология и антимикробная химиотерапия. 2012. Т. 14. № 3. С. 245–251.
17. Timmerman H.M., Koning C.J., Mulder L. et al. Monostrain, multistrain and multispecies probiotics – a comparison of functionality and efficacy // Int. J. Food Microbiol. 2004. Vol. 96. № 3. P. 219–233.
18. Klayraung S., Viernstein H., Okonogi S. Development of tablets containing probiotics: Effects of formulation and processing parameters on bacterial viability // Int. J. Pharm. 2009. Vol. 370. № 1–2. P. 54–60.
19. Бельмер С.В., Щиголева Н.Е., Хавкин А.И. и др. Пробиотическая коррекция антибиотик-ассоциированного дисбактериоза кишечника у детей. Клинические наблюдения // Вопросы современной педиатрии. 2007. Т. 6. № 3. C. 89–93.
20. Хавкин А.И., Кешишян Е.С. Эффективность пробиотика Bifidobacterium (Bifidobacterium animalis subsp. lactis) штамм DSM N 15954 при функциональных нарушениях пищеварения у детей раннего возраста: результаты проспективного открытого наблюдательного исследования // Вопросы детской диетологии. 2014. Т. 12. № 2. C. 30–36.
21. Stewart-Tull D.E. The immunological activities of bacterial peptidoglycans // Annu. Rev. Microbiol. 1980. Vol. 34. P. 311–340.
22. Oppenheim J.J., Togawa A., Chedid L., Mizel S. Components of mycobacteria and muramyl dipeptide with adjuvant activity induce lymphocyte activating factor // Cell. Immunol. 1980. Vol. 50. № 1. P. 71–81.
23. Tufano M.A., Cipollaro de l’Ero G., Ianniello R. et al. Protein A and other surface components of Staphylococcus aureus stimulate production of IL-1 alpha, IL-4, IL-6, TNF and IFN-gamma // Eur. Cytokine. Net. 1991. Vol. 2. № 5. P. 361–366.
24. Haahtela T., Korpela R., Savilahti E. et al. Probiotics in infancy induce protective immune profiles that are characteristic for chronic low-grade inflammation // Clin. Exp. Allergy. 2008. Vol. 38. № 4. P. 611–618.
25. Oksaharju A., Kankainen M., Kekkonen R.A. et al. Probiotic Lactobacillus rhamnosus downregulates FCER1 and HRH4 expression in human mast cells // World J. Gastroenterol. 2011. Vol. 17. № 6. P. 750–759.
26. Osborn D.A., Sinn J.K.H. Probiotics in infants for prevention of allergic disease and food hypersensitivity // Cochrane Database of Systematic Reviews. 2007. Iss. 4. CD006475.
27. Isolauri E., Arvola T., Sütas Y. et al. Probiotics in the management of atopic eczema // Clin. Exp. Allergy. 2000. Vol. 30. № 11. P. 1604–1610.
28. Holmes E., Kinross J., Gibson G.R. et al. Therapeutic modulation of microbiota-host metabolic interactions // Sci. Transl. Med. 2012. Vol. 4. № 137. P. 137rv6.
Correction of alterations in gut microbiota
S.V. Belmer
Pirogov Russian national research medical university
Contact person: Sergey Viktorovich Belmer, belmersv@mail.ru
A wide range of disorders is associated with alterations in gut microbiota which, in their turn, may complicate the disease. Probiotics are live microorganisms which improve quantitative and qualitative parameters of microbiota and are considered effective preparations for the correction of microbiota disturbances. Probiotics are commonly prescribed for diarrhea (including antibiotic-associated diarrhea), irritable bowel syndrome and other disorders. The article addresses the use of complex probiotic Linex for the prevention of antibiotic-induced intestinal dysbiosis.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.