Магнитно-резонансная томография с гадоксетовой кислотой для выявления метастазов увеальной меланомы в печени. Серия клинических наблюдений
- Аннотация
- Статья
- Ссылки
- English
Цель — определение лучевых признаков метастазов УМ в печень для их раннего выявления и дифференциальной диагностики с другими очаговыми поражениями печени.
Материал и методы. Ретроспективно проанализированы данные лучевых исследований 50 пациентов с УМ (32 мужчины и 18 женщин в возрасте 29–86 лет), обследованных за период с января 2019 по декабрь 2022 г. Обследование печени на предмет выявления метастазов УМ проводилось с помощью мультипараметрической магнитно-резонансной томографии (МРТ) на томографах Philips Achieva 3.0T и на 1.5T GE Optima MR450 сканерах с отсроченной гепатоспецифической фазой сканирования на 10-й минуте исследования. Всего проведено 66 МРТ-исследований печени у 50 больных. 50 больных исследованы хотя бы один раз, 12 – дважды, трое — трижды и один больной прошел обследование четыре раза.
Результаты. У 29 (58%) пациентов были обнаружены образования в печени. У 13 (26%) больных выявлены очаги с МР-характеристиками злокачественных опухолей. У трех из 13 больных с метастазами поражение печени было выявлено одновременно с первичной УМ. У остальных десяти больных метастазы были выявлены в сроки от одного года до 22 лет после лечения первичной опухоли. Наряду с метастазами были выявлены кисты у 12 пациентов, гемангиомы — у шести. У 21 (42%) пациента данных по очаговому поражению печени получено не было.
Размеры очагов варьировали от 2 до 78 мм (средний размер очага 4,5 мм). Единичные очаги (до 4 мм) выявлены у двух пациентов, множественные — у семи. Множественные очаги визуализировались в обеих долях печени, единичные — в правой доле. У шести (из 13) пациентов с метастазами в печени наблюдался гиперинтенсивный МР-сигнал на нативных Т1-взвешенных изображениях (Т1-ВИ) в метастатических очагах поражения, тогда как большинство метастазов при первичных опухолях другого генеза имеют сигнал пониженной интенсивности на Т1-ВИ, что было расценено как наличие в структуре меланина. Такая же интенсивность сигнала может наблюдаться при жировой инфильтрации очагового образования, кровоизлиянии в очаг, высокобелковом субстрате кистозных элементов опухоли и в результате лечебного метаморфоза (например, после химиотерапии). Первую категорию можно исключить с помощью импульсных последовательностей с жироподавлением, в том числе внутриклеточного жира (в противофазе). Вторая категория очагов была исключена при динамическом наблюдении пациентов, так как с течением времени при распаде гемоглобина меняется интенсивность сигнала и, кроме того, кровоизлияние в очаге обычно имеет более гетерогенную структуру. У всех пациентов первичное МРТ печени было проведено до медикаментозного лечения, в том числе до химиотерапии. Кистозных метастазов у пациентов обнаружено не было.
Мы предположили у двух пациентов инфильтративный характер роста метастазов в синусоидальном пространстве, а у остальных девяти — узловой в перипортальной области. Предположения сделаны на основе локализации, очертаний и форм образований, в соответствии с гистологической классификацией моделей роста метастазов УМ H.E. Grossniklaus.
Заключение. Для дифференциальной диагностики метастазов УМ с другими очаговыми опухолевыми и неопухолевыми изменениями печени следует ориентироваться на следующие признаки на магнитно-резонансных снимках. Гиперинтенсивный сигнал на бесконтрастных Т1-ВИ и Т2-ВИ является патогномоничным признаком наличия метастаза меланомы, обусловлен содержанием в нем меланина, однако отсутствие гиперинтенсивного очага печени на бесконтрастных томограммах не исключает наличия метастаза меланомы в связи с возможностью развития его беспигментного варианта.
Для метастазов УМ характерно неоднородное быстрое накопление контраста в артериальную фазу и быстрое «вымывание» его в венозную и отсроченную фазы исследования; отсутствие накопления гепатотропного контрастного вещества в гепатобилиарную фазу свидетельствует об отсутствии в очаге нормальных гепатоцитов. На диффузионно-взвешенных изображениях метастазы в печени характеризуются ограничением диффузии. Небольшое количество наблюдений не позволяет нам сделать однозначное заключение о характере роста метастазов УМ в печени, однако преобладание метастазов с четкими границами может свидетельствовать о преимущественно узловом характере их роста.
Цель — определение лучевых признаков метастазов УМ в печень для их раннего выявления и дифференциальной диагностики с другими очаговыми поражениями печени.
Материал и методы. Ретроспективно проанализированы данные лучевых исследований 50 пациентов с УМ (32 мужчины и 18 женщин в возрасте 29–86 лет), обследованных за период с января 2019 по декабрь 2022 г. Обследование печени на предмет выявления метастазов УМ проводилось с помощью мультипараметрической магнитно-резонансной томографии (МРТ) на томографах Philips Achieva 3.0T и на 1.5T GE Optima MR450 сканерах с отсроченной гепатоспецифической фазой сканирования на 10-й минуте исследования. Всего проведено 66 МРТ-исследований печени у 50 больных. 50 больных исследованы хотя бы один раз, 12 – дважды, трое — трижды и один больной прошел обследование четыре раза.
Результаты. У 29 (58%) пациентов были обнаружены образования в печени. У 13 (26%) больных выявлены очаги с МР-характеристиками злокачественных опухолей. У трех из 13 больных с метастазами поражение печени было выявлено одновременно с первичной УМ. У остальных десяти больных метастазы были выявлены в сроки от одного года до 22 лет после лечения первичной опухоли. Наряду с метастазами были выявлены кисты у 12 пациентов, гемангиомы — у шести. У 21 (42%) пациента данных по очаговому поражению печени получено не было.
Размеры очагов варьировали от 2 до 78 мм (средний размер очага 4,5 мм). Единичные очаги (до 4 мм) выявлены у двух пациентов, множественные — у семи. Множественные очаги визуализировались в обеих долях печени, единичные — в правой доле. У шести (из 13) пациентов с метастазами в печени наблюдался гиперинтенсивный МР-сигнал на нативных Т1-взвешенных изображениях (Т1-ВИ) в метастатических очагах поражения, тогда как большинство метастазов при первичных опухолях другого генеза имеют сигнал пониженной интенсивности на Т1-ВИ, что было расценено как наличие в структуре меланина. Такая же интенсивность сигнала может наблюдаться при жировой инфильтрации очагового образования, кровоизлиянии в очаг, высокобелковом субстрате кистозных элементов опухоли и в результате лечебного метаморфоза (например, после химиотерапии). Первую категорию можно исключить с помощью импульсных последовательностей с жироподавлением, в том числе внутриклеточного жира (в противофазе). Вторая категория очагов была исключена при динамическом наблюдении пациентов, так как с течением времени при распаде гемоглобина меняется интенсивность сигнала и, кроме того, кровоизлияние в очаге обычно имеет более гетерогенную структуру. У всех пациентов первичное МРТ печени было проведено до медикаментозного лечения, в том числе до химиотерапии. Кистозных метастазов у пациентов обнаружено не было.
Мы предположили у двух пациентов инфильтративный характер роста метастазов в синусоидальном пространстве, а у остальных девяти — узловой в перипортальной области. Предположения сделаны на основе локализации, очертаний и форм образований, в соответствии с гистологической классификацией моделей роста метастазов УМ H.E. Grossniklaus.
Заключение. Для дифференциальной диагностики метастазов УМ с другими очаговыми опухолевыми и неопухолевыми изменениями печени следует ориентироваться на следующие признаки на магнитно-резонансных снимках. Гиперинтенсивный сигнал на бесконтрастных Т1-ВИ и Т2-ВИ является патогномоничным признаком наличия метастаза меланомы, обусловлен содержанием в нем меланина, однако отсутствие гиперинтенсивного очага печени на бесконтрастных томограммах не исключает наличия метастаза меланомы в связи с возможностью развития его беспигментного варианта.
Для метастазов УМ характерно неоднородное быстрое накопление контраста в артериальную фазу и быстрое «вымывание» его в венозную и отсроченную фазы исследования; отсутствие накопления гепатотропного контрастного вещества в гепатобилиарную фазу свидетельствует об отсутствии в очаге нормальных гепатоцитов. На диффузионно-взвешенных изображениях метастазы в печени характеризуются ограничением диффузии. Небольшое количество наблюдений не позволяет нам сделать однозначное заключение о характере роста метастазов УМ в печени, однако преобладание метастазов с четкими границами может свидетельствовать о преимущественно узловом характере их роста.

Введение
Увеальная меланома (УМ) – наиболее распространенная злокачественная внутриглазная опухоль. По данным разных авторов, она составляет от 5 до 8% от числа меланом всех локализаций и 85% от всех внутриглазных новообразований [1–3]. В странах Европы и Америки заболеваемость составляет 0,6–0,9 случая на 100 тыс. взрослого населения [4–6], в Москве и Московской области – 0,9 на 100 тыс. взрослого населения [7].
В 91% случаев метастазы УМ развиваются в печени [8–10], второе место по частоте локализации метастазов занимают легкие и органы средостения. Изолированное метастатическое поражение печени наблюдается у каждого второго пациента с метастатической УМ, в то время как изолированное метастатическое поражение головного мозга, костей, кожи или мягких тканей встречается очень редко [11]. Средняя продолжительность жизни больных УМ с метастазами в печень составляет 4–15 месяцев.
Недостаточная эффективность системной химиотерапии, иммунной и таргетной терапии вызвала необходимость развития методов локальной химиоэмболизации и радиоэмболизации метастазов УМ в печени, что возможно только при выявлении одиночных метастазов. В связи с этим особое значение приобретает их выявление с помощью методов визуализации. Согласно клиническим рекомендациям Министерства здравоохранения Российской Федерации [12], всем пациентам следует выполнять лучевую диагностику в оптимальном объеме: магнитно-резонансную томографию (МРТ) органов брюшной полости с внутривенным контрастированием для более раннего выявления метастатического поражения печени, что может повлиять на выбор дальнейшей тактики лечения.
Одной из самых высокоточных и избирательных уточняющих диагностических методик для определения метастатического поражения паренхимы печени является МРТ c применением гепатотропного контрастного вещества (ГКВ) [13]. Однако широкое применение ГКВ ограничено его более высокой стоимостью и низкой распространенностью по сравнению с другими гадолиний-содержащими контрастными препаратами. В литературе нет описания отличительных МР-признаков метастазов УМ в печени от метастазов меланомы другой первичной локализации, а также их классификаций.
Цель – определение сигнальных характеристик, очертаний и локализации метастазов УМ в печени для их раннего выявления и дифференциальной диагностики с другими очаговыми поражениями печени.
Материал и методы
Проведен ретроспективный анализ данных лучевых исследований печени 50 пациентов с УМ, обследованных в Московском областном научно-исследовательском клиническом институте (МОНИКИ) им. М.Ф. Владимирского в период с января 2019 г. по декабрь 2022 г. (32 мужчин и 18 женщин в возрасте 29–86 лет). У 48 больных УМ была подтверждена морфологически. У двух больных диагноз УМ установлен на основании клинических данных и результатов ультразвукового исследования глаза. В зависимости от вида лечения первичной опухоли больные распределились следующим образом: 42 пациентам c УМ T3N0M0 была произведена энуклеация пораженного глаза; пять пациентов по поводу УМ получили брахитерапию; одному пациенту с УМ T2N0M0 была ранее проведена транспупиллярная термотерапия; двое больных от лечения первичной опухоли отказались.
Все пациенты подписали информированное согласие на диагностическое исследование. Всего проведено 66 МРТ-исследований печени. Однократно были обследованы 50 пациентов, дважды – 12, трижды – три, четыре раза – один больной. При обследовании печени у пациентов с УМ были использованы следующие МР-томографы: Philips Achieva 3.0T (Netherlands (NL)) и GE (General Electric) Signa 1.5T (US). Наш стандартный протокол включал: (до введения контраста) поперечные и фронтальные T2 TSE (turbo spin echo), толщина среза 4 мм; поперечные Т1-FS (mDIXON (William Thomas Dixon technique)), толщина среза 3 мм; поперечные DWI (diffusion-weighted images) с тремя b-факторами (50–500–1000), толщина среза 4 мм; поперечные Т1-FS (mDIXON) (после внутривенного болюсного контрастирования с использованием гепатотропного контрастного препарата на основе гадоксетовой кислоты, вводимой в дозе 0,1 мл/кг массы тела пациента, в артериальную, венозную отсроченную фазы и гепатоспецифическую фазу на 10-й минуте; средняя скорость введения контрастного препарата – 2 мл/с). Время исследования в среднем составило около 30 минут.
Результаты
Характеристика больных и вид лечения увеальной меланомы с метастатическим поражением печени
У 29 (58%) из 50 обследованных обнаружены какие-либо образования в печени. У 13 больных (26%) выявлены очаги с МР-характеристикой злокачественных опухолей. Наряду с метастазами были выявлены кисты –
у 12 (24%) пациентов, гемангиомы – у шести (12%) пациентов.
У 21 (42%) пациента данных, свидетельствующих об очаговом поражении печени, не было получено. Доброкачественные образования в печени были выявлены у десяти мужчин и шести женщин, злокачественные опухоли печени (метастазы) определялись у шести мужчин и семи женщин. У остальных пациентов на момент исследования очаговых образований в печени выявлено не было [14].
При анализе данных МРТ печени установили: у девяти из 13 больных УМ метастазы в печень выявлены в сроки от 1 года до 22 лет после лечения первичной опухоли, у четырех – очаги в печени с признаками злокачественной опухоли выявлены одновременно с первичной УМ (табл. 1).
Из них двум больным в связи с офтальмогипертензией и выраженным болевым синдромом выполнили энуклеацию пораженного глаза, еще одной больной – экзентерацию орбиты. Затем им провели системную иммунотерапию ингибиторами контрольных точек. Один больной от лечения первичной опухоли и системной терапии метастатического поражения печени отказался и умер от метастатической болезни через 12 месяцев.
Биопсию очаговых образований в печени выполнили у пяти больных, в том числе у двух пациентов с первично-множественными злокачественными опухолями (ПМЗО):
УМ и нейроэндокринной опухолью поджелудочной железы; УМ и раком молочной железы. У двух больных с ПМЗО выявлен «немеланомный» характер метастатического поражения печени, у остальных трех больных при гистологическом исследовании биоптата определен метастаз УМ. У восьми из 13 пациентов с метастазами в печени гистологически была подтверждена только первичная опухоль, метастаз предполагался на основании клинических и диагностических данных. У пяти из восьми пациентов были получены данные аутопсии.
Информация по метастатическому поражению печени, видам лечения, а также данные по продолжительности жизни пациентов обобщены в табл. 2. Как видно из данных, у четырех пациентов метастазы в печени были диагностированы при динамическом МРТ-исследовании: у одного выявлены через четыре месяца от первичной МРТ, у трех – через один год от первичной МРТ.
МР-характеристики метастатических очагов
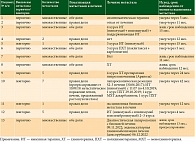
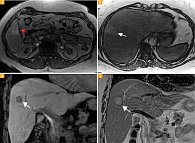
Размеры очагов варьировали от 2 до 78 мм (средний размер очага 4,5 мм). Единичные очаги (до 4 мм) выявлены у четырех пациентов (рис. 1А, 1Б), множественные очаги – у семи (рис. 1В, 1Г). Множественные очаги визуализировались в обеих долях печени, единичные – в правой доле.
У восьми пациентов контуры очагов были достаточно четкими, у трех пациентов очаги имели нечеткие очертания.
На Т2-взвешенных изображениях (Т2-ВИ) все метастазы имели повышенный МР-сигнал по отношению к паренхиме печени. На Т1-ВИ у шести из 11 пациентов метастазы в печени характеризовались гипоинтенсивным сигналом. Сочетанный МР-сигнал на бесконтрастных Т1-ВИ, как гипоинтенсивный, так и гиперинтенсивный, определялся в метастазах УМ у пяти пациентов.
Гиперинтенсивный сигнал в очагах поражения печени, как на бесконтрастных Т1-ВИ, так и на Т2-ВИ, у пяти больных мог быть обусловлен отложением меланина (рис. 2А, 2Б).
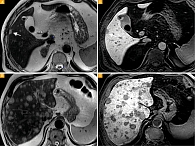
На диффузионно-взвешенных изображениях (ДВИ) с использованием b-факторов b50, b1000 и картах измеряемого коэффициента диффузии (ADC, eADC) все метастазы характеризовались ограничением диффузии: гиперинтенсивный сигнал на DWI, гипоинтенсивный – на изображениях ADC и гиперинтенсивный – на изображениях eADC (рис. 3).
В артериальную и венозную фазы исследования характер «накопления» контрастного вещества был разнородным. У двух пациентов контрастирование очагов в сосудистые фазы не выявлено. У одного пациента в сосудистые фазы сканирования (артериальную, венозную и отсроченную) визуализировались очаги с изоинтенсивным МР-сигналом печени. У девяти пациентов отмечалось более выраженное контрастирование очагов в артериальную фазу. Среди них у двух наблюдалось контрастирование по периферии очагов по типу «кольца», у семи – неоднородное контрастирование.
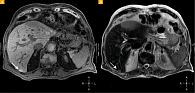
При нетипичных для метастазов характеристиках выполнение гепатоспецифической фазы позволило дать более точное представление о природе подозрительных очагов. Отсутствие накопления контрастного вещества в отсроченную фазу в подозрительных очагах свидетельствует об отсутствии в них гепатоцитов (рис. 1).
МР-характеристики других очагов
Выявленные при МР-исследовании кисты печени представляли собой образования жидкостных сигнальных характеристик, с четкими ровными контурами, не накапливающие контрастный препарат, неосложненные наличием перегородок и неоднородным содержимым, размерами от 3 до 20 мм.
Обнаруженные гемангиомы имели преимущественно центрипетальный характер накопления контрастного препарата, достаточно четкие неровные контуры, размеры от 4 до 45 мм. Вместе с тем наблюдались небольшие очаги (менее 5 мм) с неоднозначными сигнальными характеристиками контрастирования. Атипичные гемангиомы могут демонстрировать вариабельные паттерны контрастирования с быстрым и гомогенным накоплением контрастного препарата в артериальную фазу, что в совокупности с сомнительными данными ДВИ усложняет их корректное определение. Помимо этого, в результате тромбоза, фиброза или некроза очаговых образований может возникать не накапливающая контраст центральная часть. Кроме того, гемангиомы, будучи сосудистыми образованиями, имеют гипоинтенсивный МР-сигнал в гепатоспецифическую фазу – такой же, как и метастазы, что затрудняет их дифференциальную диагностику.
При таких клинических ситуациях именно динамическое исследование позволило нам провести дифференциальный диагноз этих очагов.
Обсуждение
Несмотря на общность происхождения, кожная и увеальная меланомы отличаются друг от друга молекулярно-генетическими изменениями, клиническими проявлениями, ответом на таргетную терапию, особенностями метастазирования. В основе развития кожной меланомы лежит митоген-активируемая протеинкиназа (МАРК), и главное событие в патогенезе кожной меланомы – активация мутированной BRAF-киназы. Значительного увеличения продолжительности жизни удалось достичь у пациентов с метастатической меланомой кожи, используя таргетные препараты – ингибиторы мутаций BRAF-киназного сигнального пути [15].
При увеальной меланоме происходят драйверные мутации в генах, ассоциированных с G-белком – субъединицами GNAQ или GNA11. Таким образом, ингибиторы BRAF-киназы, применяемые при таргетной терапии кожной меланомы, нецелесообразны для лечения УМ. Иммунотерапия ингибиторами контрольных точек также малоэффективна ввиду низкой мутационной активности УМ.
Медикаментозное лечение, воздействующее на активацию Ras-киназного сигнального пути при УМ, еще в стадии клинических испытаний. В настоящее время единственным надежным методом лечения одиночных метастазов УМ остается их локальное разрушение. Таким образом, на первый план выходит ранняя диагностика одиночных метастазов УМ.
Различаются кожная и увеальная меланома и особенностями метастазирования, в частности развитием отдаленных метастазов: кожная меланома чаще метастазирует в головной мозг, УМ – в печень.
Печень является доминирующим органом при развитии вторичного поражения при меланоме сосудистой оболочки глаза, так как молекулы HGF (лиганды на поверхности гепатоцитов) взаимодействуют с с-MET-рецепторами клеток УМ [16, 17].
При меланоме кожи «золотым стандартом» диагностики метастатического поражения органов признана позитронно-эмиссионная томография с компьютерной томографией (ПЭТ/КТ). Однако ПЭТ/КТ с использованием радиофармпрепарата (РФП) обладает значительной лучевой нагрузкой и не может применяться часто. Кроме того, в случае УМ, метастазы которой в отличие от метастазов кожной меланомы небольших размеров, диагностическая ценность ПЭТ/КТ невысока [18]. И в нашей когорте пациентов у большинства (29 из 50) были образования печени преимущественно маленького размера (< 10 мм, в среднем 2–4 мм). В этой связи дифференциальная диагностика мелких очаговых образований печени приобретает решающее значение.
Вследствие отсутствия ионизирующего излучения МРТ не имеет ограничений по частоте применения. А благодаря высокому разрешению в отображении мягкотканных структур метод МРТ c внутривенным контрастированием демонстрирует при очаговом поражении печени наиболее высокую чувствительность (94%) и специфичность (82–89%) [19]. В исследовании метастазов в печень колоректального рака была подтверждена высокая чувствительность МРТ с DWI и использованием гадоксетовой кислоты (91,4%) по сравнению с КТ (80,9%), особенно при поражениях маленького размера [20].
Высокодоступным методом диагностики без значительной лучевой нагрузки считается ультразвуковое исследование. Однако этот метод, в отличие от МРТ брюшной полости, операторозависим.
В свою очередь, один раз проведенное МРТ-исследование может быть проконсультировано разными специалистами. В частности, при МРТ брюшной полости используют стандартные импульсные последовательности Т1 и Т2 взвешенных изображений. Гиперинтенсивный очаг печени на бесконтрастных изображениях, как на Т1-ВИ, так и на Т2-ВИ, может быть обусловлен отложением меланина и является патогномоничным признаком для метастазов меланомы в дифференциальной диагностике очагового поражения печени [21, 22].
При сравнении метастазов в печени кожной и увеальной меланом было отмечено, что у пациентов с УМ более высокая экспрессия антигена MelanA, более высокое содержание меланина в клетках [23]. В этой связи логично предположить, что повышение МР-сигнала на Т1-ВИ в очаговых образованиях печени при наличии в анамнезе УМ будет патогномонично для метастазов УМ. И хотя данная сигнальная характеристика встречалась только у 5 (38,5%) из 13 обследованных нами пациентов с метастазами, она имеет решающее значение при обнаружении и дифференциальной диагностике метастатических очагов меланомы.
Свойство ГКВ накапливаться только в клетках печени делает поиск метастазов даже небольших размеров весьма достоверным. Известно, что кровоснабжение метастазов в печени происходит из бассейна печеночной артерии, в то время как кровоснабжение нормальных гепатоцитов всего лишь на 30% осуществляется из печеночной артерии, а остальная паренхима преимущественно кровоснабжается ветвями воротной вены [24]. Эти данные лежат в основе широко используемых МР-критериев: наличие «ободка» в артериальную фазу при «быстром», артериальном, кровоснабжении метастазов и понижение интенсивности сигнала в венозную фазу сканирования при раннем «вымывании» контрастного препарата. Однако таким типом контрастирования могут характеризоваться не только метастазы, но и первичные злокачественные опухоли печени. Более того, атипичное контрастирование может наблюдаться и в доброкачественных очагах. Гипоинтенсивный МР-сигнал от очага в отсроченную фазу исследования с применением ГКВ достоверно указывает на отсутствие в нем нормальных гепатоцитов [25].
По данным M. Wagner и соавт., использование режима ДВИ незначительно повышает чувствительность обнаружения метастазов УМ в печени [26]. Однако в этой работе представлены изображения только с низким и средним значениями b-фактора. Показано, что низкие значения b-фактора чувствительны для выявления любых образований печени [27]. В нашем исследовании использовались ДВИ с низким, средним и высокими значениям b-фактора, в том числе 500 и 1000, которые более специфичны для обнаружения злокачественных новообразований печени. В целом использование разных значений b-факторов не только повышает выявляемость очаговых образований печени, но и позволяет определить их характеристики [28]. Особенно важна роль ДВИ при дифференциальной диагностике мелких очагов печени с атипичным накоплением контрастного препарата [29].
Безусловно, наиболее трудными для обнаружения являются субкапсулярные метастатические очаги, так как изменение МР-сигнала на границе сред иногда еле различимо, и только проведение мультипараметрического МР-исследования позволяет минимизировать риск пропуска метастатического очага [30].
H.E. Grossniklaus и соавт. выделяют две модели роста метастазов УМ в печени: инфильтративную и узловую. Инфильтративно метастазы УМ растут в синусоидальных пространствах печеночной дольки, не содержат сосудистых каналов и не экспрессируют фактор роста эндотелия сосудов VEGF. Узловая модель роста характерна для метастазов УМ, которые возникают в перипортальной области. В процессе роста они захватывают портальную вену, становятся гипоксическими, экспрессируют MMP9 и VEGF, вызывая ангиогенез. Инфильтративный рост метастазов частично контролируется изменениями в иммунной микросреде в синусоидальном пространстве, в то время как узловой рост зависит от соотношения VEGF/PEDF микросреды в перипортальной области. Распознавание различных моделей роста метастатазов УМ в печени имеет клиническое значение. Узловая модель метастазов лучше поддается химиоэмболизации и радиоэмболизации, поскольку она васкуляризована по сравнению с инфильтративной моделью. Инфильтративная модель в большей степени контролируется изменениями в иммунной микросреде в синусоидальном пространстве и должна лучше отвечать на иммунотерапию [31, 32].
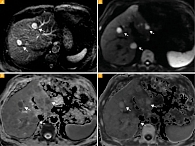
Сопоставляя результаты наших исследований с гипотезой H.E. Grossniklaus, мы определили у двух из десяти пациентов инфильтративный характер метастазов, а у остальных восьми – узловой. У одного нашего пациента в одной доле печени наблюдались разные модели роста метастазов (рис. 4). На основании анализа данных МР-исследований в динамике мы предположили, что узловой и инфильтративный характер метастазов – это стадии единого метастатического процесса.
Тем не менее небольшое количество наблюдений не позволило нам сделать более определенное заключение о различиях в характере роста метастазов УМ. Точная неинвазивная характеристика метастазов поможет определить категорию пациентов с наиболее неблагоприятным прогнозом для разных видов таргетного лечения.
Заключение
С помощью МР-исследования с гепатотропным контрастным препаратом нам удалось выявить метастазы УМ в печень, определить их количество, размеры, локализацию и предполагаемый тип роста.
Патогномоничным признаком метастаза меланомы является гиперинтенсивный сигнал на бесконтрастных Т1-ВИ и Т2-ВИ. Отсутствие гиперинтенсивного очага печени на бесконтрастных томограммах не исключает метастаза меланомы в связи с возможностью развития его беспигментного варианта. Для метастазов УМ характерно неоднородное быстрое накопление контраста и быстрое «вымывание» в сосудистые фазы исследования. «Вымывание» гепатотропного контрастного вещества в отсроченную фазу свидетельствует об отсутствии в очаге нормальных гепатоцитов. На ДВИ метастазы в печень характеризуются ограничением диффузии. Использование разных b-факторов ДВИ способствует корректной дифференциальной диагностике метастазов с другими очаговыми образованиями печени. Мы визуализировали преимущественно узловой характер роста метастазов, однако при дальнейшем наблюдении с увеличенным количеством пациентов мы надеемся установить более релевантные значения характеристик роста метастазов УМ в печени.
O.A. Sevryugina, Ye.Ye. Grishina, PhD, Ye.A. Stepanova, PhD, L.B. Denisova
M.F. Vladimirsky Moscow Regional Research Clinical Institute
Contact person: Yelena A. Stepanova, stepanovamoniki@gmail.com
Uveal melanoma (UM) is the most common primary intraocular malignant tumor. About 96% of UM patients develop metastatic melanoma to the liver. Insufficient effectiveness of systemic chemotherapy, immune and target therapy has necessitated the development of methods of local chemoembolization and radioembolization of UM metastases, which is possible only when single metastases to the liver are detected. Due to this reason correct and early single metastases detection in liver is significant.
Objective. To characterize MRI features of UM metastases to the liver, its early detection and correct differential diagnosis using gadoxetic acid, a hepatocyte-specific contrast agent.
Material and methods. The data of radiological studies of 50 UM patients (n = 50, 32 men and 18 women; age range, 29–86 years) who were hospitalized between January 2019 and December 2022 were retrospectively analyzed. Examinations of the liver with DCE-MRI on a scanner Philips Achieva 3.0T and GE Optima 1.5T MR450 were performed for each UM patient with standard protocol including 10 min post-contrast images after intravenously administration of a gadoxetic acid (10 ml Primovist™). 66 MRI studies of the liver were performed in total. 50 patients were examined once, 12 patients were examined twice, three patients – three times, and one patient was examined four times.
Results. Any liver lesions were diagnosed in more than half (29 patients, 58%) of all patients. Lesions with MRI characteristics of malignant tumors were identified in 13 patients (26%). 3 patients from 13 were diagnosed with UM and UM liver metastases at the same time. All the other 10 patients developed liver metastases between 1 to 22 years after a diagnosis of a primary tumor. Cysts were detected in 12 patients, hemangiomas – in 6. No lesions in liver were is obtained in 21 (42%) patients. The size of the liver lesion varied from 2 mm to 78 mm (mean lesion size 4.5 mm). Single lesions (up to 4) were detected in two patients. 8 from 10 patients were diagnosed with multiple metastases. Multiple liver lesions were visualized in both lobes of the liver, single – in the right lobe. An increased MR signal of the liver lesions was observed both on non-contrast T1 and T2 weighted images in half of the patients with metastases which was associated with the presence of melanin deposition. The simultaneous presence of such a combination of signals can also be observed in the presence of fat in the focal formation and in the subacute stage of hemorrhage into the lesion, during the phase of hemoglobin decay into extracellular methemoglobin (7–28 days). We excluded the first category using pulse sequences with fat suppression, including intracellular fat (in-phase and out-of-phase). The second category of foci was excluded during dynamic observation of patients, since the final product of hemosiderin decay is visualized as hypointense on T2-WI, and hemorrhage in the lesion usually has a more heterogeneous structure in contrast to melanin deposition. The infiltrative growth pattern of liver metastases we suggest in two patients in sinusoidal space, the nodular one in the remaining eight patients in the periportal region depending on the localization, outline and shape of the formations, according to the histological classification of growth patterns of UM metastases by H.E. Grossniklaus.
Conclusion. Gadoxetic acid-enhanced MRI with the DWI is an effective technique for the detection and systematization of uveal melanoma metastases. The following MRI features may help for differential diagnosis of UM metastases with other focal lesions in the liver. Hyperintense signal on non-contrast T1-WI is associated with the presence of melanin. The absence of a hyperintense liver lesion does not exclude melanoma metastasis due to the possibility of developing its non-pigmented variant. UM metastases are characterized by heterogeneous rapid accumulation of contrast and rapid "wash-out" in the vascular phases of the study. "Wash-out" of the hepatotropic contrast agent in the delayed phase indicates the absence of normal hepatocytes in the lesion.
All the metastases in liver are characterized by restricted diffusion. A small number of observations does not allow us to make an unambiguous conclusion about the nature of the growth of UM metastases in the liver, however, the predominance of metastases with clear contours may indicate a predominantly nodular nature of their growth.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


