Оценка функции протезированных клапанов в современной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Введение
За последние десятилетия ведение пациентов с клапанной болезнью сердца (КБС) существенно изменилось. Благодаря быстрому развитию методик вмешательств на клапанах заболевание стало менее летальным [1]. Протезирование получает широкое распространение, соответственно в клинической практике возрастает количество пациентов с протезами. Их ведение требует комплексной оценки функции протезированного клапана с учетом клинической информации и результатов инструментальных исследований.
Клиническая информация чрезвычайно важна, поскольку позволяет определить показания к исследованию, симптомы, размер и тип протеза клапана, а также дату операции. Необходимо учитывать такие показатели, как артериальное давление, частота сердечных сокращений (ЧСС), рост, вес. Так, ЧСС влияет на продолжительность диастолического наполнения, а следовательно, на средние градиенты митрального и трикуспидального клапанов. Показатели роста и веса используются при расчете площади поверхности тела, которую необходимо знать для вычисления индексированных показателей.
При оценке функции протезов основополагающими являются инструментальные методы [2]. Для практических врачей разных специальностей становится актуальным приобретение компетенций по ведению пациентов с протезированными клапанами. Важно также понимание основных принципов, которыми руководствуются при использовании указанных методов диагностики.
Типы протезов клапанов
Выбор протезов клапанов широк. Разнообразие обусловлено локализацией имплантации, основной патологией, операционной техникой и индивидуальными особенностями пациента. Например, механические клапаны более долговечны, чем биологические [3], тем не менее требуют постоянной антикоагулянтной терапии [2]. Однако несколько причин, включая предпочтения пациента, привели к тому, что за последнее десятилетие частота протезирования механическими клапанами сократилась. При этом увеличилась частота транскатетерных процедур и снизилась частота имплантаций механических клапанов [4].
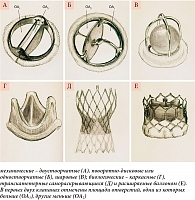
Наиболее распространенным среди механических клапанов типом считается двустворчатый (рис. 1). Он обеспечивает наилучшую для таких протезов гемодинамику [5]. Запирающий элемент в нем выполнен в виде двух симметрично расположенных полуокружных створок, прикрепленных к каркасу посредством шарнирного соединения. Примерами двустворчатого протеза служат зарубежные St. Jude Medical, Carbomedics и отечественные Карбоникс, Роскардикс, Мединж.
Согласно данным литературы, реже применяются одностворчатые (или поворотно-дисковые) протезы с конструкцией запирающего элемента в виде диска, закрепленного шарнирно с возможностью вращения вокруг оси, расположенной в плоскости корпуса, такие как Bjork-Shiley, ЛИКС, МИКС. Имеются также разновидности с единственной опорой, идущей через центр диска со специальным отверстием для нее, – Medtronic-Hall. Эта опора в форме «гусиной шеи» позволяет диску свободно перемещаться. Необходимо отметить, что шаровой клапан Старра – Эдвардса больше не имплантируется.
Биологические протезы могут представлять собой ксенотрансплантаты (ксенографты), содержащие ткань перикарда свиньи или крупного рогатого скота, гомотрансплантаты (из трупного материала) или аутотрансплантаты (операция Росса). Часто используются стентированные ксенографты, в которых створки перикарда монтируются либо внутри, либо снаружи каркаса стента. В целях увеличения площади клапана и снижения трансклапанного градиента разработаны бескаркасные протезы (в частности, Freestyle) [6]. Продолжает развиваться технология транскатетерного протезирования [4] с использованием баллонорасширяемых интрааннулярных или самораскрывающихся супрааннулярных и интрааннулярных протезов, проходящих клинические исследования. К таким протезам относятся SAPIEN, Evolut, Harmony, Navitor, МедЛаб-КТ.
Дисфункции протезированных клапанов
Известно несколько категорий дисфункции протезированных клапанов [7]:
- структурная;
- неструктурная;
- инфекционный эндокардит (ИЭ);
- тромбы.
Под структурной дисфункцией клапана понимают постоянные внутренние изменения протеза клапана: износ, разрушение, фиброз или кальцификацию створок, а также перелом или деформацию каркаса или стойки. Структурная дисфункция в биологических протезах встречается чаще, чем в механических. Наиболее частая причина дегенерации биопротезов – кальцификация. Обычно она поражает створки и элементы каркасов [8].
Неструктурная дисфункция – любая аномалия протеза, не связанная с его конструкцией, но приводящая к нарушению функции клапана. Например, дисфункция, возникающая при несоответствии размера протеза размеру пациента. В этом случае возникают высокий градиент и функциональный стеноз [2]. Еще одна часто описываемая в литературе неструктурная дисфункция – параклапанная утечка. В имплантированных хирургическим путем клапанах она может возникать из-за отхождения пришивной манжеты, ИЭ, аневризмы восходящей аорты, а в транскатетерных клапанах – из-за неправильного прилегания к нативной ткани или глубины имплантации, а также кальцификации створки или кольца [7]. Кроме того, описаны эмболизация клапана, дилатация камер сердца после имплантации, ущемление створок или дисфункция из-за паннуса (фиброзной ткани, которая растет в перианнулярной области) [9].
ИЭ становится все более актуальной клинической проблемой. ИЭ можно наблюдать в любое время после операции у 1–6% пациентов с протезами клапанов с частотой 0,3–1,2% на каждый пациенто-год [10]. При механических клапанах инфекция почти всегда распространяется из пришивной манжеты и приводит к таким осложнениям, как утечки, абсцесс и распространение на соседние структуры. Инфекции биопротезного клапана могут возникать в створках и распространяться на пришивное кольцо или параклапанную область. В аортальной позиции иногда имеют место псевдоаневризмы [11]. Инфицированная псевдоаневризма при протезированном клапане является результатом дренирования параклапанного абсцесса в соседнюю камеру сердца. I.D. Ried и соавт. (2024) указывают на более высокую частоту перечисленных осложнений у пациентов, носящих протезы, содержащие полимерные частицы [12].
У 0,3–8% пациентов с протезированными клапанами сердца наблюдаются тромбы [13]. Механические клапаны более тромбогенны, чем биологические, но только при условии недостаточной антикоагулянтной терапии. Состояние сопровождается риском эмболии, который зависит от подвижности, размера и возраста тромба.
Градиенты давления и площадь отверстия
Общие принципы оценки гемодинамики в протезированных клапанах схожи с таковыми оценки стенозов нативных клапанов и заключаются в описании явлений, возникающих при прохождении жидкости через трубку с локальным сужением. При этом учитывают эффективную (EOA) и геометрическую (GOA) площадь отверстия, максимальную скорость кровотока (Vmax), градиент (ΔP) и восстановление давления [14].
Ключевым уравнением расчета градиентов давления считают упрощенное уравнение Бернулли:
∆P = 4V2.
У пациентов с аортальными протезами и большим сердечным выбросом или узким выходным трактом левого желудочка (ЛЖ) при проксимальной скорости (V1) > 1,5 м/с эту скорость уже нельзя игнорировать. Градиент давления рассчитывают по формуле:
∆P = 4(V22 - V12).
Более полно функции протеза характеризует эффективная площадь отверстия, которую рассчитывают с помощью уравнения непрерывности:
![]() ,
,
где EOA – эффективная площадь отверстия;
SV – ударный объем;
VTI – интеграл линейной скорости кровотока [15].
В некоторых искусственных клапанах, например двустворчатых, имеется разделение на несколько потоков, где восстановление давления происходит отдельно [16]. Так, меньшее центральное отверстие в двустворчатых клапанах (рис. 1) приводит к образованию высокоскоростной струи, что соответствует локализованному падению давления, которое нормализуется, как только центральный поток воссоединяется с потоками, исходящими из двух больших боковых отверстий [16]. Если внимание исследователя сосредоточено только на центральном отверстии (например, при допплерографии), возможны переоценка ΔP и недооценка ЕОА.
Несоответствие размеров протеза и пациента
Частота возникновения умеренного несоответствия между размером протеза аортального клапана и размером пациента – 20–70%, тяжелого – 2–20%. Подобное несоответствие наблюдается, когда EOA в протезе слишком мала по сравнению с размером тела и потребностями пациента в кровотоке в состоянии покоя [17]. Обычно это может быть одной из причин высоких трансклапанных градиентов.
В условиях клапанной болезни с низким потоком градиент (ΔP) может быть не повышен, но связан с худшим исходом [18]. Поэтому для оценки меры тяжести предпочтителен расчет ЕОА, которую соотносят с площадью поверхности тела, то есть индексированной EOA. Чем она ниже, тем клинический исход хуже. Как правило, с уменьшением индексированной ЕОА градиенты увеличиваются постепенно. При значениях менее 0,8–0,9 см2/м2 (в среднем 0,85 см2/м2 ) их увеличение становится более выраженным, что демонстрирует экспоненциальный рост [19].
К неблагоприятным исходам относятся сердечная недостаточность, снижение толерантности к нагрузке, высокая частота госпитализации, развитие дисфункций ЛЖ с низким потоком и градиентом, митральная регургитация и снижение выживаемости [20].
Несоответствие размеров протеза и пациента также может возникать при использовании митральных протезов [21]. Расчет индексированной EOA митрального протеза методом периода полуснижения давления часто приводит к завышению результата вычислений, поэтому используют уравнение непрерывности. Пороговые значения расчетных величин для митрального протеза выше, чем для аортального: менее 1,2 см2/м2 для умеренного несоответствия и менее 0,9 см2/м2 – для тяжелого [22].
Регургитация
Регургитация в протезированных клапанах может быть физиологической и патологической.
Фракция физиологической регургитации не превышает 10–15% [2]. Ее подразделяют на два типа:
ретроградное смещение объема крови (объема закрытия), вызванное движением окклюдера (запирающего элемента);
истинная тривиальная легкая регургитация в шарнирах этого элемента.
В шаровых механических клапанах объем закрытия обычно мал, а истинная регургитация и вовсе отсутствует. В других механических клапанных протезах с поворотными дисками возникают оба вида регургитации. При этом истинная регургитация происходит через так называемые промывочные жиклеры либо через центральное отверстие в протезах, устроенных по типу Medtronic-Hall. В биологических клапанных протезах, чаще в бескаркасных, также обнаруживают незначительную центральную регургитацию, что связано в основном с повышением чувствительности допплеровских режимов.
Патологическая регургитация может быть как центральной, так и параклапанной. Патологическая центральная клапанная регургитация чаще наблюдается при использовании биологических клапанов. Параклапанная регургитация встречается при любом типе протезов. Распространенность параклапанной регургитации колеблется от 5 до 20%. Большинство утечек клинически и гемодинамически незначимы и в отсутствие эндокардита характеризуются доброкачественным течением [23].
Данные эхокардиографии
Одна из характеристик протеза, визуально оцениваемая в ходе эхокардиографии, – подвижность. Так, независимое или покачивающееся движение протеза аортального клапана служит диагностическим признаком его частичного отхождения. Однако повышенная подвижность протеза митрального клапана не обязательно обусловлена его дисфункцией, а может быть связана, например, с реконструкцией предсердий или необычным расположением пришивного кольца внутри левого предсердия. Такая подвижность отличается от частичного отхождения отсутствием параклапанной регургитации [24].
Другая визуальная характеристика – утолщение корня аорты. Оно может быть обусловлено либо гематомой и отеком после установки протеза, которые постепенно редуцируются, либо абсцессом корня, не имеющим закономерной динамики после вмешательства. Для дифференциальной диагностики этих состояний используют интраоперационные и повторные послеоперационные исследования [24]. Визуализации поддаются также тромбы, представляющие собой образования умеренной эхоплотности, способные распространяться в полости сердца. В биопротезных клапанах тромб может проявляться в виде утолщения створок [25].
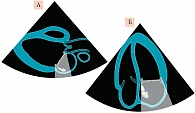
Оценить функцию протеза клапана без допплеровской эхокардиографии в импульсно-волновом, непрерывно-волновом и цветном режимах невозможно. Это исследование применяется также для оценки клапанной регургитации в нативном клапане [26]. Однако в ходе исследования могут возникать сложности из-за акустической реверберации и затенения от протеза (рис. 2). Аномальную струю удается визуализировать, если она исходит и/или движется за пределами таких зон. Использование 3D-трансэзофагеальной эхокардиографии (TЭЭ) с допплерографией улучшает оценку и измерение протезной регургитации [27], а также дифференциацию центральных и боковых струй. Обычно в ходе исследования выбирают точки, в которых лучше видны клапан или параклапанные структуры. Так, вид протезов анфас позволяет легко локализовать параклапанные утечки. Такой вид наиболее удобен для чрескожных вмешательств. Оптимальные 3D-снимки позволяют визуализировать окружающие ткани и ориентиры клапанов таким образом, чтобы можно было указать и отобразить локализацию поражения [28].
Допплерографию используют при расчете ЕОА по указанной выше формуле. Необходимо учитывать, что неточное измерение диаметра выносящего тракта и неверное положение контрольного объема способны привести к ошибкам при оценке этой площади при аортальных протезах [29]. В ходе исследования механических клапанов рекомендуется располагать контрольный объем чуть ниже их плоскости и учитывать наибольший диаметр, измеренный перпендикулярно выносящему тракту. При исследовании транскатетерных клапанов контрольный объем должен находиться апикальнее каркаса (на пике систолы), а диаметр измеряется по внешним краям (outer-to-outer) [30]. При использовании диаметра по внутренним краям, внутри стента, результат вычисления оказывается завышенным. В качестве альтернативы расчета SV можно использовать биплановый (модифицированный) метод Simpson и 3D-объемы ЛЖ. Однако T. Kitano и соавт. (2019) показали, что такие методы в отличие от магнитно-резонансной томографии (МРТ) сердца недооценивают SV [31]. При протезах митральных клапанов для расчета ударного объема используют поток либо через аортальное кольцо, либо через легочное в отсутствие регургитации.
В недавнем анализе исходов при хирургических и транскатетерных вмешательствах на аортальном клапане хорошие диагностические характеристики показал DVI, индекс допплеровской скорости. Показатель в этом исследовании рассчитывали по формуле:
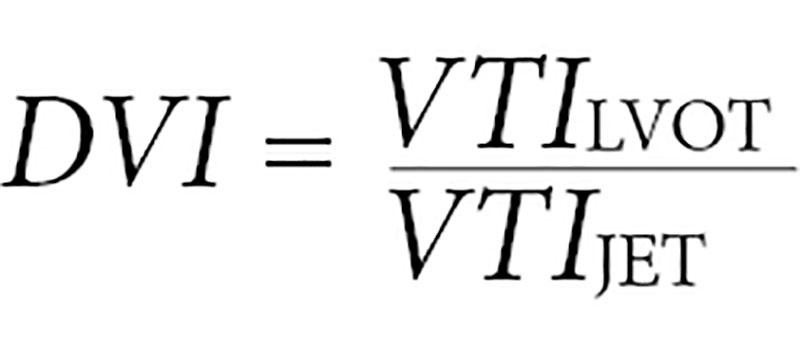 ,
,
то есть как отношение измеренного в импульсно-волновом режиме интеграла скорости кровотока проксимальнее клапана в выносящем тракте ЛЖ (VTILVOT) к измеренному в непрерывно-волновом режиме VTI, проходящему через клапан (LVIJet). DVI ≤ 0,35 ассоциируется с неблагоприятным исходом при хирургических вмешательствах, но не при транскатетерных [32].
Предлагаются также DVI для митрального (только соотношение обратное: VTI через митральный клапан соотносят с VTI в выносящем тракте ЛЖ), легочного и трикуспидального протезов, но требуются дополнительные исследования [25].
Как и у всех пациентов с КБС, у лиц с протезами клапанов может наблюдаться несоответствие между симптомами и гемодинамикой в покое. В таких ситуациях полезно выполнение стресс-эхокардиографии с физическими или фармакологическими нагрузками. Для фармакологических нагрузок применяют добутамин. Многие авторы отдают предпочтение физическим нагрузкам, особенно велоэргометрии в положении лежа, поскольку после теста на беговой дорожке гемодинамика может быстро вернуться к исходному уровню перед измерениями. В целом протоколы оценки протеза аналогичны таковым оценки нативного клапана [33].
Другие методы оценки функции протезов
Первым неинвазивным методом оценки механических клапанов была кинофлюороскопия. Механические клапаны обычно рентгеноконтрастны, что позволяет оценить основание (в том числе его аномальный наклон, указывающий на отхождение и возможную регургитацию) и окклюдер, его подвижность [34]. При биопротезных клапанах ценность метода ограниченна. В настоящее время из-за широкого использования ТЭЭ и компьютерной томографии (КТ) кинофлюороскопия отошла на задний план и является дополнительным инструментом.
В силу широкой доступности эхокардиографии частота выполнения инвазивного (катетерного) гемодинамического метода при дисфункции клапанных протезов сократилась. Как и для нативных клапанов, для расчета EОА протеза применима формула Горлина [1]. Не исключены повреждение катетера и осложнения при пересечении им механического клапана [35]. При необходимости инвазивной оценки митрального стеноза рекомендуется прямое измерение давления в левом предсердии транссептальным методом. Для оценки протезированной трансклапанной или параклапанной регургитации и других осложнений, в том числе наличия свищей и псевдоаневризмы, целесообразно введение контраста [2].
Точную функциональную и анатомическую оценку протеза клапана и камер сердца обеспечивает КТ. КТ незаменима при исследовании механических протезов. С целью визуализации сердечного цикла КТ синхронизируют с электрокардиограммой, которая обычно проводится с относительной задержкой (в процентах). При нарушениях ритма используют ретроспективное стробирование и реконструкцию с абсолютной задержкой (в миллисекундах) [36]. Применение КТ в рутинном наблюдении ограниченно, но целесообразно в случае, если обычное обследование не выявило этиологию дисфункции, а также при планировании структурного вмешательства. КТ позволяет изучить кальцификацию створок биопротеза, однако общепринятой диагностической стратегии количественного анализа такой кальцификации пока не существует [37]. КТ может также играть роль в диагностике ИЭ при протезированном клапане: в то время как ТЭЭ позволяет оценить вегетации и перфорации створок, КТ обеспечивает достоверное обнаружение корневого абсцесса [38]. Проведение КТ с контрастом важно для визуализации и дифференциальной диагностики тромба, паннуса или установления другой причины ограничения движения створок. Тромб может проявляться как утолщение и гипоаттенуация створок. Метод позволяет оценить это утолщение и ограничение движения, а также обнаружить и локализовать параклапанные утечки, не скрытые металлическими деталями [39].
Дополнительную роль в оценке протеза клапана играет МРТ сердца. Разная импульсная последовательность МРТ сердца ассоциируется с разными артефактами. Степень выраженности артефакта зависит также от типа клапана и может быть незначительной или очень выраженной, препятствующей диагностике. При наличии минимальных артефактов на киноизображениях можно распознать наличие стеноза или регургитации, визуализировать экскурсию створок или окклюдеров, провести планиметрию ЕОА и идентифицировать увеличенную подвижность при частичном отхождении [40]. Современные возможности МРТ связаны с получением фазоконтрастных изображений, фазовым кодированием в плоскости. Это улучшает визуализацию турбулентности потока через стенозированные протезы клапанов или клапанной/параклапанной регургитации, позволяет проводить прямую количественную оценку пиковых скоростей/градиентов через протезы, общего ударного объема, объема и фракции регургитации [26, 41].
Наконец, следует отметить позитронную эмиссионную томографию (ПЭТ) сердца. Ее основная роль заключается в выявлении ИЭ протезированного клапана. ПЭТ с фтордезоксиглюкозой показывает интенсивное увеличение поглощения в ткани при наличии ИЭ. Однако это следует интерпретировать с осторожностью, поскольку небольшое или даже умеренное параклапанное поглощение считается нормальным в течение года после операции [42]. Имеются также публикации о выявлении клапанов с риском структурной дегенерации с мощью ПЭТ и новых радиофармпрепаратов, но результаты в этой области ограниченны, требуются дальнейшие исследования [37].
Заключение
Эхокардиография, цветная и спектральная допплерография являются предпочтительными методами оценки протезированных клапанов сердца. В целом оценка их функции – более сложная задача, чем исследование нативных клапанов, из-за субоптимальной визуализации, а также вариабельности гемодинамики и площади просвета широкого диапазона типов и размеров протезов. Нередко для определения механизма дисфункции или тяжести регургитации требуется расширенная визуализация. В дополнение к традиционной роли 2D и 3D ТЭЭ в оценке дисфункции клапана мощными методами визуализации стали КТ и МРТ. КТ обеспечивает получение изображений с высоким разрешением и предпочтительна при использовании механических клапанов. В то же время основным преимуществом современной МРТ является количественная оценка тяжести регургитации. Решение о выборе дополнительного метода визуализации, соответствующего клиническому состоянию пациента, типу и положению протеза клапана, а также предполагаемой обструкции или регургитации, должно быть взвешенным, поскольку каждый метод имеет преимущества и ограничения.
I.N. Posokhov, PhD, Prof., Ye.A. Praskurnichiy, PhD, O.I. Morozova, PhD
State Scientific Center of the Russian Federation – A.I. Burnazyan Federal Medical Biophysical Center
Central State Medical Academy
Russian Medical Academy of Continuous Professional Education
Contact person: Igor N. Posokhov, igor@posohov.ru
Due to the rapid development of technology in clinical practice, patients who have undergone surgery on heart valves are increasingly being observed. It is becoming relevant for doctors of different specialties to acquire competencies in the assessment and management of patients with prosthetic valves. Within these competencies, it is also important to understand the basic principles of using modern diagnostic methods.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.