Предикторы возникновения макулярного отека после брахитерапии у пациентов с увеальной меланомой
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проанализированы данные 292 пациентов (96 (33%) мужчин, 196 (67%) женщин; 292 глаза), пролеченных методом БТ в период 2018–2023 гг. в МНТК «Микрохирургия глаза» им. академика С.Н. Федорова. Средний возраст пациентов составил 56 (25–89) лет. Максимальная высота УМ до проведения БТ варьировалась от 1,32 до 10,83 мм (средняя – 4,6 мм), протяженность – от 4,19 до 17,40 мм (средняя – 10,8 мм).
Результаты. При анализе предикторов развития МО методом Каплана – Мейера установлено следующее. Локализация УМ в верхнем и внутреннем сегментах (p = 0,0249), парамакулярное расположение УМ (p = 0,0378), высота опухолевого очага более 3,5 мм (p = 0,0003), протяженность опухоли свыше 11,1 мм (p = 0,0015), доза облучения на склеру более 527 Гр (p < 0,0001), активность офтальмоаппликатора более 812 сГр/ч (p = 0,015), диаметр офтальмоаппликатора более 15 мм (p = 0,0004) ассоциируются с высокой вероятностью развития МО после лучевой терапии у пациентов с УМ.
Заключение. Лучевая макулопатия является предсказуемым осложнением лучевой терапии УМ, негативно влияющим на исход зрительных функций. Выявлены не только достоверные факторы риска развития МО, но и их точные количественные параметры. Это позволит в дальнейшем разработать алгоритм ведения таких пациентов.
Материал и методы. Проанализированы данные 292 пациентов (96 (33%) мужчин, 196 (67%) женщин; 292 глаза), пролеченных методом БТ в период 2018–2023 гг. в МНТК «Микрохирургия глаза» им. академика С.Н. Федорова. Средний возраст пациентов составил 56 (25–89) лет. Максимальная высота УМ до проведения БТ варьировалась от 1,32 до 10,83 мм (средняя – 4,6 мм), протяженность – от 4,19 до 17,40 мм (средняя – 10,8 мм).
Результаты. При анализе предикторов развития МО методом Каплана – Мейера установлено следующее. Локализация УМ в верхнем и внутреннем сегментах (p = 0,0249), парамакулярное расположение УМ (p = 0,0378), высота опухолевого очага более 3,5 мм (p = 0,0003), протяженность опухоли свыше 11,1 мм (p = 0,0015), доза облучения на склеру более 527 Гр (p < 0,0001), активность офтальмоаппликатора более 812 сГр/ч (p = 0,015), диаметр офтальмоаппликатора более 15 мм (p = 0,0004) ассоциируются с высокой вероятностью развития МО после лучевой терапии у пациентов с УМ.
Заключение. Лучевая макулопатия является предсказуемым осложнением лучевой терапии УМ, негативно влияющим на исход зрительных функций. Выявлены не только достоверные факторы риска развития МО, но и их точные количественные параметры. Это позволит в дальнейшем разработать алгоритм ведения таких пациентов.
Введение
Различия в выживаемости после энуклеации и применения органосохраняющего лечения у пациентов с увеальной меланомой (УМ) отсутствуют, что делает второй метод наиболее предпочтительным [1]. Основным органосохраняющим методом лечения УМ является лучевая терапия (ЛТ), включающая брахитерапию (БТ), протонотерапию и стереотаксическую радиохирургию — гамма-нож и кибер-нож [2].
Макулярный отек (МО) лучевого генеза считается наиболее частой причиной снижения зрения у пациентов с УМ. МО характеризуется эндотелиальными изменениями сосудов сетчатки, опосредованными ионизирующим излучением [3]. МО – закономерное осложнение лечения УМ после ЛТ, снижающее качество жизни пациентов [4]. Тем не менее МО возникает далеко не у всех пациентов, перенесших ЛТ. По данным зарубежных авторов, на развитие МО влияют различные факторы: пол, возраст, наличие соматической патологии, в частности сахарный диабет (СД), размеры и локализация опухоли, доза облучения на склеру и вершину опухоли, дополнительное лечение УМ в виде транспупиллярной термотерапии (ТТТ) [5–7].
Необходимо отметить, что работы, посвященные определению предикторов возникновения МО у пациентов с УМ, в России отсутствуют.
Цель – установить на основании статистического анализа достоверные факторы риска (предикторы) развития МО у пациентов с УМ после БТ.
Материал и методы
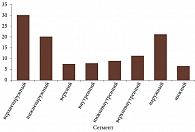
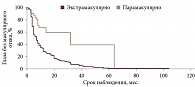
Проанализированы данные 292 пациентов (96 (33%) мужчин, 196 (67%) женщин; 292 глаза), пролеченных методом БТ в период с 2018 по 2023 г. в МНТК «Микрохирургия глаза» им. академика С.Н. Федорова. Средний возраст пациентов составил 56 (25–89) лет. Максимальная высота УМ до проведения БТ варьировалась от 1,32 до 10,83 мм (средняя – 4,6 мм), протяженность – от 4,19 до 17,4 мм (средняя – 10,8 мм). Вторичная отслойка сетчатки (ВОС) имела место в 178 (60%) случаях, а ее средняя высота до проведения БТ составляла 1,8 мм (0,1–7,2 мм). Юкстапапиллярная локализация опухоли наблюдалась в 29 (10%) случаях. В 204 (70%) случаях в процесс была вовлечена наружная полусфера глазного яблока. Распределение опухолей по локализации представлено на риc. 1.
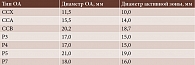
Основная характеристика используемых офтальмоаппликаторов (ОА) с Ru-106 приведена в табл. 1. Средняя поглощенная доза на склеру при БТ составила 1076 Гр (281–1872 Гр), на вершину – 150 Гр (100–200 Гр). Средняя активность ОА – 1134 сГр/ч (535–2214 сГр/ч).
Средняя максимальная корригируемая острота зрения до лечения составляла 0,7 (0,002–1,2).
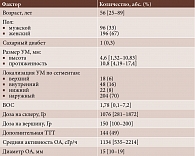
Основная характеристика пациентов и анализируемых факторов возникновения МО представлена в табл. 2.
Для дальнейшего статистического анализа были отобраны следующие факторы риска развития МО: пол и возраст пациентов (на момент лечения), высота и протяженность УМ, высота ВОС, локализация УМ по сегментам (верхний, наружный, нижний, внутренний), юкстапапиллярное и парамакулярное расположение опухоли, вовлечение в процесс цилиарного тела, доза облучения на склеру и вершину, активность и диаметр ОА, проведение дополнительной ТТТ, наличие СД.
Статистическая обработка данных проводилась с использованием компьютерных программ MedCalc и Microsoft Office Excel. Однофакторный анализ включал ROC-анализ и анализ методом Каплана – Мейера, многофакторный – метод пропорциональных рисков Кокса.
Результаты
После лечения МО развился в 148 (51%) случаях, в 144 (49%) случаях МО не диагностирован. Средний срок развития МО после ЛТ составил 13 месяцев (от одного до 104).
Для определения точки cut-off для количественных факторов (возраст пациентов, высота и протяженность УМ, высота ВОС, доза на склеру и вершину, активность и диаметр ОА) был проведен ROC-анализ.
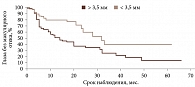
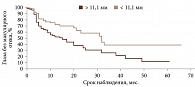
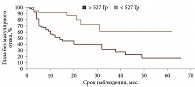
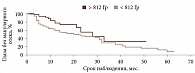
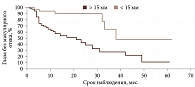
По результатам ROC-анализа при оценке влияния факторов риска определены статистически значимые критерии: возраст пациентов менее 54 лет (p < 0,001; AUC 0,649), высота УМ более 3,5 мм (p < 0,001; AUC 0,645), протяженность опухоли более 11,1 мм (p < 0,001; AUC 0,651), ВОС более 0,7 мм (p = 0,009; AUC 0,609), доза на склеру более 527 Гр (p < 0,001; AUC 0,712), активность ОА более 812 сГр/ч (p = 0,002; AUC 0,585), диаметр ОА более 15 мм (p < 0,001; AUC 0,655). В то же время доза на вершину опухоли не оказывала достоверного влияния на развитие МО (p = 0,386; AUC 0,542).
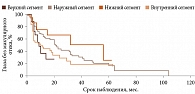
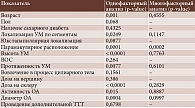
При анализе предикторов развития МО методом Каплана – Мейера установлено следующее. Локализация УМ в верхнем и внутреннем сегментах (p = 0,0249) (рис. 2.), парамакулярное расположение УМ (p = 0,0378) (рис. 3), высота опухолевого очага более 3,5 мм (p = 0,0003) (рис. 4), протяженность опухоли более 11,1 мм (p = 0,0015) (рис. 5), доза на склеру более 527 Гр (p < 0,0001) (рис. 6), активность ОА более 812 сГр/ч (p = 0,015) (рис. 7), диаметр ОА более 15 мм (p = 0,0004) (рис. 8) с высокой степенью достоверности ассоциируются с развитием постлучевого МО. В то же время возраст пациентов (р = 0,2519), пол (р = 0,068), высота ВОС (р = 0,2569), вовлечение в процесс цилиарного тела (р = 0,1561), юкстапапиллярная локализация УМ (р = 0,0877), наличие СД (р = 0,4325) достоверно не влияют на развитие МО.
Согласно данным многофакторного анализа, проведенного методом пропорциональных рисков Кокса, единственным достоверным фактором риска развития лучевого МО является парамакулярная локализация УМ (p = 0,0002).
Однофакторный и многофакторный анализ предикторов развития МО представлен в табл. 3. Средний срок наблюдения – 15 месяцев (от одного до 104).
Обсуждение
Лучевая терапия зарекомендовала себя как высокоэффективный метод достижения локального контроля над опухолью. Тем не менее ионизирующее излучение сопряжено с развитием осложнений, которые могут не только снижать остроту зрения, но и приводить к вторичной энуклеации. В связи с этим изучение предикторов развития лучевых осложнений крайне актуально и может помочь в разработке новых методов профилактики и лечения осложнений после ЛТ УМ.
Показано, что риск развития лучевых осложнений и степень снижения остроты зрения после ЛТ связаны с возрастом пациентов, размером (высотой и протяженностью) опухоли, ее локализацией, расстоянием до макулы и диска зрительного нерва, дозой облучения и наличием различных общесоматических заболеваний [5–7].
По данным N. Horgan и соавт., развитие видимого при выполнении оптической когерентной томографии (ОКТ) достоверно связано с максимальной толщиной (р = 0,0016) и протяженностью опухоли (р < 0,0001), дозой облучения и мощностью дозы в основании очага (р = 0,0315 и р = 0,0204 соответственно) [7].
C.L. Shields и соавт. предложили нанограмму, согласно которой учитываются факторы, максимально влияющие на прогнозирование изменений остроты зрения после ЛТ УМ. Речь идет об изначальной остроте зрения 0,6 или менее (100 баллов), диаметре основания опухоли более 11 мм (80 баллов), мощности дозы облучения на вершину опухоли более 164 Гр (78 баллов), высоте опухоли более 4 мм (76 баллов), инсулинозависимом диабете 2-го типа (75 баллов) и аномальном фовеолярном статусе на ОКТ (72 балла). При 56 баллах риск снижения остроты зрения через два и четыре года увеличивается с 6 до 14%, при 496 баллах – с 88 до 99% [8].
L. Tagliaferri и соавт. в исследовании, посвященном оценке номограммы для прогноза лучевой макулопатии у пациентов с УМ после проведения БТ Ru-106, выявили, что статистически достоверными факторами развития МО являются ВОС (p = 0,01), наличие СД (p = 0,02), высота УМ (p = 0,03), расстояние до фовеа (p < 0,01), доза облучения на фовеа (p < 0,01) и на зрительный нерв (ЗН) (p < 0,01), расстояние до ЗН (p < 0,01), расстояние до хрусталика (p < 0,01) [6]. Номограмма исследователей включала такие показатели, как объем опухоли, расстояние до фовеа, наличие СД. Шкала оценки предусматривала от 0 до 160 очков, где 50 очков соответствуют риску развития МО 0,1, а 130 очков – 0,9. Представленные факторы риска коррелируют с данными нашего исследования в отношении ВОС и высоты опухолевого очага. Расстояние до фовеа и ЗН, доза на ЗН в рамках нашего исследования не оценивались.
I. Seibel и соавт. определили факторы риска развития лучевой ретинопатии после протонотерапии [10]. Из 1127 участников исследования с УМ у 163 развился МО лучевого генеза. При многофакторном анализе в качестве статистически достоверных факторов развития МО представлены локализация УМ по отношению к фовеа и доза на фовеа (p = 0,02 и p = 0,05 соответственно).
В исследовании L. Tarmann и соавт. 143 пациента получили БТ [11]. У 55 (38,5%) из них выявлена макулопатия лучевого генеза. Достоверными факторами риска, влияющими на развитие МО, стали форма УМ (p = 0,004), высота УМ (p = 0,037), базальный диаметр УМ (p = 0,049), протяженность УМ до диска (р = 0,005) и до фовеа (р = 0,002), отслойка нейроэпителия до лечения (р < 0,001). Недостоверным фактором была острота зрения до проведения БТ (p = 0,056).
В представленных работах в качестве статистически достоверных факторов риска развития МО часто упоминаются высота и протяженность УМ, доза на основание, ВОС, а также локализация УМ и ее протяженность до критически важных структур. Эти данные схожи с результатами нашего исследования. Но в отличие от нашего исследования в других работах ROC-анализ для определения точки cut-off количественных критериев ранее не проводился. Это не позволяет точно прогнозировать возникновение МО в конкретном случае.
Заключение
Лучевая макулопатия – одно из самых частых осложнений ЛТ у пациентов с УМ, существенно влияющих на качество зрения и жизни. Нами выявлены предикторы возникновения МО, дополненные точными количественными критериями. Локализация опухоли относительно макулы – ведущий фактор риска. Но в целях прогнозирования развития МО, а также разработки новых методов его профилактики и купирования необходима комплексная оценка всех достоверных факторов риска.
V.A. Yarovaya, Ye.O. Malakshinova, A.S. Alekseev, D.P. Volodin, A.A. Yarovoy
Interdisciplinary Scientific and Technical Complex ‘Eye Microsurgery’ named after Academician S.N. Fedorov
Contact person: Yekaterina O. Malakshinova, ekaterinamalakshinova@yandex.ru
Purpose to determine major predictors of radiation maculopathy after plaque radiotherapy of choroidal melanoma.
Material and methods. A retrospective study of 292 patients (292 eyes) that were treated by plaque radiotherapy was performed. Among them, 96 (33%) patients were men, 196 (67%) were women. The average age of patients was 51 ± 15 years (from 17 to 73 years). Tumor thickness varied from 1.32 to 10.83 mm (average – 4.6 mm), tumor basal diameter – from 4.19 to 17.4 mm (average – 10.8 mm).
Results. Multivariate analysis using Kaplan – Meier estimates showed that superior and nasal tumor localization (p = 0.0249), paramacular tumor localization (p = 0.0378), tumor thickness more than 3,5 mm (p = 0.0003), tumor basal diameter more than 11.1 mm (p = 0.0015), sclera dose more than 527 Gy (p < 0.0001), dose rate more than 812 sGy/h (p = 0.015), plaque diameter more than 15 mm (p = 0.0004) are associated with higher risk of radiation maculopathy development.
Conclusion. Radiation maculopathy is a predictable complication following plaque radiotherapy of choroidal melanoma, which has negative effects on vision of such patients. Our study has shown not only major predictors of radiation maculopathy, but also its quantitative indicators.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


