количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Место ингибиторов протонной помпы в лечении «некислотозависимых» заболеваний. Восемнадцатая Российская гастроэнтерологическая неделя
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №5
- Аннотация
- Статья
- Ссылки
Являются ли хронический панкреатит и заболевания билиарной системы кислотозависимыми? Какова роль ингибиторов протонной помпы в алгоритмах ведения больных данными заболеваниями? Как добиться успешной эрадикации Helicobacter pylori?
Рассмотрению этих вопросов был посвящен симпозиум «Место ингибиторов протонной помпы в лечении так называемых “некислотозависимых” заболеваний», организованный компанией «Д-р Редди’с Лабораторис Лтд.», который прошел в рамках Восемнадцатой российской гастроэнтерологической недели.
В патогенезе большинства заболеваний органов пищеварения значимую роль играет уровень кислотообразования в желудке. Соответственно, эффективное лечение этих заболеваний возможно при значительном снижении кислотности желудочного сока.
Являются ли хронический панкреатит и заболевания билиарной системы кислотозависимыми? Какова роль ингибиторов протонной помпы в алгоритмах ведения больных данными заболеваниями? Как добиться успешной эрадикации Helicobacter pylori?
Рассмотрению этих вопросов был посвящен симпозиум «Место ингибиторов протонной помпы в лечении так называемых “некислотозависимых” заболеваний», организованный компанией «Д-р Редди’с Лабораторис Лтд.», который прошел в рамках Восемнадцатой российской гастроэнтерологической недели.

Профессор В.Д. Пасечников
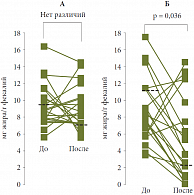
Рис. 1. Концентрация жира в фекальном содержимом у больных, получавших: А – заместительную терапию ферментами (минимикросферы в кишечнорас
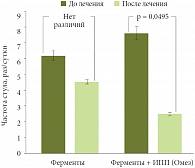
Рис. 2. Частота стула у больных, получавших заместительную терапию ферментами (минимикросферы в кишечнорастворимой оболочке) и комбинацию
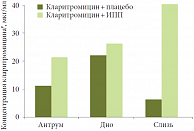
Рис. 3. Лекарственное взаимодействие омепразола и кларитромицина

Профессор В.Б. Гриневич

Таблица. Препараты группы Омеза
Как отметил в начале своего выступления д.м.н., профессор В.Д. ПАСЕЧНИКОВ (заведующий кафедрой терапии факультета последипломного и дополнительного образования Ставропольской государственной медицинской академии), хронический панкреатит (ХП) – это длительно текущее, рецидивирующее заболевание, характеризующееся прогрессирующей потерей функционирующей панкреатической паренхимы с последующим развитием фиброза ткани. Последнее, в свою очередь, приводит к снижению функции как экзокринных отделов железы, так и эндокринных.
Данные немецкого исследования изменения клинических проявлений при многолетнем течении ХП показывают, что в период манифестации панкреатита доминирует болевой синдром, но со временем интенсивность боли существенно снижается; авторы работы назвали это феноменом «выгорания» боли1. Одновременно увеличивается частота осложненных форм, что связано с прогрессирующими фиброзно-дегенеративными изменениями в паренхиме поджелудочной железы (ПЖ) и развитием абсолютной (экзокринной) панкреатической недостаточности.
«К сожалению, мы достаточно поздно диагностируем внешнесекреторную недостаточность поджелудочной железы с клинических позиций. К тому же большинство методов диагностики весьма громоздки и воспроизводимы только в условиях специализированных научных исследований. Однако в последнее время появилась возможность диагностировать панкреатическую недостаточность с помощью простого метода определения в фекальных массах уровня эластазы-1. Чувствительность и специфичность этого довольно простого метода очень высока и составляет порядка 93%», – уточнил докладчик. В норме уровень панкреатической эластазы-1 в 1 г кала составляет от 200 до 500 и более мкг/г, при легкой и умеренной степени экзокринной недостаточности поджелудочной железы (ЭНПЖ) – 100–200 мкг/г кала, при тяжелой ЭНПЖ – < 100 мкг/г кала.
Современные подходы к лечению абсолютной панкреатической недостаточности предполагают использование заместительной ферментной терапии. Препараты заместительной терапии должны иметь оптимальный состав ферментов в физиологической пропорции, обладать кислотоустойчивостью, равномерно и быстро перемешиваться с пищей, одновременно с пищей проходить через привратник и пилорический сфинктер, отличаться быстрым и 100-процентным высвобождением ферментов в двенадцатиперстной кишке (ДПК), а также безопасностью.
Известно, что у пациентов с ЭНПЖ часто снижена панкреатическая секреция бикарбоната, который не способен нейтрализовать кислотность химуса, поступающего в кишечник из желудка. В случае, когда для заместительной терапии используются ферменты, не защищенные кислотоустойчивой оболочкой, ингибирование секреции соляной кислоты желудком является необходимым условием сохранения активности ферментов, в особенности липазы, легко разрушающихся в кислой среде.
Известно, что у пациентов с ЭНПЖ часто снижена панкреатическая секреция бикарбоната, который не способен нейтрализовать кислотность химуса, поступающего в кишечник из желудка. В случае, когда для заместительной терапии используются ферменты, не защищенные кислотоустойчивой оболочкой, ингибирование секреции соляной кислоты желудком является необходимым условием сохранения активности ферментов, в особенности липазы, легко разрушающихся в кислой среде.
Кроме того, кислая среда является причиной преципитации желчи в просвете ДПК, что также ухудшает переваривание жира. Современные лекарственные формы (минимикросферы) имеют защитную кишечнорастворимую оболочку, позволяющую предотвратить инактивацию ферментов. Однако при низком уровне pH (< 4,5) в просвете ДПК кишечнорастворимая оболочка не растворяется, ферменты высвобождаются только в дистальных отделах тонкой кишки, эффективность заместительной терапии снижается вследствие быстрой инактивации липазы.
Добавление в схемы терапии ингибиторов протонной помпы (ИПП) приводит к нормализации или существенному улучшению мальдигестии жира и улучшению ответа на заместительную терапию ферментами. J.E. Dominguez-Munoz и соавт. (2006) одними из первых выдвинули и доказали идею оптимизации терапии у больных с абсолютной панкреатической недостаточностью путем добавления к ферментной терапии ИПП2. Данные опубликованного исследования показали, что у 47% пациентов, у которых, несмотря на терапию ферментами, имелась персистирующая мальдигестия, дополнительное назначение ИПП привело к улучшению пищеварения жира.
Профессор В.Д. Пасечников ознакомил участников симпозиума с результатами собственного рандомизированного открытого проспективного сравнительного исследования, целью которого было подтвердить повышение эффективности заместительной терапии ХП ферментами в кишечнорастворимой оболочке при их совместном назначении с ИПП омепразолом (Омез, Dr. Reddy’s). В исследовании приняли участие 40 пациентов с экзокринной панкреатической недостаточностью, которые были рандомизированы в 2 равнозначные группы. Выраженность экзокринной недостаточности была одинаковой в обеих группах (уровни эластазы-1 в фекальном содержимом достоверно не различались).
Добавление в схемы терапии ингибиторов протонной помпы (ИПП) приводит к нормализации или существенному улучшению мальдигестии жира и улучшению ответа на заместительную терапию ферментами. J.E. Dominguez-Munoz и соавт. (2006) одними из первых выдвинули и доказали идею оптимизации терапии у больных с абсолютной панкреатической недостаточностью путем добавления к ферментной терапии ИПП2. Данные опубликованного исследования показали, что у 47% пациентов, у которых, несмотря на терапию ферментами, имелась персистирующая мальдигестия, дополнительное назначение ИПП привело к улучшению пищеварения жира.
Профессор В.Д. Пасечников ознакомил участников симпозиума с результатами собственного рандомизированного открытого проспективного сравнительного исследования, целью которого было подтвердить повышение эффективности заместительной терапии ХП ферментами в кишечнорастворимой оболочке при их совместном назначении с ИПП омепразолом (Омез, Dr. Reddy’s). В исследовании приняли участие 40 пациентов с экзокринной панкреатической недостаточностью, которые были рандомизированы в 2 равнозначные группы. Выраженность экзокринной недостаточности была одинаковой в обеих группах (уровни эластазы-1 в фекальном содержимом достоверно не различались).
В первой группе больные (20 человек) принимали защищенные панкреатины в виде минимикросфер во время каждого приема пищи в течение месяца, вторая группа больных (20 человек) – защищенные панкреатины в комбинации с омепразолом (Омез, Dr. Reddy’s). Спустя один месяц после начала терапии оценивали ее эффективность по клиническим и лабораторным критериям. При сравнении динамики показателя фекального жира до и после терапии было выявлено, что назначение защищенного панкреатина в первой группе не привело к достоверному снижению этого показателя и, напротив, в группе больных, получавших комбинированную терапию с омепразолом, показатель фекального жира достоверно снизился (рис. 1)3.
При сравнении частоты стула до и после терапии установлено, что применение защищенного панкреатина не привело к достоверному изменению этого показателя, тогда как в группе пациентов, принимавших панкреатин в комбинации с омепразолом (Омез, Dr. Reddy’s), частота стула достоверно снизилась (рис. 2)3. Результаты исследования подтвердили необходимость назначения комбинированной терапии у части пациентов, нуждающихся в коррекции экзокринной функции ПЖ. Это нашло отражение в новом алгоритме терапии стеатореи4. «Алгоритм, который предусматривает применение комбинации ферментов с ингибиторами протонной помпы, во многом улучшает успех заместительной терапии при нарушении экзокринной недостаточности ПЖ», – отметил профессор В.Д. Пасечников, завершая свое первое выступление на симпозиуме.
При сравнении частоты стула до и после терапии установлено, что применение защищенного панкреатина не привело к достоверному изменению этого показателя, тогда как в группе пациентов, принимавших панкреатин в комбинации с омепразолом (Омез, Dr. Reddy’s), частота стула достоверно снизилась (рис. 2)3. Результаты исследования подтвердили необходимость назначения комбинированной терапии у части пациентов, нуждающихся в коррекции экзокринной функции ПЖ. Это нашло отражение в новом алгоритме терапии стеатореи4. «Алгоритм, который предусматривает применение комбинации ферментов с ингибиторами протонной помпы, во многом улучшает успех заместительной терапии при нарушении экзокринной недостаточности ПЖ», – отметил профессор В.Д. Пасечников, завершая свое первое выступление на симпозиуме.
Как повысить эффективность эрадикации на основе феномена лекарственного взаимодействия и применения высоких доз ИПП, или Как реализовать положение Маастрихт IV в практической деятельности врачей-гастроэнтерологов
Второе выступление на симпозиуме д.м.н., профессор В.Д. ПАСЕЧНИКОВ посвятил анализу причин не всегда успешного лечения заболеваний, ассоциированных с Helicobacter pylori, с помощью эрадикационной терапии и проблеме выбора наиболее оптимальных лекарственных схем. Схемы эрадикационной терапии регламентированы, однако выполнение любого стандарта на практике не всегда сопровождается 100-процентной эффективностью. В качестве показателя, свидетельствующего об оптимальности схемы лечения, все Маастрихтские рекомендации называют 80-процентную эрадикацию H. pylori, а в качестве терапии первой линии – комбинацию «ИПП + кларитромицин + амоксициллин (метронидазол)». Между тем, если в исследованиях прошлого века и начала нынешнего эффективность эрадикации H. pylori превышала 90%, то в публикациях последних лет отмечается постоянное снижение частоты эрадикации, например, в таких странах, как Испания, Италия, Франция, Турция, уровень эрадикации H. pylori составляет менее 80%5.
Основной причиной снижения эффективности эрадикационной терапии является резистентность H. pylori к используемым препаратам. Принципиальное значение имеет резистентность H. pylori к кларитромицину и метронидазолу. Количество штаммов H. pylori, резистентных к метронидазолу, в Европе и США колеблется от 40 до 70%. Во всем мире продолжается неуклонный рост числа резистентных к кларитромицину штаммов H. pylori, что оказывает негативное влияние на эффективность эрадикационной терапии. По данным ряда авторов, при резистентности H. pylori к кларитромицину эффективность эрадикации снижается до 34,5%6. Последние доступные данные о чувствительности H. pylori к антибиотикам по Москве датированы 2005 г.: у взрослых количество резистентных к метронидазолу штаммов составило 54,8%, к кларитромицину – 19,3%; у детей – соответственно 23,8 и 28,5%7.
Достаточно продолжительное время считалось, что резистентность к амоксициллину – крайне редкое явление. Однако, как показывают данные прошлогоднего исследования японских ученых, при проведении повторных курсов эрадикационной терапии у больных развивалась резистентность не только к метронидазолу и кларитромицину, но и к амоксициллину8. «Неправильный подход к терапии, недостижение целевого уровня эрадикации ведет к формированию резистентности. Недостаточная супрессия активности бактерий вызывает ответную трансформацию в виде мутации гена, отвечающего за чувствительность к антимикробной терапии, что в конечном итоге способствует росту частоты рецидивов», – констатировал профессор В.Д. Пасечников. Согласно IV Маастрихтскому соглашению (2010), тройная терапия – ИПП + кларитромицин + амоксициллин (метронидазол) – остается рекомендованной терапией первой линии.
По словам докладчика, эффективность тройной терапии во многом зависит от лекарственного взаимодействия. Кратко охарактеризовав особенности метаболизма омепразола и кларитромицина, профессор В.Д. Пасечников отметил, что при совместном приеме они мешают друг другу метаболизироваться, что было продемонстрировано в исследовании L.E. Gustavson и соавт. в 1995 г. (рис. 3)9. Данные исследования P.O. Erah и соавт. (1997) также показали устойчивость кларитромицина, амоксициллина и метронидазола при приеме омепразола10. Это нашло подтверждение и в исследовании профессора В.Д. Пасечникова, результаты которого еще не опубликованы (Пасечников В.Д., 2012, принято к печати).
Можно ли достичь необходимого уровня эрадикации H. pylori с помощью увеличения дозы ИПП в тройной терапии? Стандартная доза ИПП в тройной терапии составляет 20 мг при приеме 2 раза в сутки. Метаанализ результатов зарубежных исследований показал, что высокие дозы ИПП (40 мг, 2 раза/сутки) увеличивают эффективность эрадикации на 6–10% в сравнении со стандартными дозами11. Интенсифицированная схема была апробирована в российских исследованиях, в частности, у больных хроническим гастритом, сочетающимся с язвенной болезнью12. Интенсифицированная схема включала омепразол 20 мг 4 раза/сутки + кларитромицин 500 мг 2 раза/сутки + амоксициллин 500 мг 4 раза/сутки. Лечение проводилось в течение 10 дней, эрадикация была достигнута в 95% случаев. «Таким образом, данные многочисленных исследований позволили расширить терапевтические рекомендации, что нашло отражение в Положении 9, опубликованном в IV Маастрихтском консенсусе, где указано, что использование высоких доз ингибиторов протонной помпы дважды в день увеличивает эффективность тройной терапии», – уточнил в заключение профессор В.Д. Пасечников.
Ингибиторы протонной помпы в лечении заболеваний билиарной системы
Докладчики, выступившие на симпозиуме, были единодушны, говоря о необходимости более широкого клинического взгляда на функциональные нарушения ПЖ, заболевания билиарной системы, болезни, ассоциированные с H. pylori, облигатно учитывая потребность в коррекции моторных, секреторных и метаболических изменений, восстановлении адекватного функционирования микробно-тканевого комплекса кишечника. Как показывают результаты исследований, важная роль в достижении этих целей принадлежит секретолитической терапии препаратами Омез, Омез Инста, Омез Д. Комбинация ферментов с Омезом во многом способствует успеху заместительной терапии при нарушении экзокринной недостаточности ПЖ; использование препарата Омез в высоких дозах увеличивает эффективность эрадикационной терапии; ступенчатая терапия препаратами Омез Инста и Омез Д позволяет в кратчайшие сроки минимизировать ту клиническую симптоматику, которая соответствует кислотозависимым заболеваниям. Широкая линейка препаратов Омез с различной дозировкой позволяет осуществлять дифференцированный подход к лечению заболеваний органов пищеварения.
Достаточно продолжительное время считалось, что резистентность к амоксициллину – крайне редкое явление. Однако, как показывают данные прошлогоднего исследования японских ученых, при проведении повторных курсов эрадикационной терапии у больных развивалась резистентность не только к метронидазолу и кларитромицину, но и к амоксициллину8. «Неправильный подход к терапии, недостижение целевого уровня эрадикации ведет к формированию резистентности. Недостаточная супрессия активности бактерий вызывает ответную трансформацию в виде мутации гена, отвечающего за чувствительность к антимикробной терапии, что в конечном итоге способствует росту частоты рецидивов», – констатировал профессор В.Д. Пасечников. Согласно IV Маастрихтскому соглашению (2010), тройная терапия – ИПП + кларитромицин + амоксициллин (метронидазол) – остается рекомендованной терапией первой линии.
По словам докладчика, эффективность тройной терапии во многом зависит от лекарственного взаимодействия. Кратко охарактеризовав особенности метаболизма омепразола и кларитромицина, профессор В.Д. Пасечников отметил, что при совместном приеме они мешают друг другу метаболизироваться, что было продемонстрировано в исследовании L.E. Gustavson и соавт. в 1995 г. (рис. 3)9. Данные исследования P.O. Erah и соавт. (1997) также показали устойчивость кларитромицина, амоксициллина и метронидазола при приеме омепразола10. Это нашло подтверждение и в исследовании профессора В.Д. Пасечникова, результаты которого еще не опубликованы (Пасечников В.Д., 2012, принято к печати).
Можно ли достичь необходимого уровня эрадикации H. pylori с помощью увеличения дозы ИПП в тройной терапии? Стандартная доза ИПП в тройной терапии составляет 20 мг при приеме 2 раза в сутки. Метаанализ результатов зарубежных исследований показал, что высокие дозы ИПП (40 мг, 2 раза/сутки) увеличивают эффективность эрадикации на 6–10% в сравнении со стандартными дозами11. Интенсифицированная схема была апробирована в российских исследованиях, в частности, у больных хроническим гастритом, сочетающимся с язвенной болезнью12. Интенсифицированная схема включала омепразол 20 мг 4 раза/сутки + кларитромицин 500 мг 2 раза/сутки + амоксициллин 500 мг 4 раза/сутки. Лечение проводилось в течение 10 дней, эрадикация была достигнута в 95% случаев. «Таким образом, данные многочисленных исследований позволили расширить терапевтические рекомендации, что нашло отражение в Положении 9, опубликованном в IV Маастрихтском консенсусе, где указано, что использование высоких доз ингибиторов протонной помпы дважды в день увеличивает эффективность тройной терапии», – уточнил в заключение профессор В.Д. Пасечников.
Ингибиторы протонной помпы в лечении заболеваний билиарной системы
По словам д.м.н., профессора В.Б. ГРИНЕВИЧА (заведующий 2-й кафедрой терапии Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург), так называемые «истинные» кислотозависимые заболевания часто сосуществуют с болезнями билиарной системы. Так, например, при язвенной болезни ДПК у 81% пациентов отмечаются вторичные нарушения моторной функции желчевыводящих путей и желчного пузыря, у 29,1% – признаки хронического холецистита, у 8,3% – желчнокаменная болезнь, у 76% пациентов – признаки хронического панкреатита13. Поэтому современная схема лечения обострения холелитиаза и билиарнозависимого панкреатита предполагает с первого же дня назначение ИПП. «Есть еще одно важное положение, именуемое “единством верхней половины живота”. Иными словами, это единство эзофагогастродуоденобилиарнопанкреатической системы, венцом которого является гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
Совершенно очевидно, что в большей степени базовыми являются заболевания желчного пузыря, билиарной системы и поджелудочной железы», – уточнил докладчик. Сочетанное воздействие кислотного и билиарного рефлюксов выявляется у 60–80% больных с эрозивным эзофагитом и у 90–93% больных ГЭРБ, осложненной пищеводом Барретта14. В клиническом эквиваленте, согласно статистике Министерства здравоохранения Российской Федерации (2006 г.), проблема полиморбидности в отечественной гастроэнтерологии выглядит следующим образом: практически каждый подросток в возрасте 10–14 лет имеет 1–2 заболевания органов пищеварения; с возрастом происходит «накопление» хронических заболеваний желудочно-кишечного тракта (ЖКТ); в возрасте 35–40 лет и старше у большинства пациентов отмечается несколько (3–5) гастроэнтерологических заболеваний.
По мнению докладчика, между гиперсекрецией соляной кислоты и дисфункцией билиарной системы существует патогенетическая взаимосвязь, а для холереза и холекинеза имеет преимущественное значение дисбаланс энтероэндокринной регуляции и нарушение моторики. Еще в середине прошлого века академик А.М. Уголев назвал ДПК «гипофизом системы пищеварения». Согласно последним данным Кембриджского института медицинских исследований, ДПК представляет собой энтероэндокринный центр ЖКТ, который содержит максимальное количество эндокринных клеток, вырабатывающих такие вещества, как холецистокинин, глюкагон, секретин, мотилин, гистамин. Холецистокинин, например, стимулирует расслабление сфинктера Одди, увеличивает ток печеночной желчи, повышает панкреатическую секрецию, снижает давление в билиарной системе, блокирует секрецию соляной кислоты париетальными клетками желудка.
По мнению докладчика, между гиперсекрецией соляной кислоты и дисфункцией билиарной системы существует патогенетическая взаимосвязь, а для холереза и холекинеза имеет преимущественное значение дисбаланс энтероэндокринной регуляции и нарушение моторики. Еще в середине прошлого века академик А.М. Уголев назвал ДПК «гипофизом системы пищеварения». Согласно последним данным Кембриджского института медицинских исследований, ДПК представляет собой энтероэндокринный центр ЖКТ, который содержит максимальное количество эндокринных клеток, вырабатывающих такие вещества, как холецистокинин, глюкагон, секретин, мотилин, гистамин. Холецистокинин, например, стимулирует расслабление сфинктера Одди, увеличивает ток печеночной желчи, повышает панкреатическую секрецию, снижает давление в билиарной системе, блокирует секрецию соляной кислоты париетальными клетками желудка.
Глюкагоноподобный пептид-1 (энтероглюкагон), стимулированный дериватами желчных кислот, ослабляет моторную активность желудка, способствует расслаблению сфинктера Одди, снижению давления в ДПК, ингибирует секрецию соляной кислоты париетальными клетками. Результат очевиден: гиперсекреция соляной кислоты способствует формированию атрофического дуоденита, гипомоторной дискинезии, билиарного сладжа, который встречается у 40% больных язвенной болезнью (ЯБ). Закисление проксимальных отделов кишечника (ДПК и тощей кишки) сопровождается нарушением формирования моторно-миграционного комплекса, преимущественно в виде пилороспазма, с целью ограничения поступления соляной кислоты в ДПК, а также спазма сфинктера Одди. Развитие дуоденостаза на фоне кислотозависимых заболеваний ведет к изменению градиента давления желчевыводящих путей и просвета ДПК с нарушением холекинеза15, 16. Установлено, что желчнокаменная болезнь, билиарный сладж, хронический панкреатит являются отражением системной воспалительной реакции, которую, в свою очередь, инициирует кишечная эндотоксемия17, 18. «Если говорить о билиарнозависимом панкреатите, то через 24 часа от начала заболевания прочное место в этиологии и исходах панкреатита занимает кишечный липополисахарид», – пояснил докладчик.
В 2009 г. академик В.Т. Ивашкин обосновал патогенетические факторы формирования инсулинорезистентности, триггерными механизмами которой являются фактор некроза опухоли альфа (ФНО-альфа) и кишечный липополисахарид. C.K. Glass в 2012 г. более детально описал данный механизм, который представляет собой замкнутый круг: нарушения микробного тканевого комплекса кишечника приводят к хроническому системному воспалению, что способствует развитию инсулинорезистентности, которое также приводит к нарушению микробного комплекса кишечника19. Фактором, потенцирующим хроническое системное воспаление, является висцеральное ожирение.
Согласно данным исследований, проведенных в 2012 г. в отделении гастроэнтерологии, гепатологии и нутрициологии Питтсбургского университета (США), установлено, что объем висцерального жира пропорционален объему панкреатического, а масштабы панкреатического некроза пропорциональны объему панкреатического жира. Хроническое системное воспаление и метаболические нарушения, обусловленные гиперсекрецией соляной кислоты, заболеваниями билиарной системы и дисбиотическими нарушениями, усугубляют изменение биохимизма желчи и нарушение холереза. «Оптимизировать секрецию соляной кислоты, чтобы адекватно функционировала билиарная система, помогают препараты группы Омез, особенно Омез Инста и Омез Д», – пояснил профессор В.Б. Гриневич (табл.).
Омез Инста позволяет в кратчайшие сроки минимизировать клиническую симптоматику, которая соответствует кислотозависимым заболеваниям, в том числе болезням билиарной системы. Омез Инста является ИПП с ускоренным действием – максимальная концентрация омепразола в плазме достигается уже через 10 минут, в отличие от других ИПП20. Быстрый эффект обусловлен тем, что, во-первых, омепразол находится в препарате в свободном виде и, во-вторых, происходит феномен «кислотного рикошета», когда при быстром ощелачивании среды в желудке отмечается стимуляция выработки гастрина и рефлекторное повышение кислотопродукции за счет увеличения до 30% доли активных париетальных клеток.
Омез Инста позволяет в кратчайшие сроки минимизировать клиническую симптоматику, которая соответствует кислотозависимым заболеваниям, в том числе болезням билиарной системы. Омез Инста является ИПП с ускоренным действием – максимальная концентрация омепразола в плазме достигается уже через 10 минут, в отличие от других ИПП20. Быстрый эффект обусловлен тем, что, во-первых, омепразол находится в препарате в свободном виде и, во-вторых, происходит феномен «кислотного рикошета», когда при быстром ощелачивании среды в желудке отмечается стимуляция выработки гастрина и рефлекторное повышение кислотопродукции за счет увеличения до 30% доли активных париетальных клеток.
Докладчик представил следующий механизм действия Омеза Инста: натрия гидрокарбонат – вторая составляющая Омеза Инста – нейтрализует соляную кислоту в желудке и способствует резкому увеличению pH, после чего происходит стимуляция выработки гастрина и увеличение доли активных париетальных клеток с одновременной защитой омепразола от разрушения, способствуя его быстрой резорбции. Сравнительная фармакокинетика омепразола замедленного высвобождения (ЗВ) и омепразола ускоренного действия (УСД) показала, что Cmax омепразола-УСД достигается в 5 раз быстрее (менее чем за 30 минут) и при этом ее пик в 2 раза выше, чем у ИПП-ЗВ. При неэрозивной ГЭРБ и ЯБ, не ассоциированной с H. pylori, Омез Инста назначают по 1 пакетику (5,885 г) 1 раз в день в течение 5 дней, начиная с 6-го дня – Омез в дозе 20 мг/сут; при эрозивной ГЭРБ (рефлюкс-эзофагит) и ЯБ, ассоциированной с H. pylori, – Омез Инста по 1 пакетику (5,885 г) 2 раза в день в течение 3 дней, начиная с 3-го дня – Омез в дозе 40 мг 2 раза/сут.
Таким образом, Омез Инста обладает целым рядом преимуществ: он может применяться «по требованию», эффективен для профилактики ночного кислотного прорыва, минимизирует разрушение антибиотика в кислой среде желудка, потенцируя эрадикационную терапию. Оптимальным решением проблемы кислотозависимости считается ступенчатая терапия. Пациенту для быстрого устранения изжоги и боли сразу же после приема пищи и немедленного облегчения состояния назначается Омез Инста, в последующем, когда на первое место выходят симптомы диспепсии, пациента переводят на Омез Д, поскольку в состав этого препарата, помимо омепразола, снижающего желудочную секрецию, входит домперидон, который повышает тонус нижнего сфинктера пищевода, нормализует моторно-эвакуаторную функцию желудка и ДПК, что позволяет пище своевременно проходить физиологические этапы пищеварения.
«В настоящий момент на базе 2-й клиники терапии усовершенствования врачей Военно-медицинской академии им. С.М. Кирова проводится исследование клинической эффективности ступенчатой терапии Омезом Инста и Омезом Д у пациентов с заболеваниями билиарной системы и сопутствующей неэрозивной ГЭРБ, в котором принимают участие 60 больных. Медикаментозное лечение осуществляется в следующем режиме: Омез Инста – по 1 пакетику 1 раз в день в течение 5 дней с последующим переходом на Омез Д – по 1 капсуле 2 раза в сутки в течение 14 дней. Контрольная группа получает антациды. Анализ динамики клинической симптоматики на фоне терапии показал более эффективное снижение болевого синдрома, изжоги, диспепсии в исследуемой группе по сравнению с группой контроля. Большую эффективность ступенчатой терапии подтверждают данные лабораторных показателей и оценка качества жизни пациентов», – констатировал профессор В.Б. Гриневич. Подытоживая вышесказанное, докладчик еще раз подчеркнул, что заболевания билиарной системы являются кислотозависимыми, и линейка препаратов группы Омез обеспечивает высокодифференцированный вариант патогенетической терапии болезней билиарной системы.
Заключение
Таким образом, Омез Инста обладает целым рядом преимуществ: он может применяться «по требованию», эффективен для профилактики ночного кислотного прорыва, минимизирует разрушение антибиотика в кислой среде желудка, потенцируя эрадикационную терапию. Оптимальным решением проблемы кислотозависимости считается ступенчатая терапия. Пациенту для быстрого устранения изжоги и боли сразу же после приема пищи и немедленного облегчения состояния назначается Омез Инста, в последующем, когда на первое место выходят симптомы диспепсии, пациента переводят на Омез Д, поскольку в состав этого препарата, помимо омепразола, снижающего желудочную секрецию, входит домперидон, который повышает тонус нижнего сфинктера пищевода, нормализует моторно-эвакуаторную функцию желудка и ДПК, что позволяет пище своевременно проходить физиологические этапы пищеварения.
«В настоящий момент на базе 2-й клиники терапии усовершенствования врачей Военно-медицинской академии им. С.М. Кирова проводится исследование клинической эффективности ступенчатой терапии Омезом Инста и Омезом Д у пациентов с заболеваниями билиарной системы и сопутствующей неэрозивной ГЭРБ, в котором принимают участие 60 больных. Медикаментозное лечение осуществляется в следующем режиме: Омез Инста – по 1 пакетику 1 раз в день в течение 5 дней с последующим переходом на Омез Д – по 1 капсуле 2 раза в сутки в течение 14 дней. Контрольная группа получает антациды. Анализ динамики клинической симптоматики на фоне терапии показал более эффективное снижение болевого синдрома, изжоги, диспепсии в исследуемой группе по сравнению с группой контроля. Большую эффективность ступенчатой терапии подтверждают данные лабораторных показателей и оценка качества жизни пациентов», – констатировал профессор В.Б. Гриневич. Подытоживая вышесказанное, докладчик еще раз подчеркнул, что заболевания билиарной системы являются кислотозависимыми, и линейка препаратов группы Омез обеспечивает высокодифференцированный вариант патогенетической терапии болезней билиарной системы.
Заключение
Докладчики, выступившие на симпозиуме, были единодушны, говоря о необходимости более широкого клинического взгляда на функциональные нарушения ПЖ, заболевания билиарной системы, болезни, ассоциированные с H. pylori, облигатно учитывая потребность в коррекции моторных, секреторных и метаболических изменений, восстановлении адекватного функционирования микробно-тканевого комплекса кишечника. Как показывают результаты исследований, важная роль в достижении этих целей принадлежит секретолитической терапии препаратами Омез, Омез Инста, Омез Д. Комбинация ферментов с Омезом во многом способствует успеху заместительной терапии при нарушении экзокринной недостаточности ПЖ; использование препарата Омез в высоких дозах увеличивает эффективность эрадикационной терапии; ступенчатая терапия препаратами Омез Инста и Омез Д позволяет в кратчайшие сроки минимизировать ту клиническую симптоматику, которая соответствует кислотозависимым заболеваниям. Широкая линейка препаратов Омез с различной дозировкой позволяет осуществлять дифференцированный подход к лечению заболеваний органов пищеварения.
1. Uhl W., Buchler M.W., Malfertheiner P., Beger H.G., Adler G., Gaus W. A randomised, double blind, multicentre trial of octreotide in moderate to severe acute pancreatitis // Gut. 1999. Vol. 45. № 1. P. 97–104.
2. Domínguez-Muñoz J.E., Iglesias-García J., Iglesias-Rey M., Vilariño-Insua M. Optimising the therapy of exocrine pancreatic insufficiency by the association of a proton pump inhibitor to enteric coated pancreatic extracts // Gut. 2006. Vol. 55. № 7. P. 1056–1057.
3. Domínguez-Muñoz J.E. Chronic pancreatitis and persistent steatorrhea: what is the correct dose of enzymes? // Clin. Gastroenterol. Hepatol. 2011. Vol. 9. № 7. P. 541–546.
4. Graham D.Y., Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance // Gut. 2010. Vol. 59. № 8. P. 1143–1153.
5. Sasaki M., Ogasawara N., Utsumi K., Kawamura N., Kamiya T., Kataoka H., Tanida S., Mizoshita T., Kasugai K., Joh T. Changes in 12-year first-line eradication rate of Helicobacter pylori based on triple therapy with proton pump inhibitor, amoxicillin and clarithromycin // J. Clin. Biochem. Nutr. 2010. Vol. 47. № 1. P. 53–58.
6. Кудрявцева Л.В. Биологические свойства H. рylori // Альманах клинической медицины. Т. 14. М., 2006. С. 39–46.
7. Nishizawa T., Suzuki H., Tsugawa H., Muraoka H., Matsuzaki J., Hirata K., Ikeda F., Takahashi M., Hibi T. Enhancement of amoxicillin resistance after unsuccessful Helicobacter pylori eradication // Antimicrob. Agents Chemoter. 2011. Vol. 55. № 6. P. 3012–3014.
8. Gustavson L.E., Kaiser J.F., Edmonds A.L., Locke C.S., DeBartolo M.L., Schneck D.W. Effect of omeprazole on concentrations of clarithromycin in plasma and gastric tissue at steady state // Antimicrob. Agents Chemother. 1995. Vol. 39. № 9. P. 2078–2083.
9. Erah P.O., Goddard A.F., Barrett D.A., Shaw P.N., Spiller R.C. The stability of amoxycillin, clarithromycin and metronidazole in gastric juice: relevance to the treatment of Helicobacter pylori infection // J. Antimicrob. Chemother. 1997. Vol. 39. № 1. P. 5–12.
10. Villoria A. Acid-related diseases: are higher doses of proton pump inhibitors more effective in the treatment of Helicobacter pylori infection? // Gastroenterol. Hepatol. 2008. Vol. 31. № 8. P. 546–547.
11. Захарова Н.В. Helicobacter pylori-ассоциированные хронические гастриты: патогенез, возможности дифференцированной терапии: Автореф. дисс. ... докт. мед. наук. СПбМАПО, 2009.
12. Диагностика основных синдромов и заболеваний желудочно-кишечного тракта, печени, желчевыводящих путей: учеб.-метод. пособие / Под ред. И.В. Маева. М.: ФГОУ «ВУНМЦ Росздрава», 2007. 108 с.
13. Васильев Ю.В. Гастроэзофагеальная рефлюксная болезнь. М.: Планида, 2011. 24 с.
14. Яковенко Э.П. Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (четвертое Московское соглашение) / Методические рекомендации № 37 Департамента здравоохранения города Москвы. М.: ЦНИИГ, 2010. 12 с.
15. Corazziari E., Shaffer E.A., Hogan W.J., Sherman S., Toouli J. Functional disorders of the biliary tract and pancreas // Gut. 1999. Vol. 45. Suppl. 2. P. II48– II54.
16. Гриневич В.Б., Успенский Ю.П. Секретолитическая терапия кислотозависимых заболеваний органов пищеварения с позиций клинициста // Экспериментальная и клиническая гастроэнтерология. 2003. № 6. С. 15–28.
17. De Jonge W.J. Mast cells in intestinal inflammation, barrier function, and postoperative motility // J. Pediatr. Gastroenterol. Nutr. 2011. Vol. 53. Suppl. 2. P. S56–S57.
18. Glass C.K., Jerrold M. Olefsky Inflammation and Lipid Signaling in the Etiology of Insulin Resistance // Cell Metabolism. Vol. 15. № 5. P. 635–645.
19. Рациональная фармакотерапия заболеваний органов пищеварения / Под ред. В.Т. Ивашкина. М.: Литтерра, 2007. 1056 с.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.