Метод прогнозирования вероятности развития пароксизма фибрилляции предсердий у пациентов с коморбидным течением синдрома обструктивного апноэ сна и фибрилляции предсердий
- Аннотация
- Статья
- Ссылки
- English
Цель – разработать метод прогнозирования вероятности развития пароксизма ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП.
Материал и методы. Объектом исследования стали 46 пациентов с персистирующей формой ФП (76,1% мужчин, 23,9% женщин). Среди них 11 – с ФП без СОАС, 35 – с ФП и СОАС. Средний возраст пациентов составил 57,2 ± 6,4 года. Уровень индуцируемого гипоксией фактора 1-альфа в крови испытуемых определяли с помощью иммуноферментного анализа. СОАС диагностировали на основании результатов кардиореспираторного мониторинга. Конечной точкой исследования был новый эпизод ФП, возникший в течение года после эффективной электрической кардиоверсии. С учетом рецидива ФП пациенты были рандомизированы на две группы. Первую составили пациенты без рецидива ФП, вторую – пациенты с рецидивом ФП. Статистическая обработка выполнялась в программах STATISTICA 10.0, RStudio 1.1.183.
Результаты. Разработан метод прогнозирования вероятности развития пароксизма ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП (чувствительность – 93%, специфичность – 82%).
Выводы. Метод служит основой для стратификации вероятности рецидивирования ФП у пациентов с СОАС и ФП и, как следствие, позволяет своевременно выбрать оптимальное лечение для таких пациентов.
Цель – разработать метод прогнозирования вероятности развития пароксизма ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП.
Материал и методы. Объектом исследования стали 46 пациентов с персистирующей формой ФП (76,1% мужчин, 23,9% женщин). Среди них 11 – с ФП без СОАС, 35 – с ФП и СОАС. Средний возраст пациентов составил 57,2 ± 6,4 года. Уровень индуцируемого гипоксией фактора 1-альфа в крови испытуемых определяли с помощью иммуноферментного анализа. СОАС диагностировали на основании результатов кардиореспираторного мониторинга. Конечной точкой исследования был новый эпизод ФП, возникший в течение года после эффективной электрической кардиоверсии. С учетом рецидива ФП пациенты были рандомизированы на две группы. Первую составили пациенты без рецидива ФП, вторую – пациенты с рецидивом ФП. Статистическая обработка выполнялась в программах STATISTICA 10.0, RStudio 1.1.183.
Результаты. Разработан метод прогнозирования вероятности развития пароксизма ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП (чувствительность – 93%, специфичность – 82%).
Выводы. Метод служит основой для стратификации вероятности рецидивирования ФП у пациентов с СОАС и ФП и, как следствие, позволяет своевременно выбрать оптимальное лечение для таких пациентов.

Введение
Фибрилляция предсердий (ФП) – недоброкачественная аритмия, ассоциируемая со значительным риском осложнений и смертностью. Ее распространенность в общей популяции достигает 3% [1]. Синдром обструктивного апноэ сна (СОАС) характеризуется повторяющимися эпизодами тотального или частичного коллапса верхних дыхательных путей на уровне глотки во время сна и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях. СОАС относится к наиболее распространенному типу нарушений дыхания во сне. Этим недугом страдают около 1 млрд людей в мире [2]. Вместе с тем, по данным A. Benjafield и соавт., о наличии этой патологии не знают 30 млн пациентов с СОАС [3]. Значит, каждый из них не получает должной терапии, что ухудшает качество и прогноз их жизни.
Пациенты с СОАС составляют 10% общего населения, однако в популяции пациентов с ФП распространенность СОАС существенно выше (21–74%) [4, 5]. СОАС является не только модифицируемым фактором риска ФП, но и усугубляет течение аритмии, становясь значительным бременем для системы здравоохранения [4, 6–9].
В настоящее время стратегия контроля ритма считается предпочтительной в ведении пациентов с ФП. В многоцентровом (n = 135) рандомизированном исследовании EAST-AFNET 4 принимали участие 2789 пациентов с диагнозом ФП до года. Период наблюдения составил 5,1 года. Проведен сравнительный анализ тактики контроля ритма и тактики контроля частоты сердечных сокращений. Результаты исследования продемонстрировали, что стратегия контроля ритма снижает в целом на 21% риск развития инсульта, острого коронарного синдрома, частоту госпитализаций в связи с декомпенсацией хронической сердечной недостаточности [10].
Проблема рецидивирования ФП – одна из наиболее важных и одновременно сложных в современной кардиологии [11]. Подсчитано, что возврат ФП в первый год после восстановления ритма у пациентов, не находящихся на антиаритмической терапии, достигает 71–84%, у пациентов, приверженных лечению антиаритмическими препаратами, – 44–67%.
Установлено, что темп прогрессирования ФП в среднем составляет 8–22% на протяжении первого года после кардиоверсии [11]. СОАС у пациентов с ФП вносит существенный вклад в рефрактерность к антиаритмической терапии, неэффективность электроимпульсной терапии и аблации, развитие осложнений ФП [4, 6–9]. При этом в исследованиях оценки эффективности СиПАП-терапии у пациентов с ФП и СОАС были получены оптимистичные результаты [4, 5, 12].
Феномен хронической интермиттирующей гипоксии (ХИГ), возникающий у пациентов с СОАС, играет ключевую роль в патогенезе синдрома, способствует электрическому и структурному ремоделированию миокарда, а также гемодинамическим нарушениям, провоцируя развитие ФП. Гипоксией индуцируемый фактор 1-альфа (hypoxia inducible factor-1α, HIF-1α) известен своими кардиопротективными эффектами – активируется при гипоксии и быстро подвергается деградации при восстановлении кислородного гомеостаза. Однако воздействие ХИГ на данный фактор приводит к его стабилизации и негативным последствиям. Так, повышенное образование супероксид-аниона О2 на фоне волнообразно протекающей ХИГ запускает сигнальный каскад, связанный с активацией фосфолипазы С, Ca2+/кальмодулин-зависимой протеинкиназы и протеинкиназы C. В результате усиливается экспрессия протеинкиназ пути mTOR (mammalian target of rapamycin), что приводит к синтезу HIF-1α, ингибированию пролилгидроксилазы (фермент, который в условиях нормоксии разрушает HIF-1α) и стабилизации молекулы HIF-1α. В дальнейшем HIF-1α связывается с белком-коактиватором транскрипции p300 и образует функционально активный транскрипционный комплекс [2, 13].
Установлена линейная зависимость между уровнем HIF-1α и повышением индекса апноэ/гипопноэ [14]. Предполагается, что определение уровня HIF-1α позволяет выявить лиц с СОАС [15]. Следует отметить, что уровень HIF-1α повышается и при ФП, а также по мере трансформации ФП в персистирующую или постоянную форму [16–18].
HIF-1α, участвуя в таких сигнальных каскадах, как «активные формы кислорода/HIF-1α/эндотелин 1», «стресс эндоплазматического ретикулума/HIF-1α», через индукцию воспалительных процессов, стимуляцию выработки активных форм кислорода, активацию симпатоадреналовой и ренин-ангиотензин-альдостероновой систем, стимуляцию процессов фиброза [2, 14, 19], становится неотъемлемым участником развития и прогрессирования ФП.
Сказанное подтверждает необходимость поиска и разработки метода прогнозирования вероятности рецидива аритмии у пациентов с ФП и СОАС.
Цель исследования – разработать метод прогнозирования вероятности развития пароксизма ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП.
Материал и методы
Проспективно обследовано 46 пациентов с персистирующей формой ФП, последовательно поступавших в Гродненский областной клинический кардиологический центр для проведения плановой электроимпульсной терапии. Критерии включения: мужской и женский пол, возраст 30–70 лет, наличие ФП, информированное согласие пациента на участие в исследовании. Критерии исключения: ФП на фоне органических клапанных пороков сердца, ишемическая болезнь сердца (ИБС) выше II функционального класса стенокардии, недостаточность кровообращения выше IIА стадии, острый или перенесенный инфаркт миокарда, анамнез кардиохирургического вмешательства, некоронарогенные заболевания миокарда, нарушение мозгового кровообращения на момент обследования и в предшествовавшие ему шесть месяцев, декомпенсированный сахарный диабет, заболевания щитовидной железы с нарушением функции, другая тяжелая эндокринная патология, хронические декомпенсированные заболевания печени, почек, легких, активный воспалительный процесс любой локализации, злокачественные новообразования, предположительная связь между ФП и алкогольными эксцессами, краниофациальная и лор-патология, требующие хирургической коррекции, прием психотропных средств (бензодиазепиновых снотворных, барбитуратов, транквилизаторов), отсутствие иных нарушений дыхания во сне, отказ пациента от участия в исследовании или его низкая приверженность участию в нем.
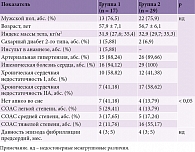
Среди пациентов с ФП 40 (86,96%) пациентов имели ИБС и артериальную гипертонию (АГ), 5 (10,87%) – только ИБС, 1 (2,17%) – только АГ, 3 (6,5%) – сахарный диабет (СД) 2-го типа, 1 (2,2%) пациент – инсульт в анамнезе. Средний возраст пациентов составил 57,2 ± 6,4 года. Мужчин насчитывалось 35 (76,1%), женщин – 11 (23,9%). Продолжительность аритмического анамнеза составила 5,3 ± 2,4 месяца. Средний балл по шкале CHA2DS2-VASc – 3,2 (2,2; 4), по шкале HAS-BLED – 2 (1; 3). Минимальный индекс массы тела (ИМТ) – 22,13 кг/м2, максимальный – 43,7 кг/м2.
Всем пациентам провели общеклиническое обследование согласно действующим протоколам. Ультразвуковое исследование выполняли всем пациентам на фоне ФП ультразвуковой системой Philips, IE-33 с использованием стандартных позиций. Для диагностики СОАС использовали 24-часовой полифункциональный кардиореспираторный мониторинг с программно-аппаратным комплексом «Кардиотехника-04-3Р», оценкой и расчетом индекса апноэ/гипопноэ (ИАГ) и индекса гипоксемии (ИГ). По итогам мониторинга СОАС был верифицирован у 76,1% пациентов выборки; ИАГ варьировался от 7 до 80 эпизодов/ч, ИГ – от 11 до 80 в час. Для количественного определения уровня HIF-1α в сыворотке крови использовали набор Human HIF-1α ELISA Kit Cat. ЕН0551 для твердофазного «сэндвич»-варианта иммуноферментного анализа (анализатор Sunrise TECAN). Порядок приготовления проб, реагентов и схема опыта были прописаны в инструкции изготовителя тест-систем (Wuhan Fine Biotech Corporation, Китай). Забор венозной крови у пациентов проводили в соответствии с правилами асептики и антисептики – из локтевой вены в утренние часы натощак в состоянии покоя после кардиореспираторного мониторирования. Электроимпульсная терапия выполнялась по стандартной общепринятой методике разрядом 150 Дж. Ежедневная профилактическая антиаритмическая терапия проводилась у всех пациентов: антиаритмические препараты II (метопролол 100 (50; 100) мг, бисопролол 5 (2,5; 7,5) мг или карведилол 12,5 (6,25; 12,5) мг) и III классов (амиодарон 200 (200; 400) мг) по V. Williams в модификации H. Singh и D. Harrison. Период наблюдения за пациентами составил один год. В виде конечной точки оценивали развитие рецидива ФП, под которым понималась индукция ФП продолжительностью не менее 30 секунд, зафиксированная на электрокардиограмме (ЭКГ) или в ходе холтеровского мониторирования ЭКГ. С учетом рецидива ФП пациенты были рандомизированы на две группы: первая – без рецидива ФП (n = 17), вторая – с рецидивом ФП (n = 29).
При обработке полученных данных использовали лицензионную версию программы STATISTICA 10.0 для Windows (StatSoft, Inc., США) и программу RStudio 1.1.183 (версия языка R – 3.4.3, пакеты ROCR, boot). Поскольку количественные признаки не соответствовали закону нормального распределения, при сравнении применяли непараметрические методы статистики. Данные представлены в виде медианы, 25% и 75% квартилей. Для оценки различий количественных признаков между независимыми группами использовали U-критерий Манна – Уитни, при анализе категориальных данных – точный двусторонний тест Фишера и χ2 Пирсона. Различия считались достоверными при р < 0,05. На основании данных наблюдений за исследуемой выборкой было составлено уравнение логистической регрессии с бинарным откликом и логит-функцией связи. Для оценки качества полученной модели выполнены ROC-анализ и кроссвалидация методом скользящего контроля.
Результаты и обсуждение
Рецидивы ФП зарегистрированы у 29 (63%) пациентов выборки, 17 (37%) пациентов сохранили синусовый ритм. Характеристики пациентов с учетом возврата аритмии представлены в табл. 1.
Показатели ИАГ и ИГ во второй были достоверно выше, чем в первой – 30 (14; 43) и 17 (9; 30), 11 (4; 15) и 3 (1; 10) соответственно (р < 0,05). Достоверных межгрупповых различий по уровню сатурации кислорода крови не получено.
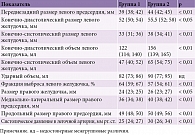
При анализе данных Эхо-КГ пациенты второй группы по сравнению с пациентами первой характеризовались достоверно большей дилатацией левого предсердия (ЛП) – 44 (42; 45) и 39 (38; 42) соответственно (р < 0,01), правых отделов сердца (р < 0,05), более высокими показателями систолического давления в легочной артерии – 30 (26; 34) и 25 (24; 27) соответственно (р < 0,01) и уровнем преднагрузки, а также более низкими значениями фракции выброса (ФВ) левого желудочка (ЛЖ) – 57 (54; 61) и 64 (59; 67) соответственно (р < 0,01). В табл. 2 представлена характеристика пациентов исследуемых групп.
У пациентов второй группы уровень HIF-1α составил 9,34 (3,71; 17,05) нг/мл, у пациентов первой – 3,83 (1,39; 8,39) нг/мл (р = 0,016). Корреляция прослеживалась между уровнем HIF-1α и ИАГ (R = 0,65; p < 0,001), и ИГ (R = 0,74; p < 0,001). Однофакторный регрессионный анализ показал, что уровень HIF-1α служит предиктором риска рецидива ФП в течение года после кардиоверсии (относительный риск 1,2; 95%-ный доверительный интервал (ДИ) 1,1–1,3; p = 0,002). Для выявления признаков, влияющих на развитие рецидива ФП, проведен многофакторный регрессионный анализ полученных данных. В модель множественной регрессии были включены следующие показатели: пол, возраст, давность эпизода ФП, наличие СОАС, АГ, ИБС, СД 2-го типа, анамнез инсульта, ИМТ, уровень HIF-1α, а также параметры Эхо-КГ (переднезадний размер ЛП и ФВ ЛЖ). Путем выбора лучшей комбинации предикторов c наивысшим предсказательным потенциалом в модель бинарной регрессии с логит-функцией связи были внесены следующие параметры: уровень HIF-1α, ФВ ЛЖ, размер ЛП. Оценки коэффициентов модели приведены в табл. 3.
В ходе анализа было составлено уравнение регрессии для оценки влияния сочетания факторов на риск развития рецидива ФП у пациентов с персистирующей формой ФП с сопутствующим СОАС:
ρ = 1/1+е -(k+0,157*X1+0,3607*X2-0,1958*X3 ,
где – вероятность развития рецидива ФП;
e – основание натурального логарифма (e = 2,718);
k – константный показатель (k = -4,5898);
Х1 – уровень HIF-1α (нг/мл);
Х2 – переднезадний размер левого предсердия (мм);
Х3 – фракция выброса ЛЖ (%).
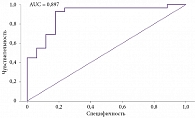
Полученную математическую модель оценивали с помощью ROC-анализа. Площадь под ROC-кривой составила 0,897 (95% ДИ 0,79– 0,99) (рисунок).
При расчетном значении p > 0,439 у пациентов с персистирующей формой ФП с сопутствующим СОАС в течение первого года после эффективной электроимпульсной терапии определялась высокая вероятность развития рецидива аритмии с чувствительностью 93% и специфичностью 82%.
Выводы
Установлено, что уровень HIF-1α, размер ЛП и ФВ ЛЖ независимо связаны с вероятностью развития рецидива ФП в течение года после эффективной электроимпульсной терапии у пациентов с коморбидным течением СОАС и ФП. Разработана математическая модель с чувствительностью 93% и специфичностью 82%, позволяющая своевременно оценивать вероятность пароксизма у пациентов с ФП и СОАС и имеющая клиническое преимущество перед тактикой пассивного наблюдения.
T.I. Balabanovich, PhD, V.I. Shyshko, PhD
Grodno State Medical University
Contact person: Tatiana I. Balabanovich, TatiBo1@yandex.ru
In recent years, there has been growing interest in atrial fibrillation (AF) associated with obstructive sleep apnea (OSA). Many studies support the role of the hypoxia-induced factor 1-alpha pathway in the pathogenesis of AF and OSA. Several predictors of relapse after electrical cardioversion have been established, but assessing each patient’s individual risk remains challenging. However, few researches have been performed on the prediction of AF progression in particular group of patients with concomitant OSA by developing composite risk prediction model.
The purpose – to develop a predictive mathematical model to assess the AF relapse risk during the first year after electrical cardioversion in patients with persistent AF and OSA.
Material and methods. 46 AF patients have been examined. Among them 35 patients with OSA. OSA was verified by cardiorespiratory monitoring. The average age of the patients was 57.2 ± 6.4 years (76.1% males). Serum levels of HIF-1α were assayed using commercially available ELISA kit. The median follow-up time was 1 year. The end point was the new relapse of AF after cardioversion. Statistical analysis was performed using STATISTICA 10.0, RStudio 1.1.183.
Results. The combined model based on ultrasound structural function parameters and blood marker HIF-1α in predicting the relapse of AF in patients with OSA and AF was developed (sensitivity 93%, specificity 82%).
Conclusion. Given the higher prevalence of OSA in AF population, identification of individuals in this cohort who are at risk for AF recurrence after electrical cardioversion may help to avoid the unnecessary risks and develop exact interventions improving the prognosis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.