Мукоактивные препараты в лечении острого кашля
- Аннотация
- Статья
- Ссылки
- English

Кашель: эпидемиология, классификация, клиническая картина
Кашель занимает второе место среди причин обращения за амбулаторной медицинской помощью [1] и первое среди симптомов, обусловленных патологией респираторной системы. Кашель как симптом характерен более чем для 50 нозологических форм [2].
Для правильной диагностики и лечения основного заболевания, ставшего причиной кашля, необходимо сформулировать синдром кашля, патогномоничный для конкретной нозологической формы. Для этого устанавливаются:
-
время возникновения кашля;
-
его продолжительность;
-
продуктивность/непродуктивность;
-
затруднения экспекторации;
-
сопутствующие симптомы.
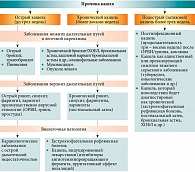
По длительности выделяют острый кашель (до трех недель), подострый (от трех до восьми – десяти недель) и хронический кашель (более восьми недель) (рис. 1) [1, 3, 4]. Однако такое разделение в значительной степени условно, поскольку указанные характеристики кашля не взаимоисключают друг друга.
Развившийся в результате острой респираторной вирусной инфекции (ОРВИ) кашель (первоначально определяемый как острый) в отдельных случаях может продолжаться более трех недель. Если воспалительный процесс распространяется на всю слизистую оболочку нижних дыхательных путей, наблюдается гиперпродукция бронхиальной слизи и гиперреактивность бронхов, то кашель приобретает подострое течение и классифицируется как постинфекционный [5]. Гиперпродукция вязкой бронхиальной слизи, гиперреактивность дыхательных путей приводят к значительным нарушениям мукоцилиарного клиренса, затруднениям экспекторации мокроты, мукостазу, бактериальной колонизации дыхательных путей. Часто наблюдаются лихорадка, астения, мокрота желто-зеленого цвета.
У больных хроническим бронхитом/хронической обструктивной болезнью легких (ХОБЛ) в периоды обострения на фоне ОРВИ/гриппа при правильном лечении выраженный кашель может продолжаться всего две-три недели, неоднократно рецидивируя в течение года. При этом в период ремиссии данный симптом может отсутствовать.
В то же время острый кашель может быть симптомом таких тяжелых заболеваний, как тромбоэмболия легочной артерии, отек или рак легкого. Это наиболее распространенный симптом, связанный с обострениями и неизбежной госпитализацией больных, страдающих бронхиальной астмой и ХОБЛ [3].
Хронический кашель чаще является симптомом серьезных хронических респираторных заболеваний, но может быть и единственным признаком внелегочной патологии, в частности заболеваний верхних дыхательных путей или желудочно-кишечного тракта [6].
Продуктивный кашель наблюдается при воспалительных/инфекционных поражениях нижних дыхательных путей, которым сопутствует гиперпродукция бронхиальной слизи. Продуктивный кашель, как правило, влажный, сопровождается экспекторацией мокроты – вязкой бронхиальной слизи, гноя, продуктов тканевого распада и др. В свою очередь отсутствие экспекторации мокроты – сухой кашель – может быть как следствием неэффективности продуктивного кашля, так и результатом непродуктивного кашля, например при постназальном затеке, гастроэзофагеальной рефлюксной болезни и других заболеваниях, при которых не происходит гиперпродукции мокроты.
Следует отметить, что эффективность продуктивного кашля (экспекторация мокроты) зависит от многих причин: фазы заболевания (при пневмонии продуктивный кашель в течение определенного времени остается сухим, при хроническом бронхите, бронхиальной астме нарастание бронхиальной обструкции может сопровождаться прекращением экспекторации мокроты), локализации процесса (например, при различной локализации злокачественного процесса или туберкулеза легких – в паренхиме легкого, бронхах, плевре) и др. В то же время может наблюдаться ложная продуктивность – например, при постназальном затеке у больных с ринитами и/или синуситами откашливается назальная слизь.
Среди причин неэффективности продуктивного кашля выделяют [7]:
-
недостаточно выраженный кашлевой рефлекс (у стариков, новорожденных и др.);
-
большую вязкость мокроты;
-
малую мощность воздушной струи во время кашлевого толчка, обусловленную ригидностью грудной клетки, малой податливостью легких или нарушениями бронхиальной проходимости;
-
недостаточно глубокое дыхание (продвижение секрета в бронхах пропорционально глубине дыхания).
Кроме того, в определенных ситуациях (при переломе ребер, других травматических повреждениях грудной клетки, после перенесенных хирургических вмешательств на органах грудной клетки и брюшной полости и др.) больные непроизвольно противятся кашлю (табл. 1) [8].
Лечение
Следует отметить, что проблема острого кашля изучена недостаточно, равно как и возможности его медикаментозной терапии [9]. После установления причин кашля должно проводиться этиотропное и патогенетическое лечение основного заболевания. Параллельно – симптоматическое:
-
противокашлевое – для предотвращения, управления и/или подавления кашля;
-
прокашлевое – для большей эффективности кашля.
Противокашлевая терапия при остром кашле, связанном с инфекцией дыхательных путей, не показана. Неспецифическая противокашлевая терапия рекомендована только в том случае, если кашель не способствует очистке дыхательных путей и является скорее симптоматическим. Применяется преимущественно в случаях безуспешной специфической терапии, например при неоперабельном раке легкого [10, 11].
Прокашлевая терапия патогенетически обоснована, если кашель выполняет защитную функцию и его необходимо стимулировать – при бронхитах, пневмонии и др.
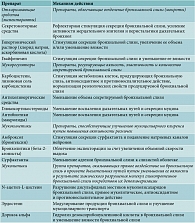
В настоящее время известно большое количество лекарственных средств, которые, воздействуя на вязкость, эластичность и адгезивность бронхиальной слизи, облегчают ее экспекторацию. Эти препараты получили название мукоактивных. Одни мукоактивные препараты применяются уже не одно столетие (их относят к средствам народной медицины), другие – специально синтезированные – стали широко применяться только с середины XX в. В зависимости от преобладающего механизма действия выделяют четыре класса мукоактивных препаратов: отхаркивающие (экспекторанты), мукорегуляторы, муколитики и мукокинетики (табл. 2) [12].
Это деление в некоторой степени условно, поскольку и мукокинетик амброксол и мукорегулятор карбоцистеин обладают способностью расщеплять межмолекулярные связи мукополисахаридов бронхиальной слизи, а муколитик ацетилцистеин – антиадгезивными свойствами. В то же время врачи должны знать особенности механизмов действия наиболее часто и успешно применяемых лекарственных средств – амброксола, карбоцистеина, ацетилцистеина и эрдостеина, чтобы осознанно делать выбор в каждом конкретном случае.
Далее рассмотрим подробно препараты, наиболее часто применяемые при лечении острого кашля при ОРВИ, остром бронхите, пневмонии и др.
Мукорегуляторы
Карбоцистеин (Бронкатар, Флюдитек и др.), лизиновая соль карбоцистеина (Флуифорт) обладают прежде всего мукорегулирующим эффектом (табл. 2). Механизм их действия связан с активацией сиаловой трансферазы – фермента бокаловидных клеток слизистой оболочки бронхов. Карбоцистеин уменьшает количество нейтральных гликопептидов и увеличивает количество гидроксисиалогликопептидов. В результате нормализуется вязкость и эластичность слизи. Под действием препарата происходят регенерация слизистой оболочки, восстановление ее структуры, уменьшается (нормализуется) количество бокаловидных клеток, особенно в терминальных бронхиолах, а значит, и количество вырабатываемой слизи. Кроме того, восстанавливается секреция IgA (специфическая защита) и число сульфгидрильных групп (неспецифическая защита), улучшается мукоцилиарный клиренс (потенцируется деятельность реснитчатых клеток). Противовоспалительный эффект характерен для всех препаратов тиоэфирной группы, воздействующих на активные формы кислорода [13]. При риновирусных инфекциях карбоцистеин подавляет воспалительный процесс в слизистой оболочке дыхательных путей путем снижения продукции цитокинов [14].
В среднем к третьему дню приема карбоцистеина увеличивается объем мокроты, в последующие два-три дня она становится менее вязкой и легче откашливается. Хороший и стабильный муколитический эффект отмечается к седьмым – девятым суткам лечения.
Добавление лизина к молекуле карбоцистеина способствовало повышению эффективности лечения. Так, при ОРВИ уже через четыре дня возможно прекращение приема препарата. При этом активность мукоцилиарного клиренса и нормальная вязкость бронхиальной слизи сохраняются еще в течение восьми дней [15].
Карбоцистеин одинаково эффективен во всех отделах дыхательных путей и среднего уха, имеющих сходное строение эпителия и реснитчатые клетки. Ввиду противовоспалительного, мукорегенераторного, муколитического действия карбоцистеин может быть показан при острых ринитах, риносинуситах, трахеитах.
Карбоцистеин эффективен только in vivo, поэтому его препараты выпускаются в виде таблеток, капсул, сиропа. В виде сиропа применяется у детей с пяти лет.
Мукокинетики
Бромгексин – синтетическое производное алкалоида вазицина. Является пролекарством, так как в печени превращается в активный метаболит – амброксол. Действие препарата начинается через 24–48 часов после приема. Особенностями бромгексина являются его самостоятельное противокашлевое действие и способность провоцировать бронхиальную обструкцию. Последнее отмечается при использовании эффективных доз (8–16 мг), что ограничивает прием препарата. Именно поэтому бромгексин рекомендуется применять только в составе комбинированных препаратов (Бромгексин 8, Бронхосан, Аскорил и др.) [10].
Амброксол (Лазолван, Амбробене, Халиксол и др.) уменьшает вязкость секрета бронхиальных желез, оказывает муколитическое (секретолитическое) и отхаркивающее действие, что связано с деполимеризацией и разрушением кислых мукопротеинов и мукополисахаридов мокроты (табл. 2). Кроме того, амброксол стимулирует выработку нейтральных полисахаридов и, воздействуя на бронхиальные железы, вызывает высвобождение лизосомальных ферментов. Однако наиболее важной является способность препарата стимулировать альвеолярными пневмоцитами второго порядка и клетками Клара синтез сурфактанта и двигательную активность ресничек мерцательного эпителия, что приводит к восстановлению мукоцилиарного клиренса. Кроме того, препарат активизирует образование трахеобронхиального секрета пониженной вязкости через изменение химизма мукополисахаридов мокроты. В результате разжижается вязкая бронхиальная слизь, уменьшается ее адгезивность и облегчается ее продвижение по дыхательным путям [16].
Амброксол в большей степени, чем бромгексин, способствует повышению синтеза, секреции сурфактанта и предотвращению его распада. Это делает амброксол необходимым у больных, находящихся на длительной ингаляционной терапии, в частности оксигенотерапии (при которой разрушается сурфактант), или искусственной вентиляции легких. Таким образом, амброксол опосредованно повышает мукоцилиарный транспорт (уменьшая адгезию бронхиальной слизи), что в сочетании с усилением секреции гликопротеинов (мукорегуляторное действие) обусловливает выраженный отхаркивающий эффект. Препарат достоверно влияет на вязкость мокроты, ее гнойность и проходимость [17]. Амброксол одинаково эффективен и в условиях in vivo, и в условиях in vitro, что позволяет назначать его перорально, парентерально и ингаляционно. Этим объясняется большое разнообразие лекарственных форм: таблетки, растворы для приема внутрь и ингаляций, капсулы ретард для приема один раз в день, ампулы для инъекций и ингаляций. Препарат начинает действовать через 36–72 часа. В случае необходимости быстрого разжижения чрезмерно вязкой мокроты одновременно с пероральным возможно ингаляционное введение препарата [17].
Препарат показан и при ОРВИ, и для профилактики обострений хронических заболеваний, например, бронхиальной астмы, ХОБЛ. Амброксол проникает через плацентарный барьер и выделяется с грудным молоком, поэтому он не рекомендуется к применению в первом триместре беременности и при кормлении грудью [18].
Муколитики
N-ацетил-L-цистеин (Флуимуцил, АЦЦ Лонг и др.), производное L-цистеина (табл. 2), относится к группе тиолов. Содержащиеся в его молекуле реактивные тиоловые сульфгидрильные (SH) группы разрывают дисульфидные связи мукополисахаридов мокроты, оказывая прямое муколитическое действие. В результате деполимеризации макромолекул мокрота, в том числе гнойная, становится менее вязкой и адгезивной. К разжижению мокроты приводит и стимуляция деятельности мукозных клеток, секрет которых способен лизировать фибрин, кровяные сгустки, гной [10, 12].
В 1989 г. O.T. Auroma и соавт. обнаружили мощный антиоксидантный эффект N-ацетил-L-цистеина, как прямой (нейтрализация свободных радикальных групп), так и непрямой (увеличение синтеза глутатиона) [19]. Это свойство N-ацетил-L-цистеина широко используется при лечении передозировки парацетамола [20]. Кроме того, на антиоксидантном эффекте основываются противовоспалительные свойства N-ацетил-L-цистеина [21]. Кроме того, N-ацетил-L-цистеин косвенно влияет на продукцию бронхиальной слизи, оказывая мукорегуляторное действие. Однако антиоксидантный эффект препарата проявляется в дозах, значительно превышающих рекомендованные, – 1200–1800 мг.
N-ацетил-L-цистеин одинаково эффективен как в условиях in vivo, так и в условиях in vitro. Многообразие лекарственных форм (таблетки, порошок, растворы, ампулы для инъекций) позволяет варьировать пути введения препарата и индивидуализировать терапию. Средняя суточная доза – 600 мг. Препарат начинает действовать через 30–90 минут. Следует отметить, что пероральный прием N-ацетил-L-цистеина может инактивировать действие антибиотиков, поэтому между приемами препаратов должно пройти не менее двух часов [16].
Необходимо также учитывать, что ингаляции N-ацетил-L-цистеином могут вызвать бронхиальную обструкцию при бронхиальной астме. К редким нежелательным явлениям относятся нерезко выраженные диспепсические расстройства. Прием препарата при сухом непродуктивном кашле скорее неоправдан, поскольку способствует усилению тяжелого надсадного кашля. С осторожностью N-ацетил-L-цистеин следует назначать больным с пониженным кашлевым рефлексом во избежание «затопления» легких из-за чрезмерного уменьшения вязкости и эластичности бронхиальной слизи (лицам старших возрастных групп, детям) [10].
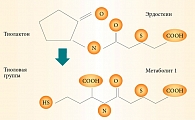
Эрдостеин (Эрдомед) был синтезирован в 1990-е гг. Химическая структура – N-(карбокси-метил-тиоацетил) гомоцистеин тиолактон. Является пролекарством. Имеет две блокированные тиоловые группы. При первичном прохождении через печень метаболизируется с образованием как минимум трех активных метаболитов, главную роль из которых играет N-тиодигликолил-гомоцистеин (метаболит 1) (рис. 2).
Эрдостеин обладает муколитическим, антиоксидантным, противовоспалительным, антиадгезивным и мукорегуляторным действием [22].
Тиоловые группы метаболита разрывают дисульфидные мостики, которые связывают волокна гликопротеинов, что приводит к уменьшению эластичности и вязкости бронхиальной слизи. Эрдостеин усиливает и ускоряет освобождение дыхательных путей от секрета, улучшает секреторную функцию эпителия и увеличивает эффективность мукоцилиарного клиренса в верхних и нижних отделах дыхательных путей [12].
Благодаря наличию сульфгидрильных групп эрдостеин оказывает выраженное антиоксидантное действие, как прямое, так и непрямое. Прямой антиоксидантный эффект заключается в снижении продукции активных форм кислорода, таких как гипохлорная кислота, гидроген пероксид, супероксид анион и пероксинитрит [23]. Непрямой эффект подразумевает предотвращение тканевого повреждения в результате воздействия продуктов окислительного стресса [24], увеличивает уровень глутатиона в жидкости бронхоальвеолярного лаважа [25] и печени, повышает активность альфа-1-антитрипсина в легких курильщиков [26]. Антиоксидантный эффект, как прямой, так и непрямой, наблюдается при приеме средней терапевтической дозы. Выраженный антиоксидантный эффект эрдостеина позволяет рекомендовать его пациентам с хроническими бронхолегочными заболеваниями, а также активным и пассивным курильщикам.
Противовоспалительное действие эрдостеина заключается в снижении уровеня маркеров воспаления (альбумина, IgG, дезоксирибонуклеиновой кислоты) и повышении уровня противовоспалительных медиаторов (IgA, лактоферрина, лизоцима) [27].
Антиадгезивное действие эрдостеина заключается в снижении бактериальной адгезии к клеткам организма хозяина [28]. Препарат блокирует микрофиламенты и микрофимбрии бактерий: посредством своих тиоловых (SH) групп разрушает белок (пилин) в микрофимбриях бактерий. В результате адгезия бактерии к клетке организма хозяина становится невозможной.
Кроме того, эрдостеин увеличивает концентрации антибиотиков (амоксициллина, ципрофлоксацина) в бронхиальной слизи, обеспечивая эффект последействия, усиливает антиадгезивный эффект кларитромицина и других антибиотиков и увеличивает период последействия антибиотика до восьми часов. При этом препарат повышает концентрацию антибиотика в мокроте, не уменьшая сывороточные концентрации [29].
Таким образом, препарат потенцирует действие антибиотиков при респираторных инфекциях, а также применяется при вирусном генезе заболевания, предупреждая их назначение.
Помимо муколитического действия, характерного для тиолов, эрдостеин усиливает мукорегуляторное действие эпителия дыхательных путей и стимулирует их моторную функцию. Вследствие прямого влияния на функциональное состояние реснитчатого эпителия дыхательных путей повышает эффективность мукоцилиарного клиренса (мукокинетическое действие). При этом препарат обладает умеренным противокашлевым действием.
Эрдостеин быстро абсорбируется в желудочно-кишечном тракте и метаболизируется в печени до трех активных метаболитов. Период полувыведения – более пяти часов. Прием пищи не влияет на фармакокинетические параметры. Максимальная концентрация – 3,46 мкг/мл, время до достижения максимальной концентрации – 1,48 часа, площадь под кривой «концентрация – время» от 0 до 24 часов – 12,09. 64,5% эрдостеина связывается с белками плазмы крови. Препарат выводится в виде неорганических сульфатов через почки и кишечник [16].
Назначается взрослым с 18 лет. Применяется перорально (капсулы 300 мг № 20 и гранулы для приготовления суспензии 35 мг/мл).
Применение препарата показано при развитии кашля с трудноотделяемой мокротой при ОРВИ, остром бронхите, пневмонии, для профилактики пневмонии и частичного ателектаза после хирургических вмешательств. Клинические эффекты (снижение частоты и выраженности кашля, положительная динамика аускультативных данных: жесткое дыхание и хрипы) наблюдаются уже к окончанию первых суток приема препарата [30]. У пациентов с обострением хронического бронхита на фоне терапии эрдостеином было достигнуто значительное разжижение бронхиальной слизи и хорошая экспекторация ее ко второму дню терапии [31].
Обратите внимание: в отличие от других вышеописанных мукоактивных препаратов эрдостеин хорошо переносится при сухом непродуктивном кашле, характерном для большинства ОРВИ. Это обусловлено прежде всего противокашлевым эффектом препарата [12].
Немаловажную роль играет и непрямой антиоксидантный эффект препарата – повышение уровня глутатиона в печени – в связи с широко распространенным приемом парацетамола при ОРВИ. Повышение уровня глутатиона препятствует развитию печеночной недостаточности при абсолютной или относительной передозировке парацетамола.
Эффективность эрдостеина в комплексной терапии обострений ХОБЛ показана в нескольких рандомизированных плацебоконтролируемых исследованиях. Так, в международном мультицентровом рандомизированном плацебоконтролируемом двойном слепом исследовании в параллельных группах был отмечен синергизм эрдостеина с амоксициллином у пациентов с инфекционным обострением ХОБЛ [32]. Контролируемое рандомизированное исследование EQUALIFE подтвердило эффективность эрдостеина при лечении больных ХОБЛ – количество обострений уменьшилось на 32%, госпитализаций – на 44%, объем форсированного выдоха за первую секунду вырос на 14% [33].
Препарат не оказывает повреждающего воздействия на желудочно-кишечный тракт. Возможна кумуляция метаболитов при почечной недостаточности. Противопоказан при нарушении функции печени, почечной недостаточности, гомоцистеинурии, фенилкетонурии. Прием препарата в период беременности и лактации возможен только по очень строгим показаниям.
Заключение
Эрдостеин – новый эффективный мукоактивный препарат с выраженной антиадгезивной активностью. Эрдостеин потенцирует действие антибиотиков при респираторных инфекциях, а также применяется при вирусном генезе заболевания во избежание их назначения. Эрдостеин назначается с целью более раннего и стойкого регресса респираторных симптомов и снижения риска бактериальных осложнений пациентам в группе риска (пожилые, иммунокомпрометированные, активные и пассивные курильщики), а также в следующих случаях:
-
при кашле с трудноотделяемой мокротой;
-
затяжном кашле;
-
патологии желудка и двенадцатиперстной кишки;
-
борьбе с зависимостью от табака и отказе от курения.
I.L. Klyachkina
Russian Medical Academy of Postgraduate Education
Contact person: Irina Lvovna Klyachkina, formozailk2012@yandex.ru
Until now, acute cough has been poorly examined similarly to an opportunity of its medicated therapy. Here, the drugs most commonly used in treatment of acute cough during acute respiratory viral infections, acute bronchitis, pneumonia etc. are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.