Мультипробиотик Бак-Сет: инновационные возможности в коррекции кишечного микробиоценоза у детей. IV Всероссийская научно-практическая конференция по детской гастроэнтерологии и нутрициологии. Сателлитный симпозиум компании «Фармамед»
- Аннотация
- Статья
- Ссылки
Как показали результаты исследований, на фоне применения мультиштаммового пробиотика Бак-Сет Беби восстанавливается активность облигатной толстокишечной микрофлоры в отсутствие нежелательных реакций. Особенностям формирования и сохранения кишечной микробиоты у младенцев, эффективности и безопасности мультипробиотиков нового поколения Бак-Сет Беби и Бак-Сет Форте в коррекции функциональных нарушений желудочно-кишечного тракта и восстановлении нарушенной микробиоты кишечника у детей раннего возраста был посвящен симпозиум компании «Фармамед» (Москва, 20 октября 2015 г.).
Как показали результаты исследований, на фоне применения мультиштаммового пробиотика Бак-Сет Беби восстанавливается активность облигатной толстокишечной микрофлоры в отсутствие нежелательных реакций. Особенностям формирования и сохранения кишечной микробиоты у младенцев, эффективности и безопасности мультипробиотиков нового поколения Бак-Сет Беби и Бак-Сет Форте в коррекции функциональных нарушений желудочно-кишечного тракта и восстановлении нарушенной микробиоты кишечника у детей раннего возраста был посвящен симпозиум компании «Фармамед» (Москва, 20 октября 2015 г.).



Дисбиоз кишечника у детей: лечить или не лечить?
По словам заведующей кафедрой педиатрии Российской медицинской академии последипломного образования, заслуженного врача РФ, д.м.н., профессора Ирины Николаевны ЗАХАРОВОЙ, с появлением новых представлений о микробиоте кишечника термин «дисбактериоз» признан устаревшим. Вместо него используют термин «дисбиоз», под которым понимают нарушения микробиоты, приводящие к формированию патологических состояний.
Следует отметить, что некоторые врачи продолжают назначать бактериологический анализ кала на дисбактериоз, который в настоящее время подвергается критике. Недостатки культурального анализа, достаточно дорогостоящего, длительного и трудоемкого, состоят прежде всего в низкой информативности, поскольку большинство микроорганизмов в кале некультивируемые. С внедрением метода секвенирования ДНК в 1999 г. (определения нуклеотидной последовательности генов 16S РНК) удалось установить, что только 10% микрофлоры кишечника культивируется.
Метод полимеразной цепной реакции (ПЦР) позволил определить, что в кишечнике обитает около 1000 видов микроорганизмов, 99% из которых анаэробные. Их состав существенно отличается от того, который ранее представлялся по данным посева.
В 2008 г. был запущен глобальный проект «Микробиом человека», направленный на расшифровку генома бактерий, населяющих организм человека. На сегодняшний день расшифровано около 3 млн генов, что примерно в 150 раз превышает набор генов человека1.
По составу микрофлоры людей можно разделить на три энтеротипа, каждый из которых включает множество видов бактерий, вне зависимости от места проживания, состояния здоровья или возраста2. У первого энтеротипа доминируют грамотрицательные анаэробные палочковидные бактерии семейства Bacteroidaceae, у второго – условно патогенные бактерии рода Prevotella, у третьего – анаэробные бактерии рода Ruminococcus. Следовательно, наличие определенного энтеротипа позволяет прогнозировать особенности обмена веществ и предрасположенность к конкретным заболеваниям.
Кишечная микробиота представляет собой динамически изменяющийся состав микробов, характерных для каждого человека. К факторам, влияющим на становление кишечной микробиоты у младенцев, относят микрофлору матери (вагинальную, кишечную, кожную), способ родоразрешения, гестационный возраст, окружающую среду. Микрофлора плода формируется во второй половине беременности при помощи бактериальной транслокации. Подтверждение тому – Escherichia coli и бифидобактерии, обнаруженные на 24-й неделе гестации в желудке, тонкой и толстой кишке плода.
Согласно анализу литературы, заселение кишечника микрофлорой зависит от социального статуса страны. В странах с низким уровнем дохода колонизация кишечника бактериями происходит значительно раньше: практически у всех детей в течение первых дней жизни в стуле обнаруживаются энтеробактерии. В странах с высоким уровнем дохода, например в Швеции, у 25% детей после недельного пребывания в родильном доме энтеробактерии в стуле отсутствуют. В США у 35% детей кишечник не колонизирован в течение первых двух недель жизни.
В исследование, посвященное оценке влияния способа родоразрешения и среды обитания на микробиоту новорожденного, были включены четыре ребенка, рожденных естественным путем, и шестеро детей, появившихся на свет путем кесарева сечения. Забор образцов флоры с кожи, слизистой оболочки полости рта и влагалища рожениц брали за час до родов, забор образцов флоры с кожи, полости рта и носоглотки – через пять минут после родов, анализ мекония – через 24 часа. Микрофлора младенцев, рожденных естественным путем, была аналогична влагалищной флоре матери с преобладанием Lactobacillus, Prevotella, Sneathia и проч. У младенцев, рожденных путем кесарева сечения, доминировали Staphylococcus, Corynebacterium, Propionibacterium spp.
В другом исследовании участвовали 24 доношенных ребенка, образцы фекалий которых были собраны в четырехмесячном возрасте. Состав микробиоты изучали методом ПЦР. Согласно полученным данным, в микробиоте детей, рожденных естественным путем, доминировали Bifidobacterium, Firmicutes и др. У детей, рожденных путем кесарева сечения, отмечалось недостаточное количество Bacteroides, а у детей, рожденных путем планового кесарева сечения, – особенно низкое бактериальное разнообразие.
Методом ПЦР изучали образцы стула у недоношенных детей с сепсисом и без него. Данные показали, что меконий у младенцев нестерилен, с преобладанием Lactobacillus, Staphylococcus, Enterobacteriales. У детей с развившимся сепсисом сначала наблюдалось низкое разнообразие микробных сообществ, затем – преобладание стафилококков. У здоровых детей микробное сообщество было более разнообразным с преобладанием Clostridium, Klebsiella, Veillonella. Исследователи пришли к выводу, что у детей с очень низкой массой тела при рождении меконий нестерилен, у новорожденных с поздним сепсисом менее разнообразно микробное сообщество, поэтому длительный прием антибиотиков губителен и еще больше снижает микробное разнообразие.
Наличие условно патогенной флоры в кишечнике способствует не только стимуляции иммунной системы, но в ряде случаев может сопровождаться появлением признаков воспаления слизистой оболочки кишечника. Одним из возможных маркеров такого воспаления может быть уровень кальпротектина в кале. J.M. Rhodas и соавт.3 показали, что у детей с кишечными коликами уровень кальпротектина в два раза выше, чем у детей контрольной группы. N. Kapel и соавт.4 установили, что уровень кальпротектина у доношенных и недоношенных детей к четырем-пяти месяцам жизни снижается до нормальных значений.
Микрофлора кишечника выполняет защитную, пищеварительную, детоксикационную и антиканцерогенную функции. Она участвует в синтезе витаминов, регуляции обмена холестерина. Уже не подвергается сомнению тот факт, что, чем более разнообразна микробиота кишечника младенца, тем более здоровым он будет.
Безусловно, выбор пробиотика при дисбиотических нарушениях у детей должен основываться на принципах доказательной медицины. На сегодняшний день известно пять пробиотиков с доказанной эффективностью: Bifidobacterium longum, B. lactis, Lactobacillus rhamnosus, L. casei и L. reuteri. Кроме того, продолжаются исследования по использованию определенного штамма в лечении конкретной болезни. В протокол ведения детей с острым гастроэнтеритом Европейского общества педиатров, гастроэнтерологов, гепатологов и детских нутрициологов (2014) вошли четыре штамма микроорганизмов: Saccharomyces boulardii, L. rhamnosus (LGG), L. acidophilus LB и L. reuteri. При антибиотикоассоциированной диарее применяются S. boulardii, L. rhamnosus (LGG), а при непереносимости лактозы – Streptococcus thermophilius.
Особый интерес у специалистов вызывают мультиштаммовые пробиотические препараты, оказывающие комплексное действие при функциональных нарушениях желудочно-кишечного тракта (ЖКТ) у детей раннего возраста. Одним из представителей мультиштаммовых пробиотиков является Бак-Сет Беби. Это пробиотик нового поколения, созданный в Великобритании и зарегистрированный в России. В его состав входят L. casei, L. rhamnosus, L. acidophilus, Bifidobacterium breve, B. infantis, B. longum, S. thermophilius, а также фруктоолигосахариды в качестве пребиотиков.
Все штаммы, входящие в состав препарата, имеют оригинальное происхождение, включены в перечень европейского качества, что доказывает высокий уровень безопасности. Исследования кислотоустойчивости пробиотических штаммов Бак-Сет при pH = 2 в течение двух часов продемонстрировали высокую жизнеспособность. C. Chapman и соавт.5 доказали, что в отличие от отдельных штаммов мультиштаммовые пробиотики характеризуются более высокой антимикробной активностью (р < 0,05).
В Московском амбулаторно-поликлиническом центре № 133, являющемся клинической базой кафедры педиатрии РМАПО, было проведено рандомизированное плацебоконтролируемое исследование клинической эффективности мультиштаммового пробиотика Бак-Сет Беби. В исследовании участвовали 45 детей (от рождения до одного года) с функциональными нарушениями ЖКТ, развившимися при переходе на искусственное питание или при введении прикорма. Основную группу составили 30 детей (средний возраст 3,28 ± 0,29 месяца), которые получали пробиотик Бак-Сет Беби по одному саше один раз в день за 15 минут до еды в течение 14 дней. В группу плацебо вошли 15 детей (средний возраст 3,39 ± 0,32 месяца). Длительность наблюдения составила 21 день.
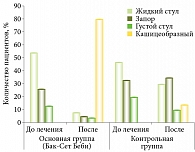
Результаты исследования показали хорошую клиническую эффективность мультиштаммового пробиотика Бак-Сет Беби в купировании функциональных нарушений ЖКТ у детей раннего возраста. В начале наблюдения у половины детей основной группы стул был жидкий, водянистый. У 26% детей самостоятельный стул отсутствовал. Через две недели от начала приема пробиотика Бак-Сет Беби у детей основной группы отмечалась выраженная положительная динамика – у 80% детей стул стал кашицеобразным. У 86,6% детей группы плацебо нарушения характера стула сохранялись (рис. 1).
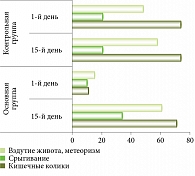
Оценка динамики симптомов функциональных нарушений ЖКТ до и после коррекции показала, что в основной группе проявления кишечных колик были купированы у 86% детей, срыгивания – у 70%, метеоризм – у 78%. В то же время в группе плацебо положительная динамика в отношении срыгивания, вздутия и колик была выражена незначительно (рис. 2).
Результаты оценки состояния микробиоты кишечника, в частности динамика лабораторных показателей на основании общего содержания короткоцепочечных жирных кислот (КЖК), продемонстрировали наличие резкой активизации анаэробных микроорганизмов, продуцирующих пропионовую и масляную кислоту (1-й тип), активизацию аэробных микроорганизмов, продуцирующих в основном уксусную кислоту, представителей факультативной микрофлоры (2-й тип). В группе плацебо изменения были выражены незначительно.
«Оценка значений анаэробного индекса показала увеличение продуктов токсичных форм кислорода вследствие активизации условно патогенной флоры. Эффект на продукцию нашими условно патогенными микроорганизмами соответствующих КЖК был в целом положительный», – пояснила профессор И.Н. Захарова. Изменения уровня изокислот свидетельствовали, с одной стороны, о тенденции к нормализации процессов протеолиза, с другой – о естественной элиминации остаточных микроорганизмов на фоне коррекции.
На основании полученных результатов были сформулированы следующие выводы:
-
пробиотик Бак-Сет Беби – эффективное средство для коррекции нарушений кишечной микробиоты у детей первого года жизни;
-
применение пробиотика Бак-Сет Беби способствует восстановлению активности облигатной толстокишечной микрофлоры, в частности бифидо- и лактобактерий, за счет изменения видового состава микроорганизмов, характеризующегося снижением активности факультативных и остаточных анаэробных (при 1-м типе) и аэробных (при 2-м типе) популяций микрофлоры, а также восстановления внутрипросветной среды обитания;
-
при использовании пробиотика Бак-Сет Беби не зарегистрировано нежелательных явлений или признаков непереносимости.
Место мультиштаммовых пробиотиков в педиатрической практике
Микробная экология – наука, изучающая взаимоотношения микроорганизмов. Медицинская микробная экология является одним из ее разделов. По мнению д.м.н., профессора, заведующей кафедрой педиатрии с инфекционными болезнями у детей Российского национального исследовательского медицинского университета им. Н.И. Пирогова Любови Алексеевны ХАРИТОНОВОЙ, микроэкология кишечника в этом плане представляет особый интерес.
ЖКТ считается одной из наиболее сложных экосистем организма человека. С одной стороны, нарушение функции органов сопровождается изменением состава микрофлоры, с другой – качественный и количественный состав самой микрофлоры определяет характер биохимических процессов. Роль микрофлоры кишечника заключается в обеспечении резистентности к инфекциям, выработке антибиотических веществ (лактолин, лактоцидин, ацидофилин), создании кислой среды, активации клеточного и гуморального звеньев иммунного ответа GALT-системы и селективной стимуляции лимфатического аппарата.
Микрофлора кишечника участвует во всех видах обмена – жировом, белковом, кислотном, витаминном. Она регулирует микроэлементный баланс и иммунную систему, выполняет детоксикационную функцию. Нарушение микроэкологии кишечника сопровождается снижением общей иммунологической резистентности, развитием аллергических реакций, формированием патогенных клонов бактерий и транслокацией бактерий с развитием эндогенных инфекционных процессов, вплоть до гнойно-септических.
Формирование микроэкологии кишечника ребенка начинается во внутриутробном периоде. На этот процесс влияет генетически детерминированная толерантность к индигенной микрофлоре, сформированной внутриутробно, а также колонизационная резистентность к ауто- и аллохтонным микроорганизмам матери. В процессе формирования микрофлоры кишечника кроме иммунной системы особую роль играют антимикробный эффект секретов желудка, состав и количество муцинов, напряженность кислорода по толщине биопленки, скорость обновления, созревания и метаболизма мукозного эпителия.
Установлено, что наиболее высокая активность бета-галактозидазы присуща молочнокислым бактериям штамма L. acidophilus LA-1, которые способны сами по себе продуцировать лактазу – фермент, расщепляющий лактозу. Но лактаза микробного происхождения, которая накапливается в йогуртах и других кисломолочных продуктах в процессе их изготовления, лишь в незначительной степени помогает утилизировать повышенные концентрации лактозы, поступающей с пищей. От того, насколько кишечная стенка способна вырабатывать фермент лактазу, также зависит состояние микрофлоры кишечника.
На сегодняшний день накоплен большой опыт коррекции микробиоценоза у детей с помощью средств, влияющих на разные звенья этиопатогенеза дисбиозов, в том числе пробиотиков. Однако надо помнить, что пробиотики не обладают колонизационной резистентностью, несмотря на то, что их капсульные формы обеспечивают активность при прохождении кислотного барьера желудка и их штаммы отобраны из микрофлоры человека. Пробиотики оказывают быстрый терапевтический эффект, элиминируются из кишечника в течение трех – семи дней. Поэтому длительная пробиотическая терапия не предотвращает риска развития антибиотик-ассоциированной диареи у детей даже через шесть месяцев после перенесенной инфекции. Применение пробиотиков с антибактериальными препаратами вовсе нецелесообразно. Антибиотики значительно снижают колонизационную резистентность пробиотиков и ускоряют их элиминацию. Возможность развития инфекционных процессов обусловлена штаммами, входящими в состав пробиотиков. Чрезмерная иммунная стимуляция (сенсибилизация) лимфатического аппарата кишечника нередко ухудшает состояние ребенка. Кроме того, за счет передачи генов, ответственных за экспрессию факторов патогенности, могут формироваться новые клоны бактериальных штаммов.
Перечисленных недостатков лишены мультиштаммовые пробиотики, содержащие ацидофильные лактобактерии, в частности мультипробиотик Бак-Сет Форте. Это единственный мультипробиотик, содержащий 14 штаммов пробиотических бактерий, устойчивых в кислой среде желудка, усиливающих и дополняющих действие друг друга. В одной капсуле Бак-Сет Форте содержатся 2 млрд живых бактерий. Мультиштаммовый пробиотик нового поколения Бак-Сет Форте предназначен для взрослых и детей с трех лет.
Профессор Л.А. Харитонова представила первые результаты углубленного клинического исследования эффективности, переносимости и безопасности препарата Бак-Сет Форте в педиатрической практике. Целью мультицентрового плацебоконтролируемого исследования стала оценка влияния мультиштаммового пробиотика Бак-Сет Форте на состояние кишечной микробиоты и клиническую картину у детей с атопическим дерматитом, запорами и диареей.
В исследовании участвовали 120 детей в возрасте от четырех до 12 лет. Методом случайной выборки они были разделены на пять групп. В первую основную группу вошли 30 детей с диареей на фоне приема антибиотиков, ротавирусной инфекцией, синдромом мальабсорбции, во вторую основную группу – 30 детей с расстройством стула (запором) на фоне смены рациона питания, в третью основную группу – 30 детей с атопическим дерматитом легкой и средней степени. Первую группу плацебо составили 15 детей с функциональными кишечными нарушениями после перенесенных острых кишечных инфекций, вторую группу плацебо – 15 детей с атопическим дерматитом.
Дети трех основных групп помимо базисной терапии получали пробиотик Бак-Сет Форте по одной капсуле один раз в день перед завтраком в течение 14 дней. Дети двух групп плацебо помимо базисной терапии получали плацебо по одной капсуле один раз в день перед завтраком в течение 14 дней. Родителям всех детей были даны подробные рекомендации по правильному питанию и режиму, контролю за стулом.
Обследование включало три визита: первый – скрининговый, второй – рандомизация, выдача препарата/плацебо, нулевой день терапии, третий – через 14 дней от начала приема Бак-Сет Форте, через 15 дней после первого визита. До начала исследования и после него всем детям бесплатно проводились общеклинические исследования, ультразвуковое исследование (УЗИ) пищеварительного тракта, расширенное исследование кала на дисбиоз в Московском научно-исследовательском институте эпидемиологии и микробиологии им. Г.Н. Габричевского.
Результаты показали, что практически по всем клиническим симптомам после приема Бак-Сет Форте наблюдалась положительная динамика – от 80 до 100% во всех трех основных группах. У детей с запорами клинический эффект наступал в первые сутки от начала приема препарата. Более чем у половины детей с атопическим дерматитом на протяжении первой недели приема Бак-Сет Форте исчезали общие симптомы, нивелировались сыпь, шелушение, купировался кожный зуд.
Копрологическое исследование показало положительную динамику со стороны примесей в стуле (слизь, кровь) – от 70 до 100%. Примерно в пять раз снизился уровень лейкоцитов, в десять раз – содержание нейтрального жира, в 1,5 раза – жирных кислот и внутриклеточного крахмала. Это свидетельствовало о нормализации процессов пищеварения и нивелировании воспалительного процесса в стенке кишечника. Наиболее значимыми были изменения со стороны условно патогенной микрофлоры. Обращало на себя внимание постепенное купирование диареи, в среднем на третьи – пятые сутки при ротавирусной инфекции и в первые сутки у детей с хронической диареей, обусловленной пищевой непереносимостью. Полученные данные коррелировали с частотой и длительностью исчезновения атопических реакций, что позволило говорить о противовоспалительном и иммуномодулирующем эффекте Бак-Сет Форте. Ключевым результатом стала подтвержденная максимальная клиническая эффективность мультипробиотика Бак-Сет Форте, заключавшаяся в нивелировании запоров и хронической диареи с первого дня применения, подавлении атопических и воспалительных реакций.
В подтверждение сказанного профессор Л.А. Харитонова привела пример из собственной клинической практики.
Больная К., пять лет.
Клиническая картина: с рождения неустойчивый стул, обильный, пенистый, зловонный, с примесью слизи и прожилками крови. Последний год диарея отмечалась каждые два месяца, длительность – две-три недели. Появился гемоколит. Больная за год похудела на 5 кг.
Объективно: дефицит массы тела – 20%. Органы без особенностей. Печень и селезенка не увеличены.
При обследовании исключены целиакия, лактазная недостаточность, непереносимость белка коровьего молока, экзокринная недостаточность поджелудочной железы. При колоноскопии выявлены признаки язвенного колита в илеоцекальной области.
Лечение: назначена специфическая терапия. Состояние улучшилось, но явления метеоризма и кишечных колик сохранялись.
К терапии добавили пробиотик Бак-Сет Форте по одной капсуле один раз в день перед завтраком в течение 14 дней. В течение суток от начала приема пробиотика у пациентки нормализовался стул, исчезли колики и метеоризм, появился аппетит. Еще два раза пациентке назначали курс лечения пробиотиком Бак-Сет Форте.
Всего в течение месяца было проведено три курса терапии мультипробиотиком Бак-Сет Форте. В итоге у пациентки полностью нормализовался стул, она прибавила в весе 2 кг, признаки обострения колита исчезли.
Опираясь на клинический опыт и результаты наблюдательного исследования, профессор Л.А. Харитонова констатировала: «У наблюдаемых детей имели место выраженные нарушения микроэкологии кишечника с клиническими проявлениями. После назначения пробиотика Бак-Сет Форте отмечалось не только восстановление микроэкологии, но и купирование клинических симптомов в отсутствие побочных эффектов». В заключение она отметила, что хорошая эффективность и переносимость мультипробиотика Бак-Сет Форте позволяют рекомендовать его для внедрения в широкую педиатрическую практику.
Эффективность Бак-Сет Форте. Клинические случаи
Успешный опыт применения мультиштаммового пробиотика Бак-Сет Форте у детей с функциональными расстройствами ЖКТ ассистент кафедры педиатрии с инфекционными болезнями у детей Российского национального исследовательского медицинского университета им. Н.И. Пирогова, к.м.н. Татьяна Викторовна КУЧЕРЯ продемонстрировала на двух примерах из собственной практики.
Пациентка Настя, четыре с половиной года.
Анамнез жизни: родилась от первой беременности, протекавшей на фоне хронического пиелонефрита, с угрозой невынашивания в первом триместре и токсикозом в третьем триместре. Роды срочные в 40 недель. Вес при рождении – 3680 г, рост – 53 см, состояние после рождения – 8/9 баллов по шкале Апгар. Приложена к груди в родовом зале. Привита по возрасту. Состоит на диспансерном учете у нефролога с диагнозом «хронический пиелонефрит».
Анамнез заболевания: за шесть месяцев до обращения к специалисту у девочки обострился хронический пиелонефрит – получила два курса антибактериальной терапии (Амоксиклав, Супракс), затем в течение двух месяцев – уросептики (Фурамаг, Канефрон Н). После курса терапии появился стойкий запор – стул один раз в три дня, плотно оформленный, большого размера, иногда со свежей кровью. Порой стул удавалось получить только после использования микроклизм. Родители девочки обратились за помощью к гастроэнтерологу.
При осмотре состояние удовлетворительное, кожные покровы чистые от сыпи, суховатые на ощупь, со следами расчесов и мелкопластинчатым шелушением на ягодицах. Живот обычной формы, немного вздут, симметричен. Поверхностная пальпация живота безболезненная, при глубокой пальпации в правой подвздошной области определяются петли кишечника, плотно заполненные каловыми массами. Печень – у края реберной дуги, край ровный, селезенка не пальпируется. Перианальная область не изменена, стул был два дня назад, мочеиспускание не нарушено.
Клинические и лабораторные данные: при УЗИ органов брюшной полости – перегиб желчного пузыря в области шейки, реактивные изменения поджелудочной железы. Показатели мочи в границах возрастной нормы. Общий анализ крови и мочи в норме, анализ кала на яйца глистов и простейшие отрицательный. Кал «овечий», темно-коричневого цвета, плотной консистенции. При микроскопии обнаружены остатки непереваренной пищи, единичные переваренные мышечные волокна, неперевариваемая растительная клетчатка, нейтральный жир, соли жирных кислот в небольшом количестве, лейкоциты и эритроциты – 0–2, 0–1 в поле зрения. Анализ микрофлоры кишечника показал снижение дефектной флоры. Уменьшение общего уровня летучих жирных кислот – 21,7 ммоль/г.
Диагноз: функциональное нарушение работы кишечника; запоры; дисфункция билиарного тракта; нарушение микробиоты кишечника; реактивные изменения поджелудочной железы.
Лечение: стол № 4, терапия препаратами Форлакс, Фламин, Креон, Стимбифид, Бак-Сет Форте.
На фоне лечения отмечалась положительная динамика – с четвертого дня приема мультипробиотика Бак-Сет Форте стул стал ежедневным, самостоятельным, мягкооформленным. Исчезли боли в животе. По окончании курса лечения восстановилась влажность кожных покровов, исчезло шелушение. Данные макро- и микроскопии кала подтвердили улучшение переваривающей способности ЖКТ. Нормализовалась флора кишечника, существенно увеличилась продукция летучих жирных кислот – 124,81 ммоль/г.
Пациентка Василиса, три года.
Анамнез жизни: родилась от первой беременности, протекавшей на фоне анемии матери, с угрозой невынашивания в первом триместре. Срочные роды в 39–40 недель, вес при рождении – 3120 г, рост – 50 см, состояние при рождении – 8/9 баллов по шкале Апгар. Приложена к груди в родовом зале. Привита по возрасту. На диспансерном учете не состояла. Отец девочки страдает бронхиальной астмой.
Анамнез заболевания: за восемь месяцев до обращения к гастроэнтерологу у девочки появилась сыпь на теле, конечностях, единичные зудящие элементы на волосистой части головы; начались боли в животе, сопровождавшиеся неустойчивым стулом, плохо перевариваемым, неоформленным, со склонностью к диарее. Обследована на паразитарные инвазии. Анализы отрицательные. Получала антигистаминные препараты с временным эффектом, придерживалась прописанной аллергологом диеты, дважды была проведена тест-терапия Немозолом с интервалом два месяца (последний курс – за две недели до обращения к специалисту). После курса терапии динамики практически не отмечалось. Родители девочки обратились к гастроэнтерологу.
При осмотре: состояние удовлетворительное, но самочувствие страдает. Кожные покровы сухие с элементами мелкопластинчатого шелушения, со следами расчесов на конечностях и туловище. Живот обычной формы, поверхностная пальпация безболезненна, при глубокой пальпации в левой подвздошной области определяются петли кишечника, урчание по его ходу. Печень – +2 см от края реберной дуги, край ровный, селезенка не пальпируется. В области анального отверстия – гиперемия и следы расчесов.
Клинические и лабораторные данные: УЗИ органов брюшной полости показало загиб желчного пузыря в области шейки, гепатомегалию, реактивные изменения поджелудочной железы, общий анализ крови – эозинофилию 6%. Анализы кала на яйца глистов и простейшие, кала на антиген лямблий, соскоба на энтеробиоз, крови на антитела к аскаридам, токсокарам, описторхам отрицательные. При макроскопических исследованиях обнаружены изменения в анализах кала, общий уровень продукции летучих жирных кислот значительно снижен – 33,36 ммоль/г. Диагноз: функциональное нарушение кишечника; синдром нарушенного всасывания; дисфункция билиарного тракта; нарушение микробиоты кишечника; реактивные изменения печени и поджелудочной железы; возможна паразитарная инвазия.
Лечение: стол – гипоаллергенный, терапия препаратами Энтерол, Секстафаг, Энтеросгель, Фламин, Бак-Сет Форте.
На фоне лечения отмечалась незначительная положительная динамика. На третий день от начала приема Бак-Сет Форте у девочки с утра усилились боли в животе и вздутие живота: после дефекации обнаружено большое количество (несколько десятков) гельминтов белого цвета размером 5–10 мм (согласно лабораторным данным – острицы). Курс Бак-Сет Форте был прерван. Назначили мебендазол 100 мг однократно с повторным курсом через две недели. По окончании противопаразитарной терапии вновь назначили курс мультипробиотиком Бак-Сет Форте в течение 14 дней, по окончании которого отмечалась положительная динамика со стороны кожных покровов, стул стал мягкооформленным, цилиндрическим, в основном один раз в сутки. Кроме того, улучшились состояние микрофлоры, продукция желчных кислот и соотношение летучих жирных кислот. Нормализовались аппетит и самочувствие.
Как известно, нормальная микрофлора кишечника является антагонистом кишечных паразитов. Бак-Сет Форте не только восстанавливает пищеварение, но и нормализует микробиоту кишечника. «Если бы мы не назначили пробиотик Бак-Сет Форте, возможно, ребенок страдал бы энтеробиозом еще долго. Бак-Сет Форте – универсальный пробиотик при различных нарушениях стула и аллергии и может применяться в комплексном лечении паразитарных инвазий», – отметила Т.В. Кучеря, завершая выступление.
Заключение
Мультиштаммовые пробиотические препараты оказывают комплексное воздействие в лечении функциональных нарушений ЖКТ у детей. Исследования показали, что мультиштаммовый пробиотик Бак-Сет Беби эффективен и безопасен в коррекции нарушений кишечной микробиоты у детей первого года жизни. Бак-Сет Беби – единственный мультипробиотик, обогащенный пребиотиком, разрешенный к применению у детей с первых дней жизни. На фоне его применения наблюдается тенденция к восстановлению активности облигатной толстокишечной микрофлоры в отсутствие нежелательных явлений. Таким образом, мультиштаммовый пробиотик Бак-Сет Беби может быть рекомендован к применению у детей первого года жизни для коррекции функциональных нарушений ЖКТ, возникающих на фоне введения прикорма, перевода на искусственное или смешанное вскармливание.
Единственный пробиотик, содержащий 14 штаммов пробиотических бактерий, Бак-Сет Форте предназначен для коррекции различных нарушений стула и аллергии у детей старше трех лет. Бак-Сет Форте высокоэффективен в нивелировании запоров и хронической диареи с первого дня применения, подавлении атопических и воспалительных реакций, при воспалительных заболеваниях кишечника и в комплексном лечении паразитарных инвазий у детей.
Хорошая эффективность и переносимость мультипробиотика Бак-Сет Форте позволяют рекомендовать его для внедрения в широкую педиатрическую практику.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.