Сложности диагностики и тактики ведения детей с гастроинтестинальной формой пищевой аллергии. XXIV Конгресс детских гастроэнтерологов России и стран СНГ. Сателлитный симпозиум компании «Фармамед»
- Аннотация
- Статья
- Ссылки




Многообразие клинических проявлений гастроинтестинальной пищевой аллергии у детей. Дифференциальная диагностика
Открывая симпозиум, заведующая отделением аллергологии ФГБУН «ФИЦ питания и биотехнологии», д.м.н., профессор Вера Афанасьевна РЕВЯКИНА отметила, что число больных, страдающих аллергическими заболеваниями, неуклонно растет. Пусковым фактором многих аллергических заболеваний служит пищевая аллергия. По данным статистики, в Европе пищевой аллергией страдают 11–26 млн человек. В большинстве своем это дети от рождения до пяти лет. Отмечается тенденция к увеличению числа детей старшего и подросткового возраста с проявлениями пищевой аллергии.
Пищевая аллергия влияет на формирование и последующее развитие ряда заболеваний у детей: атопического дерматита, крапивницы, ангиоотеков, аллергического ринита, бронхиальной астмы, анафилаксии и гастроинтестинальных проявлений. Проблема пищевой аллергии в XXI в. приобретает особую значимость из-за внедрения в пищевую индустрию новых технологий и появления скрытых пищевых аллергенов.
Пищевая аллергия – реакция повышенной чувствительности организма к пищевым продуктам, в основе которой лежат иммунные механизмы развития. Она отличается полиморфизмом клинических проявлений, поражает различные органы и системы и может быть Ig-Е- и не-IgE- опосредованной. Моноаллергия чаще встречается у детей первых месяцев жизни, а с возрастом может развиваться поливалентная сенсибилизация.
На данный момент официальной унифицированной классификации пищевых аллергенов не существует, поскольку практически любой пищевой продукт способен вызвать аллергическую реакцию. Выделяют пищевые аллергены растительного и животного происхождения. К наиболее распространенным аллергенам животного происхождения относят коровье молоко, яйцо, рыбу, морепродукты. Основными пищевыми аллергенами растительного происхождения считаются пищевые злаки, бобовые (арахис, соя), зонтичные (морковь, сельдерей, петрушка, укроп), пасленовые (томат, картофель, перец, кофе) культуры, фрукты (цитрусовые, банан, персик), орехи и др. Пищевую аллергию могут вызвать генетически модифицированные или комбинированные пищевые продукты, а также продукты с перекрестной реактивностью. В этой связи у детей с пищевой аллергией может определяться сенсибилизация не только к пищевым, но и другим аллергенам. Не случайно в последнее время особое значение придают изучению перекрестных реакций между пищевыми и непищевыми (пыльцевыми, эпидермальными) аллергенами. Перекрестные реакции необходимо учитывать при составлении диетических рационов.
Основными механизмами развития пищевой аллергии считаются воздействие причинно-значимых пищевых аллергенов, нарушение баланса Th1/Th2-лимфоцитов, функциональная недостаточность Т-регуляторных лимфоцитов, гиперпродукция IgE, активация иммунокомпетентных клеток (макрофагов, дендритных клеток, Th2-лимфоцитов, В-лимфоцитов, нейтрофилов), тучных клеток, эозинофилов, базофилов. В патологический процесс прямо или косвенно вовлекаются практически все органы и системы: кожный покров, глаза, верхние и нижние дыхательные пути, желудочно-кишечный тракт (ЖКТ) и др.
По мнению докладчика, в настоящее время приоритетным направлением в изучении пищевой аллергии являются выделение фенотипов, факторов риска и биомаркеров пищевой аллергии, а также персонализированная диетотерапия. Последняя подразумевает индивидуальный подход и базируется на результатах клинико-аллергологического и иммунологического и генетического обследований.
Клиническая картина гастроинтестинальных проявлений пищевой аллергии неспецифична: колики, метеоризм, боль в животе, рвота, частые и обильные срыгивания, отказ от материнского молока, тошнота у детей старшего возраста, запор, диарея, наличие слизи и крови в стуле, нарушение сна, снижение массы тела. В большинстве случаев эти симптомы вызывают коровье молоко, арахис, яйцо, рыба, морепродукты, пшеница, соя.
В основе развития гастроинтестинальных проявлений пищевой аллергии лежат IgE-опосредованные и не-IgE-опосредованные аллергические механизмы. К IgE-опосредованным гастроинтестинальным проявлениям пищевой аллергии относят оральный аллергический синдром, гастроинтестинальную анафилаксию, к клеточно-опосредованным – аллергическую энтеропатию, пищевой энтероколит, пищевой проктоколит, проктит. Смешанные IgE- и не-IgE-опосредованные реакции лежат в основе развития аллергических эозинофильных эзофагитов, гастроэнтеритов.
Такая IgE-опосредованная реакция, как гастроинтестинальная анафилаксия, развивается в течение нескольких минут или двух часов после воздействия аллергена, клинически проявляется тошнотой, рвотой, болью в животе, диареей и, как правило, ассоциирована с аллергенами белка коровьего молока, куриного яйца, рыбы, орехов, бобовых.
Оральный аллергический синдром у детей старшего возраста обычно развивается после употребления сырых свежих фруктов и овощей. Проявляется зудом, покалыванием и отеком губ, языка, неба, ротоглотки. Нередко встречается перекрестная реакция с пыльцой растений. Например, у лиц с повышенной чувствительностью к пыльце березы развитие орального аллергического синдрома может быть связано с употреблением в пищу яблок, моркови, лесного ореха, а у детей с аллергией на пыльцу амброзии – с употреблением бананов и дыни.
Аллергический эозинофильный эзофагит отмечается во всех возрастных группах. Его типичные проявления – тошнота, дисфагия, рвота, боль в эпигастральной области, раздражительность. При этом уровень общего IgE в сыворотке крови в норме или слегка повышен, а специфические IgE могут и вовсе отсутствовать.
Гастроэзофагеальный рефлюкс (ГЭР) и рефлюкс-эзофагит, как правило, выявляются у детей старшего возраста, страдающих пищевой аллергией, и по клинической картине практически не отличаются от классического ГЭР. У детей младшего возраста ГЭР обычно вызывается аллергией к белкам коровьего молока. Характерные симптомы: повторяющаяся рвота, затяжной кашель, нередко бронхообструктивный синдром, повторяющиеся пневмонии, в осложненных случаях задержка физического развития. Важным фактором риска возникновения аллергического ГЭР является наследственный отягощенный анамнез по атопии.
Аллергическая энтеропатия протекает по клеточно-опосредованному механизму и чаще манифестирует у детей старше четырех месяцев. Проявляется типичным синдромом мальабсорбции: хроническая диарея, рвота, дистрофия, большой живот. При морфологическом исследовании обнаруживаются атрофический энтерит с атрофией ворсин, гиперплазией крипт, в слизистом и подслизистом слоях повышен уровень эозинофилов.
Эозинофильный энтероколит может встречаться во всех возрастных группах, чаще у детей раннего возраста. Его клиническими признаками являются диарея, слизь в стуле с примесью крови, задержка физического развития. Кожные пробы могут быть отрицательными, а уровень IgE в норме. Дифференциальная диагностика затруднительна, в ряде случаев приходится исключать воспалительные заболевания кишечника, целиакию, кишечные инфекции.
Эозинофильный проктит встречается у детей первых месяцев жизни и может сопровождаться жидким стулом с примесью крови, развитием анемии. Эндоскопически у детей выявляются линейные эрозии, отек слизистой оболочки дистальных отделов кишечника. Результаты гистологического исследования демонстрируют признаки эозинофильной инфильтрации. Эти виды гастроинтестинальной аллергии рефрактерны к традиционной терапии, положительная динамика отмечается на фоне элиминационной диеты. При морфологическом исследовании выявляются лимфоцитарная инфильтрация, лимфоидные узлы, интерстициальный отек, эозинофильная инфильтрация собственной пластинки.
Диагностика пищевой аллергии обеспечивается комплексным использованием анамнестических, клинических, лабораторных и инструментальных методов исследования. В диагностике пищевой аллергии (особенно гастроинтестинальных проявлений) ведущую роль играет анамнез, который позволяет заподозрить развитие аллергической реакции на пищевой продукт и обосновать последующие этапы аллергологического обследования. Особое внимание следует уделять наследственному анамнезу и оценке клинических симптомов, наличию стекловидной слизи в кале, эффективности диетотерапии и антигистаминных препаратов у данной категории пациентов. Среди лабораторных методов обследования наиболее информативны общий анализ крови, исследование аллергенспецифических IgE, IgG-антител к пищевым аллергенам в сыворотке крови, определение уровня общего IgE, сывороточного и секреторного IgА.
Для диагностики пищевой аллергии европейские гастроэнтерологи используют пищевые провокационные пробы, что не разрешено к применению в нашей стране. Одним из методов диагностики является проведение тестов, оценивающих повреждения слизистой оболочки ЖКТ. Например, оценка кишечной проницаемости (тест с ксилозой, маннитолом, рамнозой), определение экскреции с калом эозинофильного катионного протеина.
Для диагностики гастроинтестинальной пищевой аллергии широко используется эзофагогастродуоденоскопия (ЭГДС) с электронно-микроскопическим исследованием биоптатов слизистой оболочки пищевода, желудка и тонкой кишки.
Профессор В.А. Ревякина отметила, что запоздалая диагностика пищевой аллергии приводит к назначению неадекватной терапии, неправильному применению смесей для вскармливания детей первых месяцев жизни, назначению голодных диет и развитию белково-энергетической недостаточности, анемии и низкому качеству жизни.
Наиболее частыми диагнозами, с которыми в клинической практике приходится дифференцировать признаки гастроинтестинальной пищевой аллергии у детей, являются лактазная недостаточность, целиакия, болезнь Крона, неспецифический язвенный колит и ферментопатия.
Алгоритм современной терапии гастроинтестинальных проявлений пищевой аллергии у детей должен учитывать этиологические факторы, особенности клинических симптомов и патогенетических механизмов.
С давних пор для лечения пищевой аллергии у детей используется диетотерапия. В зависимости от механизма развития гастроинтестинальных проявлений применяют элиминационную или ротационную диетотерапию. Основным методом лечения пищевой аллергии остается элиминационная диета с исключением причинно-значимого аллергена с адекватной заменой специализированными продуктами. В основе диетотерапии пищевой аллергии лежит индивидуальный подход к назначению лечебного питания у детей с учетом возраста, аппетита, характера сенсибилизации, степени нарушения пищевого статуса, толерантности к пищевым нагрузкам. При этом важную роль в диетотерапии играют щадящая кулинарная обработка продуктов и постепенное расширение рациона за счет переносимых продуктов в период ремиссии.
Из медикаментозных методов терапии гастроинтестинальных проявлений пищевой аллергии у детей младшего возраста активно применяют антигистаминные препараты, пероральные формы кромогликата натрия, кетотифен. Системные глюкокортикостероиды (ГКС) могут назначаться при тяжелых гастроинтестинальных проявлениях пищевой аллергии. Среди приоритетных направлений в терапии гастроинтестинальной пищевой аллергии рассматривается возможность применения биологической терапии – анти-интерлейкин-5-антителами (меполизумаб), а также анти-IgЕ-терапии (омализумаб).
Для коррекции дисбиотических изменений у детей с аллергией используют пробиотики. Определенные пробиотические штаммы продемонстрировали эффективность в профилактике аллергических проявлений, уменьшении риска развития антибиотик-ассоциированной диареи, ротавирусной инфекции и др. По данным наблюдений за детьми, рожденными от матерей, придерживавшихся рекомендованных рационов питания во время беременности, кумулятивная частота развития атопического дерматита к шести месяцам была достоверно ниже в группе детей, матери которых в период беременности получали гипоаллергенную диету и пробиотик с содержанием Lactobacillus reuteri (по сравнению с контрольной группой).
В этой связи целесообразно использование мультиштаммового пробиотика нового поколения Бак-Сет (Великобритания), содержащего несколько видов лактобацилл, бифидобактерий и термофильного стрептококка. Пробиотик Бак-Сет (Бак-Сет Беби, Бак-Сет Форте) используется для профилактики аллергии у детей с высоким риском развития атопии с целью индукции оральной толерантности, а также коррекции гастроинтестинальных проявлений пищевой аллергии.
Современные подходы к ведению и лечению больных с гастроинтестинальными проявлениями пищевой аллергии
Симпозиум продолжила врач-аллерголог, старший научный сотрудник отделения аллергологии ФГБУН «ФИЦ питания и биотехнологии», к.м.н. Инна Анатольевна ЛАРЬКОВА. Ее доклад был посвящен тактике ведения детей с гастроинтестинальными проявлениями пищевой аллергии.
По словам докладчика, пищевая аллергия – это междисциплинарная проблема, требующая совместных усилий таких специалистов, как педиатр, гастроэнтеролог, аллерголог, диетолог, терапевт, семейный врач. Ведение больных с гастроинтестинальными проявлениями пищевой аллергии в клинической практике связано с трудностями точной верификации диагноза и установления причинно-значимого фактора. Не случайно сегодня применяется не только гипердиагностика клинически незначимых реакций, зачастую не имеющих отношения к пищевой аллергии, но и гиподиагностика истинной пищевой аллергии, даже с развитием тяжелых реакций. В ряде случаев гастроинтестинальные проявления не распознаются или оцениваются неправильно в течение длительного периода. В практике педиатра часто встречаются такие диагнозы, как дисбиоз и лактазная недостаточность. Кроме того, существует терминологическая путаница, когда объединяются понятия пищевой аллергии и пищевой непереносимости (вместо термина «непереносимость» в настоящее время предложен термин «интолерантность»). Нужно понимать, что пищевая интолерантность – это неаллергическая гиперчувствительность к пищевым ингредиентам, тогда как основа пищевой аллергии всегда иммунный ответ на контакт с аллергеном.
Сегодня нет единого общепризнанного диагностического теста пищевой аллергии. Двойная слепая плацебоконтролируемая провокационная проба, являющаяся золотым стандартом диагностики пищевой аллергии, в России не проводится. Поэтому в диагностический алгоритм пищевой аллергии входят сбор аллергологического анамнеза, оценка жалоб и клинического статуса, назначение элиминационной диеты, проведение провокационных проб (попытка введения в рацион подозреваемого продукта), лабораторные исследования (клинический анализ крови, определение уровня общего и специфического IgE, копрология), постановка кожных проб (в период ремиссии заболевания), эзофагогастродуоденоскопия (ЭГДС) и колоноскопия с биопсией.
Врач должен обращать внимание на такие симптомы, как колики, метеоризм, срыгивание, рвота, отрыжка воздухом, диарея, запор, характер стула (непереваренный, наличие слизи, крови, стеаторея), беспокойство, плач, плохой сон, отказ от еды, плохая прибавка массы тела, отставание в росте. При этом у каждого больного с пищевой аллергией перечисленные симптомы могут быть разной степени интенсивности.
При сборе анамнеза детей с подозрением на пищевую аллергию особое значение придается семейному и личному аллергологическому анамнезу. Необходимо уточнить причинно-значимую связь развития симптомов с тем или иным продуктом, первые проявления, время от приема до начала развития реакции, частоту и постоянство симптомов при употреблении в чистом виде или в составе других продуктов, длительность симптомов, результаты элиминационных диет, а также наличие предшествующих инфекционных состояний и характер лечения (особенно антибактериальные препараты и бактериофаги).
При диагностике IgE-опосредованной пищевой аллергии данные анамнеза считаются первоочередными. Кроме того, аллерголог использует кожные пробы (кожные скарификационные пробы, прик-тесты), которые служат важным инструментом диагностики пищевой аллергии для выявления причинно-значимого аллергена (как и сенсибилизации в целом) и степени сенсибилизации к нему. Однако результаты кожного тестирования зависят от качества выполнения процедуры, качества аллергенов и наличия предшествующей или текущей терапии (антигистаминные препараты, системные или местные ГКС, антидепрессанты) и могут быть как ложноположительными, так и ложноотрицательными. То же можно сказать и о диагностике in vitro: уровень специфических IgE отражает уровень сенсибилизации. Докладчик подчеркнула, что отсутствие специфических IgE-антител не исключает диагноз пищевой аллергии. Поэтому анализ всех результатов аллергологического обследования, как кожных проб, так и лабораторных обследований, возможен только в контексте анализа врачом анамнестических и клинических данных.
При диагностике не-IgE-опосредованной пищевой аллергии сохраняют актуальность данные анамнеза, диетологические методы диагностики, такие как элиминационная диета и провокационная проба, а также результаты эндоскопических и гистологических исследований. Традиционное аллергологическое обследование (кожные пробы, уровень специфических IgE), как правило, в данной ситуации неинформативно. Наличие сходных по клиническим проявлениям IgE-опосредованных и не-IgE-опосредованных реакций гиперчувствительности к различным пищевым белкам, а также отсутствие доступных в повседневной практике методов диагностики не-IgE-опосредованной пищевой аллергии затрудняют диагностический поиск. Таким образом, диагностика пищевой аллергии остается трудной задачей из-за отсутствия методов, позволяющих выявлять многообразие всех механизмов аллергических реакций, лежащих в основе пищевой аллергии.
Основным терапевтическим мероприятием при пищевой аллергии является диетотерапия, включающая элиминацию причинно-значимого продукта, адекватную замену исключенного продукта, коррекцию рациона по микронутриентам при индивидуальных сроках соблюдения диеты. Можно сказать, что проблема пищевой аллергии уникальна, ведь речь идет, наверное, о единственном аллергическом заболевании, при котором диета является как основной (а иногда и единственной) диагностической, так и лечебной стратегией. При этом диетотерапия включает несколько этапов. Диагностическая элиминационная диета при положительной динамике клинических симптомов на фоне исключения из пищевого рациона подозреваемого продукта позволяет подтвердить наличие аллергии к нему (продолжительность от двух до шести недель). Лечебная элиминационная диета с исключением всех выявленных причинно-значимых пищевых аллергенов и триггерных факторов проводится в течение шести месяцев и более (в случае тяжелых аллергических реакций). Особую роль в этом могут сыграть результаты молекулярной аллергодиагностики, которая хотя и не является активным диагностическим инструментом в руках аллерголога, но может помочь в выявлении маркеров тяжелых реакций у пациента, а значит, и необходимости удлинения сроков лечебной элиминационной диеты. На заключительном этапе диетотерапии (в период ремиссии) врач предпринимает попытки расширить пищевой рацион. Важно понимать, что из рациона исключаются только причинно-значимые продукты, а не все потенциально
опасные.
Как известно, основным триггером пищевой аллергии в раннем возрасте являются белки коровьего молока. Если ребенок находится на естественном вскармливании, необходимо максимально долго сохранять грудное вскармливание при соблюдении матерью строгой безмолочной диеты. При искусственном вскармливании ребенку назначают смеси на основе полного гидролиза белка или аминокислотные смеси (в зависимости от тяжести клинических проявлений). Не назначаются гипоаллергенные смеси, смеси на основе козьего молока, кисломолочные, соевые смеси. Памятуя о белке коровьего молока как основном аллергене, врач не должен забывать о других распространенных аллергенах, прежде всего таких, как глютен, яйцо, соя, дрожжи.
Фармакотерапия заболевания предусматривает применение антигистаминных препаратов, системных и топических ГКС, мембраностабилизаторов (кетотифен, кромогликат натрия), энтеросорбентов, пробиотиков, пребиотиков, симбиотиков. В современной клинической практике для лечения гастроинтестинальных проявлений пищевой аллергии (в частности, эзофагита) применяют также монтелукаст, омализумаб, реслизумаб.
И.А. Ларькова подробно рассмотрела вопрос применения про- и пребиотиков в целях профилактики и лечения аллергических заболеваний.
Пробиотики представляют собой активные бактериальные штаммы. Пребиотики – «еда» для полезных бактерий, они метаболизируются только бактериями кишечника и способствуют повышению активности пробиотиков. Симбиотики – комбинации пре- и пробиотиков. Классификации пробиотиков основаны на количестве микроорганизмов, входящих в препарат, их родовой принадлежности или наличии дополнительных компонентов в составе препарата.
Эксперты Всемирной организации по аллергии рекомендуют употребление пробиотиков беременным, кормящим матерям с высоким риском развития аллергии, а также младенцам с высоким риском развития аллергии для профилактики атопического дерматита.
По данным многочисленных исследований, сбалансированная комбинация пробиотических микроорганизмов (Bifidobacterium, Lactobacillus, Lactococcus lactis и Streptococcus thermophilus) способствует модуляции иммунного ответа.
На отечественном фармацевтическом рынке представлен мультиштаммовый пробиотик Бак-Сет Беби, в состав которого входят семь пробиотических штаммов в титре 109 (L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, S. thermophilus), а также фруктоолигосахариды в качестве пребиотиков. Все штаммы, входящие в состав препарата, имеют оригинальное происхождение, включены в перечень европейского качества, что доказывает высокий уровень безопасности. Щадящая технология производства препарата позволяет сохранить невредимой клеточную стенку бактерий и таким образом повысить их жизнеспособность и устойчивость в кислой среде.
Большой интерес вызывают работы по изучению эффективности пробиотиков в профилактических и терапевтических схемах лечения аллергических заболеваний. На базе клиники ФГБУН «ФИЦ питания и биотехнологии» проводится рандомизированное открытое сравнительное клинико-иммунологическое исследование эффективности и безопасности препарата Бак-Сет Беби при пищевой аллергии (гастроинтестинальные и кожные проявления) у детей раннего возраста. Целями исследования являются оценка клинической эффективности и безопасности применения указанного пробиотика, а также возможности контроля аллергического воспаления и индукции пищевой толерантности у детей с пищевой аллергией. В исследовании участвуют 80 пациентов от шести месяцев до трех лет с пищевой аллергией. 50 детей составляют основную группу (препарат Бак-Сет Беби на фоне диетотерапии и стандартной фармакотерапии), 30 – группу сравнения (диетотерапия и стандартная фармакотерапия).
В вводном периоде наблюдения в течение одного месяца всем детям назначалась диета, далее в течение 20 дней дети основной группы получали препарат Бак-Сет Беби.
Изучив динамику гастроинтестинальных и кожных проявлений пищевой аллергии, исследователи пришли к выводу, что включение в комплексное лечение детей с гастроинтестинальными и кожными проявлениями пищевой аллергии мультиштаммового пробиотика Бак-Сет Беби обеспечило повышение эффективности диетотерапии и общепринятой фармакотерапии.
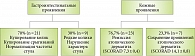
На рисунке 1 представлена динамика гастроинтестинальных и кожных проявлений пищевой аллергии у 50 детей основной группы на фоне применения пробиотика. Как видно, у 94% детей отмечалось купирование гастроинтестинальных симптомов, у 90% – ремиссия кожных проявлений. В то же время в контрольной группе (рис. 2) лишь 70% детей отмечали улучшение гастроинтестинальных проявлений. У 76,7% детей наблюдалась ремиссия атопического дерматита.
В ходе исследования зафиксирована высокая эффективность и безопасность мультиштаммового пробиотика Бак-Сет Беби у детей с пищевой аллергией. Клиническое исследование в настоящий момент продолжается.
Гастроинтестинальная пищевая аллергия: трудный диагноз. Клинический разбор больных
Сотрудник отделения аллергологии клиники ФГБУН «ФИЦ питания и биотехнологии» Валерий Алексеевич МУХОРТЫХ продемонстрировал клинические примеры дифференцированной диагностики и лечения детей с гастроинтестинальными проявлениями пищевой аллергии. В повседневной клинической практике родители, как правило, обращаются с такими жалобами, как метеоризм, беспокойный сон, замедление прибавки массы тела и роста, запоры, диарея, высыпания на коже, боль в животе, срыгивание, колики, неустойчивый характер стула у детей. Зачастую педиатры не распознают гастроинтестинальные проявления пищевой аллергии, ставят диагнозы дисбактериоза кишечника, лактазной недостаточности, функциональных нарушений ЖКТ. В связи с этим необоснованно отменяется грудное вскармливание, назначаются безлактозные, кисломолочные, соевые смеси.
Клинический случай 1. Девочка, пять месяцев. Жалобы на срыгивания после каждого кормления, вздутие живота, запоры до трех-четырех дней, стул с примесью слизи. Из анамнеза жизни: ребенок от первой физиологически протекавшей беременности, роды путем кесарева сечения (тазовое предлежание). Наследственность по аллергическим заболеваниям отягощена – у матери атопический дерматит, у отца – поллиноз. Из анамнеза заболевания: с первого месяца жизни ребенок находился на смешанном вскармливании – грудное молоко и смесь на основе цельных белков коровьего молока. На фоне данного рациона у ребенка наблюдались обильные срыгивания после каждого кормления. Мать не соблюдала диету. Со второго месяца жизни ребенка родители стали отмечать повышенное газообразование, запоры до трех-четырех дней, слизь в стуле. Замена смеси на антирефлюксную, по рекомендации педиатра, результата не дала.
Девочка была госпитализирована в отделение аллергологии ФГБУН «ФИЦ питания и биотехнологии». При обследовании: в общем анализе крови – эозинофилия (8%), общий анализ мочи, биохимический анализ крови – в норме, иммунологический анализ крови – уровни IgA, G, M в норме, IgЕ повышен (122 МЕ/мл). Ультразвуковое исследование (УЗИ) органов брюшной полости показало вторичные изменения поджелудочной железы, повышенное газообразование в кишечнике. Копрология: умеренная стеаторея, умеренное количество слизи, единичные лейкоциты. Специфические IgЕ-антитела к белкам коровьего молока – 12,5 МЕ/мл (3-й класс аллергии). С учетом результатов анализов ребенку заменили смесь лечебной смесью на основе глубокогидролизованного молочного белка. Кроме того, назначен пробиотик Бак-Сет Беби с положительным эффектом – срыгивания купировались, стул стал ежедневным без патологических примесей.
Диагноз: пищевая аллергия (аллергия к белкам коровьего молока).
Клинический случай 2. Девочка, четыре года. Жалобы на метеоризм, постоянное вздутие живота, плохой аппетит, колики, отрыжку, неприятный запах изо рта, отсутствие прибавки в весе. Из анамнеза жизни: ребенок от второй беременности, протекавшей на фоне анемии в первых двух триместрах, маловодия в третьем триместре, первых срочных самостоятельных родов. При введении кисломолочных продуктов у ребенка в девять месяцев наблюдались явления периорального дерматита. Наследственность по аллергическим заболеваниям отягощена – у матери поллиноз. При обследовании в отделении аллергологии ФГБУН «ФИЦ питания и биотехнологии» в общем анализе крови наблюдалась эозинофилия; общий анализ мочи, биохимия, протеинограмма – в норме, иммунологический анализ крови в пределах нормы, уровень общего IgЕ значительно повышен (623 МЕ/мл – при норме до 100). По данным УЗИ органов брюшной полости – признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. Антитела к трансглутаминазе в норме, анализ крови на гельминты, простейшие – отрицательный, углеводы в кале в норме, панкреатическая эластаза в кале – в норме. Результаты копрологии: стеаторея, умеренное количество слизи, мыла, обнаружен крахмал. При исследовании в крови уровня IgЕ к пищевым аллергенам выявлена максимальная степень сенсибилизации к глютену (+4), сенсибилизация к белкам коровьего молока не установлена.
Исходя из результатов лабораторных и инструментальных исследований, ребенку назначили диагностическую безглютеновую диету в течение месяца с возвращением к молочным продуктам и пробиотик Бак-Сет Беби. Во время контрольного осмотра через месяц отмечалась положительная динамика: ребенок стал прибавлять в весе, боль в животе не беспокоила, вздутие существенно уменьшилось. Было решено продолжить данную диету еще шесть месяцев. Курс пробиотиков также был продлен.
Диагноз: пищевая аллергия (аллергия к глютену).
Клинический случай 3. Мальчик, девять месяцев. Жалобы на срыгивание, метеоризм, неустойчивый стул, эпизодически разжиженный, высыпания на коже, сопровождающиеся зудом. Наследственность по аллергическим заболеваниям отягощена – у отца реакция на пыль и лекарственная непереносимость, у сестры отца – атопический дерматит. Ребенок от первой беременности, протекавшей на фоне слабости родовой деятельности. Роды первые, путем кесарева сечения. К груди был приложен в первые сутки, грудное вскармливание в течение двух недель, до четырех с половиной месяцев – смешанное вскармливание. Далее ребенок переведен на искусственное вскармливание различными смесями (Семпер, Нутрилон Комфорт, Симилак Премиум, Хумана ГА и др.). Прикорм введен с шести месяцев. Отмечалась удовлетворительная переносимость кабачков. При использовании остальных продуктов прикорма даже в малых количествах наблюдались высыпания.
С рождения частые срыгивания, колики, метеоризм, сохранявшиеся до шести месяцев. С первого месяца жизни отмечались распространенные высыпания без зуда, что было расценено педиатром как аллергическая реакция на питание матери. Была рекомендована строгая безмолочная диета кормящей матери, однако ребенку назначались молочные смеси, которые из-за отсутствия положительной динамики как со стороны кожи, так и со стороны гастроинтестинальных проявлений постоянно менялись. При переходе на гипоаллергенную смесь состояние ребенка ухудшалось. В шесть месяцев ввели смесь на основе полного гидролиза молочного белка (Фрисопеп АС), на фоне применения которой отмечалось улучшение состояния кожи, уменьшение гастроинтестинальных проявлений. Через месяц было зафиксировано незначительное ухудшение состояния кожных покровов, в связи с чем педиатр рекомендовал замену смеси на аминокислотную смесь, которую ребенок получает по настоящее время. На фоне применения аминокислотной смеси отмечались полное купирование кожных проявлений и улучшение гастроинтестинальных проявлений. При этом расширить питание не представлялось возможным. При попытках введения каш (гречневой, рисовой, кукурузной), мяса обострялся кожный процесс. В качестве прикорма получал только кабачок в малых количествах.
В семь с половиной месяцев мальчик обследован на дисбактериоз. Получал терапию бактериофагами, курс ферментотерапии (Креон) без положительного эффекта.
При обследовании в отделении аллергологии ФГБУН «ФИЦ питания и биотехнологии» в общем анализе крови – эозинофилия, протеинограмма – снижена глобулиновая фракция 11,1 г/л (норма 20–35). В иммунологическом анализе крови снижены уровни IgA, G и M, уровень общего IgЕ повышен (232 МЕ/мл при норме до 100). По данным УЗИ органов брюшной полости – признаки вторичных изменений поджелудочной железы, S-образная деформация желчного пузыря. Копрология: умеренная стеаторея, умеренное количество слизи, крахмал, единичные лейкоциты. При исследовании специфических IgЕ-антител к белкам коровьего молока, глютену, капусте белокочанной, кабачку, баранине, кролику, индейке, кукурузе, гречихе и рису – нулевой класс аллергии.
В период госпитализации ребенка предпринимались попытки расширить рацион за счет введения индейки, кролика, гречневой каши. Но даже на малую дозу продуктов (5–10 г) появлялась мгновенная реакция в виде усиления кожных и гастроинтестинальных проявлений. После консультации врача-иммунолога в НИИ иммунологии был заподозрен первичный иммунодефицит, что потребовало дообследования – контроль уровней IgA, G, M через три месяца с последующим решением вопроса о дальнейшей тактике лечения. Из-за подозрения на иммунодефицит ребенок должен наблюдаться в специализированном отделении. Расширение рациона возможно на фоне проведения патогенетической терапии.
Диагноз: первичный иммунодефицит.
Клинический случай 4. Мальчик, один год четыре месяца. Жалобы на боль и вздутие живота, слабость, плохой стул с непереваренными остатками пищи и слизи, высыпания, не сопровождающиеся зудом. Наследственность по аллергическим заболеваниям отягощена – у матери и ее родной сестры поллиноз. Ребенок от первой беременности, протекавшей физиологически, самостоятельных родов. Грудное вскармливание до одного месяца, далее – искусственное вскармливание (Симилак) до одного года двух месяцев. Прикорм с шести месяцев – реакций не отмечалось.
В год два месяца появились жалобы на сильное вздутие живота. После обращения родителей ребенка в больницу г. Ростова последовала госпитализация в инфекционное отделение с диагнозом «острый неуточненный энтероколит, тяжелая форма с токсико-эксикозом, дисферментоз». После трех курсов антибактериальных препаратов состояние ухудшилось: усилилось вздутие живота, появился жидкий стул со слизью и непереваренными остатками пищи до 15 раз в сутки. На фоне обезвоживания мальчик находился в отделении реанимации, где была продолжена антибиотикотерапия и проведена коррекция питания. Смесь Симилак отменили. После отмены смеси стул нормализовался, вздутие живота уменьшилось, однако сохранились примеси слизи и непереваренных остатков пищи в кале. Была рекомендована коррекция питания: безмолочные каши, фрукты. Вздутие живота сохранялось.
Ребенку провели ЭГДС, по результатам которой был установлен умеренно выраженный дуоденит, а при гистологическом исследовании фрагментов тощей кишки – хронический выраженный еюнит. Такая клиническая картина характерна для синдрома мальабсорбции.
На фоне лечения (безглютеновая безмолочная диета, инфузионная терапия глюкозо-солевыми растворами с включением новокаина, Но-шпа, преднизолон, дексаметазон, Макмирор, Креон, Эспумизан, Мотилиум) отмечалась положительная динамика – вздутие живота уменьшилось, ребенок стал спокойнее, прибавил в весе 500 г. Стул кашицеобразный со слизью, небольшим количеством непереваренной пищи. Из-за сохранения жалоб на гастроинтестинальные нарушения ребенок был госпитализирован в отделение аллергологии ФГБУН «ФИЦ питания и биотехнологии».
При комплексном обследовании были выявлены положительные антитела IgА к трансглутаминазе (высокие уровни). Уровень общего IgЕ – 13 МЕ/мл. При исследовании уровня специфических IgЕ-антител к пищевым аллергенам сенсибилизация к белкам коровьего молока, глютену не была выявлена. Содержание углеводов, кальпротектина в кале в норме. Копрология: стеаторея, мыла, крахмал, умеренное количество клетчатки. По данным УЗИ – признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. Данные ЭГДС с биопсией тонкой кишки (повторно) – структура слизистой оболочки тощей кишки характерна для нелеченой целиакии. Ребенку была назначена пожизненная безглютеновая диета с возвращением в рацион молочных продуктов. Через месяц при контрольном осмотре на фоне строгой безглютеновой диеты родители отметили существенное улучшение состояния: колики не беспокоили, стул стал ежедневным без патологических примесей.
Диагноз: целиакия.
Клинический случай 5. Мальчик, семь лет. Жалобы на периодическую боль в животе, отрыжку, эпизодически рвоту, метеоризм, неприятный запах изо рта, изменения в копрограмме (стеаторея). Наследственность по аллергическим заболеваниям отягощена: у отца – пищевая аллергия, лактазная недостаточность, до настоящего времени непереносимость молока, у бабушки по материнской линии – бронхиальная астма. У ребенка с года отмечались колики, неоформленный стул со слизью и непереваренными частичками пищи, выраженная стеаторея, метеоризм, что расценивалось педиатром как синдром мальабсорбции. Неоднократно заменяли одну молочную смесь другой без положительного эффекта. Был переведен на вскармливание гидролизатами, на фоне чего симптомы со стороны ЖКТ сохранялись. В девять месяцев на фоне гастроинтестинальных проявлений, стеатореи, снижения уровня эластазы в кале ребенок был обследован на муковисцидоз. Потовая проба – отрицательная. Был исключен также диагноз целиакии. До пяти лет неоднократно обследовался на предмет исключения муковисцидоза, синдрома Швахмана – Даймонда, что, однако, не подтверждалось. Со слов матери, улучшение состояния наблюдалось на фоне приема ферментов, при их отмене состояние резко ухудшилось. Неоднократно госпитализировался в разные стационары с синдромом мальабсорбции, исключались неспецифический язвенный колит, болезнь Крона. Диагноз пищевой аллергии не установлен. В пять лет ребенок впервые попал к аллергологу. Проведено аллергологическое обследование: специфические IgЕ-антитела к белку коровьего молока, гречке, свинине, картофелю, груше, кролику, желтку, капусте – не обнаружены. Тем не менее аллерголог принял решение о назначении безмолочной диеты, на фоне чего жалобы разной интенсивности сохранялись. Ребенок был направлен на консультацию в отделение аллергологии ФГБУН «ФИЦ питания и биотехнологии».
При обследовании выявлен повышенный уровень IgЕ – 303 МЕ/мл. По данным УЗИ органов брюшной полости – признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. Экспресс-тест на целиакию отрицательный. Данные копрологии: стеаторея, мыла, крахмал, умеренное количество клетчатки. При исследовании сыворотки крови на уровень специфических IgЕ-антител к пищевым аллергенам установлена высокая степень сенсибилизации к глютену. Сенсибилизация к коровьему молоку, гречке, рису, индейке, баранине, свинине, кролику не обнаружена.
С учетом результатов анализов ребенку назначили диагностическую безглютеновую диету в течение месяца, в рацион постепенно возвращали молочные продукты. Через месяц при контрольном осмотре на фоне строгой безглютеновой диеты родители отмечали существенное улучшение: боли в животе не беспокоили, стул стал ежедневным без патологических примесей. Было рекомендовано продолжить диетотерапию до шести месяцев. Следует отметить, что в этой семье у младшего брата в возрасте одного года шести месяцев с выраженными проявлениями атопического дерматита и небольшими гастроинтестинальными проявлениями в виде неустойчивого стула мать самостоятельно (до консультации аллерголога) исключила глютен из питания ребенка и получила выраженный положительный эффект.
Диагноз: пищевая аллергия (аллергия к глютену).
Эозинофильный эзофагит. Реалии сегодняшнего дня
По мнению профессора кафедры аллергологии и клинической иммунологии Российского университета дружбы народов, д.м.н. Дали Шотаевны МАЧАРАДЗЕ, вопросам диагностики и лечения эозинофильных гастроинтестинальных заболеваний уделяется незаслуженно мало внимания в специальной литературе. Кроме того, имеет место гиподиагностика эозинофильных гастроинтестинальных заболеваний. Эти заболевания характеризуются эозинофильной инфильтрацией ткани ЖКТ в отсутствие другой очевидной причины эозинофилии. Сегодня классификация пищевой аллергии включает гастроинтестинальные заболевания эозинофильной этиологии.
Эозинофильный эзофагит – самая распространенная патология из эозинофильных гастроинтестинальных заболеваний. Реже встречаются эозинофильный гастрит и эозинофильный энтерит и колит. Эозинофильный эзофагит – хроническое, иммунное/антигенопосредованное заболевание пищевода, характеризующееся симптомами пищеводной дисфункции, а гистологически – преимущественно эозинофильным воспалением.
В западных странах распространенность эозинофильного эзофагита оценивается примерно в 4,4–9,5 случая на 100 000 человек. В отечественной литературе таких данных очень мало. Среди городского населения заболевание регистрируется чаще, чем среди сельских жителей. Среди больных с установленным диагнозом эозинофильного эзофагита преобладают лица мужского пола (76% взрослых и 66% детей). Описаны семейные кластеры, хотя точное расположение локусов неизвестно. Недавно появилось сообщение о высокой распространенности эозинофильного эзофагита среди детей с нарушениями соединительной ткани. При наблюдении 425 детей с пищевой аллергией на молоко, яйцо, пшеницу и сою в общей сложности у 17 из них в дальнейшем развился эозинофильный эзофагит. Продукт считался причиной эозинофильного эзофагита, если при его исключении из рациона симптомы заболевания купировались, а повторное введение приводило к их возобновлению. Наиболее распространенными триггерами эозинофильного эзофагита в данной подгруппе детей были молоко, яйцо, пшеница, соя. Кроме того, 94% из них страдали различными аллергическими заболеваниями. Спустя три-четыре года у ряда пациентов, которые «переросли» пищевую аллергию, может развиться эозинофильный эзофагит как реакция на те же самые аллергенные продукты.
Симптомы эозинофильного эзофагита и гастроэзофагеальной рефлюксной болезни (ГЭРБ) во многом совпадают, поэтому дифференциальная диагностика этих заболеваний весьма затруднительна. Как известно, при ГЭРБ доказана эффективность ингибиторов протонной помпы (ИПП). Золотой стандарт диагностики эозинофильного эзофагита подразумевает наличие не менее 15 эозинофилов в поле зрения в образцах биопсии пищевода, взятой из нескольких мест при ЭГДС через восемь недель терапии максимальной дозой ИПП.
В патогенезе эозинофильного эзофагита ведущая роль принадлежит Th2-иммунному ответу. Дополнительный ответ регулируется провоспалительными цитокинами. В крови больных обнаруживаются повышенные уровни интерлейкина (ИЛ) 1-альфа, 6 и 8, но более низкие уровни ИЛ-12, 17 и СD40L (по сравнению со здоровыми лицами). Доказана тесная связь между эозинофильным эзофагитом и атопическими заболеваниями (бронхиальная астма, аллергический ринит и атопический дерматит).
Симптомы эозинофильного эзофагита зависят от возраста. Для новорожденных и детей первых трех лет жизни характерно разнообразие неспецифических жалоб: частый отказ от еды, срыгивание, рвота, боль в животе. Дети более старшего возраста указывают на снижение аппетита, ощущение инородного тела в горле, зуд, першение в горле, боль в животе. У подростков и взрослых преобладают дисфагия и затрудненное глотание, загрудинные боли. Пациенты описывают дисфагию как ощущение затруднения глотания твердой и/или жидкой пищи. Ротоглоточная дисфагия наблюдается при нервно-мышечных расстройствах (инсульт, паркинсонизм), а также сухости слизистой оболочки, вызванной воздействием препаратов или лучевой терапии. Кроме эозинофильного эзофагита пищеводная дисфагия обычно связана с анатомическими дефектами пищевода (в том числе ГЭРБ) и расстройствами моторики. У больных дисфагией наиболее распространенной причиной является эозинофильный эзофагит.
Для диагностики эозинофильного эзофагита нужно учитывать наличие симптомов дисфункции пищевода, гистологически подтвержденный уровень эозинофилов свыше 15 в поле зрения. Поскольку типичные клинические симптомы эозинофильного эзофагита, такие как дисфагия, изжога и боль в груди, очень схожи с таковыми ряда других заболеваний, прежде всего ГЭРБ, необходимо учитывать и критерии исключения. По рекомендации экспертов для подтверждения диагноза эозинофильного эзофагита больным следует назначить повторную морфологическую оценку биоптатов пищевода после двухнедельного курса лечения ИПП.
Дифференциальная диагностика усложняется тем, что клинические признаки эозинофильного эзофагита – дисфагия и эозинофилия пищевода могут сопровождать ГЭРБ, болезнь Крона, заболевания сосудов, инфекционный и медикаментозный эзофагит, эозинофильный гастроэнтерит и злокачественные новообразования пищевода. Поэтому диагностика эозинофильного эзофагита одновременно требует подтверждения исследованием биоптатов слизистой оболочки пищевода и обязательного исключения других заболеваний, прежде всего ГЭРБ. Осмотр врача и стандартные лабораторные анализы, как правило, не выявляют каких-либо выраженных нарушений, за исключением легкой эозинофилии периферической крови и повышения уровня общего IgE.
Верхняя эндоскопия является первым диагностическим шагом при исследовании всех пациентов с дисфагией. При подозрении на эозинофильный эзофагит проведение биопсии обязательно, даже если слизистая оболочка нормальная или у больного имеются другие потенциальные причины дисфагии. Эксперты рекомендуют от двух до четырех биопсий из проксимального и дистального отделов пищевода. В одном из исследований получение трех биоптатов из разных мест пищевода позволило правильно диагностировать эозинофильный эзофагит почти в 97% случаев. 100%-ной диагностической чувствительности у взрослых позволяет достичь исследование не менее пяти биоптатов: из дистальной части (5 см выше желудочно-пищеводного перехода), середины пищевода (10 см выше желудочно-пищеводного перехода) и проксимальной части (5 см ниже верхнего сфинктера пищевода).
Классификация эозинофильного эзофагита включает такие основные параметры, как кольца, борозды, экссудат, отек, а также дополнительные эндоскопические параметры пищевода (сужение его калибра, подвижные кольца, стриктура и ранимость слизистой оболочки пищевода). Таким образом, наиболее характерные признаки заболевания разделены на две категории – протекающие с воспалением и фиброзными изменениями. Отличительной эндоскопической особенностью фиброзного воспаления при эозинофильном эзофагите считаются кольца, стриктуры и слизистая оболочка типа папиросной бумаги.
В настоящее время обнаружен новый фенотип эозинофильного эзофагита. Речь идет о пациентах, которые имеют пищеводную эозинофилию и позитивно реагируют на лечение ИПП снижением количества эозинофилов в ткани пищевода. Такие больные, как правило, имеют типичные симптомы эозинофильного эзофагита, а при исключении ГЭРБ – положительный клинико-морфологический ответ на восьминедельный курс лечения ИПП в высоких дозах (20–40 мг, аналогично схеме лечения эрозивного эзофагита). Патогенез нового фенотипа заболевания связывают с нарушением эпителиального барьера и дальнейшей активацией иммунных механизмов.
Профессор Д.Ш. Мачарадзе отметила, что лечение эозинофильного эзофагита представляет собой непростую задачу, особенно в педиатрической практике. Согласно современным представлениям, первым терапевтическим шагом является элиминационная диета с исключением из рациона больного эозинофильным эзофагитом шести наиболее распространенных продуктов: молока, яйца, пшеницы, сои, арахиса, моллюсков и ракообразных. Из медикаментозных средств терапии для лечения эозинофильного эзофагита применяют топические ГКС, которые значительно снижают синтез факторов роста эозинофилов и индуцируют апоптоз эозинофилов. Топические ГКС, иммунодепрессанты и биологические агенты назначают детям и взрослым для индукции ремиссии и в качестве поддерживающей терапии. При необходимости больным эозинофильным эзофагитом проводят хирургическое лечение – дилатацию пищевода.
Правильная клиническая диагностика в сочетании с исследованием биоптата ткани пищевода и других лабораторных методов (в том числе аллергологического обследования) обеспечивает эффективность терапии эозинофильного эзофагита.
Заключение
Мультиштаммовые пробиотики Бак-Сет Беби и Бак-Сет Форте (Probiotics Int., Великобритания) зарекомендовали себя как эффективное и безопасное средство для коррекции нарушений кишечной микробиоты у детей разного возраста.
Бак-Сет Беби разрешен к применению у детей с первых дней жизни. В его состав входят L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, S. thermophilus, а также фруктоолигосахариды в качестве пребиотиков. На фоне применения Бак-Сет Беби наблюдается тенденция к восстановлению активности облигатной толстокишечной микрофлоры в отсутствие нежелательных явлений. Входящие в состав пробиотического комплекса бактерии нормализуют баланс микрофлоры кишечника, положительно влияют на иммунитет и способствуют формированию оральной толерантности.
Бак-Сет Форте предназначен для коррекции нарушений стула и подавления атопических и воспалительных реакций у детей старше трех лет. В его состав входят 14 штаммов пробиотических бактерий, которые благодаря высоким концентрациям достигают толстого кишечника без потери активности и жизнеспособности.
Применение мультиштаммовых пробиотических препаратов Бак-Сет Форте и Бак-Сет Беби помогает эффективно восстановить баланс микрофлоры кишечника, нормализовать пищеварение у детей при запорах, приеме антибиотиков, кишечных инфекциях, аллергических состояниях.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.