количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Некоторые подходы к лечению железодефицитной анемии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №5
- Аннотация
- Статья
- Ссылки
У больных ЖДА в режиме монотерапии применялся БАД Сидерал – продукт на основе липосомного железа (Липофер) в сочетании с витаминами С и В12, которые способствуют усвоению железа.
Купирование клинических признаков заболевания было достигнуто менее чем за 14 дней. БАД Сидерал не вызывала побочных эффектов, все пациенты отмечали хорошую переносимость продукта.
Проведено исследование эффективности биологически активной добавки (БАД) к пище для коррекции железодефицитной анемии (ЖДА).
У больных ЖДА в режиме монотерапии применялся БАД Сидерал – продукт на основе липосомного железа (Липофер) в сочетании с витаминами С и В12, которые способствуют усвоению железа.
Купирование клинических признаков заболевания было достигнуто менее чем за 14 дней. БАД Сидерал не вызывала побочных эффектов, все пациенты отмечали хорошую переносимость продукта.

Таблица 1. Стандартные сроки проведения ферротерапии железодефицитной анемии (ЖДА) (по А.И. Воробьеву)
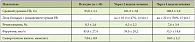
Таблица 2. Динамика показателей ферростатуса на фоне применения Сидерала
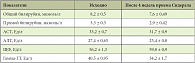
Таблица 3. Динамика показателей биохимического анализа крови на фоне приема Сидерала
Железодефицитная анемия (ЖДА) является общенациональной проблемой здравоохранения многих стран. Распространенность латентного дефицита железа (ЛДЖ) в странах Европы и в России составляет 30–40%, а в некоторых российских регионах (Север, Северный Кавказ, Восточная Сибирь) достигает 50–60% [1]. В высокоразвитых странах примерно 12% женщин страдают ЖДА, а частота развития ЖДА у беременных составляет от 20 до 80%. Распространенность дефицита железа зависит от возраста, пола, экологических и социально-экономических условий, наличия сопутствующих заболеваний. Железо является незаменимым микроэлементом, абсолютно необходимым для нормальной жизнедеятельности живых организмов [2].
Железо входит в состав дыхательных ферментов и участвует в окислительно-восстановительных процессах, а в составе гема эритроцитов – в оксигенации органов и тканей. Многие метаболические процессы протекают с участием железа: синтез стероидов, метаболизм лекарственных препаратов, пролиферация и дифференцировка клеток, регуляция активности генов [2, 3]. Основные патологические изменения, возникающие при ЖДА, связаны со снижением участия железа в тканевом дыхании. Количество железа в организме человека в среднем составляет 3–4 г. Основная часть железа (65%) находится в гемоглобине. Железо содержится в миоглобине (3,5%), тканевых ферментах (0,5%), плазме (0,1%) и различных депо (костном мозге, селезенке, печени – 30%).
Поступление в организм экзогенного железа обеспечивается его всасыванием в желудочно-кишечном тракте (ЖКТ). Ежедневно с пищей поступает 10–20 мг этого микроэлемента, однако усваивается не более 2,5 мг. Железо всасывается только в двухвалентной форме, наиболее интенсивно этот процесс происходит в двенадцатиперстной кишке и верхних отделах тощей кишки. В пище в основном содержится трехвалентное железо, то есть железо в окисленном состоянии; при взаимодействии с аскорбиновой кислотой и другими органическими кислотами (соляной, янтарной, пировиноградной) оно переходит в двухвалентное. Усвоение железа из продуктов снижается после их тепловой обработки, замораживания, длительного хранения.
В кровяном русле железо соединяется с транспортным белком – трансферрином, который доставляет железо в костный мозг или тканевые депо. Функцией белка ферритина является депонирование запасов железа в тканях. Депонированное железо используется в синтезе гемоглобина, миоглобина и других железосодержащих соединений. ЖДА является самым распространенным анемическим синдромом, на ее долю приходится 80–90% всех анемий [3]. По определению Л.И. Идельсона (1981), ЖДА – это заболевание, при котором снижается уровень железа в сыворотке крови, костном мозге и других депо, в результате чего нарушается образование гемоглобина, эритроцитов, возникает гипохромная анемия с расстройством трофики [4]. Причины железодефицитных состояний условно разделяются на 3 группы [5].
1. Особые периоды жизни и специфические состояния:
- интенсивный рост (первый год жизни ребенка, беременность, лактация), когда повышается потребность в железе вследствие возрастания его утилизации.
- кровопотери:
- из ЖКТ (диафрагмальные грыжи, варикоз вен пищевода, язвы, опухоли, дивертикулез, геморрой, глистные инвазии);
- из органов мочевыделительной системы;
- из дыхательных путей;
- мено- и метроррагии;
- вследствие применения нестероидных противовоспалительных препаратов (НПВП), глюкокортикостероидов (ГКС), антикоагулянтов;
- длительное донорство;
- программный гемодиализ;
- травмы;нарушения всасывания и утилизации железа:
- резецированные желудок и кишечник;
- снижение желудочной секреции;
- синдром мальабсорбции;
- длительное применение антибиотиков;злокачественные новообразования;применение гормональных контрацептивов.
- недостаточное питание (вегетарианство, анорексия);
- хроническая алкогольная интоксикация;
- избыточные физические нагрузки.
Диагностика и лечение ЖДА
В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ), общим признаком анемии является уменьшение концентрации гемоглобина у мужчин и женщин до уровня ниже 110 г/л. Тяжесть анемии оценивают по степени снижения уровня гемоглобина:
Во всех случаях ЖДА необходимо установить причину возникновения данного состояния и по возможности устранить ее. Лечение должно быть комплексным и включать диету в сочетании с препаратами железа. Поскольку железо из пищи усваивается в ограниченном количестве, медикаментозная терапия для пациентов с ЖДА является обязательной. Гемотрансфузия в лечении тяжелой анемии может применяться только по жизненным показаниям (железо плохо утилизируется из перелитых эритроцитов). Показанием к проведению гемотрансфузии является не столько уровень гемоглобина, сколько состояние гемодинамики.
Основным источником железа для человека являются продукты животного происхождения (мясо, свиная и телячья печень, почки, сердце, индюшиное мясо). В рацион включают зелень, овощи, фрукты, так как усвоение железа улучшается при наличии в пище витамина С. Всасывание железа ухудшают: танин (содержится в чае и кофе), фитин (содержится в рисе, соевой муке), а также молоко и творог из-за высокого содержания кальция. Выбор содержащего железо препарата является прерогативой врача. Имеется множество железосодержащих препаратов, соответствующих требованиям, призванным обеспечить наибольшую эффективность лечения. Основными требованиями к проведению лечения препаратами железа являются:
В настоящее время пероральные препараты железа разделены на 2 основные группы: ионные и неионные (последние представлены протеиновым и гидроксидполимальтозным комплексом трехвалентного железа) [2, 7]. Ионные препараты представлены солями двухвалентного железа, в том числе сульфатом железа (Тардиферон, Фенюльс, Ферроплекс, Сорбифер, Ферро-Фольгамма и др.); хлоридом (Гемофер); глюконатом, фумаратом (Хеферол, Ферронал, Мегаферин). В случае непереносимости солевых препаратов двухвалентного железа, являющихся на сегодняшний день наиболее эффективными в лечении анемии и восполнении депо железа, возможно использование препаратов трехвалентного железа в виде гидроксидполимальтозного комплекса.
В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ), общим признаком анемии является уменьшение концентрации гемоглобина у мужчин и женщин до уровня ниже 110 г/л. Тяжесть анемии оценивают по степени снижения уровня гемоглобина:
- легкая – 90–100 г/л;
- средней тяжести – 70–89 г/л;
- тяжелая – менее 70 г/л.
Во всех случаях ЖДА необходимо установить причину возникновения данного состояния и по возможности устранить ее. Лечение должно быть комплексным и включать диету в сочетании с препаратами железа. Поскольку железо из пищи усваивается в ограниченном количестве, медикаментозная терапия для пациентов с ЖДА является обязательной. Гемотрансфузия в лечении тяжелой анемии может применяться только по жизненным показаниям (железо плохо утилизируется из перелитых эритроцитов). Показанием к проведению гемотрансфузии является не столько уровень гемоглобина, сколько состояние гемодинамики.
Основным источником железа для человека являются продукты животного происхождения (мясо, свиная и телячья печень, почки, сердце, индюшиное мясо). В рацион включают зелень, овощи, фрукты, так как усвоение железа улучшается при наличии в пище витамина С. Всасывание железа ухудшают: танин (содержится в чае и кофе), фитин (содержится в рисе, соевой муке), а также молоко и творог из-за высокого содержания кальция. Выбор содержащего железо препарата является прерогативой врача. Имеется множество железосодержащих препаратов, соответствующих требованиям, призванным обеспечить наибольшую эффективность лечения. Основными требованиями к проведению лечения препаратами железа являются:
- достаточное содержание элементарного железа в препарате;
- использование соли железа, обеспечивающей его наибольшую биодоступность;
- введение с препаратом железа аскорбиновой кислоты, повышающей биодоступность препарата, а также витаминов – фолиевой кислоты, цианокобаламина, играющих важную роль в гемопоэзе; недостаток этих витаминов вызывает нарушение синтеза ДНК в кроветворных клетках, что негативно влияет на скорость синтеза Hb.
В настоящее время пероральные препараты железа разделены на 2 основные группы: ионные и неионные (последние представлены протеиновым и гидроксидполимальтозным комплексом трехвалентного железа) [2, 7]. Ионные препараты представлены солями двухвалентного железа, в том числе сульфатом железа (Тардиферон, Фенюльс, Ферроплекс, Сорбифер, Ферро-Фольгамма и др.); хлоридом (Гемофер); глюконатом, фумаратом (Хеферол, Ферронал, Мегаферин). В случае непереносимости солевых препаратов двухвалентного железа, являющихся на сегодняшний день наиболее эффективными в лечении анемии и восполнении депо железа, возможно использование препаратов трехвалентного железа в виде гидроксидполимальтозного комплекса.
Сидерал в монотерапии дефицита железа
В данной статье авторы делятся опытом использования биологически активной добавки (БАД) к пище Сидерал (производство компании «Фарма Нутра», Италия), которую применяли в режиме монотерапии с целью коррекции ЖДА. В отличие от классических препаратов на основе солей железа, БАД Сидерал представляет собой продукт на основе липосомного железа (Липофер) в сочетании с витаминами С и В12, которые способствуют его усвоению. Липофер всасывается напрямую из кишечника, не оказывая раздражающего действия на желудок и кишечник. Липосомы (замкнутые пузырьки, самопроизвольно образующиеся в смесях фосфолипидов с водой) способны быть переносчиками лекарственных средств. Липосомное железо в ЖКТ находится в защитном окружении липосом, которые в тонкой кишке связываются с хиломикронами и транспортируются в лимфатическую систему, а оттуда поступают в кровь и печень, благодаря чему при низких дозировках обеспечивается высокая биодоступность железа.
В капсуле Сидерала (350 мг) содержатся следующие активные компоненты: витамин С (60 мг), Липофер (14 мг железа в виде пирофосфата, кукурузный крахмал, лецитин сои), витамин В12 (0,3 мкг); вспомогательные вещества: пищевой желатин, фосфат кальция, стеарат магния, диоксид кремния, диоксид титана. Продукт выпускается в блистерах по 20 капсул в упаковке. Прием Сидерала не зависит от приема пищи и назначается по 1 капсуле в сутки, продолжительность приема 30 дней. Сидерал занимает первое место в рейтинге железосодержащих препаратов в стране-изготовителе – Италии. БАД Сидерал разрешен к применению в России (зарегистрирован 11.02.2011) для коррекции дефицита железа, в том числе при беременности и кормлении грудью. Однако до сих пор в нашей стране не проводилось работ по изучению применения Сидерала для коррекции ЖДА.
В данной статье авторы делятся опытом использования биологически активной добавки (БАД) к пище Сидерал (производство компании «Фарма Нутра», Италия), которую применяли в режиме монотерапии с целью коррекции ЖДА. В отличие от классических препаратов на основе солей железа, БАД Сидерал представляет собой продукт на основе липосомного железа (Липофер) в сочетании с витаминами С и В12, которые способствуют его усвоению. Липофер всасывается напрямую из кишечника, не оказывая раздражающего действия на желудок и кишечник. Липосомы (замкнутые пузырьки, самопроизвольно образующиеся в смесях фосфолипидов с водой) способны быть переносчиками лекарственных средств. Липосомное железо в ЖКТ находится в защитном окружении липосом, которые в тонкой кишке связываются с хиломикронами и транспортируются в лимфатическую систему, а оттуда поступают в кровь и печень, благодаря чему при низких дозировках обеспечивается высокая биодоступность железа.
В капсуле Сидерала (350 мг) содержатся следующие активные компоненты: витамин С (60 мг), Липофер (14 мг железа в виде пирофосфата, кукурузный крахмал, лецитин сои), витамин В12 (0,3 мкг); вспомогательные вещества: пищевой желатин, фосфат кальция, стеарат магния, диоксид кремния, диоксид титана. Продукт выпускается в блистерах по 20 капсул в упаковке. Прием Сидерала не зависит от приема пищи и назначается по 1 капсуле в сутки, продолжительность приема 30 дней. Сидерал занимает первое место в рейтинге железосодержащих препаратов в стране-изготовителе – Италии. БАД Сидерал разрешен к применению в России (зарегистрирован 11.02.2011) для коррекции дефицита железа, в том числе при беременности и кормлении грудью. Однако до сих пор в нашей стране не проводилось работ по изучению применения Сидерала для коррекции ЖДА.
Материалы и методы исследования
Мы провели наблюдательное проспективное несравнительное исследование, в котором участвовало 30 больных: 19 женщин и 11 мужчин. Возраст больных составил от 18 до 79 лет; средний возраст – 46,9 ± 4,6 года. Всем больным был поставлен диагноз ЖДА на основании уровня Hb менее 110 г/л (но не менее 70 г/л), снижения содержания сывороточного железа менее 9 ммоль/л. Лечение Сидералом осуществлялось в режиме монотерапии. В случае наличия у пациентов сопутствующих заболеваний эти заболевания были в фазе ремиссии. Эффективность БАД Сидерал оценивалась по следующим критериям:
Сидерал назначался внутрь по 1 капсуле в сутки на протяжении 30 дней. До начала участия в исследовании пациенты подписывали и датировали письменное информированное согласие. Были соблюдены все критерии включения и невключения в исследование в соответствии с протоколом исследования N C и D B3.2012. Контрольные визиты (2-й и 3-й) проводились через 2 и 4 недели от начала приема Сидерала. На визитах проводился физикальный осмотр (с измерением артериального давления и пульса на сонной и лучевой артериях), сбор данных о сопутствующей терапии, оценка и регистрация нежелательных явлений, клинический и биохимический анализы крови, выдача и возврат упаковок Сидерала с оценкой приверженности пациентов терапии. Забор венозной крови для определения показателей ферростатуса проводился через сутки после прекращения приема Сидерала.
Мы провели наблюдательное проспективное несравнительное исследование, в котором участвовало 30 больных: 19 женщин и 11 мужчин. Возраст больных составил от 18 до 79 лет; средний возраст – 46,9 ± 4,6 года. Всем больным был поставлен диагноз ЖДА на основании уровня Hb менее 110 г/л (но не менее 70 г/л), снижения содержания сывороточного железа менее 9 ммоль/л. Лечение Сидералом осуществлялось в режиме монотерапии. В случае наличия у пациентов сопутствующих заболеваний эти заболевания были в фазе ремиссии. Эффективность БАД Сидерал оценивалась по следующим критериям:
- динамика клинических синдромов (анемического и сидеропенического) в процессе лечения;
- динамика уровня Hb в крови через 2 и 4 недели приема Сидерала по сравнению с исходным значением;
- доля больных с нормализацией уровня Hb в крови (для женщин –
- более 120 г/л, для мужчин –
- более 130 г/л) через 4 недели приема Сидерала;
- доля больных с ответом на терапию Сидералом через 2 недели лечения (повышение уровня Hb на ≥ 10 г/л по сравнению с исходным значением);
- доля больных с ответом на терапию Сидералом через 4 недели лечения (повышение уровня Hb на ≥ 20 г/л по сравнению с исходным значением);
- динамика уровня ретикулоцитов крови через 2 и 4 недели приема Сидерала по сравнению с исходным значением;
- динамика уровня сывороточного ферритина через 2 и 4 недели приема Сидерала по сравнению с исходным значением;
- динамика биохимических показателей крови (общего и связанного билирубина, аланин-
- аминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), гамма-глутамилтранспептидазы (гамма-ГТ)), определяемых с целью оценки безопасности и переносимости БАД Сидерал.
Сидерал назначался внутрь по 1 капсуле в сутки на протяжении 30 дней. До начала участия в исследовании пациенты подписывали и датировали письменное информированное согласие. Были соблюдены все критерии включения и невключения в исследование в соответствии с протоколом исследования N C и D B3.2012. Контрольные визиты (2-й и 3-й) проводились через 2 и 4 недели от начала приема Сидерала. На визитах проводился физикальный осмотр (с измерением артериального давления и пульса на сонной и лучевой артериях), сбор данных о сопутствующей терапии, оценка и регистрация нежелательных явлений, клинический и биохимический анализы крови, выдача и возврат упаковок Сидерала с оценкой приверженности пациентов терапии. Забор венозной крови для определения показателей ферростатуса проводился через сутки после прекращения приема Сидерала.
Результаты исследования
В результате проведенного исследования было установлено, что при лечении ЖДА купирование клинических признаков заболевания было достигнуто менее чем за 14 дней. Общая слабость, головокружение, потливость, одышка при нагрузке в среднем были купированы на 10,4 ± 1,2 день. Такие объективные симптомы, как бледность кожных покровов, тахикардия, артериальная гипотония, сохранялись дольше (16 ± 0,9 дня). Ни субъективные жалобы, ни отклонения от нормы при физикальном осмотре, приведенные выше, не были отмечены при обследовании на 3-м контрольном визите (через 4 недели лечения). Через 2 недели лечения средний уровень Hb составил 101,3 ± 3,8 г/л, количество больных с повышением уровня Hb на 10 и более г/л составило 14 человек (47%) (табл. 2). В динамике уровень ретикулоцитов через 2 недели составил 6,3 ± 2,3‰ (исходно 8,3 ± 2,6‰). Уровень сывороточного ферритина через 2 недели равнялся 39,0 ± 20,2 мкг/л (исходно 85,8 ± 27,4 мкг/л).
Концентрация ферритина сыворотки колебалась у одних и тех же больных и по группе в целом в широких пределах. Достоверных изменений средней величины не получено. Отмечался высокий уровень ферритина у отдельных больных (от 99 до 707 мкг/л), что, возможно, связано с характером основного заболевания, обусловившего развитие ЖДА у этих больных, в частности с лежащим в основе заболевания воспалением, для которого характерно увеличение такого показателя, как ферритин (будучи «белком воспаления», ферритин недостаточно специфично отражает запасы железа в организме человека). Через 4 недели приема Сидерала средний уровень Hb равнялся 108,5 ± 2,9 г/л, количество больных с повышением уровня Hb ≥ 20 г/л по сравнению с исходным значением составило 15 человек (50%). Величина прироста Hb через 4 недели равнялась в среднем по группе 15,5 г/л. Наиболее активный прирост Hb имел место у больных с анемией средней тяжести (величина прироста Hb через 4 недели в этой группе составила 22,6 г/л).
Нормализация уровня Hb в крови через 4 недели приема Сидерала отмечена у 6 больных (у 2 мужчин и 4 женщин). В динамике уровень ретикулоцитов через 4 недели составил в среднем 7,6 ± 3,4‰ (через 2 недели равнялся 6,3 ± 2,3‰). У 10 человек наблюдался выраженный ретикулоцитарный криз. Уровень сывороточного ферритина в динамике через 4 недели составил в среднем 33,5 ± 18,6 мкг/л (при исходном уровне 85,8 ± 27,4 мкг/л). Нарастание концентрации Hb на фоне приема Сидерала сопровождалось повышением уровня сывороточного железа до 9,65 ± 1,2 мкмоль/л (исходно 7,04 ± 0,9 мкмоль/л). Однако это не сопровождалось достоверными изменениями концентрации ферритина в сыворотке крови (функцией ферритина является депонирование запасов железа в тканях) и увеличением числа ретикулоцитов в крови. Побочных эффектов при приеме Сидерала не было зарегистрировано ни в одном случае. Все пациенты отмечали хорошую переносимость БАД Сидерал. При биохимическом анализе крови (уровни общего и прямого билирубина, АСТ, АЛТ, ЩФ, гамма-ГТ) неблагоприятных изменений не выявлено (табл. 3). Биохимические показатели крови, оцененные исходно и в динамике, находились в пределах нормальных величин, что свидетельствовало об отсутствии побочных эффектов.
В результате проведенного исследования было установлено, что при лечении ЖДА купирование клинических признаков заболевания было достигнуто менее чем за 14 дней. Общая слабость, головокружение, потливость, одышка при нагрузке в среднем были купированы на 10,4 ± 1,2 день. Такие объективные симптомы, как бледность кожных покровов, тахикардия, артериальная гипотония, сохранялись дольше (16 ± 0,9 дня). Ни субъективные жалобы, ни отклонения от нормы при физикальном осмотре, приведенные выше, не были отмечены при обследовании на 3-м контрольном визите (через 4 недели лечения). Через 2 недели лечения средний уровень Hb составил 101,3 ± 3,8 г/л, количество больных с повышением уровня Hb на 10 и более г/л составило 14 человек (47%) (табл. 2). В динамике уровень ретикулоцитов через 2 недели составил 6,3 ± 2,3‰ (исходно 8,3 ± 2,6‰). Уровень сывороточного ферритина через 2 недели равнялся 39,0 ± 20,2 мкг/л (исходно 85,8 ± 27,4 мкг/л).
Концентрация ферритина сыворотки колебалась у одних и тех же больных и по группе в целом в широких пределах. Достоверных изменений средней величины не получено. Отмечался высокий уровень ферритина у отдельных больных (от 99 до 707 мкг/л), что, возможно, связано с характером основного заболевания, обусловившего развитие ЖДА у этих больных, в частности с лежащим в основе заболевания воспалением, для которого характерно увеличение такого показателя, как ферритин (будучи «белком воспаления», ферритин недостаточно специфично отражает запасы железа в организме человека). Через 4 недели приема Сидерала средний уровень Hb равнялся 108,5 ± 2,9 г/л, количество больных с повышением уровня Hb ≥ 20 г/л по сравнению с исходным значением составило 15 человек (50%). Величина прироста Hb через 4 недели равнялась в среднем по группе 15,5 г/л. Наиболее активный прирост Hb имел место у больных с анемией средней тяжести (величина прироста Hb через 4 недели в этой группе составила 22,6 г/л).
Нормализация уровня Hb в крови через 4 недели приема Сидерала отмечена у 6 больных (у 2 мужчин и 4 женщин). В динамике уровень ретикулоцитов через 4 недели составил в среднем 7,6 ± 3,4‰ (через 2 недели равнялся 6,3 ± 2,3‰). У 10 человек наблюдался выраженный ретикулоцитарный криз. Уровень сывороточного ферритина в динамике через 4 недели составил в среднем 33,5 ± 18,6 мкг/л (при исходном уровне 85,8 ± 27,4 мкг/л). Нарастание концентрации Hb на фоне приема Сидерала сопровождалось повышением уровня сывороточного железа до 9,65 ± 1,2 мкмоль/л (исходно 7,04 ± 0,9 мкмоль/л). Однако это не сопровождалось достоверными изменениями концентрации ферритина в сыворотке крови (функцией ферритина является депонирование запасов железа в тканях) и увеличением числа ретикулоцитов в крови. Побочных эффектов при приеме Сидерала не было зарегистрировано ни в одном случае. Все пациенты отмечали хорошую переносимость БАД Сидерал. При биохимическом анализе крови (уровни общего и прямого билирубина, АСТ, АЛТ, ЩФ, гамма-ГТ) неблагоприятных изменений не выявлено (табл. 3). Биохимические показатели крови, оцененные исходно и в динамике, находились в пределах нормальных величин, что свидетельствовало об отсутствии побочных эффектов.
Выводы
- БАД Сидерал продемонстрировала хороший эффект в лечении железодефицитной анемии.
- БАД Сидерал, назначаемая по 1 капсуле 1 раз в день в течение 4 недель, обеспечивала купирование клинических признаков ЖДА и нарастание показателей Нb с повышением его уровня ≥ 20 г/л в 50% случаев.
- Нормализация уровня Нb в крови через 4 недели лечения отмечена у 6 пациентов с анемией легкой степени тяжести.
- БАД Сидерал очень хорошо переносилась больными и не вызывала побочных эффектов.
- Данная продолжительность лечения недостаточна для нормализации уровня Нb и сывороточного железа в крови, что объясняет необходимость пролонгированного применения Сидерала, чему, в свою очередь, способствуют отличная переносимость и удобство приема.
- Общая длительность лечения должна зависеть от исходной тяжести анемии и определяться в соответствии со стандартными сроками проведения ферротерапии.
1. Анемия – скрытая эпидемия / Под ред. В.М. Чернова. М.: МегаПро, 2004. 76 с.
2. Цветкова О.А Медико-социальные аспекты железодефицитной анемии // РМЖ. 2009. Т. 17. № 5 (344). С. 387–390.
3. The World Health Report. 22. Screening for Iron Deficiency Anlmia – Including Iron Prophilaxis. Recommendation. WHO, Geneva, 1998.
4. Идельсон Л.И. Гипохромные анемии М.: Медицина, 1981. 190 с.
5. Верткин А.Л., Годулян О.В, Городецкий В.В. Лечение железодефицитной анемии и сидеропении комбинированным ферропрепаратом, содержащим фолиевую кислоту и цианокобаламин // Фарматека. 2005. № 6. С. 59–64.
6. Алиментарные анемии / Серия технических докладов, № 405. Всемирная организация здравоохранения, 1973.
7. Дворецкий Л.И. Гипохромные анемии // Consilium Мedicum. 2001. Т. 3. № 9.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.