В клинической медицине и в гастроэнтерологии в частности такой симптом, как боль в животе, занимает главенствующее место, что обусловлено, во-первых, его распространенностью, а во-вторых, клинической и прогностической значимостью. Абдоминальная боль представляет собой типовой патологический процесс, который лишен нозологической принадлежности. Дать правильную оценку боли и выбрать тактику ведения пациента – далеко не простая задача для врача. От качества оценки боли зависит точность диагноза и своевременное начало лечения. Согласно отчету Всемирной организации гастроэнтерологов и эндоскопистов (OMGE), точность диагностики причин боли в животе к началу XXI века составила лишь 50%, а промежуток времени между появлением боли в животе и верификацией диагноза, включая злокачественные новообразования, составлял от 8 до 37 недель [1]. Международная ассоциация по изучению боли (IASP) определяет симптом боли как:
- неприятное ощущение и эмоциональное переживание, связанное с действительным или возможным повреждением тканей;
- один из видов чувствительности, возникающих вследствие поступления в ЦНС патологических импульсов с периферии без единого универсального раздражителя.
При определении тактики ведения пациента с абдоминальной болью в первую очередь нужно опираться на патогенетический механизм и клиническую классификацию боли, согласно которой боли в животе подразделяют на висцеральные, париетальные (соматические) и отраженные (иррадиирующие) [1, 2].
Классификация абдоминальной боли
Висцеральная боль возникает при раздражении болевых рецепторов органов брюшной полости (ноцицепторов), иннервируемых вегетативной нервной системой. Висцеральная боль:
- может быть схваткообразной или тупой;
- характеризуется отсутствием четкой локализации;
- может отличаться ритмичностью, т.е. быть связанной с приемом пищи, временем суток, актом дефекации;
- может сопровождаться вегетативными реакциями, такими как слабость, бледность, потливость, одышка;
- зоны восприятия боли могут быть размыты или ограничены эпигастральной, мезогастральной, гипогастральной областями;
- при повреждении пищевода, желудка, желчного пузыря, желчевыводящих путей, поджелудочной железы боли проецируются в эпигастральную область;
- при патологии тонкой, слепой кишки боли проецируются в мезогастрии (периумбиликальная область);
- при поражении толстой кишки, органов малого таза боли проецируются в гипогастральную область;
- при вовлечении в патологический процесс парных органов (почки, придатки матки) боль проецируется в боковые отделы живота.
В месте локализации боли отмечается болезненность при пальпации. Висцеральные боли являются следствием нарушения, в первую очередь, моторной функции органов. Поскольку большинство органов пищеварения – это полые органы, механизм формирования боли в значительной степени связан с нарушением тонуса их гладкой мускулатуры с преобладанием гипертонуса. Ведущие механизмы болей – это спазм и растяжение полого органа (спастическая абдоминальная боль и дистензионная боль). Париетальная боль (соматическая):
- возникает при раздражении париетальной брюшины и более четко локализуется в месте раздражения;
- боль, как правило, острая, чаще с внезапным началом, интенсивная, постоянная;
- отсутствует ритмичность;
- свойственна иррадиация;
- лекарственная терапия неэффективна, порой противопоказана.
Большинству больных, как правило, необходимо хирургическое лечение. Париетальные боли возникают при перфорации и пенетрации органов. Отраженные (иррадиирующие) боли:
- локализуются в различных областях, часто удаленных от патологического очага;
- могут быть связаны с заболеваниями органов, расположенных вне брюшной полости, и через афферентные нейроны проецироваться на ту или иную область живота;
- боль передается на участки поверхности тела, которые имеют общую с пораженным органом брюшной полости корешковую иннервацию.
Психогенные боли:
- возникают при отсутствии очага раздражения, которым можно было бы объяснить пусковой механизм боли;
- характер этих болей определяется особенностями личности (наблюдаются у лиц с психоэмоциональными нарушениями);
- боль постоянная, тупая, монотонная, длительная, продолжается месяцами, сочетается с болевым синдромом другой локализации (головная боль, боль во всем теле);
- прекращаются или уменьшаются в условиях психического покоя, отсутствуют во время сна;
- положительный эффект достигается при лечении психотропными средствами.
По продолжительности и течению абдоминальные боли подразделяются на:
- острые, которые развиваются быстро, имеют небольшую продолжительность (от нескольких часов или дней до 1–3 недель);
- хронические, когда имеет место постепенное нарастание, длительное сохранение или рецидивирование на протяжении недель и месяцев.
Хронические боли подразделяются на органические и функциональные. Острая боль несет в себе прогностически неблагоприятную ситуацию, угрожающую развитием тяжелых осложнений, и не исключает необходимости проведения оперативного вмешательства. При острой боли у пациента, как правило, выражены симптомы интоксикации (тошнота, головокружение, сухость языка, гипотония, частый пульс). Больным с острой болью показаны госпитализация и интенсивное наблюдение. При появлении у пациента болей в животе необходимо проводить дифференциальный диагноз с инфарктом миокарда, нижнедолевой пневмонией, тромбозом мезентериальных сосудов, разрывом аневризмы брюшной аорты. Боль в животе может выступать как «маска» таких заболеваний и состояний, как депрессия, заболевания позвоночника, анемия, инфекция мочевых путей.
У пожилых пациентов и лиц, страдающих сахарным диабетом, возможно наличие «стертой» клинической симптоматики, отсутствие отчетливых болевых ощущений. Помимо оценки данных анамнеза и осмотра больного алгоритм лабораторно-инструментального обследования при абдоминальной боли включает рентгенографию, эзофагогастродуоденоскопию (ЭГДС), ультразвуковое исследование (УЗИ) по поисковой методике, биохимический скрининг, общий анализ крови и мочи, исследование кала. На основании полученных результатов можно сделать окончательное заключение о характере патологического процесса и боли (органическая или функциональная).
Наибольшую сложность представляет диагностика хронической функциональной боли в животе, когда при детальном обследовании не удается обнаружить органической патологии и морфологического субстрата, вызвавшего боль, что чревато выбором неправильной тактики ведения больных. Значительную долю гастроэнтерологической патологии составляют функциональные нарушения органов пищеварения. Из числа больных, обращающихся к гастроэнтерологам, 30–50% имеют симптомы различных функциональных расстройств. Проблема функциональных расстройств настолько актуальна, что в 1988, 1999 и 2006 гг. международной экспертной группой были приняты Римские критерии функциональных расстройств желудочно-кишечного тракта, содержащие определение, классификацию, диагностические тесты и методы лечения функциональных расстройств [3, 4, 5].
Классификация функциональных расстройств системы пищеварения
Функциональные гастроинтестинальные расстройства классифицируются следующим образом:
1. Пищеводные расстройства:
- «комок» в горле;
- регургитация;
- функциональная боль за грудиной преимущественно пищеводного генеза;
- функциональное жжение за грудиной;
- функциональная дисфагия;
- неспецифические (неопределенные) пищеводные дисфункции.
2. Гастродуоденальные расстройства:
- функциональная диспепсия (язвенноподобная, дисмоторная, неспецифическая);
- аэрофагия;
- функциональная рвота.
3. Кишечные расстройства:
- синдром раздраженного кишечника;
- функциональное вздутие живота (метеоризм);
- функциональный запор;
- функциональная диарея;
- неспецифические (неопределенные) функциональные расстройства кишечника.
4. Функциональная абдоминальная боль:
- синдром функциональной абдоминальной боли;
- неспецифическая (неопределенная) абдоминальная боль.
5. Билиарные расстройства:
- дисфункция желчного пузыря;
- дисфункция сфинктера Одди.
6. Аноректальные расстройства.
7. Функциональные расстройства у детей.
В соответствии с Римскими критериями выделено несколько общих признаков функциональных расстройств вне зависимости от уровня поражения:
- Продолжительность основных симптомов не менее 3 месяцев на протяжении последнего года.
- Отсутствие органической патологии и видимого морфологического субстрата.
- Множественный характер жалоб со стороны разных органов и систем при общем хорошем состоянии и благоприятном течении заболевания без значимого прогрессирования.
- Существенное нарушение качества жизни пациента.
Функциональная боль является висцеральной болью и сопровождается спазмом и нарушением двигательной функции органов желудочно-кишечного тракта (ЖКТ) неясного генеза. В основе функциональной боли лежит феномен висцеральной гиперчувствительности (гипералгезия – боль, возникающая под воздействием мягких повреждающих стимулов). Хроническая функциональная боль в животе является диагнозом исключения. Признаками, исключающими функциональный характер боли, служат:
- немотивированная потеря массы тела;
- ночные боли;
- возникновение заболевания в возрасте после 40–50 лет;
- лихорадка;
- любые изменения, выявленные при непосредственном обследовании больного (гепатомегалия, спленомегалия, увеличение лимфоузлов и т.д.);
- любые изменения лабораторных показателей крови, мочи, кала (лейкоцитоз, гипербилирубинемия, анемия, увеличение скорости оседания эритроцитов, гематурия, положительная реакция на скрытую кровь в кале и т.д.);
- любые изменения, выявленные с помощью инструментальных методов исследования (камни в билиарной системе, кисты поджелудочной железы, холедохоэктазия и т.д).
Для пациента принципиально важным является избавление от боли. Адекватная симптоматическая терапия, даже если она не имеет этиопатогенетической направленности, но купирует боль, имеет решающее значение для качества жизни пациента. Спазм – это универсальное звено в развитии многих гастроэнтерологических заболеваний, поэтому лечение спазмолитиками в этом случае является патогенетически обоснованным. Не следует допускать ситуаций, когда пациенты терпят боль в животе. Но при этом следует помнить, что при подозрении на острую боль применение анальгетиков противопоказано [1].
Выбор терапевтической тактики
После того как диагностика боли завершена, возникает одна из двух клинических ситуаций:
- Установлен характер органической патологии и вторичность функциональной боли.
- Исключена органическая патология и установлен первичный характер функциональной боли.
Это позволяет определить терапевтическую тактику и выбрать спазмолитик, который может являться этиотропной терапией при функциональной боли или обеспечить проведение симптоматического лечения, если спазм сопровождает основное заболевание, но не играет роли в его патогенезе [6]. Спазмолитические лекарственные препараты служат основным средством для купирования висцеральной абдоминальной боли. Расслабление гладких мышечных клеток сопровождается снижением тонуса стенки полого органа и внутрипросветного давления. Спазмолитики не только купируют боль, но и восстанавливают пассаж содержимого из полого органа, что ведет к улучшению кровоснабжениия его стенки [1, 7, 8]. Назначение спазмолитиков не сопровождается непосредственным вмешательством в механизмы болевой чувствительности, поэтому не «затушевывает» боли и не затрудняет диагностики острой хирургической патологии. Регуляторы моторно-эвакуаторной функции органов ЖКТ представляют собой группу препаратов нескольких фармакологических классов и различаются механизмом и избирательностью действия. Эти препараты подразделяют на:
- Прокинетики: метоклопрамид (Церукал, Реглан), домперидон (Мотилиум), итоприда гидрохлорид (Ганатон).
- Спазмолитики.
- Универсальный модулятор моторики ЖКТ тримебутина малеат (Тримедат®).
Прокинетики усиливают пропульсивную моторику верхних отделов ЖКТ за счет антагонизма с допаминовыми рецепторами. Ганатон помимо этого ингибирует активность ацетилхолинэстеразы, подавляет разрушение ацетилхолина. Спазмолитики подразделяются следующим образом:
1. Миотропные спазмолитики (уменьшают мышечный тонус путем прямого воздействия на гладкомышечные клетки), которые блокируют процесс передачи нервных импульсов в вегетативных ганглиях и нервных окончаниях, стимулирующих гладкомышечные клетки. Это антихолинергические препараты, или М-холиноблокаторы:
- селективные:
– блокаторы кальциевых каналов:
- Спазмомен (отилония бромид);
- Дицетел (пинаверия бромид);
– блокаторы натриевых каналов:
- Мебеверин, Дюспаталин (мебеверина гидрохлорид);
– донаторы окиси азота:
- изосорбида динитрат;
- Нитроглицерин;
- нитропруссид натрия (Нанипрус);
- неселективные:
- ингибиторы фосфодиэстеразы:
- дротаверин (Дротаверина гидрохлорид, Но-шпа);
- Папаверин.
2. Нейротропные спазмолитики (блокаторы холинорецепторов гладкой мышечной клетки):
- природные (атропин, гиосциамин, препараты красавки, платифиллин, скополамин);
- синтетические центральные (адифенин, апрофен, апренал, циклозил);
- полусинтетические периферические (Бускопан).
Механизм действия основных мышечных релаксантов:
- Активация М-холинорецепторов мышечного волокна.
- Активность гладкомышечных клеток находится в прямой пропорциональной зависимости от концентрации Ca++, который обеспечивает сокращение мышечного волокна. Миотропные спазмолитики должны уменьшить концентрацию ионов Ca в миоците.
- Мебеверин способствует деполяризации мембран, блокирует наполнение депо клеток внеклеточным Ca++.
- Высокая активность фосфодиэстеразы необходима для сокращения мышечного волокна. Этот фермент обеспечивает энергией гладкомышечные клетки.
Непростая ситуация сложилась в отношении применения антагониста 5HT3 -рецепторов серотонина – Алосетрона – при диарее и частичного агониста 5HT4 -рецепторов серотонина – тегасерода (Зелмак) – при запорах. И тот и другой препарат подтвердил свою эффективность в контролируемых испытаниях, но только у женщин [3]. Риск серьезных побочных явлений привел к тому, что оба препарата применяются в США с большими ограничениями. В европейских странах они не зарегистрированы. В январе 2012 г. в России зарегистрирован прукалоприд (Резолор) – полный агонист 5HT4-рецепторов серотонина, применяющийся как прокинетик при хронических функциональных запорах. При назначении того или иного релаксанта необходимо учитывать зоны распространения спазмолитического эффекта препарата (табл. 1) [9].
Но-шпа – традиционный спазмолитический препарат (применяется с 1962 г.), входящий в стандарты лечения болезней органов пищеварения. Предпочтительна в случаях, когда боль имеет сочетанную локализацию или склонна к генерализации. Но-шпу применяют чаще короткими курсами: например, для ускорения раскрытия шейки матки в родах, при головных болях напряжения, нефролитиазе, уретролитиазе, спазмах мочевого пузыря. Побочные эффекты отмечаются достаточно редко (в 0,9% случаев), но при длительном применении и в больших дозах могут наблюдаться тошнота, головокружение, тахикардия, гипотензия, запор, бессонница.
Папаверин также обладает спазмолитическим эффектом на многие органы, но его действие на миоциты ЖКТ в 5 раз слабее, чем у Но-шпы. Бускопан применяется с 1958 г., является препаратом безрецептурного отпуска. Это М-холиноблокатор, действующий в месте возникновения спазма. Холинорецепторы в большей степени представлены в ЖКТ, билиарной системе, в меньшей – в органах малого таза. Бускопан не влияет на центральную нервную систему, так как не проникает через гематоэнцефалический барьер. Снимает боль в течение 10–15 минут после применения. Оказывает антисекреторное действие. Назначается коротким курсом «по требованию», в некоторых случаях применяется до 2–3 недель. Основным показанием к применению Бускопана является функциональная и органическая патология верхних отделов ЖКТ. У него имеются атропиноподобные эффекты (сухость во рту и кожных покровов, тахикардия, задержка мочи, парез аккомодации, сонливость). Он противопоказан больным с глаукомой, миастенией.
Мебеверин (дюспаталин) оказывает максимальное спазмолитическое действие на гладкую мускулатуру тонкой и толстой кишки и отчасти воздействует на желчные пути. Путем восстановления градиента давления в кишечнике восстанавливает пассаж желчи. Уменьшая отток калия из клетки, устраняет спазм, не вызывая гипотонии толстой кишки. Препарат известен с 1965 г., применяется для курсового лечения. Представители селективных блокаторов кальциевых каналов клеток в кишечнике – дицетел и спазмомен. У них отсутствуют системное вазодилатирующее и кардиотропное действия, свойственные другим блокаторам Са-каналов. Применяются эти препараты преимущественно при лечении больных с функциональными расстройствами толстой кишки. Эффект дицетела дозозависим. 7–10% введенной дозы попадает в печень и может использоваться при лечении пациентов с билиарными болями, но в этом отношении дицетел преимуществ перед другими спазмолитиками не имеет. В качестве нежелательного эффекта он может вызвать запор. Спазмомен по эффективности незначительно отличается от дицетела. В настоящее время на российском рынке этот препарат отсутствует.
Гимекромон (Одестон) – миотропный спазмолитик, оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер Люткенса, снижает давление в билиарной системе, в связи с чем купирует билиарный болевой синдром. Не оказывает влияния на другие гладкие мышцы. Важно, что Одестон не изменяет тонус желчного пузыря.
Тримебутин (Тримедат®) – универсальный регулятор моторики, действует на всем протяжении ЖКТ, включая билиарную систему.
На практике достаточно часто у пациентов встречаются сочетанные разноплановые нарушения моторики с преобладанием того или иного компонента (гипо- или гиперкинетические расстройства). Для определения типа нарушений моторики нередко требуются сложные, инвазивные, дорогостоящие и не всегда доступные в рутинной практике методы исследования: манометрия сфинктера Одди, исследование моторики кишечника с радиоактивным золотом и др. Большинство моторных расстройств имеет сложный генез, поэтому в арсенале врача должны быть лекарственные средства, способные восстанавливать моторику вне зависимости от типа ее нарушения. Таким препаратом является тримебутин, купирующий как спастическую, так и гипомоторную дискинезию кишечника, желчевыводящих путей.
Универсальный модулятор моторики позволяет на ранней стадии начать лечение больных с функциональными расстройствами, сократить количество и стоимость диагностических процедур для уточнения характера моторных расстройств. Тримебутин синтезирован в 1969 г. во Франции и много лет применяется во многих странах под торговым названием Дебридат. В России тримебутин был заявлен российской фирмой «Валента» в 2008 г. под названием Тримедат®. Это препарат из группы опиоидных пептидов, действующий на периферические опиатные рецепторы [10, 11, 12, 13].
Опиатные рецепторы расположены на всем протяжении ЖКТ. Они находятся в нервных сплетениях кишечника – подслизистом Мейснеровском и межмышечном Ауербаховском. Известно 3 подвида опиатных рецепторов: мю-, дельта- и каппа-. Мю- и дельта-рецепторы проводят возбуждающие импульсы, каппа-рецепторы – тормозящие импульсы. Тримедат® связывается с мю-, каппа- и дельта-рецепторами, не обладая специфичностью к какому-либо одному виду. Являясь нормокинетиком, препарат оказывает двойственный регулирующий эффект. Действуя на каппа-рецепторы, он угнетает моторику, действуя на мю- и дельта-рецепторы – стимулирует моторику. Таким образом, Тримедат® оказывает спазмолитическое или прокинетическое действие в зависимости от исходного состояния моторики ЖКТ [8, 14, 15]. Тримедат® оказывает влияние на гуморальную регуляцию ЖКТ: повышает уровень мотилина, снижает уровень гастрина, глюкагона, инсулина, вазоактивного кишечного пептида, панкреатического полипептида, модулируя периферические эффекты:
- ускоряет эвакуацию из желудка;
- модулирует двигательную способность толстой кишки;
- модулирует висцеральную чувствительность.
Показания к применению:
- моторные расстройства при функциональных заболеваниях ЖКТ (неязвенная диспепсия), гастроэзофагеальная рефлюксная болезнь, диспепсические расстройства при гастродуоденальных заболеваниях (язвенная болезнь);
- синдром раздраженного кишечника, проявляющийся болями и коликами в брюшной полости, метеоризмом, диареей и/или запором;
- послеоперационная паралитическая кишечная непроходимость, подготовка к рентгенологическому и эндоскопическому исследованиям ЖКТ;
- для детей: диспепсические расстройства, связанные с нарушением моторики ЖКТ.
Режим дозирования:
- детям 3–5 лет – по 25 мг 3 раза в сутки;
- детям старше 5 лет – по 50 мг 3 раза в сутки;
- детям старше 12 лет и взрослым – по 100–200 мг 3 раза в сутки.
В целом Тримедат® является безопасным препаратом, но при его применении возможны кожные реакции.
Критерии эффективности терапии тримебутином (Тримедатом)
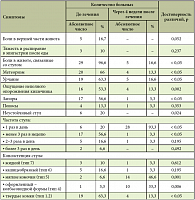
В целом ряде зарубежных рандомизированных исследований, проводимых в разные годы, была доказана эффективность тримебутина при лечении больных синдромом раздраженного кишечника (СРК), при функциональной патологии желчевыводящих путей [8, 11, 14, 16]. Авторы статьи имеют собственный опыт применения Тримедата у больных с СРК. Под наблюдением находились 30 больных с СРК в различных клинических вариантах. СРК с преобладанием запоров констатирован у 17 человек, с преобладанием диареи – у 4 человек, с преобладанием болей и метеоризма – у 9 (у 6 из них отмечался неустойчивый стул: от кашицеобразного до твердой консистенции). Возраст пациентов колебался от 16 до 56 лет (36,8 ± 2,4 года). В обследовании участвовали 23 женщины и 7 мужчин. Больные получали Тримедат® по 200 мг 3 раза в день в течение 28 дней. Критериями эффективности лечения служили:
- Динамика клинических симптомов.
- Динамика метаболитов кишечной флоры (летучих жирных кислот в кале).
- Динамика качества жизни пациентов по опроснику SF-36.
- Регистрация побочных реакций при лечении.
Для верификации диагноза пациентам проводили эндоскопические и/или рентгенологические методы исследования. Пациенты ежедневно заполняли дневник наблюдений. Динамика клинических симптомов представлена в таблице 2. На фоне лечения Тримедатом у 83,3% больных отмечена отчетливая положительная динамика клинических симптомов в основном уже в первые 10–12 дней лечения. Значительная положительная динамика отмечена при оценке опорожнения кишечника. У преобладающего числа больных (24 человека) стул имел мягкую консистенцию в виде мягких комочков или колбасовидной формы. Общая оценка эффективности Тримедата при лечении больных с СРК считалось отличной у 15 человек (50%), хорошей – у 10 человек (33,3%), удовлетворительный эффект отмечен у 4 больных (13,3%), неудовлетворительный – у 1 пациентки (3,4%).
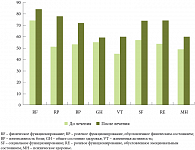
Клинический опыт использования Тримедата подтвердил безопасность этого лекарства. Побочных эффектов в проведенном нами исследовании не отмечено. Для оценки качества жизни пациентов на фоне терапии Тримедатом мы использовали русскоязычную версию опросника SF-36. Все пациенты заполняли опросник до и после 4-недельного лечения Тримедатом. Динамика показателей выявила тенденцию к улучшению качества жизни пациентов с СРК (рис.), но достоверных изменений ни в одном из 8 доменов опросника получено не было. Изучение метаболитов толстокишечной микрофлоры показало положительные сдвиги в экосистеме толстой кишки за счет восстановления среды обитания микрофлоры вследствие нормализации моторно-эвакуаторной функции кишечника.
Выводы
На основании вышеизложенного были сделаны следующие выводы:
- Эффективность Тримедата в лечении больных с СРК составила 83% у больных с разными расстройствами моторики толстой кишки, что позволяет рассматривать Тримедат® как универсальный регулятор моторики.
- Тримедат®, восстанавливая двигательную активность толстой кишки, купирует боли.
- Нормализуя моторно-эвакуаторную функцию кишечника, Тримедат® восстанавливает флору и ее функциональную активность.
Тримедат® следует активно использовать в клинической практике для купирования абдоминальной боли после исключения острой ее органической природы. Задачей врача является выбрать наиболее адекватный препарат, максимально быстро купирующий боль и обладающий минимумом побочных эффектов.