Нейропротективное действие миоинозитола: роль в профилактике гипоксических нарушений внутриутробного развития головного мозга
- Аннотация
- Статья
- Ссылки
- English




Введение
Нейропротекция мозга плода чрезвычайно важна как на ранних сроках беременности для профилактики врожденных пороков развития мозга, так и в течение всей гестации (особенно в последнем триместре) для профилактики ишемии головного мозга плода.
Аномалии развития центральной нервной системы плода возникают вследствие нарушений процессов размножения, миграции, дифференциации и программированной гибели клеток во время роста эмбриона. Значимый фактор формирования врожденных пороков развития мозга – сахарный диабет, осложняющий течение беременности не менее чем у 2,4% женщин [1].
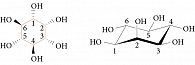
Профилактика врожденных пороков развития мозга фолатами неэффективна при так называемых фолатрезистентных пороках развития, поскольку фолаты – далеко не единственный микронутриент, необходимый для развития центральной нервной системы плода. В число главнейших нейроактивных микронутриентов, принимающих комплексное участие в эмбриогенезе и развитии мозга плода, входит миоинозитол (витамин В8), специфическая разновидность шестиатомных спиртов – инозитолов. Инозитолы (циклогексан-1,2,3,4,5,6-гексолы) представлены девятью стереоизомерами, из которых именно миоинозитол имеет принципиальное значение для функционирования всех типов клеток (рис. 1). Миоинозитол и его фосфатные производные (инозитолфосфаты, фосфатидилинозитоловые липиды) выступают в качестве важных передатчиков сигнала во внутриклеточных сигнальных каскадах.
В реферируемых научных журналах опубликовано более 40 тыс. работ о молекулярно-физиологических механизмах действия миоинозитола, включающих также результаты клинических исследований. Весь этот массив публикаций по миоинозитолу посредством современных методов интеллектуального анализа данных проанализировали О.А. Громова и соавт. [2]. Было установлено, что производные миоинозитола участвуют в передаче сигналов от рецепторов ростовых факторов и рецептора инсулина [3], расщеплении жиров и снижении уровня холестерина в крови [4], модуляции активности нейротрансмиттеров [5] и др.
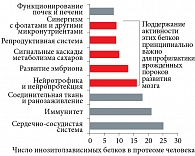
Анализ 120 миоинозитолзависимых белков протеома человека показал, что более половины из них вовлечены в поддержку жизнедеятельности сердечно-сосудистой системы, иммунитета и структуры соединительной ткани (в том числе состояния костей, хряща, кожи и процессов заживления ран). Не менее важно участие миоинозитола в метаболизме сахаров (прежде всего сигнальном каскаде инсулина) и обеспечении функционирования центральной нервной системы (включая нейротрофический и нейропротективный эффект) (рис. 2) [2].
Аномалии метаболизма миоинозитола ассоциированы с когнитивными нарушениями [6], депрессией [7], диабетической невропатией [8] и др. Фундаментальные и клинические исследования показали, что миоинозитол необходим для обеспечения нейрональной функции, включая синаптическую передачу и физиологические эффекты таких нейротрансмиттеров, как серотонин, дофамин, гамма-аминомасляная кислота, нейромедин. Миоинозитол нужен для нейрогенеза (оказывает нейротрофический эффект), нейропротекции (в том числе защиты клеток сетчатки глаза), осуществления процессов зрения, слуха, вкуса и долговременной потенциации в гиппокампе (поддержка памяти).
Столь широкий спектр биологических активностей миоинозитола позволяет предположить, что он может более специфически воздействовать на сигнальные каскады выживания нейронов в условиях стресса (гипоксии, нейротоксичности глутамата, энергетическом дефиците и гипогликемии, дисфункции митохондрий, избыточном воспалении и др.). В настоящей работе проведена валидация нейропротективного действия миоинозитола методами нейроцитологии, изучающими влияние веществ непосредственно на нейроны [9–11].
Нейроцитологические исследования дают возможность установить прямой нейропротективный эффект препаратов при разных стрессорных воздействиях. Например, при ишемии головного мозга таковыми являются энергетический дефицит, нейротоксичность глутамата, окислительный стресс, дисфункция митохондрий, метаболический ацидоз [12]. Благодаря нейроцитологическим исследованиям также можно показать влияние лекарственных средств на конкретные факторы стресса и доказать непосредственный эффект исследуемого препарата в отношении выживания именно нейронов (а не других типов клеток) [13, 14].
В настоящей работе представлены результаты экспериментальной валидации прямого нейропротективного действия миоинозитола в синергичной комбинации с фолиевой кислотой (препарат Фертина – 1000 мг инозита (миоинозитола), 100 мкг фолиевой кислоты в одном саше). Исследования проводились на зернистых нейронах мозжечка новорожденных крыс, выращенных в культуре в условиях глутаматного стресса. Уникальность этих исследований заключается в том, что они позволяют продемонстрировать прямое нейропротективное влияние миоинозитола на нейроны мозга плода. Во-первых, воспроизведение глутаматного стресса физиологически адекватно моделирует условия умеренной ишемии мозга, возникающей при внутриутробном развитии плода. Во-вторых, изучение влияния миоинозитола непосредственно на нейроны, без прохождения через центральное кровообращение, печень и другие системы организма, дает возможность доказать, что именно миоинозитол (а не какие-то другие изменения в организме, вызванные приемом препарата) проявляет нейропротективный эффект.
Материал и методы
В работе использовались семи-восьмисуточные культуры, полученные методом ферментно-механической диссоциации клеток мозжечка семидневных крыс по общепринятой методике. Животных умерщвляли летальной дозой эфирного наркоза, после чего пять минут стерилизовали 70%-ным спиртом. Далее извлекали мозжечок и переносили его в пластиковую чашку Петри, которая была заполнена фосфатным буфером, лишенным ионов кальция и магния. Фрагменты ткани инкубировали 15 минут при 37 оС в фосфатном буфере, содержащем 0,05% трипсина, 0,02% этилендиаминтетрауксусной кислоты и 0,8% глюкозы. После инкубации ткань промывали в двух сменах фосфатного буфера и один раз в среде культивирования, затем подвергали механической диссоциации в питательной среде для культивирования. В состав питательной среды входили 90% минимальной среды «Игла», 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 5 мМ KCl и 10 мМ буфера НЕРЕS, pH 7,2–7,4. Суспензию клеток центрифугировали в течение минуты при 1000 об/мин, супернатант удаляли, а осадок ресуспендировали в питательной среде.
Культивирование нейронов осуществляли в 96-луночных пластиковых планшетах, покрытых полиэтиленимином или полилизином (25 мМ хлорида калия). В каждую ячейку планшета добавляли по 0,1 мл суспензии клеток. Культивирование проводили в течение семи-восьми суток в СО2-инкубаторе, заполненном газовой смесью (95% воздуха + 5% СО2), при температуре 35,5 оС и относительной влажности 98%. К этому сроку культивированные зернистые нейроны достигали морфологической и нейрохимической зрелости. Состояние культур контролировали ежедневно и на каждом этапе эксперимента путем визуального просмотра в инвертированном микроскопе при фазовом контрасте. Вещества добавляли в среду культивирования на вторые сутки in vitro на весь срок культивирования (до семи суток). Исходя из концентрации вещества в пробирке (10 мМ) его минимально возможное разведение для добавления к культурам, позволяющее сохранить необходимые свойства питательной среды, составляло 1:10, то есть 1 мМ. Благодаря использованию 96-луночных пластиковых планшетов можно было тестировать сразу четыре различные концентрации образцов. Были выбраны следующие концентрации: 0,1, 0,2, 0,5 и 1 мМ.
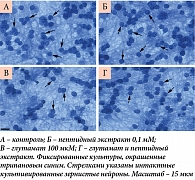
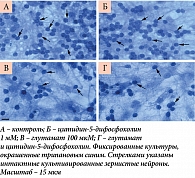
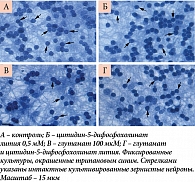
Количественную оценку выживаемости клеток проводили с помощью прямого подсчета живых нейронов. Клетки-зерна легко идентифицировать прижизненно как небольшие (7–10 мкм в диаметре) округлые или овальные нейроны. При окраске фиксированных культур трипановым синим хорошо видны ядра культивированных зернистых нейронов, занимающие большую часть тел нейронов и окруженные тонким ободком цитоплазмы (рис. 3).
Для каждого вещества было выполнено как минимум три эксперимента, причем для всех точек брали по три культуры, в каждой из которых фотографировали и просчитывали по пять последовательных полей зрения (как минимум 45 полей зрения из девяти культур трех независимых экспериментов). Количество нейронов с неизмененной морфологией в контрольных культурах принимали за 100%-ную выживаемость. Для статистического анализа использовали тест ANOVA с поправками Бонферрони и Даннета. Отличия между группами считали достоверными при p < 0,05. Результаты выражали как среднее ± SEM.
Результаты
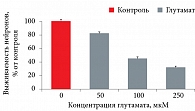
По данным предварительного моделирования повреждения культур нейронов глутаматом, было выявлено дозозависимое токсическое влияние глутамата на выживание нейронов (рис. 4). Выбор концентрации глутамата в каждом опыте осуществлялся таким образом, чтобы выживаемость культивированных зернистых нейронов составляла 30–80% от интактного контроля (что соответствует умеренному глутаматному стрессу). При выживаемости нейронов менее 30% (сильный глутаматный стресс) или более 80% (слабый глутаматный стресс) нейропротективные свойства веществ не так наглядны.
Известно, что нейропротективные свойства выявляются, как правило, при достаточно длительном применении. Поэтому в исследовании использовалась отработанная ранее «профилактическая» схема эксперимента: вещество вносилось в среду культивирования на вторые сутки и оставалось там до седьмых суток. Затем проводилась обработка клеток глутаматом и подсчитывалось число выживших нейронов [9]. Нейроцитологические эксперименты были проведены для миоинозитола и трех других нейропротективных средств: комплекса пептидов, полученных из головного мозга свиньи, цитидин-5-дифосфохолина, цитидин-5-дифосфохолината лития. В ходе исследования было использовано 1920 культур и выполнены подсчеты более чем для 200 тыс. нейронов.
Миоинозитол не проявлял токсических эффектов и не влиял на выживаемость культивированных зернистых нейронов в контроле, то есть в «холостом» эксперименте (без добавления глутамата). При воздействии глутамата миоинозитол в концентрации 0,2–0,5 мМ достоверно повышал выживаемость нейронов на 12–17%. Так, при концентрации миоинозитола 0,2 мМ выживаемость нейронов составила 54,9 ± 2,6%, при 0,5 мМ – 59,1 ± 2,9% (результаты контроля – 42,6 ± 2,2%, рис. 5). Изображения обсчитанных культур нейронов приведены на рис. 6.
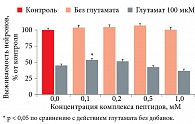
Другие средства продемонстрировали гораздо менее выраженные нейропротективные свойства. Комплекс пептидов, полученных из головного мозга свиньи, показал слабый, но достоверный нейропротективный эффект – увеличение выживаемости на 5–8%. Так, общая выживаемость при концентрации 0,1 мМ составила 53 ± 3%, 0,2 мМ – 52 ± 3% (в контроле – 45 ± 2%, р < 0,05). Более того, при концентрации комплекса пептидов, равной 1,0 мМ, был обнаружен слабый токсический эффект – выживало всего 36,3 ± 2,6% нейронов (рис. 7). Фотографии культур из просчитанных полей зрения приведены на рис. 8.
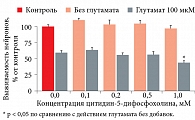
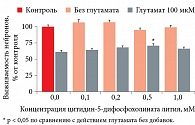
У остальных исследованных нейропротективных средств непосредственное нейропротективное влияние на выживание нейронов практически отсутствовало. Например, при воздействии цитидин-5-дифосфохолина выживаемость в контроле при действии глутамата составила 59,3 ± 3,0%, а при добавлении цитидин-5-дифосфохолина – не превышала 65% (0,1 мМ – 63,6 ± 3,6%, нет достоверных различий, p > 0,05). При этом более высокая концентрация цитидин-5-дифосфохолина (1 мМ) несколько уменьшала выживаемость культивированных зернистых нейронов – 43,6 ± 2,4% (рис. 9 и 10). Схожая ситуация наблюдалась и при использовании потенциального нейропротектора цитидин-5-дифосфохолината лития (рис. 11 и 12).
Обсуждение результатов
Результаты проведенного нейроцитологического исследования важны с точки зрения оценки нейропротективных эффектов как миоинозитола, так и «признанных» нейропротекторов. Как было отмечено выше, нейроцитологические исследования уникальны, поскольку позволяют подтвердить прямое нейропротективное влияние изучаемых веществ непосредственно на растущие нейроны плода. В то же время эффект других нейропротекторов может быть опосредованным: фосфохолин, например, может оказывать нейропротективное действие через поддержку функции печени [15].
По результатам проведения настоящей серии экспериментов установлено, что «профилактическое» применение миоинозитола (за пять суток до создания глутаматного стресса) достоверно и существенно (в среднем на 12–17%, р = 0,01) повышает выживаемость нейронов в культуре. Создание глутаматного стресса в культуре нейронов моделирует ишемию мозга плода, в частности при патологических родах. Обогащение клеточной среды миоинозитолом до создания глутаматного стресса соответствует профилактическим дотациям миоинозитола во время беременности. Поэтому полученные результаты нейроцитологического исследования имеют значение для антиишемической защиты мозга плода и в ранние, и в поздние сроки гестации.
Ишемический стресс, перенесенный эмбрионом в ранние сроки беременности, стимулирует формирование врожденных пороков развития мозга. Они возникают под действием разнообразных факторов тератогенеза: алкоголя, инфекционных заболеваний, передающихся от матери плоду, ионизирующего излучения, фармацевтических препаратов, никотина, вдыхаемого с сигаретным дымом, и др. Формирование врожденных пороков развития мозга также может быть следствием дисбаланса (как правило, недостатка) факторов роста, необходимых для роста эмбриона: витамина А, фолатов (витамина В9) и синергичных с ними пиридоксина (витамина В6), цинка, миоинозитола (витамина В8) и других эссенциальных микронутриентов [16].
Большинство (более 70%) врожденных пороков развития мозга (в том числе дефекты нервной трубки, расщелины неба) фолатчувствительны, и их формирование можно предупредить дотациями фолатов (предпочтительно в составе витаминно-минеральных комплексов) в ранние сроки беременности. В то же время формирование врожденных пороков развития мозга, несмотря на дотации фолатов, указывает на существование фолатрезистентных врожденных пороков развития мозга (30%). Риск формирования таких пороков развития можно значимо снизить путем приема препаратов миоинозитола [17], поддерживающего эмбриогенез и развитие плода [18].
Установленный непосредственный нейропротективный эффект миоинозитола – важная составляющая эмбриопротективного действия миоинозитола. В частности, трудно переоценить роль миоинозитола в профилактике врожденных пороков развития, связанных с инсулинорезистентностью, поскольку производные миоинозитола участвуют в процессах передачи сигнала от инсулинового рецептора [19]. Истощение миоинозитола в эмбриональной ткани на этапе органогенеза играет, по всей видимости, ведущую роль в индуцировании эмбриопатий, вызываемых гипергликемией. В эксперименте с моделями стрептозотоцинового диабета содержание миоинозитола в эмбрионах было ниже на 36% (p = 0,01) по сравнению с контролем, ассоциировалось с повышенной частотой нейронных повреждений (17,6% в основной группе и 1,9% в группе контроля, р < 0,001) и задержкой развития. Так, длина эмбриона в основной группе составила 3,37 ± 0,04 мм по сравнению с 3,87 ± 0,03 мм в группе контроля (p = 0,01), а число сомитов – 27,5 ± 0,2 и 29,1 ± 0,2 соответственно (p = 0,01) [20].
Миоинозитол способствует уменьшению инсулинорезистентности и одновременно необходим для преодоления негативного воздействия на нейроны повышенных уровней глюкозы. В эксперименте прием миоинозитола приводил к выраженному снижению частоты развития дефектов нервной трубки в модели стрептозотоцинового диабета, которая составила 9,5% в группе миоинозитола и 20,4% в группе контроля (р < 0,05) [21].
Анализ фолатчувствительных и фолатрезистентных моделей дефектов нервной трубки [22] в экспериментах по делеции генов позволил установить более 60 генов, инактивация которых приводит к появлению линий мышей с дефектами нервной трубки [23]. Не менее 22 из этих 60 генов кодируют белки и ферменты, активность или уровни которых существенно зависят от определенных микронутриентных кофакторов (таблица).
Воздействие миоинозитола (витамина В8) на процессы роста эмбриона неразрывно связано с активностью сигнального белка протеинкиназы С, которая поддерживает передачу сигнала от белковых факторов роста, гормонов и нейротрансмиттеров (простагландинов, адреналина, ацетилхолина, серотонина, ангиотензина и др.), регулирует вазодилатацию и гликолиз и принципиально важна для процессов роста эмбриона. В эксперименте, проведенном во время нейруляции, было установлено, что противодействие миоинозитола формированию дефектов нервной трубки связано с активностью протеинкиназ C бета 1 и гамма [24].
Рассмотрим несколько генов/белков, перечисленных в таблице. В частности, фермент инозитол-1,3,4-трифосфат-5/6-киназа (ген Itpk1) – ключевой регуляторный фермент синтеза сигнальной молекулы инозитолгексакисфосфата (IP6) – внутриклеточной сигнальной молекулы, участвующей в регуляции ионных каналов, транспорте нутриентов и строительных материалов через клеточную мембрану (эндоцитозе, экзоцитозе), транскрипции и репарации ДНК [25]. Животные с делецией/инактивацией гена жизнеспособны, фертильны, но у их эмбрионов часто обнаруживались дефекты нервной трубки, осевые дефекты скелета, замедление роста и повышенная гибель нейронов (рис. 13) [26]. Таким образом, миоинозитолзависимый фермент Itpk1 необходим для адекватного развития нервной трубки и профилактики дефектов нервной трубки (рис. 14) [25].
Фермент фосфатидилинозитол-4-фосфат-5-киназа (PIP5K, ген PIP5K1С) катализирует синтез одной из основных внутриклеточных сигнальных молекул – фосфатидилинозитола дифосфата (PIP2). Изоформа фермента PIP5K-гамма необходима для развития сердечно-сосудистой и центральной нервной систем. Целенаправленная инактивация гамма-изофермента PIP5K в эксперименте вызывала многочисленные нарушения роста клеток и развития тканей, в том числе приводящие к сердечной недостаточности, усилению гибели нейронов и дефектам нервной трубки [27].
Заключение
Ишемические повреждения центральной нервной системы плода – основная причина многочисленных заболеваний нервной системы у новорожденных. На ранних сроках беременности хроническая ишемия центральной нервной системы приводит к порокам развития мозга, на поздних сроках она ассоциирована с высоким риском асфиксии в родах, дискоординацией родовой деятельности, повышенным риском постгипоксической энцефалопатии – так называемой минимальной мозговой дисфункции и детского церебрального паралича. Хроническая ишемия мозга плода усугубляется на фоне инсулинорезистентности и глюкозотолерантности.
Миоинозитол необходим для синтеза инозитолфосфатов и фосфатидилинозитоловых липидов, которые опосредуют передачу сигнала от рецепторов факторов роста и нейротрансмиттеров внутрь клетки. Эти производные миоинозитола крайне важны для развивающегося мозга, поскольку обеспечивают адекватную коммуникацию между нейронами, снижают хроническую ишемию нейронов и защищают от негативных эффектов глюкозотолерантности.
Представленные в работе результаты подтверждают выраженное нейропротективное влияние миоинозитола на рост нейронов в культуре в условиях глутаматного стресса (повышение выживаемости нейронов в среднем на 17%). Прямое нейропротективное действие миоинозитола указывает на значимость его использования как для профилактики пороков развития, возникающих на ранних сроках, так и для нейропротекции мозга плода на поздних сроках гестации. Подчеркнем, что в дотациях миоинозитола особенно нуждаются беременные, рацион которых перегружен углеводами, женщины с диабетом (в том числе гестационным), женщины, ранее родившие ребенка с пороком развития.
Существенное преимущество микронутриентной поддержки беременности миоинозитолом – высокая безопасность его применения. Даже крайне высокие дозы миоинозитола (12 г/сут) вызывают только легкие побочные эффекты со стороны желудочно-кишечного тракта (тошноту, метеоризм, диарею) [28], в то время как в реальной клинической практике даже в гораздо меньших дозах (0,5–4 г/сут), эффективных и полностью безопасных, миоинозитол положительно влияет на развитие мозга плода.
Работа выполнена при поддержке РФФИ (гранты 19-07-00356, 17-07-01419)
I.Yu. Torshin, PhD, O.A. Gromova, MD, PhD, Prof., A.G. Kalacheva, PhD, N.K. Tetruashvili, MD, PhD, E.V. Stelmashook, DBSci, PhD, L.G. Khaspekov, DBSci, PhD
Federal Research Center ‘Computer Science and Control’ of the Russian Academy of Sciences, Moscow
Ivanovo State Medical Academy
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
Scientific Center of Neurology, Moscow
Contact person: Olga A. Gromova, unesco.gromova@gmail.com
Myo-inositol is the basis for the synthesis of an important group of signal molecules, inositolphosphates, which mediate signal transmission from receptors of growth factors and neurotransmitters. Grants myo-inositol promotes the prevention of folate-resistant defects and neuroprotection of the fetal brain ischemia. The paper presents the results of a study of the effects of myo-inositol on the growth of cerebellar neurons in culture under glutamate stress. It is shown that the effects of myo-inositol on the survival of neurons (17%) exceed the effects of drugs that are usually used for neuroprotection (peptide extracts – 10%, choline preparations – no more than 3%). Confirmed in the present work, a direct neuroprotective effect of myo-inositol indicates the importance of the use of myo-inositol during pregnancy with the aim of neuroprotection of the fetal brain.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.