Нейропсихологические показатели у пациентов с умеренным когнитивным расстройством
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование были включены 338 пациентов старше 55 лет с диагнозом УКР, обратившихся в Клинику памяти. После первого визита пациенты прошли пятинедельный курс нейрореабилитации. Когнитивные функции оценивали при первом визите с использованием шкал MoCA, MMSE и CDT, а также при повторном визите в динамике спустя три года (n = 146).
Результаты. Включенные в исследование пациенты чаще всего неправильно выполняли задания по нейрокогнитивным шкалам, связанные с отсроченным воспроизведением и языковой функцией. Через три года после проведенной когнитивной нейрореабиалитации было зарегистрировано снижение всех подразделов шкал MoCA и MMSE, кроме раздела зрительно-пространственных функций, отсроченного воспроизведения и речи.
Обсуждение. Показатели, связанные с краткосрочной памятью и языковыми функциями, улучшились, согласно результатам MoCA и MMSE, через три года после реабилитации. Это может быть обусловлено наибольшим количеством заданий в ходе нейрореабилитации, направленных на мнестические и речевые функции. Необходимы дальнейшие исследования подразделов различных нейрокогнитивных шкал, возможностей персонализированного подхода к когнитивной нейрореабилитации в зависимости от пораженных областей, а также потенциала дифференцировки различных типов УКР.
Материал и методы. В исследование были включены 338 пациентов старше 55 лет с диагнозом УКР, обратившихся в Клинику памяти. После первого визита пациенты прошли пятинедельный курс нейрореабилитации. Когнитивные функции оценивали при первом визите с использованием шкал MoCA, MMSE и CDT, а также при повторном визите в динамике спустя три года (n = 146).
Результаты. Включенные в исследование пациенты чаще всего неправильно выполняли задания по нейрокогнитивным шкалам, связанные с отсроченным воспроизведением и языковой функцией. Через три года после проведенной когнитивной нейрореабиалитации было зарегистрировано снижение всех подразделов шкал MoCA и MMSE, кроме раздела зрительно-пространственных функций, отсроченного воспроизведения и речи.
Обсуждение. Показатели, связанные с краткосрочной памятью и языковыми функциями, улучшились, согласно результатам MoCA и MMSE, через три года после реабилитации. Это может быть обусловлено наибольшим количеством заданий в ходе нейрореабилитации, направленных на мнестические и речевые функции. Необходимы дальнейшие исследования подразделов различных нейрокогнитивных шкал, возможностей персонализированного подхода к когнитивной нейрореабилитации в зависимости от пораженных областей, а также потенциала дифференцировки различных типов УКР.

Введение
Деменция – тяжелое когнитивное снижение, при котором пациент вынужден отказаться от самостоятельного выполнения привычных задач ежедневной активности. Часто деменция развивается вследствие нейродегенеративного или сосудистого поражения головного мозга. Деменция оказывает выраженное негативное влияние на качество жизни пациентов и их родственников и существенно сокращает бытовую, социальную и профессиональную активность пациентов [1].
Обычно деменция развивается в пожилом и старческом возрасте [1]. По данным Всемирной организации здравоохранения, в 2023 г. насчитывалось 55 млн человек с деменцией. По прогнозам, к 2050 г. этот показатель возрастет до 139 млн [2]. Ежегодно фиксируется почти 10 млн новых случаев заболевания. Несмотря на значительный прогресс современной медицины и науки, снижения темпов роста деменции не ожидается [2]. Заболевание затрагивает такие функции, как память, внимание, речь, исполнительные и социальные функции, зрительно-пространственные навыки, что делает пациентов зависимыми от посторонней помощи. Затраты на содержание и уход за больными деменцией умеренной и тяжелой степени в Российской Федерации достигают 74,8 млрд руб. (данные приведены без учета финансового обременения родственников пациентов с деменцией, которые осуществляют уход за своими близкими дома). По некоторым расчетам, общая стоимость содержания и ухода пациентов с деменцией доходит до 315 млрд руб. [3].
В диагностике прогрессирующих когнитивных расстройств остается актуальным раннее выявление когнитивного дефицита: на стадии умеренного или субъективного когнитивного снижения.
Исходя из современных представлений, установить диагноз умеренного когнитивного расстройства (УКР) можно при наличии признаков объективного когнитивного снижения, не приводящего пациентов к социальной, бытовой и трудовой дезадаптации. В то же время диагноз субъективного когнитивного расстройства (СКР) может быть установлен при наличии субъективного ощущения когнитивного снижения, причем результаты нейропсихологического тестирования пациента не будут существенно отличаться от возрастной нормы [4].
Результаты проведенных исследований свидетельствуют о том, что УКР страдают около 19% людей в возрасте от 65 лет [5]. УКР не всегда прогрессирует в деменцию. Так, в ряде случаев УКР протекают стационарно или отмечается тенденция к снижению их выраженности [6], однако риск трансформации УКР в деменцию высок [7]. Раннее выявление и терапия пациентов с УКР может помочь замедлить развитие деменции [8].
УКР, как и деменция, может развиваться вследствие ряда причин: сосудистого, нейродегенеративного, дисметаболического, дизиммунного, инфекционного, токсического, опухолевого и/или паранеопластического поражения головного мозга. Такое разнообразие причин, несомненно, дополнительно затрудняет диагностику данного состояния.
Согласно классификации R. Peterson, пациентов с преобладанием снижения эпизодической памяти относят к пациентам с УКР амнестического типа, которое в свою очередь может быть монофункциональным (то есть проявляться страданием только памяти) и полифункциональным (нарушение памяти сочетается с нарушениями других когнитивных функций) [9]. Отдельно выделяют так называемый неамнестический тип УКР, при котором снижение памяти нехарактерно. Неамнестический тип УКР, так же как и амнестический, принято разделять на монофункциональный и полифункциональный варианты. Существуют и другие классификации УКР, в большей степени учитывающие возможности взаимодействия когнитивных функций [10].
Скрининговые инструменты количественного нейропсихологического тестирования играют большую роль в выявлении когнитивных нарушений. На данный момент нет единого представления о том, какая шкала наиболее эффективна [11]. Одним из самых популярных и чувствительных тестов в случае УКР считают Монреальскую шкалу оценки когнитивных функций (The Montreal Cognitive Assessment, MoCA) [12, 13]. MoCA была создана в 2005 г. как альтернативный метод краткой шкалы оценки психического статуса (1975) (Mini-Mental State Examination, MMSE) [14] – количественной скрининговой шкалы, считающейся эталоном оценки тяжести когнитивных нарушений у пациентов с болезнью Альцгеймера (БА) на стадии деменции разной степени тяжести. Но, к сожалению, она менее чувствительна к когнитивному снижению, достигающему степени УКР [15]. В основном по MMSE определяют базовые когнитивные функции, такие как ориентация, память, внимание и языковые функции [11]. В раздел ориентации входят вопросы о текущей дате и месте. Блок памяти включает воспроизведение трех слов сразу и спустя некоторое время. Концентрация внимания и пространственные функции оцениваются последовательным вычитанием 7 из 100 в пять шагов, языковые функции – названием двух предметов, показанных пациенту, заданием «возьмите лист бумаги, сложите его пополам и положите на стол», повторением фразы и написанием собственного предложения, а зрительно-пространственные функции оцениваются при копировании двух пересекающихся пятиугольников. Состоянию, сопоставимому с уровнем деменции при БА, соответствует порог 24 балла MMSE [16]. Однако некоторые исследования подчеркивают важность оценки социокультурных и социодемографических факторов, влияющих на балл разных групп населения. Именно поэтому важно учитывать местные стандарты [17].
MoCA оценивает широкий спектр когнитивных функций: ориентацию, память, внимание, языковые функции, зрительно-пространственные навыки, а также абстрактное мышление [12]. В отличие от MMSE блок памяти включает задание на запоминание пяти слов вместо трех, в блоке речи пациент называет изображенные объекты и повторяет более сложные фразы, а также называет слова на определенную букву. Зрительные и исполнительные навыки оцениваются более комплексными заданиями, включающими работу с трехмерной плоскостью. Усложнение заданий MoCA по сравнению с MMSE позволяет провести детальную оценку когнитивных нарушений, но время исследования пациентов также увеличивается [18].
В данной работе мы отдельно обращаем внимание на тест CDT (Clock Drawing Test). Это самостоятельный тест рисования часов, который часто используется для оценки функций, связанных с исполнительными и зрительными навыками для повышения точности диагностики в совокупности с другими методами [19].
Своевременная диагностика УКР открывает возможности для ранней профилактики деменции, в том числе проведения реабилитационных мероприятий для восстановления когнитивных функций и/или снижения скорости прогрессии когнитивных расстройств. Реабилитация пациентов с УКР и деменцией представляет комплексный подход и включает физические упражнения, когнитивную терапию и социальное взаимодействие [20]. Показано, что регулярная физическая активность связана с улучшением памяти, внимания и исполнительной функции, что является следствием улучшения кровообращения и активации нейропластических функций мозга [21]. Когнитивные программы, нацеленные на улучшение памяти и внимания, включают решение задач на запоминание, головоломки и другие задачи, в том числе современные компьютеризированные тренинги [22]. Реабилитация через социальное взаимодействие на групповых занятиях играет ключевую роль, в том числе вследствие улучшения эмоционального состояния пациентов [23]. В совокупности эти подходы направлены на улучшение когнитивных функций и качество жизни как пациентов, так и их родственников.
Ранее нами было проведено лонгитюдное исследование влияния генетических особенностей, лабораторных и нейровизуализационных показателей на динамику когнитивных нарушений у пациентов с УКР [24]. В данной работе мы сосредоточились на детальной оценке изменения клинических нейропсихологических параметров в рассматриваемой выборке пациентов в соответствии с результатами выполненного количественного нейропсихологического тестирования, в том числе на фоне проведенной когнитивной реабилитации.
Материал и методы
В исследование были включены 338 пациентов, которые амбулаторно обратились в Клинику памяти – филиал Психиатрической клинической больницы № 1 им. Н.А. Алексеева с жалобами на субъективное снижение когнитивных функций (снижение памяти, трудности удержания внимания, трудности подбора слов и др.).
Исследование проводилось в соответствии с рекомендациями Хельсинкской декларации и заключениями протокола № 5 от 20 сентября 2020 г. этического комитета ГБУ «Научно-исследовательский клинический институт оториноларингологии им. Л.И. Свержевского» Департамента здравоохранения г. Москвы и протокола № 1 от 25 января 2022 г. этического комитета ГБУ «Психиатрическая клиническая больница № 1 им. Н.А. Алексеева Департамента здравоохранения города Москвы». Все участники исследования были детально ознакомлены с ходом исследования и подписали информированное согласие.
Критериями включения в исследование были возраст старше 55 лет и диагноз УКР.
Критерии исключения: деменция, тяжелые коморбидные соматические заболевания, а также наличие текущей инфекции или анамнестических сведений о перенесенных заболеваниях гепатитами В, С и D, ВИЧ-инфекции, сифилисе, злоупотреблении психоактивными веществами, других психиатрических и неврологических состояний, которые могут объяснять когнитивное снижение.
Дизайн исследования, а также краткая характеристика выборки представлены на рис. 1. Ранее нами были детально проанализированы особенности выборки и проведено сравнение социо-демографических показателей рассматриваемых групп [24]. Текущая работа направлена на оценку выраженности нарушений различных когнитивных доменов. Для этого мы оценивали выраженность когнитивных нарушений, используя нейрокогнитивные шкалы MoCa, MMSE и 10-балльный тест рисования часов (CDT). Оценка когнитивных функций проводилась при включении в исследование (n = 338) и повторном визите через три года (n = 146).
После первого визита была проведен пятинедельный курс нейрореабилитации, в ходе которого пациенты были разделены на группы в зависимости от выраженности когнитивных нарушений. Далее проводились групповые когнитивные тренинги. Степень сложности заданий зависела от выраженности когнитивного снижения в группе. В статье отечественных авторов приведена подробная информация о проводимой когнитивной реабилитации в Клинике памяти [25].
Статистическую обработку полученных данных осуществляли с помощью программы IBM SPSS v. 27.0. Для описания блоков различных нейрокогнитивных шкал рассчитывали процент полностью правильно выполненных заданий, а также баллы по рассматриваемым шкалам. В частности, для повторного визита были определены среднее арифметическое (M) баллов по MMSE и MoCA, стандартное отклонение (SD), а также медианные значения показателей и квартили. Статистически значимые различия между первым и последующим визитом определяли исходя из критерия Фридмана для непараметрических повторных измерений (уровень значимости при p < 0,05).
Результаты
Оценка основных когнитивных доменов с помощью нейрокогнитивных шкал при первом визите
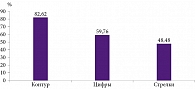
Прежде всего нами были проанализированы результаты оценки нейрокогнитивной шкалы CDT, отражающей сохранность зрительно-пространственных навыков. Доля испытуемых, правильно выполнивших части теста рисования часов (рисование контура часов, проставление циферблата, соответствие нарисованных стрелок озвученному времени), представлена на рис. 2. Наилучший результат получен при рисовании контура часов (82,62%), а наихудший – при указании обозначенного времени с помощью стрелок (48,48%).
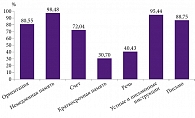
Другим важным критерием оценки когнитивных функций пациентов стал анализ шкалы MMSE. Процент испытуемых, которые правильно выполнили различные пункты MMSE, показан на рис. 3. Наилучший результат отмечался при немедленном повторении трех слов (98,48%), а наихудший – при отсроченном повторении тех же слов (30,70 %).
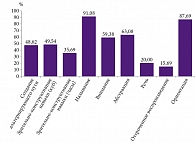
Для оценки изначального уровня когнитивных функций пациентов, обратившихся в Клинику памяти, также использовали нейрокогнитивную шкалу MoCA. Процент испытуемых, которые правильно выполнили различные блоки MoCA, показан на рис. 4. Наилучший результат зафиксирован при назывании животных на картинке (91,08%), ориентации в пространстве и времени (87,69%), а наихудшие – при отсроченном произведении запоминаемых слов (15,69%) и оценке беглости речи (20,00%).
Сравнение показателей подразделов нейрокогнитивных шкал при первом и повторном визите через три года после нейрореабилитации
На следующем этапе работы мы проанализировали значения подразделов MoCA и MMSE у пациентов, которые пришли на повторный визит через три года (n = 146).
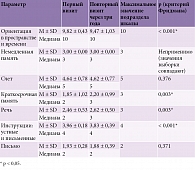
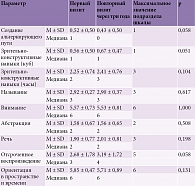
В таблице 1 приведена характеристика подразделов MMSE при первом и повторном визите через три года после проведенной нейрореабилитации.
При повторном осмотре статистически значимо повысилась успешность выполнения следующих блоков MMSE: краткосрочная память (p = 0,003), речь (p = 0,003). Некоторые подразделы шкалы (ориентация, счет, выполнение инструкций, письмо), наоборот, снизились при осмотре через три года. Следует отметить, как при первом, так и при повторном визите все пациенты с УКР полностью выполняли задание, в котором необходимо сразу повторить три слова (оценка немедленной памяти).
Наибольшая разница между двумя визитами наблюдалась при оценке краткосрочной памяти – повышение в среднем составило 0,35 балла после нейрореабилитации.
Характеристика подразделов MoCA при первом и повторном визите через три года после нейрореабилитации представлена в табл. 2.
При повторном осмотре наблюдалась тенденция к повышению успешности выполнения следующих блоков MoCA: зрительно-конструктивные навыки (как при рисовании куба, так и при рисовании часов), краткосрочная память и речь. Хотя не было статистически значимого эффекта, среднеарифметические баллы других подразделов шкалы (создание альтернирующего пути, называние животных, внимание, абстракция, ориентация), наоборот, снизилось при осмотре через три года.
Наибольшая разница между двумя визитами, как и по MMSE, наблюдалась при оценке краткосрочной памяти – повышение в среднем составило 0,51 балла после нейрореабилитации.
Обсуждение
Наша работа представляет детальную описательную характеристику снижений различных проявлений когнитивных функций у пациентов УКР, обратившихся в Клинику памяти г. Москвы, при нейропсихологическом тестировании по MoCA, CDT, MMSE, в том числе в динамике.
Результаты оценки теста рисования часов показали, что наибольшие трудности у участников исследования отмечены в отношении зрительно-пространственных функций (расстановка стрелок на часах), в меньшей степени для пациентов были характерны ошибки в данном тесте по типу импульсивности (расстановка цифр и целостность циферблата).
Оценка поддоменов MMSE показала, что наиболее выраженными когнитивными расстройствами у пациентов на момент включения в исследование были нарушения памяти, как правило в виде отсроченного воспроизведения запоминаемой информации. Указанные проблемы сочетались с речевыми расстройствами в виде трудностей воспроизведения фразы за исследователем. Сходные результаты получены при анализе поддоменов МоСА: у пациентов отмечались выраженные трудности запоминания и последующего воспроизведения списка слов в сочетании со снижением беглости речи при сохранении номинативной функции речи и нарушением зрительно-пространственных функций. Полученные результаты позволяют предположить, что наибольшее число включенных в исследование пациентов относятся к пациентам с полифункциональным амнестическим типом УКР. Подобный когнитивный паттерн обычно предполагает дальнейшее когнитивное снижение и в целом соответствует таковому при БА [26]. Сочетание зрительно-пространственных, речевых и мнестических расстройств отличает данный тип УКР от монофункционального амнестического когнитивного снижения, при котором наибольшее когнитивное снижение наблюдается при оценке краткосрочной памяти [27].
Нарушение памяти как ведущий когнитивный симптом у участников данного исследования соотносится с данными литературы о распространенности амнестического УКР [28]. В ряде работ оценивали индекс памяти по MoCA (MIS-MoCA) с начислением баллов в разделе отсроченного воспроизведения слов. При этом пациент получает 3 балла за припоминание слов без подсказки, 2 балла за названное слово с подсказкой и 1 балл за правильный выбор из нескольких предложенных вариантов [29, 30]. В связи с этим представляется перспективным дальнейшее изучение когорты пациентов с УКР с оценкой индекса подсказки и других индексов нейрокогнитивных шкал для дифференцировки различных подтипов УКР и персонификации получаемой терапии и реабилитации.
Проведенное исследование показало высокую чувствительность теста MoCA в отношении когнитивных расстройств при УКР по сравнению с MMSE и CDT. Это согласуется с данными литературы, также указывающими на более высокую эффективность MoCA по сравнению с MMSE [31].
При анализе выполнения CDT показано, что пациенты допускают больше ошибок в сложных пространственных заданиях (расстановка стрелок на часах) по сравнению с более простыми заданиями (рисование круга как контура часов). Полученные результаты согласуются с данными нейропсихологического исследования у пациентов с амнестическим УКР. Так, пациенты с БА на стадии УКР и даже легкой деменции часто не демонстрируют проблем с рисованием круга для часов, но затрудняются с правильной расстановкой стрелок. Вместе с тем выраженность зрительно-пространственных расстройств у включенных в исследование пациентов была меньше, чем степень снижения памяти. Полученные данные позволяют предположить, что тест рисования часов не является эффективным как сольный метод нейропсихологической диагностики и наибольшая эффективность может быть достигнута при сочетании теста рисования часов и тестов на запоминание с последующим воспроизведением (по МоСА или другим скрининговым шкалам, например mini-Cog). Сходные результаты получены и другими исследователями [32, 33].
Оценка состояния когнитивных функций у включенных в исследование пациентов после проведенной нейрореабилитации показала достоверное уменьшение выраженности мнестических и речевых расстройств. Положительная динамика по данным когнитивным подшкалам достигла характера статистической достоверности при оценке как по MMSE, так и по МоСА, но с меньшей чувствительностью метода. Подобные результаты весьма неожиданные, поскольку, как отмечалось выше, амнестический тип УКР в основном предполагает дальнейшее когнитивное снижение, особенно функции памяти.
Объяснить полученные нами результаты можно двояко. Во-первых, с учетом того, что пациенты получали персонифицированную когнитивную реабилитацию и при включении в исследование нарушения памяти были основным клиническим проявлением заболевания, вероятнее всего, большая часть заданий в процессе нейрореабилитации была посвящена тренировке памяти пациентов. Во-вторых, пациенты с нарушением памяти максимально хорошо отвечают на нейрореабилитацию. Полученные нами данные согласуются с результатами других исследований [26], но, безусловно, нуждаются в дальнейшем уточнении как в отношении динамики отдельных когнитивных поддоменов на фоне нейрореабилитации, так и в отношении прогрессирования нарушений памяти у пациентов с амнестическим типом УКР при наличии и/или отсутствии нейрореабилитации.
Заключение
Проведенное нами исследование показало, что наиболее распространенным является полифункциональный амнестический тип УКР. Оценка динамики когнитивных функций на фоне нейрореабилитации показала наибольшую эффективность данного метода лечения в отношении мнестических и речевых расстройств. Полученные данные могут быть результатом специфики заданий в программе нейрореабилитации, в основном нацеленных на улучшение мнестических функций. Нельзя исключать также и то, что нарушение памяти и речевых функций характеризуется наибольшим потенциалом к реабилитации. Необходимо дальнейшее детальное изучение динамики разделов нейрокогнитивных шкал на фоне реабилитации для ее дальнейшей персонификации, а также для оценки возможности использования этих тестов при дифференцировке различных видов УКР.
Работа выполнена в ГБУЗ «Психиатрическая клиническая больница № 1 им. Н.А. Алексеева Департамента здравоохранения города Москвы» (ГБУЗ «ПКБ № 1 ДЗМ») в рамках исполнения государственного задания на тему «Нейрокогнитивный тренинг в структуре медицинской реабилитации пациентов с нейродегенеративными когнитивными нарушениями разной степени выраженности» (ЕГИСУ НИОКТР рег. № 123031600063-1).
I.O. Morozova, A.I. Zeltser, V.M. Ushakova, A.V. Andryushchenko, O.V. Stepanushkina, O.A. Ratmirova, V.B. Savilov, M.V. Kurmyshev, I.S. Preobrazhenskaya, G.P. Kostyuk
N.A. Alexeev Mental-Health Clinic № 1, Moscow
V.P. Serbsky National Medical Research Centre of Psychiatry and Narcology
I.M. Sechenov First Moscow State Medical University
M.V. Lomonosov Moscow State University
Russian Biotechnological University
Contact person: Irina O. Morozova, irinashchelkanova@gmail.com
Introduction. Early detection and assessment of mild cognitive impairment (MCI) is critical to reducing the progression of dementia. Screening tools such as the Montreal Cognitive Assessment (MoCA), Mini-Mental State Examination (MMSE), and Clock Drawing Test (CDT) allow assessing key domains of cognitive decline and potential targets of cognitive rehabilitation. This paper assesses the severity of various manifestations of cognitive impairment in MCI, including over time, using the MoCA, MMSE, and CDT scales to characterize MCI symptoms and determine the impact of cognitive rehabilitation.
Material and methods. The study included 338 patients over 55 years of age with a diagnosis of MCI who came to the Memory Clinic. After the first visit, the patients underwent a 5-week course of neurorehabilitation. Cognitive functions were assessed at the first visit using the MoCA, MMSE and CDT scales, as well as at a follow-up visit over 3 years (146 patients).
Results. The patients included in the study most often incorrectly performed the tasks of the neurocognitive scales related to delayed recall and language function. Three years after the cognitive neurorehabilitation, a decrease in all subsections of the MoCA and MMSE scales was recorded, except for the section on visual-spatial functions, delayed recall and speech.
Discussion. The indicators related to short-term memory and language functions improved according to the results of the MoCA and MMSE scales three years after rehabilitation. The obtained result may be due to the largest number of tasks during neurorehabilitation aimed at mnemonic and speech functions. It is necessary to conduct further research on the subdivisions of various neurocognitive scales and to investigate the possibility of a personalized approach in cognitive neurorehabilitation depending on the affected areas, as well as the potential for differentiating between different types of MCI.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.