Новые возможности терапии тяжелого атопического дерматита у взрослых
- Аннотация
- Статья
- Ссылки
- English




Введение
Распространенность аллергических заболеваний (АЗ) в мире чрезвычайно высока, 150 млн человек только в Европе имеют тот или иной вид аллергии, 30% европейцев страдают аллергическим ринитом и конъюнктивитом, 20% – бронхиальной астмой, 15% – кожными аллергическими заболеваниями [1].
Атопический дерматит (АтД) – одно из распространенных аллергических заболеваний, встречающееся во всех странах, у лиц обоего пола и в разных возрастных группах, его частота достигает 20–40% в структуре кожных заболеваний [2]. Распространенность АтД среди детского населения составляет 20%, среди взрослого населения – 2–8% [3].
В клинической практике нередко встречается сочетание аллергических заболеваний: бронхиальной астмы, аллергического ринита, АтД [4]. Сегодня известно, что эти заболевания имеют общую патогенетическую основу – Т2-воспаление, ключевую роль в котором играют интерлейкины (ИЛ) 4, 5 и 13 [5, 6]. Общностью патогенеза обусловлена ассоциация АтД с респираторной аллергией – аллергическим ринитом и бронхиальной астмой.
Понятие и эпидемиология атопического дерматита
Атопический дерматит – многофакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения [3].
В развитии АтД играют роль генетические факторы: наличие мутации гена филаггрина, нарушение функции эпидермального барьера. Значение также имеет семейный анамнез аллергических заболеваний [7]. Развитие воспалительной реакции в коже происходит с участием Т-лимфоцитов. В острой фазе заболевания стимуляция Th2-клеток приводит к гиперпродукции иммуноглобулина (Ig) E, хронической – иммунный ответ переключается с Th2 на Th1 [8].
Атопический дерматит развивается у 80% детей, если оба родителя страдают этим заболеванием, и более чем у 50% детей – если болен один родитель. При этом риск развития заболевания увеличивается в полтора раза, если больна мать.
Раннее начало АтД (в возрасте от двух до шести месяцев) отмечается у 45% пациентов, в течение первого года жизни – у 60%. Спонтанная ремиссия заболевания к семи годам наблюдается у 65%, а к 16 годам – у 74% детей с АтД.
Нередко у пациентов с АтД наблюдается последовательное развитие других атопических заболеваний – аллергического ринита и бронхиальной астмы, так называемого атопического марша. Существует взаимосвязь между степенью тяжести АтД и развитием респираторных АЗ: у 20% детей со среднетяжелым течением и 60% с тяжелым течением могут присоединяться симптомы бронхиальной астмы и аллергического ринита [9]. Доказана роль аллергии к клещам домашней пыли, энтеротоксинам золотистого стафилококка, плесневым грибам, а также IgE-аутореактивности в механизмах развития заболевания [10].
Патогенез атопического дерматита
Кожа человека выполняет множество функций, в частности барьерную, направленную на предотвращение потери влаги и проникновение инфекционных или токсических веществ. Кожа является вторым органом по численности микроорганизмов. При этом показано, что плотность микробиома кожи составляет 1 млн бактерий на 1 см2 кожного покрова [11]. Микробиом обозначает совокупность микроорганизмов, объединенных одним органом или анатомической зоной. Кожа состоит из ряда ниш, которые колонизируются различными микроорганизмами [12]. Кожный барьер и микробиота защищают организм от внешних воздействий. Этот процесс сбалансирован, но на него постоянно влияют внутренние и внешние факторы, изменяющие состав микробиома и барьерную функцию кожи [11]. Микробиота кожи участвует в формировании иммунного ответа.
В коже больных АтД дендритных клеток (клеток Лангерганса) значительно больше, чем у здоровых людей. Дендритные клетки (ДК) презентируют антигены CD4+-Th2-лимфоцитам, которые активизируются и синтезируют цитокины ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-32, фактор некроза опухоли (ФНО) альфа при снижении секреции ИЛ-10, ФНО-гамма. При хронизации воспаления активизируются и Th1-, Th17-, Th22-клетки [3]. В поздней фазе аллергической реакции под действием ИЛ-5, ИЛ-6, ИЛ-8 усиливается миграция эозинофилов и макрофагов в очаг воспаления. Ключевыми цитокинами, вовлеченными в патофизиологические механизмы АтД, являются ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-31 и интерферон (ИФН) гамма. На сегодняшний день доказана патогенетическая роль ИЛ-4 в развитии аллергенспецифических IgE-опосредованных реакций при АтД, которая заключается в переключении синтеза антител на IgE. ИЛ-4 и ИЛ-13 связываются с общей субъединицей рецептора и имеют схожие биологические функции [13].
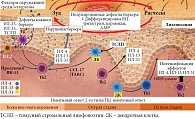
В результате зуда кожи при ее травматизации из кератиноцитов дополнительно высвобождаются нейропептиды и провоспалительные цитокины, усиливающие воспаление. В патогенезе АтД особая роль отводится барьерной функции клеток кожи. Филаггрин является ключевым структурным белком, отвечающим за функцию клеток кожи. Образующиеся полимеры профилаггрина дефосфорилируются, расщепляются с образованием мономеров филаггрина, способствующих поддержанию естественного увлажняющего фактора (группа метаболитов) и pH кожи, а также трансформации кератиноцитов в корнеоциты кожи [14]. Мутации в гене, кодирующем филаггрин, образуют усеченные полимеры профилаггрина, приводящего к нарушению морфологии кератиноцитов [15]. Как следствие – снижается барьерная функция кожи и повышается проницаемость для аллергенов окружающей среды (рис. 1) [5, 16].
В исследованиях показаны отличия микробиома кожи пациента с АтД от микробиома кожи здорового человека [17]. Продемонстрирована важная роль Staphylococcus aureus в развитии порочного круга АтД. Он способствует поддержанию воспаления и рецидивирующему течению АтД. Как известно, золотистый стафилококк (S. aureus) относится к условно-патогенной микрофлоре, однако при определенных условиях способен не только вызывать развитие вторичной инфекции на коже, но и поддерживать бактериальную сенсибилизацию и гиперпродукцию IgE. Золотистый стафилококк у 80–95% больных АтД является доминирующим микроорганизмом среди определяемых на пораженных участках кожи и у 70–75% больных на коже, свободной от высыпаний [17]. Хотя ведущую роль в механизмах развития осложненных форм АтД отводят S. aureus, у больных АтД могут развиваться и стрептодермии, вызванные гемолитическим стрептококком группы B (S. pyogenus), и смешанные стрепто-стафилодермии (обычно ассоциация золотистого стафилококка и гемолитического стрептококка), реже – пиодермии, обусловленные грамотрицательной флорой – синегнойной палочкой (Pseudomonas aeruginosa), обыкновенным протеем (Proteus vulgaris) [17].
Инфекционные агенты участвуют также в развитии и поддержании хронического аллергического воспаления кожи при АтД. Как правило, такое заболевание характеризуется частыми рецидивами, тяжелым течением и рефрактерностью к общепринятой терапии, что обосновывает необходимость назначения больным антимикробных средств.
Таким образом, микробная колонизация и суперинфекция кожи могут играть значимую роль в обострениях АтД.
Клинические проявления атопического дерматита
Клинические проявления АтД в разные возрастные периоды различны. Основные различия заключаются в локализации очагов поражения и соотношении экссудативных и лихеноидных компонентов высыпаний.
Атопический дерматит обычно развивается в первые месяцы жизни, принимая рецидивирующее течение с чередованием обострений, разных по длительности и ремиссии (полной или неполной).
Клиническая классификация АтД включает возрастные периоды болезни, стадии заболевания, распространенность кожного процесса и степень его тяжести [3].
Возрастные периоды болезни:
- I – младенческий (до двух лет);
- II – детский (от двух до 13 лет);
- III – подростковый и взрослый (от 13 лет и старше).
Младенческий период АтД обычно начинается с двух-трех месяцев жизни ребенка. В это время преобладает экссудативная форма заболевания, при которой воспаление носит острый или подострый характер. Отмечаются симметричные эритематозные, папуло-везикулезные высыпания на коже лица и волосистой части головы, экссудация с образованием чешуйко-корок. Впоследствии высыпания распространяются на кожу наружной поверхности голеней, предплечий, туловища и ягодиц, а также могут появляться в естественных складках кожи. Дермографизм обычно красный или смешанный. Субъективно отмечается зуд кожных покровов различной интенсивности. К концу указанного периода очаги сохраняются преимущественно в локтевых и подколенных сгибах, а также в области запястий и шеи. Обострения заболевания в значительной степени связаны с алиментарными факторами. Младенческий период АтД обычно завершается ко второму году жизни ребенка клиническим выздоровлением (у 60% пациентов) или переходит в следующий период (детский).
Детский период АтД характеризуется высыпаниями, которые носят менее экссудативный характер, чем в младенческом периоде, и представлены воспалительными милиарными и/или лентикулярными папулами, папуло-везикулами и эритематозно-сквамозными элементами, локализующимися на коже верхних и нижних конечностей, в области запястий, предплечий, локтевых и подколенных сгибов, голеностопных суставов и стоп. Характерно наличие зудящих узелков, эрозий и экскориаций, а также незначительная эритема и инфильтрация в области высыпаний на коже туловища, верхних и нижних конечностей, реже – на коже лица. Дермографизм становится розовым, белым или смешанным. Появляются пигментация век, дисхромии, нередко – ангулярный хейлит.
Подростковый и взрослый период АтД характеризуется высыпаниями преимущественно на сгибательной поверхности конечностей (в области локтевых и коленных сгибов, сгибательных поверхностей голеностопных и лучезапястных суставов), на задней поверхности шеи, в заушных областях. Высыпания представлены эритемой, папулами, шелушением, инфильтрацией, лихенификацией, множественными экскориациями и трещинами. В местах разрешения высыпаний в очагах поражения остаются участки гипо- или гиперпигментации. Со временем у большинства пациентов кожа очищается от высыпаний, пораженными остаются лишь подколенные и локтевые сгибы. Возможны гиперлинеарность ладоней и подошв, фолликулярный гиперкератоз («роговые» папулы на боковых поверхностях плеч, предплечий, локтей), хейлит, экзема сосков, складки на передней поверхности шеи. Наблюдается гиперпигментация кожи периорбитальной области, появляются складки под нижним веком (линии Денни – Моргана). Отмечается повышенная сухость кожи. Дермографизм белый стойкий или смешанный. Зуд выраженный, постоянный, реже – приступообразный. Нередко у подростков и взрослых преобладает лихеноидная форма заболевания, которая характеризуется сухостью, выраженным рисунком, отечностью и инфильтрацией кожных покровов, крупными, сливающимися очагами лихенизации кожи и упорным стойким зудом. Относительно редко наблюдается пруригинозная форма заболевания с характерными высыпаниями в виде множественных изолированных плотных отечных папул, на вершине которых иногда появляются мелкие пузырьки. Очаги поражения могут иметь распространенный характер с преимущественной локализацией на коже конечностей. Наиболее тяжелым проявлением АтД считается эритродермия, которая характеризуется универсальным поражением кожных покровов в виде эритемы, инфильтрации, лихенификации, шелушения и сопровождается симптомами интоксикации и нарушением терморегуляции (гипертермия, озноб, лимфоаденопатия).
Выделяют следующие стадии болезни:
- обострения (может быть фаза выраженных или умеренных клинических проявлений);
- ремиссии (может быть неполная и полная ремиссия).
По распространенности кожный процесс бывает:
- локализованным/ограниченным (площадь поражения кожи < 10%, локализация: локтевые и/или подколенные складки, кожа кистей рук, кожа шеи и/или лица);
- распространенным (площадь поражения кожи 10–50%: частично поражена кожа груди, спины; помимо локтевых и подколенных складок в процесс вовлекаются другие участки кожи конечностей (плечи, предплечья, голени, бедра));
- диффузным (площадь поражения кожи > 50%, локализация: кожа всего тела, волосистая часть головы).
Известны три степени тяжести кожного процесса. Легкое течение заболевания характеризуется преимущественно ограниченно-локализованными проявлениями кожного процесса, незначительным кожным зудом, редкими обострениями (реже одного-двух раз в год), продолжительностью рецидива до одного месяца, преимущественно в холодное время года. Длительность ремиссии – 8–10 месяцев и более. Отмечается хороший эффект от проводимой терапии.
При среднетяжелом течении имеет место распространенный характер поражения. Частота обострений – три-четыре раза в год с увеличением их продолжительности. Длительность ремиссий составляет 2–3 месяца. Процесс приобретает упорное течение с незначительным эффектом от проводимой терапии.
При тяжелом течении заболевания кожный процесс носит распространенный или диффузный характер с длительными обострениями, редкими и непродолжительными ремиссиями (частота обострений – пять раз в год и более, длительность ремиссии – 1–1,5 месяца). Лечение приносит кратковременное и незначительное улучшение. Выраженный зуд приводит к нарушению сна.
Рассматривают два основных фенотипа АтД.
Аллергический (экзогенный). Большинство пациентов (80–90%) имеют аллергическую форму АтД, для которой характерны:
- отягощенный атопический анамнез;
- связь с экзоаллергенами и респираторной аллергией;
- положительные кожные тесты с аллергенами;
- повышенный уровень sIgE у большей части больных.
Неаллергический (эндогенный). Такая форма АтД встречается реже – в 10–20% случаев, причем в основном у женщин. Сенсибилизация к экзоаллергенам не выявляется (нормальный уровень sIgE и отрицательные кожные тесты), как правило, признаки респираторной аллергии отсутствуют.
К неспецифическим факторам, вызывающим обострение АтД, относят:
- ирританты (горячая вода, избыточно хлорированная вода, моющие средства с щелочным рН, мочалки, стиральные порошки и отбеливатели, шерстяная и синтетическая одежда, тугая одежда, чистящие и дезинфицирующие средства, профессиональные химические агенты, в том числе производственный дым и запахи, контакт с соком свежих овощей и фруктов (томаты, цитрусовые, клубника));
- климатические и температурные;
- психологические;
- эндокринные;
- профессиональные;
- вирусные инфекции.
Течение АтД может осложниться присоединением вторичной инфекции (бактериальной, микотической или вирусной), что указывает на нарушение противоинфекционной защиты. На фоне АтД нередко возникает доброкачественная лимфоаденопатия (увеличение лимфатических узлов в шейной, подмышечной, паховой и бедренной областях). Рецидивирующий кератоконъюнктивит, хронический конъюнктивит, в тяжелых случаях – эктропион, формирование ранней катаракты, кератоконус – осложнения АтД со стороны глаз. Грозным осложнением АтД является эритродермия. При тяжелом течении АтД возникают различные психологические проблемы. В ряде случаев у детей с тяжелым АтД наблюдается отставание в росте.
Диагностика атопического дерматита
В диагностике АтД большую роль играют жалобы, анамнез пациента, которые позволяют оценивать характер течения заболевания, сроки его начала, наличие сопутствующих атопических заболеваний. Необходимо оценить влияние факторов, провоцирующих обострения дерматита, а также обратить внимание на склонность пациента к развитию бактериальных, вирусных и грибковых инфекций кожи. Важной может оказаться информация о наличии атопии у родственников пациента. Такой анализ позволяет оценить соответствие данных анамнеза основным и дополнительным диагностическим критериям АтД по J.M. Hanifin и G. Rajka [18].
Для диагностики АтД у пациентов всех возрастных групп используют диагностические критерии J.M. Hanifin и G. Rajka [18].
Чтобы поставить диагноз АтД, требуется наличие трех основных и не менее трех дополнительных критериев.
Основные диагностические критерии АтД:
- зуд кожи;
- типичная морфология высыпаний и локализация (дети первых лет жизни: эритема, папулы, микровезикулы с локализацией на лице и разгибательных поверхностях конечностей; дети старшего возраста и взрослые: папулы, лихенификация симметричных участков сгибательных поверхностей конечностей);
- ранняя манифестация первых симптомов;
- хроническое рецидивирующее течение;
- наследственная отягощенность по атопии.
Дополнительные критерии (позволяют заподозрить АтД, но являются неспецифическими):
- ксероз;
- положительные кожные тесты с аллергенами;
- ладонная гиперлинейность и усиление рисунка («атопические» ладони);
- стойкий белый дермографизм;
- экзема сосков;
- рецидивирующий конъюнктивит;
- продольная суборбитальная складка (линия Денни – Моргана);
- периорбитальная гиперпигментация;
- кератоконус (коническое выпячивание роговицы в ее центре).
Результаты показателей клинического, биохимического анализов крови важны как для диагностики АтД, так и для оценки сопутствующих заболеваний и состояний.
Повышение содержания общего и специфических IgE в сыворотке крови служит дополнительным диагностическим критерием АтД [19].
Кожное тестирование с экзоаллергенами проводится в отсутствие противопоказаний. Объем аллергологического обследования определяет аллерголог-иммунолог [20].
В ряде случаев для дифференциальной диагностики АтД с другими дерматозами у взрослых пациентов требуется проведение прижизненного патологоанатомического исследования биопсийного (операционного) материала кожи [21].
Дерматоскопия – еще один из приемов дифференциальной диагностики кожного процесса.
Для оценки степени тяжести атопического дерматита на момент осмотра используется показатель IGA (Investigators’ Global Assessment, глобальная оценка врача-исследователя). Поражение кожи оценивается визуально и пальпаторно. IGA представляет собой оценку по пятибалльной шкале от 0 до 4 баллов и отражает выраженность эритемы, утолщения (уплотнения) кожи и шелушения. 0 баллов соответствуют чистой коже, 4 балла (максимальная оценка) – АтД тяжелой степени [3].
В практике используется шкала SCORAD (Scoring of Atopic Dermatitis, шкала атопического дерматита). Индекс SCORAD предназначен для оценки степени тяжести АтД. SCORAD предусматривает балльную оценку шести объективных симптомов: эритемы, отека/папулезных элементов, корки/мокнутия, экскориации, лихенификации/шелушения, сухости кожи. Интенсивность каждого признака оценивается по четырехуровневой шкале: 0 – отсутствие, 1 – слабая, 2 – умеренная, 3 – сильная [3].
Индекс SCORAD рассчитывается по формуле:
SCORAD = А/5 + 7В/2 + С,
где A – распространенность поражения кожи;
B – сумма уровней интенсивности клинических симптомов АтД;
C – сумма оценок субъективных нарушений по визуальной аналоговой шкале.
На линейке внизу рисунка указывается точка, соответствующая степени выраженности оцениваемого субъективного признака, усредненное за последние трое суток. Значения индекса могут варьироваться в пределах от 0 (нет заболевания) до 103 (максимально тяжелое течение АтД).
Атопический дерматит легкой степени тяжести соответствует SCORAD < 25, средней степени – SCORAD от 25 до 50, тяжелой – SCORAD > 50.
Принципы терапии атопического дерматита
Основные цели терапии АтД:
- уменьшение клинических проявлений заболевания;
- снижение частоты обострений;
- повышение качества жизни больных;
- предотвращение инфекционных осложнений.
Необходимость избегать триггерных факторов – единая рекомендация для всех пациентов с АтД.
Лечение должно быть комплексным с учетом патогенетических особенностей IgE-зависимого и IgE-независимого механизма развития АтД, коморбидных состояний и заболеваний у конкретного больного.
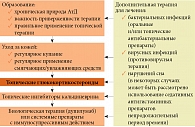
Общие рекомендации для пациентов с АтД (рис. 2):
- элиминационные мероприятия (контроль окружающей среды и др.);
- диета с учетом индивидуальных особенностей и спектра пищевой сенсибилизации;
- увлажнение кожи. Восстановление водно-липидного слоя и барьерной функции кожи;
- местная и системная фармакотерапия;
- коррекция сопутствующих заболеваний и состояний;
- обучение родителей и больного;
- реабилитация.
Согласно Европейским рекомендациям 2018 г., используется принцип ступенчатой терапии АтД (рис. 3) [22].
Независимо от формы, степени тяжести АтД все пациенты должны применять эмоленты, обеспечивающие увлажнение и смягчение кожи.
Выбор конкретного эмолента и его формы (лосьон, крем, мазь, моющие средства, средства для ванн) осуществляется индивидуально. Для достижения клинического эффекта необходимо использовать достаточный объем смягчающих средств, применять постоянно (не менее трех-четырех раз в день) как самостоятельно, так и после водных процедур [23].
Наружная терапия АтД включает в себя топические глюкокортикостероиды (ГКС), топические ингибиторы кальциневрина, препараты цинка. При выраженной инфильтрации назначают линимент нафталанской нефти [24]. Общие рекомендации по использованию местной противовоспалительной терапии основаны на трех принципах – достаточной силе, достаточной дозе и адекватном применении.
Топические ГКС. Существуют разные способы применения топических ГКС:
- интермиттирующий (чередование топических ГКС и нестероидных средств наружной терапии);
- ступенчатый (поочередное нанесение топических ГКС на различные участки кожного поражения);
- нисходящий или нисходящий интермиттирующий (переход с более сильного топического ГКС на более слабый или их чередование);
- штриховой (использование топического ГКС при большой площади поражения).
Комбинированные ГКС, содержащие антибактериальные и/или антимикотические компоненты, показаны только при клиническом и/или лабораторном подтверждении бактериальной и/или грибковой инфекции.
Топические ингибиторы кальциневрина. В международных согласительных документах по атопическому дерматиту ингибиторы кальциневрина в ряде случаев рассматриваются как альтернативная терапия топическим ГКС. Они рекомендуются для использования в качестве терапии второй линии для краткосрочного или интермиттирующего лечения у пациентов с АтД, которые имеют противопоказания или не отвечают на топические ГКС.
Топические ингибиторы кальциневрина – клеточно-селективные ингибиторы воспалительных цитокинов, которые действуют преимущественно на Т-лимфоциты, препятствуют образованию и высвобождению воспалительных цитокинов, таких как ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-8, ИЛ-10, ИФН-гамма, гранулоцитарно-макрофагальный колониестимулирующий фактор, ФНО, предотвращают пролиферацию Т-лимфоцитов, препятствуют высвобождению медиаторов воспаления (гистамин, триптаза, ФНО) из активированных тучных клеток [3].
Указанные препараты обладают высоким сродством к коже, избирательно воздействуя на кожное воспаление, проникают глубоко в эпидермис, вместе с тем характеризуются минимальной способностью к всасыванию, не влияют на синтез коллагена и тем самым не вызывают атрофию кожи.
Системная терапия атопического дерматита
Недавние успехи в изучении иммунопатогенеза АтД послужили толчком к разработке таргетных методов лечения, что ознаменовало начало новой эры в лечении тяжелых форм АтД [25]. Дупилумаб – новая перспективная возможность лечения Т2-ассоциированных аллергических заболеваний, таких как бронхиальная астма, АтД, полипозный риносинусит.
Пациентам с тяжелым течением АтД при невозможности применения биологической терапии или обострении рекомендуются системные ГКС перорально по схеме, доступной в национальных клинических рекомендациях по АтД [3]. В отдельных случаях назначают ГКС в инъекционных формах.
При тяжелом АтД у взрослых и в отсутствие противопоказаний назначается циклоспорин [3].
Для уменьшения интенсивности кожного зуда используют антигистаминные препараты перорально и парентерально.
Аллергенспецифическая иммунотерапия (АСИТ) может иметь положительный эффект у некоторых сенсибилизированных пациентов с АтД, лучшие результаты АСИТ продемонстрировала при наличии клеща домашней пыли [26].
У пациентов с респираторными аллергическими заболеваниями (аллергический ринит и легкая аллергическая бронхиальная астма), ассоциированными с АтД, нет противопоказаний для применения АСИТ.
Дупилумаб – моноклональное антитело, воздействует на рецептор ИЛ-4-альфа, блокируя тем самым сигнальные пути ИЛ-4 и ИЛ-13. В настоящее время дупилумаб (Дупиксент) одобрен в нашей стране, странах Евросоюза и США для дополнительной поддерживающей терапии бронхиальной астмы среднетяжелого и тяжелого течения у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или у пациентов с гормональнозависимой бронхиальной астмой, получающих пероральные ГКС, и для лечения среднетяжелого и тяжелого АТД у детей с шести лет, подростков и взрослых при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению, при этом дупилумаб может применяться в монорежиме или одновременно с топическими лекарственными средствами. Недавно зарегистрировано еще одно показание к терапии дупилумабом при назальном полипозе у взрослых пациентов [27].
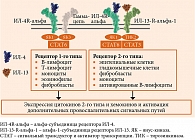
ИЛ-4 и ИЛ-13 действуют на различные клетки, участвующие в патогенезе AтД (рис. 4) [5]. Передача сигналов ИЛ-4 индуцирует активацию и дифференцировку как T2-клеток, так и В-клеток через путь JAK-STAT, а трансформация подкласса В-клеточных иммуноглобулинов приводит к увеличению продукции IgE. Оба цитокина стимулируют рекрутирование эозинофилов, действуют на дифференцировку кератиноцитов, что приводит к подавлению продукции филаггрина и молекул клеточной адгезии, способствуя тем самым образованию дефектов кожного барьера.
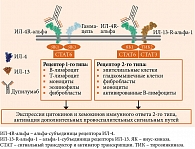
На рисунке 5 представлен основной механизм действия дупилумаба. Связываясь с ИЛ-4R-альфа-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13, дупилумаб блокирует сигнальные пути как ИЛ-4, так и ИЛ-13, тормозя активацию янус-киназы/сигнального трансдуктора и активатора транскрипции и приводя к уменьшению каскада воспаления, опосредованного Т2-клетками. Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом у пациентов снижает концентрации многих медиаторов Т2-воспаления, включая иммуноглобулин E, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, тимус-ассоциированный регуляторный хемокин), а также уровень фракции оксида азота в выдыхаемом воздухе (FeNO) – маркер эозинофильного воспаления в легких.
В исследовании J.D. Hamilton показано, что дупилумаб нормализует экспрессию воспалительных молекул T2-воспаления, что приводит к редуцированию кожного воспаления и восстановлению кожного барьера. Исследователи проанализировали экспрессию генов поврежденной и неповрежденной кожи до и после лечения дупилумабом [28]. Биопсия кожи была получена у 18 взрослых пациентов с АтД от средней до тяжелой степени, которые участвовали в двух клинических исследованиях I фазы эффективности дупилумаба (150 или 300 мг дупилумаба или плацебо один раз в неделю в течение четырех недель). Степень тяжести заболевания, оцененная по индексу экземы (EASI), значительно улучшилась у пациентов, получавших дупилумаб, по сравнению с пациентами, принимавшими плацебо.
Таким образом, введение дупилумаба влияет на экспрессию генов у пациентов с АтД через активацию структурных белков, белков липидного метаболизма и белков кожного барьера, а также подавление медиаторов воспаления и маркеров эпидермальной пролиферации. Указанные изменения завершаются нормализацией кожной структуры [25].
Эффективность дупилумаба
Результаты исследований эффективности дупилумаба подтверждены идентичными 16-недельными рандомизированными плацебоконтролируемыми исследованиями фазы III SOLO1 (NCT02277743) и SOLO2 (NCT02277769) [29]. Оба исследования включали взрослых пациентов (671 – в SOLO1 и 708 – в SOLO2) с АтД от умеренной до тяжелой степени, недостаточно контролируемым на фоне местного лечения.
Перед исследованиями 33% пациентов получали системные ГКС (как в SOLO1, так и в SOLO2); 25,9% (SOLO1) и 31,4% (SOLO2) использовали системные иммуносупрессанты [29].
В обоих исследованиях были достигнуты все первичные и вторичные конечные точки. Первичной конечной точкой обоих исследований служила оценка по шкале IGA (Investigator’s Global Assessment) (диапазон 0–4) после 16 недель лечения по сравнению с исходной. Проанализированы две ключевые вторичные конечные точки: одна касалась шкалы EASI (Eczema Area and Severity Index)-75 (доля пациентов, достигших 75%-ного снижения по шкале EASI), другая – улучшения зуда (определяемого как снижение на четыре пункта среднего еженедельного значения). В конце исследования монотерапия дупилумабом значительно улучшила признаки и симптомы AтД (зуд, сон и качество жизни) по сравнению с плацебо.
CHRONOS – исследование фазы III, направленное на оценку долгосрочного лечения (52 недели) умеренного и тяжелого АтД с применением дупилумаба и сопутствующих местных иммуносупрессоров по сравнению с плацебо [30].
Результаты исследования обобщили предыдущие данные. Клинические показатели, такие как IGA или EASI, значительно улучшились в группах дупилумаба и местных ГКС по сравнению с плацебо.
Следует отметить, что в конце исследования в группах дупилумаба было меньше обострений АтД (13% из тех, кто получал его раз в неделю, и 14% у пациентов, получавших препарат раз в две недели, по сравнению с 41% пациентов группы плацебо; p < 0,001).
Исследование CHRONOS продемонстрировало, что лечение дупилумабом (300 мг один раз в неделю или раз в две недели) снижает использование топических глюкокортикостероидов, а также системной терапии ГКС в первые 16 недель по сравнению с плацебо.
Безопасность дупилумаба
Все клинические исследования показали, что дупилумаб безопасен и хорошо переносится. Большинство побочных эффектов были легкими или умеренными и временными. Наиболее частым побочным эффектом у пациентов, получавших дупилумаб, была реакция в месте инъекции в виде преходящей эритемы или отека.
Конъюнктивит также отмечался в качестве побочного эффекта, связанного с применением дупилумаба [31]. Конъюнктивит чаще регистрировался в группе дупилумаба (2–11%), чем в группе плацебо (3%). Во всех исследованиях фазы III пациенты, получавшие дупилумаб, имели более значимые проявления конъюнктивита по сравнению с теми, кто получал плацебо. В большинстве случаев симптомы конъюнктивита были от легкой до умеренной степени выраженности и исчезали после местной терапии во время исследования.
Патогенез конъюнктивита, связанного с дупилумабом, остается невыясненным и требует дальнейших исследований.
Частота респираторных инфекций была одинаковой в группах дупилумаба и плацебо.
Головная боль чаще регистрировалась в группе дупилумаба (8–15%) по сравнению с группой плацебо (3%).
Пациенты, получавшие дупилумаб, чаще были инфицированы вирусами герпеса (5–12%) по сравнению с пациентами группы плацебо (2%), но все проявления инфекции были легкими или умеренными.
Следует отметить, что общая частота кожных инфекций была сходной в группах дупилумаба и плацебо.
Отмечено небольшое повышение уровня эозинофилов в течение первых 12 недель в группе пациентов, получавших дупилумаб. Остальные лабораторные показатели в обеих группах не различались [29].
Недавно опубликованы результаты длительного применения дупилумаба: на протяжении трех лет у взрослых пациентов и до 52 недель у подростков от 12 лет и старше с среднетяжелым и тяжелым атопическим дерматитом [32]. В этих исследованиях дупилумаб продемонстрировал благоприятный профиль безопасности и устойчивую эффективность, что полностью согласуется с ранее полученными результатами в контролируемых исследованиях.
Показания к применению дупилумаба
Дупилумаб применяют [27]:
- при АтД среднетяжелого и тяжелого течения у пациентов от шести лет и старше при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению. Препарат дупилумаб (Дупиксент) может применяться в монорежиме или одновременно с топическими лекарственными средствами;
- в качестве дополнительной поддерживающей терапии бронхиальной астмы среднетяжелого и тяжелого течения у пациентов в возрасте 12 лет и старше с эозинофильным фенотипом или пациентов с гормональнозависимой бронхиальной астмой, получающих пероральные ГКС;
- в качестве дополнительной поддерживающей терапии взрослых пациентов с плохо контролируемым тяжелым хроническим полипозным риносинуситом.
Режим дозирования дупилумаба
Препарат выпускается в предварительно заполненном шприце, содержащем 200 или 300 мг дупилумаба. Дупиксент (дупилумаб) вводят подкожно.
Рекомендуемая доза препарата дупилумаб у взрослых пациентов с АтД: начальная доза – 600 мг (две инъекции по 300 мг), далее – по 300 мг каждые две недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно.
Рекомендуемая доза препарата дупилумаб у пациентов в возрасте 6–17 лет в зависимости от массы тела:
- от 15 до < 30 кг: начальная доза – 600 мг (две инъекции по 300 мг), далее по 300 мг каждые четыре недели;
- от 30 до < 60 кг: начальная доза – 400 мг (две инъекции по 200 мг), далее по 200 мг каждые две недели;
- 60 кг и более: начальная доза – 600 мг (две инъекции по 300 мг), далее по 300 мг каждые две недели.
Инъекцию препарата может делать либо сам пациент, либо лицо, ухаживающее за ним. Необходимо до начала применения дупилумаба обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата, согласно указаниям в инструкции по медицинскому применению. Дупилумаб также может применяться у пациентов с сочетанием среднетяжелого и тяжелого атопического дерматита с тяжелой бронхиальной астмой.
Выбор терапии, ее объем, продолжительность, кратность применения лекарственных средств определяются лечащим врачом исходя из конкретной клинической ситуации, с учетом ответа на терапию и динамики кожного процесса.
Клинический случай
Пациент А., 24 года, работает курьером.
Жалобы на выраженный кожный зуд, покраснение кожи, высыпания в области конечностей, лица, шеи, груди, спины, обильное шелушение, приступы удушья, купируемые ингаляциями сальбутамола (до трех-четырех раз в неделю), постоянную заложенность носа.
Анамнез: с трехмесячного возраста – первые симптомы АтД, в возрасте одного года диагностирован распространенный АтД. Обострения АтД несколько раз в год, по поводу которых неоднократно получал лечение в стационарах. С трехлетнего возраста отмечались симптомы ринита, конъюнктивита, которые беспокоили круглый год, с шести лет – приступы удушья при контакте с домашней пылью, кошкой. Через два года – учащение приступов удушья в период с апреля по август. В девятилетнем возрасте обследован аллергологом. Диагностированы бронхиальная астма атопическая форма, аллергический ринит, выявлен спектр сенсибилизации (домашняя пыль, клещи домашней пыли, шерсть кошки, пыльца деревьев, злаковых трав). Назначена базисная терапия астмы (салметерол/флутиказона пропионат 25/250 мкг/доза по два вдоха дважды в сутки), сальбутамол ситуационно, эндоназально мометазона фуроат. На фоне терапии отмечался регресс назальной симптоматики, исчезла потребность в сальбутамоле. С семи лет проявления АтД значительно регрессировали: оставались только сухость кожи, высыпания в области локтевых сгибов, подколенных областей, которые возникали периодически и сопровождались зудом. Пациент использовал эмоленты, антигистаминные препараты. Нестойкая ремиссия АтД продлилась до 21 года. В течение последних трех лет АтД непрерывно рецидивирует, кожный процесс стал распространенным (лицо, туловище, конечности), сопровождается мучительным кожным зудом. Последнее обострение зафиксировано в сентябре 2020 г. после перенесенной ротавирусной инфекции: усилились гиперемия кожи, кожный зуд, появились обильные макуло-папулезные высыпания, отек в области лица с выраженной сухостью кожи, трещинами, болезненностью. Госпитализирован 6 ноября 2020 г. в аллергологическое отделение.
Аллергологический анамнез. Наследственность: мать пациента страдает поллинозом с клиническими проявлениями риноконъюнктивита, выявлена аллергия к пыльце деревьев. Дед по материнской линии страдал экземой. Старший брат пациента здоров.
Контакт с домашней пылью, шерстью кошки провоцирует приступы удушья.
В сезон пыления деревьев и злаковых трав учащаются приступы удушья и усиливаются симптомы аллергического ринита.
Низкая температура воздуха, физические нагрузки, отрицательные эмоции приводят к обострению кожного процесса.
Прием в пищу продуктов-гистаминолибераторов, употребление алкоголя ухудшают состояние кожи.
Нежелательных реакций на применение лекарственных средств не зафиксировано.
Анамнез жизни. Вредных привычек у пациента нет. Образование среднее техническое, однако последние три года работает курьером. С рождения пациента до шести лет в квартире жила кошка, в течение последних 18 лет домашних животных нет. Проживает с родителями, жилищные условия удовлетворительные. Профессиональных вредностей нет.
Медикаментозное лечение на момент госпитализации: цетиризин 10 мг, наружно мазь мометазона (Элоком), крем Ф99 полужирный, крем декспантенола/хлоргексидина (Бепантен плюс), салметерол/флутиказона пропионат 25/250 мкг/доза по одному вдоху два раза в день, сальбутамол 200 мкг три-четыре раза в неделю, эндоназально мометазона фуроат 200 мкг/сут.
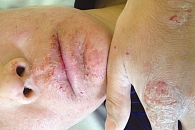
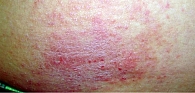
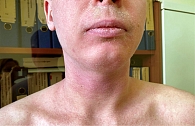
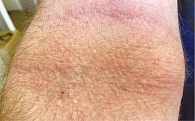
При поступлении состояние средней тяжести. Конституция нормостеническая, удовлетворительного питания. Гиперемия кожи туловища, конечностей в виде эритематозно-макулезных высыпаний, местами сливного характера и обильным лихеноидным шелушением, линейные или прерывистые следы расчесывания в локтевых сгибах, подколенных областях, на тыльной стороне кисти кожа с выраженными участками утолщения и папулами, с обильным лихеноидным шелушением и следами расчесов (рис. 6–8). Кожа лица отечна, гиперемирована (рис. 9), в области подбородка и губ трещины, шелушение, корочки. Общая оценка заболевания по шкале IGA – 4 балла. Индекс SCORAD – 58,8. Индекс EASI [33] – 47,2.
Лимфатические узлы по задней поверхности шеи при пальпации безболезненные, подвижные, мягко-эластичной консистенции. Носовое дыхание слегка затруднено с обеих сторон. Над всей поверхностью легких ясный легочный перкуторный звук. Дыхание везикулярное, выслушиваются сухие единичные хрипы на форсированном выдохе в заднебоковых отделах. Частота дыхательных движений – 16 в минуту. Тоны сердца ясные, ритмичные, частота сердечных сокращений (ЧСС) – 76 в минуту, артериальное давление – 115/70 мм рт. ст. Язык обложен белым налетом в области корня. Живот мягкий, безболезненный при пальпации. Печень, селезенка не увеличены. Стул регулярный, без патологических примесей. Область почек не изменена. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное, цвет мочи желтый без патологических примесей. Щитовидная железа визуально не увеличена, пальпация ее безболезненная.
Лабораторные исследования при поступлении. Общий клинический анализ крови: показатели в пределах нормы.
Клинический анализ мочи: показатели в пределах нормы.
Биохимический анализ крови: показатели в пределах нормы.
В крови иммуноглобулины А, М, G: показатели в пределах нормы.
Уровень С-реактивного белка – 2 мг/л (норма).
Общий IgЕ – 309 МЕ/л.
Повышены уровни специфических IgЕ к клещу домашней пыли, шерсти кошки, пыльце деревьев.
Инструментальные исследования. Электрокардиограмма: нарушение процесса реполяризации. ЧСС – 82 в минуту. Спирометрия: жизненная емкость легких – 4,16 л, 78,2%, форсированная жизненная емкость легких – 4,14 л, 81,3%, объем форсированного выдоха за первую секунду (ОФВ1) – 3,64 л, 84,4%, индекс Тиффно – 87,38%, пиковая объемная скорость выдоха – 8,92 л/c, 90,9%, средняя объемная скорость 25/75% – 3,80 л/c, 75,6%. Бронходилятационный тест с сальбутамолом (400 мкг) положительный. Прирост ОФВ1 – 250 мл и 13,47% от исходного значения.
Спиральная компьютерная томография (КТ) легких: КТ-признаков очаговых и инфильтративных изменений в паренхиме легких не выявлено. Эзофагогастроинтестиноскопия: недостаточность кардии. Признаки хронического рефлюкс-эзофагита. Гастрит смешанного характера с наличием внутрислизистых геморрагий в области свода желудка. Очаговый бульбит. Ультразвуковое исследование органов брюшной полости и забрюшинного пространства: деформация желчного пузыря. Ультразвуковое исследование щитовидной железы и паращитовидных желез: патологии не выявлено.
Диагноз: атопический дерматит, распространенная форма, тяжелого течения, стадия обострения. Бронхиальная астма, атопическая форма, средней степени тяжести, персистирующая, частично контролируемая. Аллергический персистирующий ринит средней степени тяжести. Аллергия к клещу домашней пыли, шерсти кошки, пыльце деревьев.
Сопутствующие заболевания: гастроэзофагеальная рефлюксная болезнь с рефлюкс-эзофагитом. Хронический гастрит. Хронический бескаменный холецистит.
В стационаре назначена терапия: метилпреднизолон 250 мг внутривенно на 200 мл физиологического раствора пять дней, лоратадин 10 мг внутрь десять дней, омепразол 20 мг внутрь десять дней, топическая терапия, начатая амбулаторно, продолжена. Эффект от проводимого лечения незначительный (отек лица регрессировал, несколько уменьшилась воспалительная инфильтрация кожи).
Обоснование для назначения дупилумаба. Пациент с младенческого возраста страдает атопическими заболеваниями: с трех месяцев – АтД, через три года присоединился аллергический ринит, позже – атопическая бронхиальная астма. Заболевания имеют персистирующее течение. Последние три года АтД приобрел непрерывно-рецидивирующее течение, несмотря на проводимое лечение. Терапия бронхиальной астмы давала лишь частичный контроль. Лечение, проводимое в настоящее время в стационаре, включая системные ГКС в высокой дозе, недостаточно эффективно. Принято решение о назначении биологической терапии дупилумабом. У пациента имеется показание для назначения такого лечения (АтД среднетяжелого и тяжелого течения у пациентов от шести лет и старше при недостаточном ответе на терапию топическими лекарственными препаратами или в случае, когда такие препараты не рекомендованы к применению; дупилумаб может применяться в монотерапии или одновременно с топическими лекарственными препаратами, как указано в инструкции к применению).
Первая инъекция дупилумаба 600 мг подкожно введена в условиях аллергологического отделения 13 ноября 2020 г. Местных и общих реакций на введение препарата не отмечалось.
Пациент выписан из стационара 18 ноября. Лечение дупилумабом планировалось продолжить. Существенного регресса симптоматики на момент выписки не зафиксировано. В клиническом анализе крови – эозинофилия 8%, изменений других показателей не отмечено.
Повторные инъекции дупилумаба в дозе 300 мг подкожно введены в стационаре 27 ноября, 11 и 25 декабря 2020 г. Нежелательных реакций на введение препарата не зарегистрировано.
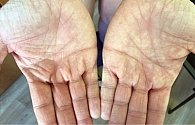
В первых числах января пациент отметил существенную положительную динамику: практически полностью исчезла гиперемия кожи, зуд возникает лишь при воздействии триггерных факторов (горячая вода), новых высыпаний нет, уменьшились воспалительная инфильтрация кожи, шелушение. Кожа стала более эластичной, исчезли трещины в области губ, значительно меньше беспокоит сухость кожи, экскориации почти исчезли (рис. 10–13).
Проведена оценка динамики течения заболевания с использованием IGA, SCORAD, EASI. Общая оценка заболевания по шкале IGA – 2 балла (исходно 4 балла), индекс SCORAD – 30,5 (исходно – 55,8), EASI – 18,3 (исходно – 47,2).
11 января 2021 г. биологическая терапия была продолжена, в стационаре провели очередную инъекцию дупилумаба 300 мг, нежелательных реакций (местных и общих) на введение препарата не зарегистрировано. Введение следующей дозы дупилумаба 300 мг запланировано на 25 января 2021 г. Пациент дополнительно использует эмоленты, гель и шампунь серии лечебной косметики Мустела. Продолжена базисная терапия бронхиальной астмы: салметерол/флутиказона пропионат 25/250 мкг/доза два раза в сутки, по поводу аллергического ринита – эндоназально мометазон 200 мкг/сут. Больной отметил повышение общего эмоционального фона.
Анализ итогов лечения дупилумабом. Применение биологической терапии позволило достичь клинического эффекта, которого не удавалось получить несколько лет от традиционной фармакотерапии. Значительно уменьшился объем топической терапии АтД, нет дополнительной потребности в антигистаминных препаратах. Пациент использует только эмоленты и средства лечебной косметики. Значительно улучшилось качество жизни, нормализовался сон, повысился эмоциональный фон. Нежелательных эффектов при использовании дупилумаба не зафиксировано. На наш взгляд, промежуточные результаты свидетельствуют о перспективности дальнейшего применения дупилумаба пациентом А.
Заключение
Общие патогенетические механизмы, лежащие в основе Т2-ассоциированных заболеваний, делают перспективным использование биологической терапии моноклональным антителом, направленным против общей субъединицы рецептора ИЛ-4/13, что приводит к подавлению функции ключевых цитокинов, участвующих в Т2-воспалительном ответе.
В России дупилумаб одобрен в 2019 г. и в настоящее время может применяться для дополнительной поддерживающей терапии пациентов в возрасте 12 лет и старше со среднетяжелой и тяжелой бронхиальной астмой, пациентов с АтД среднетяжелого и тяжелого течения с шести лет и в качестве дополнительной поддерживающей терапии взрослых пациентов с плохо контролируемым тяжелым хроническим полипозным риносинуситом.
Атопический дерматит не является угрожающим жизни заболеванием, но существенно снижает качество жизни пациентов и их окружения, повышает риск пищевой аллергии, астмы, аллергического ринита и других иммуноопосредованных воспалительных заболеваний.
Как и при многих других хронических заболеваниях, плохая приверженность терапии АтД является существенным препятствием для успешного лечения заболевания. Перед назначением любой фармакотерапии пациенты должны быть осведомлены о ее важности, основных принципах действия и возможных неблагоприятных реакциях.
На сегодняшний день дупилумаб – единственный биологический препарат для лечения АтД. Следует рассмотреть его назначение у пациентов со среднетяжелым и тяжелым течением АтД, у которых не удается достигнуть контроля на фоне традиционной фармакотерапии. Дупилумаб показал высокую эффективность и безопасность в терапии АтД у детей, подростков и взрослых.
Выбор оптимальной таргетной терапии, исходя из патогенеза Т2-ассоциированных заболеваний, является стратегически важной задачей и отвечает требованиям персонифицированной медицины.
E.V. Peredkova, PhD, O.V. Sebekina, PhD, N.M. Nenasheva, PhD, Prof., M.Yu. Peredelskaya
Russian Medical Academy of Сontinuous Professional Education
Contact person: Oksana V. Sebekina, sebekin1@mail.ru
Atopic dermatitis is a now not only large modern medical problem, but also a social problem all over the world. Epidemiological studies carried out in different countries show a high prevalence of the disease. Atopic dermatitis has a significant impact on the quality of life of patients and their family members and creates many negative socio-economic problems. Atopic dermatitis is a representative of immune-mediated, T2-associated diseases. IL-4, IL-13 play a key role in T2 inflammation, activating various mediators, cell types, promoting the production of specific IgE antibodies in B lymphocytes. The main clinical characteristics of the disease, diagnostic algorithm, principles of treatment are considered. The choice of the optimal therapy based on the pathogenesis of the disease is an important task for the clinician. Such treatment meets the requirements of personalized medicine. Biological preparations - a group of drugs that provide a point effect on the links of the pathogenesis of the disease. One of the indications for dupilumab (a monoclonal antibody aimed at blocking the signaling pathway of IL-4 and IL-13) is moderate to severe atopic dermatitis. The article presents a clinical case of severe atopic dermatitis, torpid to traditional methods of treatment. The rationale for the appointment of dupilumab in a specific clinical situation is given. An interim analysis of the use of dupilumab in a patient showed clinical efficacy, which manifested itself in a regression of symptoms, a decrease in the volume of traditional therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.