количество статей
7083
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Обзор клинических испытаний новых методов профилактики и лечения сахарного диабета у детей и подростков*
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №1 (9)
- Аннотация
- Статья
- Ссылки
В обзоре рассматриваются изучаемые в рамках клинических исследований способы подавления аутоиммунной реакции при стрессовом повреждении бета-клеток у больных сахарным диабетом 1 типа.
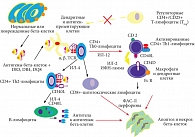
Рисунок. Иммунопатогенез СД 1 типа
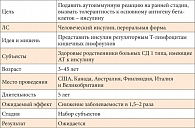
Таблица 1. Пероральный инсулин
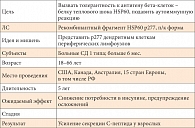
Таблица 2. DiaPep277

Таблица 3. Нейласта (Neulasta)
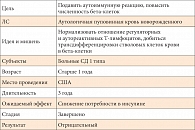
Таблица 4. Аутологичная пуповинная кровь
От идеи создания нового лекарственного средства до его выхода на рынок и широкого применения на практике в лучшем случае проходит 3 года, в худшем – 10–12 лет. Процесс вывода на рынок нового фармпрепарата выглядит примерно так: сначала рождается идея, затем разрабатываются технологии производства, потом продукт проходит доклинические испытания (раньше только на животных, теперь и на клеточных культурах в моделях in vitro), после этого – клинические исследования (КИ) и, наконец, выход на рынок. После этого на новом уровне проводятся дополнительные КИ.
Особенности проведения клинических испытаний
Как известно, существуют 4 фазы КИ. Нулевая и первая проводятся на здоровых добровольцах. На этих этапах прежде всего оцениваются безопасность препарата, а также различные фармакокинетические и фармакодинамические его параметры (объем распределения, скорость элиминации). Специфическая эффективность в отношении какого-либо заболевания оценивается во второй фазе КИ (при участии больных, в сравнении с плацебо или другими препаратами). Третья и четвертая фазы проводятся после выхода препарата на рынок, когда появляется возможность исследовать его эффективность на больших группах разных больных.
С учетом не только текущих испытаний, но и недавно закончившихся с тем или иным успехом, а также КИ, которые были прекращены по тем или иным причинам, на конец прошлого года в базе данных ClinicalTrials.Gov было зарегистрировано 135 975 КИ. На территории Российской Федерации в 2012 г. их число составило 2493, что немного меньше, чем в Японии (2534). Лидируют США (65 248), в Европе проведено 36 419 КИ. На долю сахарного диабета (СД) из общего количества (135 975) приходилось всего 9 тыс. испытаний (примерно 7%) – по 4 500 КИ в отношении лечения пациентов с СД 1 и 2 типа. С участием детей и подростков проведено КИ, касающихся СД 1 типа – 653, 2 типа – 586.
Актуальные вопросы профилактики и лечения СД 1 типа
Известно, что при этой патологии происходит аутоиммунное повреждение бета-клеток, в результате их количество, а также число других островковых клеток поджелудочной железы резко уменьшается. В результате формируется абсолютный дефицит инсулина. В соответствии с этими этапами патогенеза определяются мишени и цели проведения профилактики и лечения СД 1 типа: предупреждение аутоиммунной реакции, ее подавление, восстановление численности островковых клеток и нормализация секреции инсулина. Большое значение имеют коррекция метаболических нарушений (не только гипергликемии, но и дислипидемии, а также нарушений обмена других веществ), профилактика и лечение поздних осложнений СД. Согласно схеме иммунопатогенеза СД 1 типа (рис.), антигены нормальных или поврежденных бета-клеток представляются антиген-презентирующим клеткам. К ним, в частности, относятся дендритные клетки и др. Для представления антигенов, выходящих из бета-клеток, необходимы молекулы DR3, DR4, DQ8, которые мы обычно типируем для того, чтобы оценивать предрасположенность к СД.
Антиген-презентирующая клетка процессирует в себе антиген и через особые рецепторы представляет его CD4+ Th0-лимфоцитам. Эта популяция активируется под влиянием интерлейкина 12 (ИЛ-12) и превращается в активированные CD4+ Th1-лимфоциты. Другая часть Th0 под действием ИЛ-4+ превращается в CD4+ Тh2-лимфоциты, которые в дальнейшем будет стимулировать и вырабатывать ИЛ-4 и поверхностный антиген СD40L и стимулировать пролиферацию плазматических клеток, вырабатывающих специфические антитела уже к антигенам клеток. Основная роль в развитии дальнейшей аутоиммунной реакции разрушения бета-клеток принадлежит СD4+ Th0-лимфоцитам и СD4+ Th1-лимфоцитам. Первые за счет выработки ИЛ-4 стимулируют СD8-цитотоксические лимфоциты, а вторые – образование макрофагов и дендритных клеток, у которых возникла потеря толерантности по отношению к антигену бета-клеток. В цитотоксических лимфоцитах вырабатываются ФАС-лиганды (ФАС-Л) и перфорины – ферменты, которые играют ключевую роль в апоптозе и некрозе бета-клеток. Интерлейкин (ИЛ-1), фактор некроза опухоли (ФНО), оксид азота (NO), простагландин (ПГЕ-2) имеют тоже большое значение в гибели бета-клеток.На рисунке отражена лишь мизерная часть от общего числа молекул, участвующих в аутоиммунной реакции и разрушении бета-клеток при СД. И все же усилия ученых (иммунологов, иммуногенетиков, клеточных биологов, фармакологов), изучающих эти сложные процессы, постепенно начинают приносить плоды.
Проведенные КИ
Перечислю несколько, на мой взгляд, самых интересных КИ, три из которых уже доказали свою эффективность, а один вариант я специально привожу как пример неэффективного испытания.
Пример 1 Использование перорального инсулина для индукции толерантности к антигенам бета-клеток (табл. 1). Пероральный инсулин как средство профилактики начали применять в 1994 г. Это было первое и самое знаменитое в США исследование в области профилактики СД. Оно проводилось на сипсах больных с СД 1 типа и не дало никаких результатов. Частота заболеваемости не снизилась при лечении пероральным инсулином. В середине 2000-х гг. при ретроспективном анализе данных этого исследования выяснилось, что пероральный инсулин в определенных подгруппах пациентов все же снижает заболеваемость. Речь идет о тех пациентах, у которых в самом начале доклинического периода были антитела к инсулину, но не было других видов антител. Исследователи, организовавшие и проводившие КИ в 1990-х гг., все-таки получили разрешение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (United States Food and Drug Administration, FDA) на проведение повторного КИ уже на несколько измененных контингентах людей. Субъектами этого исследования являются здоровые родственники больных СД 1 типа (лица без каких-либо метаболических нарушений, характерных для СД). Эти люди имеют антитела к инсулину, но не имеют других видов антител. Их возраст составлял от 3 до 45 лет. В исследовании участвуют США, Канада, Австралия, Финляндия, Италия и Великобритания. Другие страны в исследование не принимаются. Ожидаемый эффект – снижение заболеваемости в 1,5–2 раза.
Пример 2 Это целая группа – 6 клинических многоцентровых испытаний, в которых исследуется синтетический белок теплового шока, точнее, его фрагмент DiaPeр277 (табл. 2). Что собой представляет белок теплового шока? Это антиген бета-клеток, который начинает на них экспрессироваться в условиях физиологического стресса (например, окислительный стресс при длительной перегрузке высокоуглеводной пищей у экспериментальных животных). Идея исследователей заключается в том, что если этот антиген будет вводиться путем подкожных инъекций к дендритным клеткам периферических лимфоузлов, то можно попытаться индуцировать толерантность к этому антигену и таким образом блокировать в самом зародыше аутоиммунную реакцию при стрессовом повреждении бета-клеток. В пилотных испытаниях уже было показано, что DiaPeр277 усиливает секрецию С-пептида у взрослых с впервые выявленным СД при длительности заболевания не более 6 месяцев. Эти результаты были встречены с большим интересом. В исследования включились 25 стран, в том числе Россия. В Москве они проводились в 4 исследовательских центрах: Эндокринологическом научном центре (проф. О.М. Смирнова), на кафедре эндокринологии и диабетологии Российской медицинской академии последипломного образования (проф. А.С. Аметов) и еще в 2 больших клиниках, причем только у взрослых. Официальные критерии включения – возраст от 18 до 66 лет, но в России в это исследование отбираются лица старше 22 лет.
Пример 3 КИ нацелено на подавление аутоиммунной реакции, но по другому принципу. В качестве лекарственного средства используется рекомбинантный фактор роста гранулоцитов (табл. 3). Идея такова: если мы будем вводить фактор роста гранулоцитов, он будет стимулировать размножение и дифференцировку гемопоэтических стволовых клеток в определенных направлениях, за счет этого удастся сбалансировать число регуляторных и аутореактивных Т-лимфоцитов. Если вернуться к схеме иммунопатогенеза СД 1 типа, то нужно отметить, что регуляторные Т-лимфоциты с фенотипом СD4+ и СD25+ играют очень важную роль в блокировании распознавания антиген-презентирующими клетками бета-клеточных антигенов. При срыве толерантности к антигенам бета-клеток этот блок перестает действовать. Препарат пэгфилграстим действительно приводит к увеличению относительного числа регуляторных Т-лимфоцитов и подавлению многих аутоиммунных процессов. Например, он эффективен при аутоиммунном ревматоидном артрите, системной красной волчанке, у некоторых пациентов с бронхиальной астмой. Именно на этом основании его пытаются использовать для подавления аутоиммунной реакции при СД 1 типа.
Пример 4 Провальное КИ (табл. 4). В Университете Флориды (Гейнсвилл, США) один научный сотрудник предложил использовать стволовые клетки (аутологичная пуповинная кровь) для того чтобы: 1) нормализовать отношения регуляторных и цитотоксических Т-лимфоцитов и 2) добиться трансдифференцировки введенных аутологичных стволовых клеток в бета-клетки. В этом исследовании участвовали дети (начиная от 1 года) с впервые выявленным СД 1 типа. Ожидался эффект снижения потребности в инсулине, но он не был достигнут. Более того, потребность в инсулине даже повысилась, а секреция С-пептида – снизилась. Примерно в 30% случаев результаты КИ оказываются не только не эффективными, но и приводят к ухудшению ситуации.
Каковы перспективы?
Родители пациентов – детей с первые выявленным СД 1 типа часто спрашивают: «Неужели нужна только инсулинотерапия?» На протяжении 10 лет я им говорю: «В самое ближайшее время появятся принципиально новые средства лечения СД 1 типа, которые будут подавлять аутоиммунную реакцию и, вероятно, вы когда-нибудь сможете избавиться от инсулинотерапии». 10 лет назад я в это свято верил, 5 лет назад у меня возникли в этом сомнения. А сейчас я абсолютно уверен в том, что через 4–5 лет на рынке появится альтернатива инсулину – достаточно специфичные иммуносупрессоры, направленные на подавление аутоиммунной реакции при СД 1 типа.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.