Доказанная эффективность и безопасность применения инсулина деглудек при лечении сахарного диабета 1 типа у беременных*
- Аннотация
- Статья
- Ссылки
- English
Инсулин деглудек представляет собой аналог базального инсулина нового поколения с улучшенным фармакокинетическим и фармакодинамическим профилями по сравнению с аналогами базальных инсулинов предыдущего поколения, однако данных о его применении во время беременности было недостаточно.
В статье представлены данные открытого международного рандомизированного контролируемого исследования EXPECT не меньшей эффективности использования инсулина деглудек во время беременности, которое проходило в 14 странах в 56 исследовательских центрах, восемь из них – российских. Из 225 женщин с СД 1 типа, принявших участие в исследовании, 67 были из России.
В исследовании EXPECT сравнивали эффективность и безопасность инсулина деглудек с инсулином детемир (оба в комбинации с инсулином аспарт) у беременных с СД 1 типа. Препаратом сравнения был выбран инсулин детемир, поскольку это первый аналог базального инсулина, одобренный к применению во время беременности и наиболее часто рекомендуемый в качестве препарата первой линии при выборе инсулина длительного действия для лечения СД у беременных.
Материал и методы. В исследование были включены женщины старше 18 лет с СД 1 типа, срок гестации у которых составлял от 8 (+0 дней) до 13 (+6 дней) недель и которые только планировали беременность.
Участниц исследования (1:1) рандомизировали с помощью интерактивной интернет-системы для применения инсулина деглудек в дозе 100 ЕД/мл один раз в день или инсулина детемир в дозе 100 ЕД/мл один или два раза в день, при этом оба препарата принимались в комбинации с инсулином аспарт в дозе 100 ЕД/мл. Беременные получали препарат исследования при рандомизации, на протяжении всего периода беременности и до 28 дней после родов (окончания исследования). Женщины, у которых на момент рандомизации беременность не наступила, начали прием препарата исследования до зачатия.
Первичная конечная точка – последнее запланированное измерение гликированного гемоглобина (HbA1c) перед родами (поле не меньшей эффективности 0,4% для деглудека по сравнению с детемиром). Вторичные конечные точки – эффективность, безопасность для матери и исходы беременности.
Первичную конечную точку оценивали у всех рандомизированных женщин, которые были беременны во время исследования. Безопасность – у всех участниц, которые были беременны во время исследования и получили хотя бы одну дозу препарата исследования.
Данное исследование зарегистрировано на сайте ClinicalTrials.gov под номером NCT03377699 и в настоящее время завершено.
Результаты. С 22 ноября 2017 г. по 8 ноября 2019 г. из 296 прошедших скрининг 225 женщин были рандомизированы для терапии инсулином деглудек (n = 111) или инсулином детемир (n = 114). Среднее значение HbA1c на исходном этапе беременности в группе инсулина деглудек составляло 6,6% при стандартном отклонении (SD) 0,6%, в группе инсулина детемир – 6,5% при SD 0,8%. В группе инсулина деглудек среднее значение последнего запланированного перед родами измерения HbA1c составило 6,2% (SD – 0,07%; 45 ммоль/моль), в группе инсулина детемир – 6,3% (SD – 0,07%; 46 ммоль/моль). Расчетная разница между группами лечения -0,11% (95% ДИ -0,31–0,08); -1,2 ммоль/моль (95% ДИ -3,4–0,9); p < 0,0001, что подтверждает не меньшую эффективность инсулина деглудек. При использовании инсулина деглудек не было зарегистрировано дополнительных проблем, связанных с безопасностью, по сравнению с применением инсулина детемир.
Инсулин деглудек представляет собой аналог базального инсулина нового поколения с улучшенным фармакокинетическим и фармакодинамическим профилями по сравнению с аналогами базальных инсулинов предыдущего поколения, однако данных о его применении во время беременности было недостаточно.
В статье представлены данные открытого международного рандомизированного контролируемого исследования EXPECT не меньшей эффективности использования инсулина деглудек во время беременности, которое проходило в 14 странах в 56 исследовательских центрах, восемь из них – российских. Из 225 женщин с СД 1 типа, принявших участие в исследовании, 67 были из России.
В исследовании EXPECT сравнивали эффективность и безопасность инсулина деглудек с инсулином детемир (оба в комбинации с инсулином аспарт) у беременных с СД 1 типа. Препаратом сравнения был выбран инсулин детемир, поскольку это первый аналог базального инсулина, одобренный к применению во время беременности и наиболее часто рекомендуемый в качестве препарата первой линии при выборе инсулина длительного действия для лечения СД у беременных.
Материал и методы. В исследование были включены женщины старше 18 лет с СД 1 типа, срок гестации у которых составлял от 8 (+0 дней) до 13 (+6 дней) недель и которые только планировали беременность.
Участниц исследования (1:1) рандомизировали с помощью интерактивной интернет-системы для применения инсулина деглудек в дозе 100 ЕД/мл один раз в день или инсулина детемир в дозе 100 ЕД/мл один или два раза в день, при этом оба препарата принимались в комбинации с инсулином аспарт в дозе 100 ЕД/мл. Беременные получали препарат исследования при рандомизации, на протяжении всего периода беременности и до 28 дней после родов (окончания исследования). Женщины, у которых на момент рандомизации беременность не наступила, начали прием препарата исследования до зачатия.
Первичная конечная точка – последнее запланированное измерение гликированного гемоглобина (HbA1c) перед родами (поле не меньшей эффективности 0,4% для деглудека по сравнению с детемиром). Вторичные конечные точки – эффективность, безопасность для матери и исходы беременности.
Первичную конечную точку оценивали у всех рандомизированных женщин, которые были беременны во время исследования. Безопасность – у всех участниц, которые были беременны во время исследования и получили хотя бы одну дозу препарата исследования.
Данное исследование зарегистрировано на сайте ClinicalTrials.gov под номером NCT03377699 и в настоящее время завершено.
Результаты. С 22 ноября 2017 г. по 8 ноября 2019 г. из 296 прошедших скрининг 225 женщин были рандомизированы для терапии инсулином деглудек (n = 111) или инсулином детемир (n = 114). Среднее значение HbA1c на исходном этапе беременности в группе инсулина деглудек составляло 6,6% при стандартном отклонении (SD) 0,6%, в группе инсулина детемир – 6,5% при SD 0,8%. В группе инсулина деглудек среднее значение последнего запланированного перед родами измерения HbA1c составило 6,2% (SD – 0,07%; 45 ммоль/моль), в группе инсулина детемир – 6,3% (SD – 0,07%; 46 ммоль/моль). Расчетная разница между группами лечения -0,11% (95% ДИ -0,31–0,08); -1,2 ммоль/моль (95% ДИ -3,4–0,9); p < 0,0001, что подтверждает не меньшую эффективность инсулина деглудек. При использовании инсулина деглудек не было зарегистрировано дополнительных проблем, связанных с безопасностью, по сравнению с применением инсулина детемир.


Введение
Отсутствие компенсации углеводного обмена у женщин с сахарным диабетом (СД) 1 типа повышает риск развития осложнений во время беременности, которые могут повлиять на здоровье как матери, так и ребенка [1–4]. Ранее проводившиеся исследования продемонстрировали более высокий риск самопроизвольных выкидышей, врожденных пороков развития, избыточного роста плода, частоты преждевременных родов, преэклампсии и перинатальной смерти у женщин с СД 1 типа по сравнению с основной популяцией [1, 2, 6–8]. Поэтому крайне важно поддерживать концентрацию глюкозы в крови в рекомендуемом целевом диапазоне на этапе планирования и во время беременности, при этом одновременно необходимо снижать риск гипогликемий [9]. В рекомендациях экспертов Американской диабетической ассоциации (American Diabetes Association – ADA) в качестве целевых значений гликированного гемоглобина (HbA1c) указаны значения менее 6,0% (менее 42 ммоль/моль), если они достижимы без выраженной гипогликемии.
Возможности инсулина детемир, аналога базального инсулина, во время беременности хорошо изучены, поэтому препарат получил широкое применение в клинической практике [10–13]. Так, в рандомизированном клиническом исследовании (РКИ) у беременных с СД 1 типа инсулин детемир способствовал улучшению контроля гликемии по сравнению с инсулином НПХ без увеличения риска развития гипогликемии у матери [10]. Международное наблюдательное исследование с участием 1457 беременных с установленным диагнозом сахарного диабета 1 и 2 типов продемонстрировало, что терапия инсулином детемир была сопоставима с терапией другими базальными инсулинами в отношении риска развития гипогликемии у матери, преэклампсии, серьезных врожденных пороков развития, перинатальной или неонатальной смерти и мертворождения [11].
Другие базальные инсулины, например инсулин гларгин в дозе 100 ЕД/мл, хотя и применяются широко, но не оценивались в РКИ при беременности [14]. Тем не менее метаанализ данных не продемонстрировал значимой разницы в эффективности и безопасности исходов для матери или новорожденного между инсулином гларгин в дозе 100 ЕД/мл и инсулином НПХ [15].
Несмотря на сообщения о применении инсулина сверхдлительного действия деглудек во время беременности [16–18], возможности его применения во время беременности официально не изучались.
Инсулин деглудек характеризуется улучшенным фармакологическим профилем «время – действие» по сравнению с аналогами базального инсулина предыдущего поколения, такими как детемир, гларгин в дозе 100 ЕД/мл. Пролонгированный и стабильный механизм всасывания инсулина деглудек обусловливает достижение периода полувыведения около 25 часов, плоского профиля действия и предсказуемого сахароснижающего эффекта в течение более 42 часов [19]. У пациентов с СД 1 типа инсулин деглудек обеспечивает большее снижение концентрации глюкозы в плазме крови натощак (ГПН) и более низкий риск развития ночной гипогликемии по сравнению с инсулином гларгин 100 ЕД/мл [20].
При использовании инсулина деглудек большее количество женщин с СД получат возможность забеременеть, поэтому проведенное РКИ, результаты которого изложены в данной статье, крайне актуально.
Целью данного исследования стало сравнение эффективности и безопасности однократного ежедневного применения инсулина деглудек и однократного или двукратного использования инсулина детемир в комбинации с инсулином аспарт у беременных с СД 1 типа.
Материал и методы
Дизайн и участники исследования
EXPECT – открытое международное исследование не меньшей эффективности применения инсулина деглудек по сравнению с эффективностью использования инсулина детемир, оба в комбинации с инсулином аспарт, в параллельных группах с активным контролем и лечением до достижения цели.
Исследование было проведено в соответствии с Хельсинкской декларацией и одобрено соответствующими этическими комитетами и органами здравоохранения согласно местным правилам.
Перед началом исследования все участники предоставили письменное информированное согласие на участие.
Женщины в возрасте 18 лет и старше с диагнозом СД 1 типа как минимум в течение одного года имели право на включение в исследование, если получали многократные ежедневные подкожные инъекции инсулина или продолжительные подкожные инфузии инсулина ≥ 90 дней до скрининга и если уровень HbA1c не превышал 8,0% (≤ 64 ммоль/моль) во время скрининга. Участницы исследования – планировавшие беременность в течение 12 месяцев после рандомизации (были готовы пройти консультирование перед беременностью) либо уже беременные одним живым плодом, гестационный возраст которого составлял от 8 (+0 дней) до 13 (+6 дней) недель, что было подтверждено результатами ультразвукового исследования.
Рандомизация
Пациентки были рандомизированы в соотношении 1:1 для получения либо инсулина деглудек (100 ЕД/мл) один раз в день, либо инсулина детемир (100 ЕД/мл) один или два раза в день, оба препарата применялись с инсулином аспарт (100 ЕД/мл), вводимым два – четыре раза в день в базис-болюсном режиме. Все препараты вводились подкожно. Был выбран открытый дизайн, поскольку время дозирования в группах лечения было неодинаковым. Рандомизация проводилась на основании наличия беременности, а также возможности продолжать использование устройства для непрерывного мониторинга гликемии, принадлежащего пациентке.
Процедуры
Рандомизированные в группу инсулина деглудек начали лечение в дозе 80% от предыдущей дозы базального инсулина в режиме один раз в сутки, рандомизированные в группу инсулина детемир начали лечение в дозе, эквивалентной предыдущей дозе базального инсулина из расчета один к одному в режиме один или два раза в сутки. Инсулин аспарт применялся в дозе, эквивалентной предыдущей болюсной дозе инсулина в единицах. Пациентки, беременные на момент рандомизации, получали препарат исследования после рандомизации, в течение всего периода беременности и 28 дней после родов, то есть до окончания исследования. Женщины, которые не были беременны на момент рандомизации, начали принимать препарат исследования до зачатия и получали его на протяжении всей беременности и до 28 дней после родов или до 12 месяцев, до наступления беременности. Не забеременевших в течение 52 недель исключили из исследования.
Во время исследования пациенток еженедельно опрашивали по телефону. Визиты к врачу осуществлялись каждые четыре недели – как во время периода зачатия, так и во время беременности. Время контактов последующего наблюдения – через 28 дней после родов, а также через 7 и 30 дней по окончании лечения или досрочного прекращения участия в исследовании.
Исходы
Основной конечной точкой исследования был уровень последнего запланированного перед родами измерения HbA1c. Данный показатель оценивали методом высокоэффективной жидкостной хроматографии в Био-Рад Лабораториз (Калифорния, США). Дополнительными конечными точками эффективности у матери выбраны доля достигших уровня HbA1c не более 6,0% (≤ 42 ммоль/моль), количество достигших уровня HbA1c не более 6,5% (≤ 48 ммоль/моль) от последнего запланированного до родов значения, последняя запланированная перед родами концентрация ГПН и последняя запланированная перед родами средняя постпрандиальная концентрация уровня глюкозы (ППГ), определяемая как среднее значение измерений концентрации глюкозы, полученное с помощью глюкометра через 90 минут после трех основных приемов пищи и записанное в дневнике наблюдения.
Дополнительные конечные точки безопасности для матери – частота эпизодов гипогликемии в течение беременности, охарактеризованных как любые, количество нежелательных явлений, вызванных лечением, в период беременности, преэклампсия при сроке беременности не менее 20 недель, способ родоразрешения, развитие угрожающей зрению ретинопатии, определяемой как пролиферативная ретинопатия или макулопатия относительно исходного уровня лечения, а также относительно исходного уровня беременности до конца визита во время лечения, и изменение массы тела относительно исходного уровня беременности до последнего запланированного визита перед родами.
Дополнительные конечные точки беременности и неонатальные конечные точки включали массу тела новорожденного при рождении, преждевременные роды (< 37 полных недель гестации), раннюю потерю плода (< 20 полных недель гестации), перинатальную смерть (внутриутробная смерть в период ≥ 20 полных недель беременности или неонатальная смерть в период < 7 полных дней после родов), неонатальную смерть (смерть младенцев в период ≥ 7 и < 28 полных дней после родов), наличие серьезных отклонений от нормальных показателей, классифицированных в соответствии с Европейскими согласованными действиями в отношении врожденных аномалий [21], живорожденных младенцев, количество нежелательных явлений у младенцев с момента рождения до окончания наблюдения и неонатальных эпизодов гипогликемии, определяемых как концентрация глюкозы в плазме крови ≤ 1,7 ммоль/л (31 мг/дл) в течение первых 24 часов после рождения или ≤ 2,5 ммоль/л (45 мг/дл) в интервале между 24 и 48 часами после рождения. Оценивались также уровни инсулина деглудек в пуповинной крови у живорожденных младенцев, изменение показателей жизненно важных функций у матери по сравнению с исходным уровнем лечения и исходным уровнем беременности, данные физикального обследования и лабораторных анализов (общего и биохимического анализов крови), а также дозы базального инсулина относительно исходного уровня беременности и по окончании лечения.
Исследовательские ретроспективные статистические сравнения проводились для дополнительных конечных точек безопасности – в отношении преждевременных родов, младенцев с высокой и низкой массой тела для гестационного возраста и гипогликемии новорожденных.
Создан независимый комитет по оценке нежелательных явлений для проверки отдельных нежелательных явлений, а именно тяжелая гипогликемия или гипогликемия, зарегистрированная как серьезное нежелательное явление, врожденные аномалии, а также внутриутробная или младенческая смерть, в соответствии с уставом комитета по оценке нежелательных явлений.
Статистика
Статистический анализ данных проводили с использованием программного обеспечения SAS 9.4M5. Для повышения безопасности участников результаты исследований регулярно контролировались независимым комитетом по мониторингу данных.
Результаты
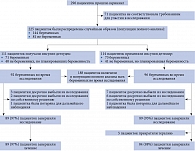
В период с 22 ноября 2017 г. по 8 ноября 2019 г. на предмет соответствия критериям исследования оценены 296 пациенток, 225 из которых были рандомизированы для получения инсулина деглудек (n = 111) или инсулина детемир (n = 114). Из 225 участниц исследования 188 были беременны. Из них 92 вошли в группу инсулина деглудек, 96 – в группу инсулина детемир. При этом 185 пациенток получили хотя бы одну дозу препарата исследования (инсулин деглудек – 91, инсулин детемир – 94) (рис. 1). Из 188 забеременевших во время исследования только 178 (95%) завершили его. Три женщины в группе инсулина деглудек и семь женщин в группе инсулина детемир выбыли из исследования или были потеряны для последующего наблюдения. В связи с пандемией COVID-19 не удалось провести оценку основной конечной точки у двух участниц, а 13 визитов в больницу для 11 участниц заменили на консультирование по телефону.
На момент скрининга из 225 участниц 94 (42%) получали инсулин гларгин (100 ЕД/мл или 300 ЕД/мл), 80 (36%) – инсулин детемир, 32 (14%) – инсулин деглудек, 12 (5%) – инсулин НПХ. Инсулин аспарт получали 143 (64%) пациентки из 225, инсулин лизпро – 59 (26%) (табл. 1). Из 225 участниц исследования 179 (80%) не проводили непрерывный мониторинг гликемии. Характеристики участниц на исходном уровне беременности были сходными между группами лечения. Однако в группе инсулина деглудек количество первородящих оказалось больше, чем в группе инсулина детемир, – 51 (55%) из 92 против 44 (46%) из 96 соответственно. Пациентки группы инсулина деглудек имели большую массу тела по сравнению с пациентками группы инсулина детемир – 70,5 и 67,8 кг соответственно.
Гликемический контроль
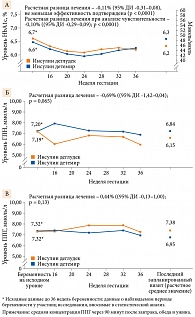
Уровень HbA1c при последнем запланированном перед родами измерении составлял 6,2% (45 ммоль/моль) у получавших инсулин деглудек и 6,3% (46 ммоль/моль) у принимавших инсулин детемир (стандартное отклонение (SD) – 0,07% для обеих групп лечения). Расчетная разница в лечении в отношении инсулина деглудек vs инсулина – -0,11% при 95%-ном доверительном интервале (ДИ) -0,31– 0,08 (-1,2 ммоль/моль (95% ДИ -3,4–0,9)) (p < 0,0001), что подтверждает не меньшую эффективность инсулина деглудек, чем инсулина детемир (рис. 2А). Аналогичные результаты получены при анализе чувствительности (см. рис. 2А). Количество участниц, у которых при последнем запланированном перед родами измерении HbA1c его уровень составил 6,0% и менее, в группах инсулина деглудек и инсулина детемир достигло 43% (n = 36/92) и 37% (n = 31/96) соответственно, не более 6,5% – 69% (n = 58/92) и 63% (n = 53/96) соответственно. Вероятность достижения этих целевых значений HbA1c статистически не различалась между группами лечения. Так, расчетное отношение шансов (ОШ) для уровня HbA1c ≤ 6,0% составило 1,95 (95% ДИ 0,92–4,17; р = 0,083), для HbA1c < 6,5% – 2,05 (95% ДИ 0,97–4,33; p = 0,062).
Среднее значение уровня HbA1c во время беременности для всех участниц представлено на рис. 2А.
В начале беременности среднее значение ГПН составляло 7,2 ммоль/л (SD – 3,0 ммоль/л) в группе инсулина деглудек и 7,2 ммоль/л (SD – 2,6 ммоль/л) в группе инсулина детемир. Среднее значение последнего запланированного перед родами измерения ГПН составило 6,2 ммоль/л (SD – 2,1 ммоль/л) в группе инсулина деглудек и 6,8 ммоль/л (SD – 2,5 ммоль/л) в группе инсулина детемир. Расчетная разница между группами лечения составила -0,69 (95% ДИ -1,42–0,04), не достигнув статистической значимости (p = 0,065) (рис. 2Б). Показатель ППГ на исходном уровне беременности был сопоставим в обеих группах лечения – 7,3 ммоль/л (SD – 1,9 ммоль/л) и 7,3 ммоль/л (SD – 2,0 ммоль/л) в группе инсулина деглудек и группе инсулина детемир соответственно. Среднее значение последнего запланированного перед родами измерения ППГ составило 7,4 ммоль/л (SD – 1,4 ммоль/л) в группе инсулина деглудек и 7,0 ммоль/л (SD – 1,6 ммоль/л) в группе инсулина детемир. Расчетная разница между группами лечения составила -0,44 (95% ДИ -0,13–1,00), не достигнув статистической значимости (p = 0,13) (рис. 2В).
Дозы инсулина
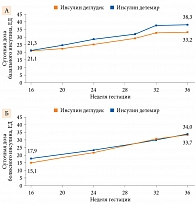
Средние общие суточные дозы инсулина в период беременности постепенно увеличивались в обеих группах. На 36-й неделе беременности средняя суточная доза базального инсулина составила 33,2 ЕД (SD – 22,4 ЕД) в группе инсулина деглудек и 38,3 ЕД (SD – 19,1 ЕД) в группе инсулина детемир (рис. 3А). При этом средняя суточная болюсная доза была сопоставимой между группами лечения – 33,7 ЕД (SD – 23,7 ЕД) и 34,0 ЕД (SD – 25,7 ЕД) в группе инсулина деглудек и группе инсулина детемир соответственно (рис. 3Б).
Безопасность
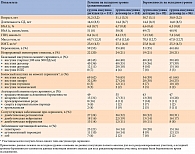
Данные о материнской безопасности представлены в табл. 2. Анализ основан на данных всех рандомизированных участниц, которые были беременны во время исследования и получили воздействие хотя бы одной дозы препарата исследования.
Частота развития любых гипогликемических событий и ночной гипогликемии в период беременности составила 118,5 в группе инсулина деглудек и 134,0 в группе инсулина детемир без клинически значимой разницы между группами. Так, расчетное отношение рисков (ОР) для любых эпизодов гипогликемии составило 0,97 (95% ДИ 0,74–1,27; р = 0,82), для ночных – 0,90 (95% ДИ 0,60–1,33; р = 0,59) (см. табл. 2). В группе инсулина деглудек зарегистрировали десять эпизодов тяжелой гипогликемии у пяти пациенток, в группе инсулина детемир – три эпизода тяжелой гипогликемии у двух участниц (расчетное ОР – 1,49 (95% ДИ 0,23–9,80); p = 0,68). Комитет по оценке нежелательных явлений выявил восемь эпизодов тяжелой гипогликемии у шести участниц группы инсулина деглудек по сравнению с четырьмя эпизодами у трех участниц группы инсулина детемир.
Необходимо отметить, что, согласно классификации ADA 2013 г. [22], любая гипогликемия – все эпизоды, возникшие в период беременности, включая тяжелую гипогликемию, подтвержденную симптоматическую гипогликемию, бессимптомную гипогликемию, вероятную симптоматическую гипогликемию и псевдогипогликемию. Для документально подтвержденной симптоматической гипогликемии и бессимптомной гипогликемии концентрация глюкозы в плазме крови должна составлять ≤ 3,1 ммоль/л. Ночная гипогликемия – любой эпизод, определяемый как указано выше и происходящий между 00:01 и 05:59 включительно. Тяжелая гипогликемия – эпизоды, требующие посторонней помощи для активного введения углеводов, глюкагона или других корректирующих действий.
Во время последнего запланированного визита перед родами средняя прибавка веса за период беременности по сравнению с исходным уровнем составила 12,0 кг (SD – 5,0 кг) в группе инсулина деглудек и 10,8 кг (SD – 5,0 кг) в группе инсулина детемир (см. табл. 2).
Клинически значимой разницы в отношении нежелательных явлений и серьезных нежелательных явлений между группами лечения не получено. Расчетное ОР для нежелательных явлений – 1,17 (95% ДИ 0,89–1,54), серьезных нежелательных явлений – 1,22 (95% ДИ 0,76–1,95). При этом ни одно нежелательное явление не привело к прекращению участия в исследовании пациенток в группе инсулина деглудек (см. табл. 2). Преэклампсия развилась у 12 и 7 женщин в группе инсулина деглудек и группе инсулина детемир соответственно (расчетное ОШ – 1,86 (95% ДИ 0,63–5,48)) (см. табл. 2).
У двух (2%) женщин в каждой группе к концу лечения развилась угрожающая зрению ретинопатия.
Способ родоразрешения был сходным в обеих группах лечения (см. табл. 2).
Данные о состоянии плода и новорожденного представлены в табл. 3. Анализ основан на данных полного анализа всех рандомизированных пациенток, которые были беременны во время исследования.
У всех беременных частота случаев ранней потери плода (< 20 недель гестации) и признанных серьезных аномалий была сходной между группами лечения.
У восьми плодов (новорожденных) в каждой группе лечения зарегистрированы серьезные пороки развития. С учетом того что рандомизацию беременных провели после восьмой недели гестации, а комитет по оценке нежелательных явлений оценил предполагаемые сроки органогенеза, четыре из восьми плодов (новорожденных) с серьезными врожденными пороками развития могли подвергаться воздействию инсулина деглудек во время органогенеза в группе инсулина деглудек, тогда как все восемь плодов (новорожденных) потенциально могли подвергаться воздействию инсулина детемир во время органогенеза в группе инсулина детемир.
Преждевременные роды произошли в 29 (34%) из 86 случаев живорождения в группе инсулина деглудек и 19 (22%) из 85 случаев живорождения в группе инсулина детемир (расчетное ОШ – 1,54 (95% ДИ 0,75–3,15)). Из 48 случаев преждевременных родов 41 был признан как поздние преждевременные роды (34–37 недель), 7 – как преждевременные роды (30–34 недели) (см. табл. 3).
Новорожденных девочек было 49% (n = 42/92) в группе инсулина деглудек и 38% (n = 32/96) в группе инсулина детемир.
Средняя масса тела новорожденных при рождении составила 3691 (2300–5960) г в группе инсулина деглудек и 3490 (1855–4750) г в группе инсулина детемир. Расчетная разница между группами лечения составила 148 г (95% ДИ -49–345), среднее значение SD массы тела при рождении у всех новорожденных – 1,5 г (для инсулина деглудек – 1,7 г, для инсулина детемир – 1,2 г). Рождение младенцев с высокой массой тела для гестационного возраста зафиксировано в 55 (64%) из 86 случаев живорождения в группе инсулина деглудек и 43 (51%) из 85 случаев живорождения в группе инсулина детемир (расчетное ОР – 1,65 (95% ДИ 0,87–3,15)). Количество новорожденных с низкой массой тела для гестационного возраста было незначительным в обеих группах лечения. Так, в группе инсулина деглудек зафиксирован 1 (1%) случай из 86, в группе инсулина детемир – 3 (4%) из 85 (см. табл. 3).
Новорожденных с неонатальной гипогликемией в течение первых 24 часов после рождения было 20 (23%) из 86 в группе инсулина деглудек и 19 (22%) из 85 в группе инсулина детемир (расчетное ОР – 1,02 (95% ДИ 0,53–1,97)). Таковых в интервале между 24 и 48 часами после рождения в обеих группах лечения было 4 (5%) и 5 (6%) соответственно.
Доля новорожденных с нежелательными явлениями после родов до последнего визита последующего наблюдения составила 63% (n = 54/86) в группе инсулина деглудек и 67% (n = 57/85) в группе инсулина детемир (расчетное ОР – 1,02 (95 % ДИ 0,70–1,48)) (см. табл. 3).
Клинически значимой разницы по сравнению с исходным уровнем беременности и по окончании лечения по показателям жизненно важных функций (средняя частота пульса, систолическое артериальное давление, диастолическое артериальное давление), данным физикального обследования или клинико-лабораторным параметрам (биохимический и общий анализ крови), оцениваемым во время исследования, не зарегистрировано.
Обсуждение результатов
Данное исследование продемонстрировало, что применение инсулина деглудек у беременных с СД 1 типа характеризуется не меньшей эффективностью в отношении контроля гликемии (изменение показателя HbA1c), чем использование инсулина детемир. При этом дополнительные проблемы, связанные с безопасностью, отсутствовали. Полученные результаты обнадеживают, поскольку инсулин детемир хорошо изучен и считается эффективным препаратом с хорошим профилем безопасности у беременных [10–13].
Инсулины деглудек и детемир способствовали увеличению частоты положительных ответов на лечение, а именно в отношении улучшения показателей HbA1c (≤ 6,0% и ≤ 6,5%), ГПН и ППГ, при этом клинически значимой разницы между группами не получено. Следует отметить, что доверительные интервалы OШ достижения определенных уровней HbA1c были относительно широкими.
Между группами, получавшими инсулин деглудек и инсулин детемир, наблюдались незначительные различия по частоте всех случаев гипогликемии и других исходов беременности для матери. Некоторые из этих диспропорций могут объясняться большим индексом массы тела (ИМТ) матери до зачатия и более высоким уровнем ППГ во время беременности в группе инсулина деглудек по сравнению с группой инсулина детемир. Тем не менее клинически значимой разницы между группами лечения в отношении развития гипогликемии (любой, ночной или тяжелой) или нежелательных и серьезных нежелательных явлений у пациенток не зарегистрировано.
Случаев перинатальной и неонатальной смерти не отмечено.
Между группами лечения результаты в целом были сходными в отношении основных врожденных аномалий, ранней потери плода (до 20 недель), преждевременных родов, гестационного возраста при рождении, массы тела при рождении и неонатальной гипогликемии.
У женщин в группе инсулина деглудек по сравнению с женщинами в группе инсулина детемир отмечена тенденция к повышению риска преждевременных родов, рождения детей, крупных к гестационному возрасту, и преэклампсии. В группе деглудек было больше пациенток с избыточной массой тела и первородящих. Возможно, что переход на другой инсулин на ранних сроках беременности мог повлиять на полученные результаты. Так, пациентки группы инсулина детемир в основном продолжили лечение инсулином детемир, тогда как пациентки группы инсулина деглудек после включения в исследование перешли на него с другого базального инсулина.
Проведенные ранее небольшие когортные исследования в условиях реальной клинической практики показали сопоставимую распространенность преждевременных родов и рождения детей, крупных для гестационного возраста, при использовании инсулина деглудек и других инсулинов [16, 18]. Для получения дополнительных доказательств в отношении влияния такого лечения на преждевременность родов требуется проведение наблюдательных исследований больших когорт беременных с СД 1 типа.
Результаты исследования EXPECT в отношении безопасности лечения в целом согласуются с результатами других РКИ и наблюдательных исследований применения аналогов базального инсулина у беременных с СД 1 типа [10, 11, 16–18].
Частота любых гипогликемий у женщин достигала 110–115 эпизодов, ночных гипогликемий – 18–19 эпизодов в РКИ, оценивавшем исходы у матерей при применении инсулина детемир по сравнению с применением инсулина НПХ [10].
Распространенность преэклампсии варьировалась от 7 до 11% в РКИ, в котором сравнивались перинатальные исходы на фоне лечения инсулином детемир и инсулином НПХ [12], и от 6 до 10% в проспективном наблюдательном сравнительном исследовании инсулина детемир с другими базальными инсулинами [11]. Это согласуется с полученными в данном исследовании значениями в отношении инсулина детемир (8%), но ниже значений в отношении инсулина деглудек (14%). Согласно метаанализу данных исследований, в которых сравнивался инсулин гларгин в дозе 100 ЕД/мл с инсулином НПХ, распространенность преэклампсии достигала примерно 8 и 11% соответственно [15]. В когортном исследовании в условиях реальной клинической практики, в котором приняли участие 67 женщин, распространенность преэклампсии у получавших инсулин деглудек до зачатия составила 10% и была сопоставима с таковой у применявших другие аналоги базального инсулина [18].
Важно отметить, что результаты исследования EXPECT в отношении среднего значения HbA1c, полученного в группах лечения, и преобладания новорожденных, крупных к сроку гестации, сходны с результатами исследования CONCEPTT, в котором оценивали эффективность непрерывного мониторинга глюкозы для контроля углеводного обмена у матерей, а также акушерских и неонатальных исходов беременности у пациенток с СД 1 типа [23].
Предел не меньшей эффективности для уровня HbA1c у матерей был несколько выше рекомендованного экспертами Европейского агентства лекарственных средств – 0,4 против 0,3% [24]. Однако эксперты Управления по контролю качества пищевых продуктов и лекарственных средств США отметили, что снижение уровня HbA1c на 0,3 или 0,4% можно рассматривать в качестве приемлемого критерия не меньшей эффективности сахароснижающих препаратов [25].
Таким образом, исследование EXPECT предоставляет доказательства эффективности и безопасности инсулина деглудек как у беременных, так и у женщин c СД 1 типа, планирующих беременность. У пациенток, планирующих беременность, важно начинать лечение до зачатия, которое должно предполагать междисциплинарный подход для оптимального выбора инсулина [9].
Заключение
Исследование EXPECT проводили среди случайно выбранных групп пациенток, которые либо уже были беременными, либо планировали беременность.
Результаты исследования свидетельствуют о том, что применение инсулина деглудек или инсулина детемир в комбинации с инсулином аспарт можно рассматривать в качестве варианта терапии СД во время беременности. Оптимизация дозы может проводиться индивидуально, независимо от того, беременна пациентка на момент начала лечения или нет. При необходимости переход на другой инсулин должен быть осуществлен на этапе планирования беременности для обеспечения оптимального контроля гликемии.
У беременных с СД 1 типа инсулин деглудек в комбинации с инсулином аспарт по сравнению с инсулином детемир в комбинации с инсулином аспарт продемонстрировал не только не меньшую эффективность в отношении показателей HbA1c до родов, но и отсутствие проблем, связанных с безопасностью лечения.
* В журнале «Эффективная фармакотерапия» опубликован расширенный реферат статьи E.R. Mathiesen, A.C. Alibegovic, R. Corcoy et al. Insulin degludec versus insulin detemir, both in combination with insulin aspart, in the treatment of pregnant women with type 1 diabetes (EXPECT): an open‑label, multinational, randomised, controlled, non-inferiority trial, подготовленный А.В. Тиселько, д.м.н., ведущим научным сотрудником отдела гинекологии и эндокринологии ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», и М.И. Ярмолинской, профессором РАН, д.м.н., профессором, заведующей отделом гинекологии и эндокринологии ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта», профессором кафедры акушерства и гинекологии ФГБНУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова». Оригинальная статья опубликована онлайн в Lancet Diabetes Endocrinol. 2023; 11 (2): 86–95; https://doi.org/10.1016/ S2213-8587(22)00307-2 и содержит дополнительные материалы.
A.V. Tiselko, MD, PhD, M.I. Yarmolinskaya, MD, PhD, Prof.
The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott
North-Western State Medical University named after I.I. Mechnikov
Contact person: Alena V. Tiselko, alenadoc@mail.ru
Diabetes mellitus (DM) remains a disease that determines the high frequency of obstetric and perinatal complications. Achieving the physiological values of glycemia as the main condition for the successful course and outcomes of pregnancy in women with diabetes remains a difficult task to date. To improve the quality of treatment of patients with DM 1 type, the method of basic bolus insulin therapy has been used for more than 30 years. Therefore, the emergence of new effective and safe insulins is extremely important for improving pregnancy outcomes in patients with diabetes.
Insulin degludec is an analogue of basal insulin of the new generation with improved pharmacokinetic and pharmacodynamics profiles compared to analogues of basal insulins of the previous generation, however, there was insufficient data on its use during pregnancy.
This article presents the results of an open international randomized controlled study of EXPECT no less effective use of insulin degludec during pregnancy, which took place in 14 countries in 56 research centers, 8 of them in Russia. Of the 225 women with DM 1 type who participated in the study, 67 were from Russia.
The EXPECT study compared the efficacy and safety of insulin degludec with insulin detemir (both in combination with insulin aspart) in pregnant women with DM 1 type. Insulin detemir was chosen as a comparison drug, since it is the first basal insulin analog approved for use during pregnancy and most often recommended as a first-line drug when choosing long-acting insulin for the treatment of diabetes in pregnant women.
Material and methods. The study included women over the age of 18 with DM 1 type, whose gestation period ranged from 8 (+0 days) to 13 (+6 days) weeks and who were just planning a pregnancy.
The study participants (1:1) were randomized using an interactive Internet system for the use of insulin degludec at a dose of 100 U/ml once a day or insulin detemir at a dose of 100 U/ml once or twice a day, while both drugs were taken in combination with insulin aspart at a dose of 100 U/ml. Pregnant women received the study drug at randomization, throughout the entire period of pregnancy and up to 28 days after delivery (the end of the study). Women who were not pregnant at the time of randomization started taking the study drug before conception.
The primary endpoint is the last scheduled measurement of glycated hemoglobin (HbA1c) before childbirth (a field of at least 0.4% efficiency for degludec compared to detemir). Secondary endpoints are efficacy, safety for the mother, and pregnancy outcomes.
The primary endpoint was evaluated in all randomized women who were pregnant during the study. Safety – for all participants who were pregnant during the study and received at least one dose of the study drug.
This study is registered on the website ClinicalTrials.gov numbered NCT03377699 and currently completed.
Results. From November 22, 2017 to November 8, 2019, out of 296 screened women, 225 were randomized for insulin degludec (n = 111) or insulin detemir (n = 114). The average HbA1c value at the initial stage of pregnancy in the degludec insulin group was 6.6% with a standard deviation (SD) of 0.6%, in the detemir insulin group -6.5% with SD of 0.8%. In the degludec insulin group, the average value of the last planned measurement of HbA1c before childbirth was 6.2% (SD – 0.07%; 45 mmol/mol), in the detemir insulin group – 6.3% (SD – 0.07%; 46 mmol/mol). The estimated difference between the treatment groups is -0.11% (95% CI -0.31–0.08); -1.2 mmol/mol (95% CI -3.4–0.9); p < 0.0001 which confirms the equally effective effectiveness of insulin degludec. When using insulin degludec, no additional safety-related problems were reported compared to the use of insulin detemir.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.