Доброкачественная гиперплазия предстательной железы как системное гормонально-метаболическое заболевание: время изменить парадигмы патогенеза и фармакотерапии
- Аннотация
- Статья
- Ссылки
- English
![Таблица. Возрастные изменения секреции ключевых гормонов и их клинические последствия [37]](/upload/resize_cache/iblock/01b/195_350_1/tuzikov1.jpg)
![Рис. 1. Физиологические эффекты витамина (гормона) D [38, 39]](/upload/resize_cache/iblock/af3/195_350_1/tuzikov2.jpg)
![Рис. 2. Возможные механизмы влияния витамина D на анатомо-функциональное состояние пузырно-уретро-простатического комплекса [47, 48]](/upload/resize_cache/iblock/01a/195_350_1/tuzikov3.jpg)
![Рис. 3. Физиологические функции ДГЭА [51]](/upload/resize_cache/iblock/583/195_350_1/tuzikov4.jpg)
![Рис. 4. Основные механизмы пролиферативных и канцерогенных эффектов инсулина [83, 89]](/upload/resize_cache/iblock/84f/195_350_1/tuzikov5.jpg)
![Рис. 5. Физиологические эффекты мелатонина [96, 97]](/upload/resize_cache/iblock/a98/195_350_1/tuzikov6.jpg)
![Рис. 6. Механизмы онкостатической активности мелатонина [101–104]](/upload/resize_cache/iblock/cee/195_350_1/tuzikov7.jpg)
![Рис. 7. Неклассические физиологические эффекты вазопрессина (АДГ) [128]](/upload/resize_cache/iblock/d01/195_350_1/tuzikov8.jpg)
![Рис. 8. Сопоставление периодов естественного течения ДГПЖ и времени наступления наиболее значимых возрастных гормональных дисбалансов при старении мужчины [9, 136, 137]](/upload/resize_cache/iblock/a06/195_350_1/tuzikov9.jpg)
![Рис. 9. Взаимодействие локальных и системных механизмов патогенеза ДГПЖ при старении мужчины [9, 137]](/upload/resize_cache/iblock/ecf/195_350_1/tuzikov10.jpg)
ДГПЖ: современные парадигмы и парадоксы патогенеза и фармакотерапии
Согласно общеизвестной парадигме патогенеза доброкачественной гиперплазии предстательной железы (ДГПЖ), это заболевание традиционно рассматривается как ассоциированное с возрастом хроническое прогрессирующее доброкачественное заболевание предстательной железы. Оно характеризуется развитием простатической железисто-стромальной гиперплазии и последующих симптомов нижних мочевых путей (СНМП) на фоне возрастного дисбаланса половых гормонов. Ключевыми механизмами патогенеза заболевания считаются повышение активности/гиперэкспрессии ферментов 5-альфа-редуктазы эпителия и ароматазы стромы, а также гиперактивность альфа-адренорецепторов и М-холинорецепторов нижних мочевых путей и предстательной железы, закономерно приводящие к появлению и прогрессированию обструктивных и/или ирритативных СНМП/ДГПЖ [1–3].
К сожалению, такое достаточно узкое патофизиологическое понимание сущности ДГПЖ как локального (органного) патологического процесса до сих пор диктует основные направления фармакотерапии данного заболевания. Как правило, применяются суперселективные препараты с преимущественно симптоматическими локальными эффектами в пузырно-уретрально-простатическом сегменте (чаще всего альфа-1-адреноблокаторы, М-холинолитики, агонисты бета-3-адренорецепторов, фитопрепараты, биорегуляторные пептиды, биологически активные добавки). Сегодня только две группы препаратов для лечения ДГПЖ реально способны оказать патогенетическое влияние на ее клиническое течение и прогрессирование – это ингибиторы 5-альфа-редуктазы (но частота их назначения, к сожалению, в пять раз ниже, чем симптоматических альфа-1-адреноблокаторов) и ингибиторы фосфодиэстеразы 5 типа. Даже если принять, что ДГПЖ есть локальная патология предстательной железы, то почему для ее лечения широко используются только симптоматические препараты, а не эффективные патогенетические? Это первый парадокс ДГПЖ.
Второй парадокс ДГПЖ. Если весь сценарий ДГПЖ происходит в условиях прогрессирующего дисбаланса половых гормонов, почему ни в одном современном руководстве по ведению пациентов с СНМП/ДГПЖ нет рекомендаций по гормональному скринингу, а препараты тестостерона до сих пор не указаны в качестве эффективных патогенетических средств при СНМП/ДГПЖ у гипогонадных мужчин? Между тем для такого утверждения накоплена внушительная доказательная база, а мужской гипогонадизм в научной литературе рассматривается как один из достоверных предикторов СНМП/ДГПЖ [4–10]. Видимо, до сих пор само слово «тестостерон» приводит в ужас многих урологов и онкологов из-за старого мифа 1941 г. о том, что «тестостерон – пища для голодной опухоли простаты». В XXI в. этот миф развеян и ушел в небытие благодаря революционным работам американского профессора А. Morgentaler и его коллег. Прогрессивные урологи и онкологи сегодня не боятся тестостерона [11–15]. Более того, в настоящее время предлагается принципиально новая парадигма патогенеза ДГПЖ. Задаются вопросы – только ли тестостерон нужен для поддержания оптимального гормонального гомеостаза в предстательной железе и только ли его возрастной дефицит способен приводить к простатической гиперплазии? Может быть, в этом процессе играют роль и другие ассоциированные с возрастом гормональные дисбалансы, поскольку ДГПЖ инициируется, формируется и прогрессирует не в изолированной лабораторной модели предстательной железы, а в организме в целом! Именно по этой причине следует рассматривать патогенез локальных (органных) изменений, характерных для ДГПЖ, в неразрывной связи с механизмами системного старения организма. И старение всего организма, и локальное старение предстательной железы (чем собственно и является ДГПЖ) представляют собой однонаправленные и прогрессирующие с возрастом процессы общебиологического старения с разницей лишь в уровнях локализации. Старение организма характеризуется системными факторами, а старение предстательной железы – клеточно-тканевыми факторами старения соответственно. Именно поэтому патогенез ДГПЖ должен рассматриваться не изолированно, а в рамках современных теорий биологического старения организма в целом.
ДГПЖ с точки зрения современных теорий биологического старения
В начале 1950-х гг. известный отечественный геронтолог профессор В.М. Дильман выдвинул и обосновал идею о роли нарушений гормонального гомеостаза как одного из пусковых механизмов клеточного и системного старения, которая к 1980-м гг. была постулирована им как элевационная (гормональная) теория старения. Согласно данной теории, старение и ассоциированные с возрастом заболевания следует рассматривать как обусловленный возрастными гормональными дисбалансами побочный продукт реализации генетической программы онтогенеза [16].
Онтогенетическая модель возрастной эндокринологии открыла новые подходы к профилактике преждевременного старения и болезней, связанных с возрастом и являющихся основными причинами смерти человека: болезней сердца, злокачественных новообразований, инсультов, метаболической иммунодепрессии, атеросклероза, сахарного диабета пожилых, ожирения, психической депрессии, аутоиммунных и других заболеваний. Из онтогенетической модели следует, что развитие болезней и естественных старческих изменений можно затормозить, если стабилизировать состояние гормонального гомеостаза на уровне, достигаемом ко времени окончания развития и стабилизации всех функций организма, что, по мнению В.М. Дильмана, происходит у человека в 20–25 лет. Вот почему, согласно его взглядам, «одним из эффективных средств профилактики рака и продления жизни может быть поддержание гормонов в организме человека на уровне 20–25-летнего возраста». Если замедлить скорость старения, можно увеличить видовые пределы продолжительности жизни человека [17].
Сегодня хорошо известно, что старение эндокринной системы – один из важнейших механизмов клеточного и системного старения. Новейшие научные данные не только подтверждают правильность идей В.М. Дильмана, но и обосновывают важную роль возрастных гормональных дисбалансов (прежде всего половых гормонов) в реализации таких доказанных ключевых механизмов биологического старения, как митохондриальная дисфункция и ускоренное старение теломер клеточных хромосом на фоне прогрессирующего с возрастом окислительного стресса. Последний усугубляет все выше описанные патологические процессы, замыкая порочный круг биологического старения. В этой связи своевременная коррекция возрастного андрогенного дефицита – это одна из важнейших и эффективнейших фармакотерапевтических опций антивозрастной терапии у мужчин. Следует отметить, что антивозрастная терапия одновременно демонстрирует высокую безопасность в отношении предстательной железы [18–20].
Роль гормонов в обеспечении клеточного метаболизма и стабильности генетического аппарата клеток подтверждается новыми данными. Так, в митохондриях клеток – главных производителей клеточной энергии и мощнейших внутриклеточных антиоксидантов, противостоящих окислительному стрессу, – выявлена активная экспрессия рецепторов к половым стероидным гормонам, а также к глюкокортикоидам, тиреотропным гормонам, мелатонину, инсулину, витамину D и др. [21–26]. Поэтому гормоны способны оказывать физиологическое влияние на клетки не только посредством геномных механизмов активации тех или иных генов ДНК ядра, активируя внутриклеточный рибосомальный синтез биологических трансмиттеров, роль которых в клетках выполняют клеточные факторы роста, но и путем негеномных влияний, прежде всего на ДНК митохондрий и их ферментные системы, участвующие в обеспечении упомянутых ранее ключевых биологических функций митохондрий в клетках [27]. Кроме того, активность ключевого фермента, обеспечивающего генетическую стабильность клетки, – теломеразы также зависит от уровня эндогенных гормонов (прежде всего половых стероидных гормонов). Их нормальный уровень рассматривается как предиктор генетической стабильности клетки и длительности цикла ее жизнедеятельности [28]. Так, в клинико-экспериментальных исследованиях показана способность тестостерона регулировать активность фермента теломеразы во многих клетках организма, включая герминогенный эпителий яичек, а также секреторный эпителий предстательной железы и семенных пузырьков [29–32].
Таким образом, эндокринные факторы являются своеобразными патогенетическими «связующими звеньями», объединяющими другие механизмы старения, постулированные наиболее популярными современными теориями биологического старения (в частности, теломеразной теорией и свободнорадикальной теорией, или теорией окислительного стресса) [33, 34]. В этой связи рассмотрение современного патогенеза и подходов к профилактике и терапии ДГПЖ как классического примера ассоциированного с возрастом заболевания у мужчин абсолютно невозможно без учета возрастных гормональных дисбалансов, поскольку предстательная железа – самый гормонозависимый орган у мужчин [35, 36]. В таблице представлены важнейшие возрастные гормональные дисбалансы, происходящие по мере биологического старения, и их системные и локальные (применительно к предстательной железе) последствия [37].
Роль наиболее значимых возрастных гормональных дисбалансов в патогенезе ДГПЖ
Дефицит витамина D
Традиционные представления о витамине D связаны прежде всего с его ключевой ролью в кальциево-фосфорном гомеостазе и влиянием на минеральную плотность костной ткани [38]. Однако он не является витамином в классическом понимании, поскольку биологически неактивен и только за счет двухступенчатого метаболизма в организме превращается в активную гормональную форму [38]. Витамин D обладает многообразными биологическими эффектами благодаря взаимодействию со специфическими рецепторами, локализованными в ядрах клеток многих тканей и органов (головного мозга, предстательной железы, молочной железы, кишечника, иммунокомпетентных клетках). Это также кардинально отличает его от традиционных витаминов и позволяет классифицировать витамин D как гормон D, способный генерировать и модулировать биологические реакции более чем в 40 тканях-мишенях за счет регуляции транскрипции генов (медленный геномный механизм) и быстрых негеномных молекулярно-клеточных реакций. В настоящее время принято говорить о классических и неклассических физиологических эффектах витамина (гормона) D (рис. 1) [39].
Современные эпидемиологические данные свидетельствуют о высокой частоте нераспознанного дефицита/недостаточности витамина (гормона) D у больных уроандрологического профиля. Так, M.S. Pitman и соавт. (2011), проанализировав результаты обследования 3763 мужчин из урологических баз данных, пришли к выводу, что 68% имели неадекватный уровень витамина D, а 52% из них – нераспознанные недостаточность или дефицит витамина D [40].
Чаще всего D-дефицит обнаруживается у людей моложе 50 лет (44,5%), лиц негроидной расы (53,2%) и испанцев (41,6%) (р < 0,001). В мультивариационном анализе раса, возраст, время года или диагноз рака были независимыми предикторами статуса по витамину D [40]. По данным И.А. Тюзикова (2014), более 50% российских мужчин имеют недиагностированную недостаточность витамина (гормона) D, а у каждого третьего мужчины наблюдается тяжелый дефицит витамина (гормона) D. При этом наиболее часто дефицит витамина (гормона) D у мужчин выявляется при ожирении, андрогенном дефиците, бесплодии и заболеваниях предстательной железы [41].
В последние годы установлена достоверная связь между уровнем витамина D в крови и частотой заболеваний предстательной железы у мужчин. Так, блокада простатических рецепторов к витамину (гормону) D в эксперименте приводила к развитию аутоиммунного хронического простатита. Это связано со способностью естественных метаболитов витамина (гормона) D оказывать выраженные антибактериальные и противовоспалительные свойства путем активации тканевого синтеза природного антибиотика – белка кателицидина [42–45]. Плазменный уровень 25(OH)-витамина D находится в достоверной обратной связи с объемом предстательной железы [46]. Витамин (гормон) D ингибирует ROK-киназу, циклооксигеназу 2 и простагландин Е2 в стромальных клетках простаты, что объясняет локальные антипролиферативные эффекты витамина D в отношении ДГПЖ (рис. 2) [47, 48].
Предварительное определение уровня витамина (гормона) D в крови перед пункционной биопсией предстательной железы может иметь важное значение с точки зрения прогнозирования положительных или отрицательных результатов биопсии [49]. Данные систематического обзора 2014 г. свидетельствуют, что дефицит витамина (гормона) D может выступать в качестве достоверного предиктора и фактора риска рака предстательной железы [50].
Дефицит дегидроэпиандростерона
С момента открытия в 1930-х гг. и вплоть до недавнего времени дегидроэпиандростерон (ДГЭА) и его транспортная сульфатная форма ДГЭА-С рассматривались у мужчин как слабые надпочечниковые андрогены, вклад которых в общий мужской андрогенный фон считался клинически не значимым. Однако эту точку зрения сегодня следует признать ошибочной. ДГЭА и ДГЭА-С – это не только прогормоны (субстрат для дальнейшего синтеза тестостерона и эстрогенов в гонадах), но и мощные гормоны с самостоятельными физиологическими эффектами (рис. 3) [51].
Прежде всего ДГЭА-С – это ключевой буферный гормон стрессоустойчивости, так как представляет собой естественный антиглюкокортикостероид, противостоящий кортизолу – ключевому гормону стресса. Уровень кортизола резко повышается при любом стрессе, приводя к блокаде синтеза ДГЭА-С и половых стероидов. Вот почему соотношение «ДГЭА/кортизол» – ключевой маркер устойчивости к стрессу. Для адекватной защиты от стресса должен преобладать ДГЭА-С, обладающий протективным эффектом в отношении центральной нервной системы, а не кортизол, который оказывает деструктивное влияние на гиппокамп [52]. Секреция ДГЭА и ДГЭА-С в надпочечниках начинает снижаться уже после 30 лет, что ассоциируется с возрастным снижением стрессоустойчивости [53].
В 1988 г. канадский профессор Фердинанд Лабри ввел понятие интракринологии – раздела эндокринологии. Он обнаружил пути и механизмы образования андрогенов (тестостерона) и эстрогенов из ДГЭА-С непосредственно внутри клеток периферических тканей по требованию, автономно от половых желез (гонад), минуя системный кровоток. Такой интракринный синтез половых гормонов происходит в коже, мышечной ткани, головном мозге, молочной и предстательной железах [54]. В настоящее время известно, что только 60% внутрипростатического 5-альфа-дигидротестостерона – ключевого андрогена предстательной железы синтезируется из тестикулярного тестостерона, поступающего в железу из системного кровотока. Остальные 40% синтезируются автономно (независимо от тестикулярного стероидогенеза) именно из ДГЭА. При этом интракринный синтез выявлен как в железистом эпителии (тестостерон), так и в строме органа (эстрогены). ДГЭА, будучи биохимическим предшественником тестостерона, в строме простаты под влиянием стромальных ароматаз легко трансформируется в эстрогены. На фоне возрастного снижения уровня тестикулярного тестостерона предстательная железа для поддержания андрогенного гомеостаза начинает активно использовать для синтеза 5-альфа-дигидротестостерона именно ДГЭА, дефицит которого также способен повышать активность 5-альфа-редуктазы и приводить к развитию ДГПЖ [55]. Так сформировалась новая эндокринно-аутокринно-интракринно-паракринная модель взаимодействия стромы и эпителия предстательной железы с учетом метаболизма в них ДГЭА. Это послужило основой для разработки рабочей гипотезы, согласно которой в патогенезе простатической пролиферации, характерной для ДГПЖ и рака простаты, возрастной дефицит надпочечниковых андрогенов (ДГЭА, ДГЭА-С) может играть такую же важную роль, как и возрастной дефицит тестикулярного тестостерона [51, 55].
По данным И.А. Тюзикова (2016), несмотря на то что возрастное снижение синтеза тестостерона имеет важное значение в патогенезе ДГПЖ (активация простатических 5-альфа-редуктаз), одной из непосредственных причин возрастного феномена простатической пролиферации может быть прогрессирующая с возрастом адреналовая (надпочечниковая) недостаточность (слабость), или синдром истощения надпочечников. Это состояние сопровождается резким снижением синтеза прогестерона и особенно ДГЭА, которые, являясь биохимическими предшественниками тестостерона, косвенно приводят к его эндогенному дефициту. Вместе эти факторы, очевидно, запускают механизмы активации 5-альфа-редуктазы, заканчивающейся простатической железистой пролиферацией и гиперплазией с формированием ДГПЖ или даже раком предстательной железы [56]. Таким образом, роль ДГЭА-С в патогенезе опухолевых заболеваний предстательной железы требует дальнейшего активного изучения.
Дефицит прогестерона
Патофизиологическое значение возрастного снижения секреции прогестерона у мужчин, в отличие от женщин, остается не до конца понятным. Прогестерон в цикле стероидогенеза у мужчин является одним из первых универсальных биохимических субстратов. Он, имея сравнительно небольшой период жизни, быстро может трансформироваться как в глюкокортикоиды и минералокортикоиды, так и в ДГЭА и далее в тестостерон и эстрогены. В связи с таким сложным циклом синтеза и трансформации проведение исследований прогестерона у мужчин достаточно затруднительно.
Прогестерон выполняет важные физиологические функции, о которых было сказано выше. Кроме того, именно прогестерон является своеобразным модулятором экспрессии эстрогеновых и андрогеновых рецепторов, поэтому его роль в гормонозависимых процессах, включая ДГПЖ, вполне реальна. Известно, что в клетках предстательной железы экспрессируются рецепторы ко всем половым стероидным гормонам, включая прогестерон [57]. Прогестерон в ткани предстательной железы выполняет важные функции природного ингибитора 5-альфа-редуктазы, препятствуя развитию железистой гиперплазии, а также оказывает ингибирующее влияние на строму. При этом у больных ДГПЖ уровень прогестерона в крови существенно ниже, чем у здоровых мужчин [58, 59]. Кроме того, в ряде работ по исследованию молекулярно-клеточных механизмов рака предстательной железы показаны антипролиферативные эффекты прогестерона у мужчин в отношении данного заболевания, что позволило авторам рассматривать данный гормон как природный простатический онкостатик [60–62].
Дефицит тестостерона
Андрогенозависимость нижних мочевых путей и особенно предстательной железы предопределяет активное участие андрогенов (прежде всего тестикулярного тестостерона) в обеспечении их адекватного анатомо-функционального состояния [63]. Рецепторы к тестостерону обнаружены во всех отделах мужской мочеполовой системы, поэтому эндогенный тестостерон наряду с ДГЭА-С выполняет ключевые функции в обеспечении андрогенного баланса предстательной железы и структур мочевого пузыря и уретры (оба являются субстратами для интрапростатического синтеза 5-альфа-дигидротестостерона).
Минимальная активность 5-альфа-редуктазы выявляется при уровне плазменного тестостерона 7,0 нг/мл, что соответствует физиологической концентрации тестостерона (норма 4,0–10,0 нг/мл). Активность фермента усиливается как при низком, так и при высоком содержании тестостерона. Следовательно, нормальный уровень тестостерона в плазме можно рассматривать как наиболее важное условие физиологически достаточной активности 5-альфа-редуктазы для обеспечения в простате нормальной концентрации 5-альфа-дигидротестостерона (известно, что повышение активности этого фермента ассоциируется с ДГПЖ) [64].
При дефиците тестостерона в предстательной железе реципрокно усиливается синтез 5-альфа-дигидротестостерона, направленный на восстановление андрогенового баланса железы в условиях дефицита важного субстрата (тестикулярного тестостерона). При этом всегда развивается симультанная простатическая гиперплазия (увеличение размеров простаты) и возникает дефицит еще одного важного метаболита тестостерона – андростендиола, который выполняет функции природного блокатора альфа-адренорецепторов шейки мочевого пузыря и уретры. В результате на фоне дефицита тестостерона формируется как статический, так и динамический компонент ДГПЖ.
Кроме того, тестостерон модулирует функции нейрорецепторного аппарата нижних мочевых путей, поддерживает рефлекторные пути тазовой части автономной нервной системы, ответственные за накопление мочи в мочевом пузыре, оказывает прямое влияние на экспрессию генов в нейронах и постсинаптические негеномные рецепторы, подавляющие сокращение детрузора у мужчин [65, 66]. Тестостерон активно участвует в регуляции болевой рецепции и перцепции у мужчин, в частности за счет активной модуляции болевых ощущений из нижних мочевых путей и органов малого таза, опосредованных синтезом оксида азота (NO), эндогенных опиатов, фактора роста нервных окончаний и ряда других биорегуляторных пептидов [67, 68].
Тестостерон обеспечивает нормальное функционирование всех сосудистых, мышечных и нервных элементов предстательной железы и детрузора мочевого пузыря, влияя на NO-зависимую иннервацию и вазодилатацию в фибромускулярной строме, железистом эпителии и кровеносных сосудах транзиторной зоны предстательной железы и детрузора [69–72]. Интенсивность и плотность микроциркуляции, размеры, дифференцировка и функция эпителия предстательной железы и мочевого пузыря в силу высокой чувствительности к экзогенным и эндогенным гормональным воздействиям также во многом зависят от уровня эндогенного тестостерона [73–76]. Выявлена достоверная обратная корреляция между уровнем тестостерона и детрузорным давлением на выходе, а также детрузорным давлением и скоростью мочеиспускания. Низкий уровень тестостерона коррелировал с детрузорной гиперактивностью, которая приводила к двуфазным сокращениям детрузора во время фазы наполнения [77].
Следствием дефицита тестостерона становится уменьшение экспрессии NO-синтазы, снижение синтеза NO в предстательной железе и детрузоре мочевого пузыря, что закономерно ведет к тазовому атеросклерозу и гипоксии указанных органов, развитию железистой атрофии детрузора и предстательной железы. В условиях гипоксии усиливаются процессы фибробластогенеза, пролиферации и замедляется апоптоз, что может привести к простатической гиперплазии [78–81].
Инсулинорезистентность
Согласно современному определению, инсулинорезистентность – это нарушение биологического ответа (метаболического и молекулярно-генетического) инсулинчувствительных тканей на воздействие инсулина (экзогенного и эндогенного) вследствие снижения чувствительности. Этот процесс закономерно сопровождается нарушением метаболизма углеводов, жиров, белков, изменениями в синтезе ДНК, регуляции транскрипции генов, дифференцировке и росте клеток и тканей организма [82].
Инсулинорезистентность всегда сопровождается хронической гиперинсулинемией, которая носит компенсаторный характер. Это оправданная патофизиологическая реакция, имеющая целью обеспечить клетки ключевым субстратом энергетического обмена – глюкозой, клеточный дефицит которой имеет место при ее нормальном уровне в плазме крови. Организм вынужден делать это, стимулируя избыточную секрецию инсулина (гиперинсулинемия). В детском возрасте такой механизм является физиологическим, так как позволяет организму ребенка расти и развиваться. Однако после 40 лет даже у здоровых людей происходит снижение чувствительности тканей к инсулину, и тогда инсулинорезистентность приобретает патологический характер. При этом инсулин – это мощный митогенный гормон, поэтому такой метаболический возрастной сценарий закономерно ведет к повышению рисков опухолевых заболеваний, в том числе предстательной железы [83–85].
Одно из следствий гиперинсулинемии/инсулинорезистентности – накопление конечных продуктов гликолиза и свободных жирных кислот, ведущее к хроническому асептическому воспалению, что может приводить к повреждению эндотелия сосудов и развитию атеросклероза, дополнительно повышая онкологические риски [86–88]. В результате гиперинсулинемии/инсулинорезистентности могут возникнуть патологическая стойкая тканевая вазоконстрикция и тяжелая клеточная гипоксия, поскольку синтез NO нарушается, а синтез эндотелина 1 поддерживается. Клеточная гипоксия сегодня рассматривается как важный механизм канцерогенеза и метастазирования (рис. 4) [83, 89]. Кроме того, гиперинсулинемия/инсулинорезистентность индуцируют повышенную симпатическую активность, увеличивая метаболизм глюкозы в вентромедиальных гипоталамических нейронах. Это ведет к повышенной активности всех центральных и периферических альфа-адренорецепторов гладких мышц, включая простатическую капсулу и шейку мочевого пузыря, что вызывает СНМП даже в отсутствие ДГПЖ [90]. Эта концепция изучалась и на животных моделях, и в клинических исследованиях. В экспериментальной модели на крысах повышенная автономная симпатическая активность (инсулинорезистентность) стимулировала рост предстательной железы и приводила как к ДГПЖ, так и к СНМП без простатической гиперплазии (за счет индуцирования тазовой автономной метаболической невропатии) [91].
Таким образом, давно известный в эндокринологии феномен развивающейся с возрастом патологической инсулинорезистентности становится одним из ключевых факторов патогенеза опухолевых заболеваний, включая доброкачественные и злокачественные опухоли предстательной железы у мужчин [92]. Сегодня растет количество доказательств участия инсулина и инсулинопосредованных механизмов в развитии и прогрессировании рака. Связь «инсулин – рак» выявлена в различных обсервационных и эпидемиологических исследованиях, которые продемонстрировали более высокую частоту рака у пациентов с центральным ожирением, сахарным диабетом 2 типа и другими патологическими состояниями, сопровождающимися повышенным уровнем циркулирующего инсулина, инсулинорезистентностью, гиперинсулинемией. Риск развития рака также повышен у пациентов с сахарным диабетом, у которых проводимая терапия приводит к хронической гипогликемии [93]. Парадокс заключается в том, что любая антираковая терапия может стимулировать формирование или усугублять уже имеющуюся недиагностированную инсулинорезистентность. Следствием этого становятся дальнейший рост опухоли, снижение эффективности противоопухолевой терапии, повышение рисков сердечно-сосудистых событий и впервые выявленного сахарного диабета 2 типа [94]. Метаанализ эпидемиологических исследований показал положительное влияние приема препаратов из группы бигуанидов (инсулиновых сенситайзеров), в частности метформина, не только на клиническое течение углеводных нарушений, но и на снижение частоты онкологических рисков [95].
Дефицит мелатонина
Мелатонин – индольный гормон эпифиза, синтез которого происходит из незаменимой аминокислоты триптофана путем его метаболизма в серотонин при обязательном участии витамина D в темное время суток. Синтез и секреция мелатонина в эпифизе снижаются с возрастом, достигая наименьших значений примерно к 70 годам, что становится одним из важных патогенетических факторов возрастной бессонницы (инсомнии). Однако эпифизарный мелатонин составляет не более 5% от всех запасов мелатонина в организме. Около 95% эндогенного мелатонина синтезируются практически во всех клетках независимо от уровня внешней освещенности (экстраэпифизарный мелатонин). Это позволяет говорить о наличии в организме целой эндокринной системы мелатонина, который не только является фундаментальным регулятором процессов хронобиологии, но и обладает целым спектром мощных метаболических эффектов (рис. 5) [96, 97].
Помимо наличия в предстательной железе рецепторов к мелатонину выявлена способность железистого эпителия к самостоятельному синтезу этого гормона, независимо от синтеза и секреции в эпифизе, поэтому мелатонин крайне важен для нормального метаболизма предстательной железы [98]. Более 30 лет назад были обнаружены нарушения синтеза мелатонина у больных с раком предстательной железы [99, 100]. К настоящему времени получены убедительные доказательства того, что мелатонин благодаря разнообразным физиологическим эффектам может рассматриваться не только как ключевой регулятор всех хронобиологических процессов в организме и гормон долголетия, но и как один из активных антипролиферативных и онкостатических гормонов, в том числе по отношению к опухолям предстательной железы (рис. 6) [101–104].
Дефицит серотонина
Серотонин – важнейший мозговой нейростероид, который вместе с допамином, вазопрессином и окситоцином обеспечивает синтез эндогенных опиоидов (эндорфинов) в так называемой системе вознаграждения мозга. В этой связи его часто называют гормоном счастья, хотя в строгом понимании гормоном серотонин не является [105]. В головном мозге серотонин регулирует сон и настроение, уменьшает аппетит, повышает либидо и улучшает сексуальность, выступает в качестве мощного анальгетика и антидепрессанта [106]. При нарушении обмена мозгового серотонина развиваются депрессии, наличие которых достоверно ухудшает клиническое течение любых СНМП, обусловленных ДГПЖ, которые в свою очередь усугубляют течение депрессии [107–109].
Как было сказано выше, серотонин является промежуточным звеном синтеза мелатонина, поэтому по аналогии с мелатонином мозговая ткань содержит только 5% всех запасов эндогенного серотонина, а 95% его образуется на периферии в клетках диффузной эндокринной системы, прежде всего в кишечнике. Нейроэндокринные клетки предстательной железы также обладают способностью к синтезу, накоплению и использованию серотонина для метаболических потребностей, тем более что серотониновые рецепторы экспрессируются не только в ткани здоровой предстательной железы, но и ее опухолях, а также детрузоре и уретре [110, 111].
Роль периферического серотонина в патогенезе ДГПЖ остается недостаточно изученной и противоречивой. Одни иммуногистохимические исследования выявили резкое снижение как экспрессии серотониновых рецепторов, так и абсолютного уровня серотонина в ткани ДГПЖ по сравнению со здоровой тканью [112, 113]. В других исследованиях указывается на диссоциацию экспрессии серотониновых рецепторов в ткани предстательной железы и детрузора при ДГПЖ. В норме в детрузоре экспрессия 5-HT2B- и 5-HT7-рецепторов к серотонину выше, чем экспрессия 5-HT2A-, 5-HT3A- и 5-HT4-рецепторов. В простате при ДГПЖ в наибольшей степени повышена экспрессия 5-HT3A- и 5-HT7-серотониновых рецепторов, в то время как экспрессия 5-HT2A-рецепторов резко снижена [114]. Вместе с тем точно известно, что серотонин может оказывать дозозависимое влияние на рост раковых клеток: высокий уровень серотонина стимулирует, а низкий уровень ингибирует рост опухолевых клеток посредством уменьшения притока крови к ним через воздействие на 5-НТ1- и 5-НТ2-рецепторы. Есть данные об участии серотонина в процессах миграции раковых клеток и о том, что развитие некоторых опухолей сопровождается нарушением функций и экспрессии серотониновых рецепторов. Так, уровень сывороточного серотонина оказался достоверным маркером прогноза карциномы мочевого пузыря, аденокарциномы предстательной железы и почечно-клеточной карциномы [115]. Таким образом, связь серотонина и простатической пролиферации, лежащей в основе ДГПЖ, может быть обусловлена как нарушением его синтеза и секреции, так и нарушением экспрессии и функций серотониновых рецепторов, которых сегодня описано семь типов (многие из них при ДГПЖ практически не изучены).
Дефицит вазопрессина
Вазопресссин (известный также как аргинин-вазопрессин, антидиуретический гормон (АДГ) или аргипрессин) представляет собой пептидный гормон с очень коротким периодом полураспада (16–24 минуты). Вазопрессин синтезируется в нейронах супраоптического и паравентрикулярного ядер гипоталамуса в виде предшественника – препроАДГ, который сначала там же трансформируется в проАДГ, а затем в составе нейросекреторных гранул по аксонам нейронов гипоталамуса поступает в нейрогипофиз.
Вазопресссин оказывает эффекты посредством V1- и V2-рецепторов. V1A-рецепторы локализованы в гладких мышцах сосудов, печени, а также в центральной нервной системе. V1B-рецепторы экспрессируются в передней доле гипофиза (аденогипофизе) и головном мозге, где вазопрессин выступает в роли нейромедиатора. Они отвечают за поведенческую и нейроэндокринную адаптацию к стрессу и регулируют «систему вознаграждения мозга», а также принимают участие в некоторых психиатрических состояниях, в частности депрессиях [116, 117]. V2-рецепторы локализованы преимущественно в почках и являются мишенью многих лекарств при несахарном диабете. В центральной нервной системе эти рецепторы могут быть потенциальной мишенью для борьбы с когнитивными расстройствами [118].
Согласно общепринятому мнению, вазопрессин оказывает два важнейших классических физиологических эффекта – антидиуретический и вазопрессорный. Антидиуретический подразумевает удержание воды в организме посредством увеличения ее реабсорбции в дистальных канальцах и собирательных трубочках нефронов почек. Вазопрессорный связан с увеличением периферического сосудистого сопротивления на фоне увеличения объема циркулирующей крови вследствие задержки жидкости в организме. Поэтому возрастной дефицит вазопрессина, ассоциированный с возрастным дефицитом мелатонина, приводит к развитию ночной или суточной полиурии у стареющего человека. Полиурия – один из ключевых патогенетических механизмов такого атрибута старения, как ноктурия [119]. Нарушение ночного сна, связанное с ноктурией, существенно и достоверно повышает риск летального исхода у пожилых людей. После поправки на возраст, пол и уровень базовой медицинской помощи в целом риск смерти у пожилых людей с эффективностью сна < 80% был в 1,93 раза выше, чем у пожилых людей с эффективностью сна ≥ 80% [120].
Помимо того что ноктурия – самый частый симптом нарушения мочеиспускания у стареющего мужчины, это патологическое состояние заметно опережает появление других СНМП. Согласно имеющимся данным, у мужчин старше 50 лет частота ноктурии в среднем составляет 58,9%. В то же время учащение мочеиспускания отмечают всего 35,9% мужчин, а симптомы обструкции – 27,7%, причем оба этих симптома дают о себе знать уже после того, как у мужчины сформируется как минимум однократная ноктурия [121]. Кроме того, среди всех СНМП ноктурия оказывает самое негативное влияние на качество жизни стареющего мужчины, сравнимое с тем, как если бы у него был рак предстательной железы [122]. Таким образом, ноктурия, связанная с возрастными гормональными дисбалансами, уже давно рассматривается как самостоятельная междисциплинарная проблема, а урологический миф о том, что ноктурия – это «самый ранний симптом ДГПЖ», уже давно забыт как страшный сон [123–125].
Однако сегодня можно говорить о наличии у вазопрессина не только классических, но и широкого спектра неклассических физиологических эффектов (рис. 7) [126–128]. В настоящее время изучается влияние вазопрессина на пролиферацию и рост клеток, которое обусловлено способностью вазопрессина непосредственно стимулировать синтез белка и клеточных факторов роста через V1А-рецепторы [129, 130]. Такие эффекты вазопрессина описаны в отношении эпителия кишечника, почек, предстательной железы и некоторых клеток и тканей [131, 132]. Установлено, что опухолевые клетки также содержат рецепторы к вазопрессину и секретируют нейропептиды [133].
В целом роль вазопрессина в патогенезе ДГПЖ, в отличие от его роли в патогенезе ноктурии и других ассоциированных с возрастом заболеваний, остается малоизученной. Однако следует отметить, что вазопрессин может регулировать процессы старения в результате взаимодействия с трансмембранным белком KLOTHO, который широко экспрессируется в организме и выступает в качестве гормона, но в основном влияет на почки и центральную нервную систему. Этот белок является основным фактором, определяющим продолжительность жизни [134]. Он циркулирует в крови и связывается с рецепторами в различных клетках, повышая их устойчивость к окислительному стрессу, ускоряющему процесс старения. Связывание KLOTHO с рецепторами подавляет внутриклеточный каскад инсулина, что также повышает устойчивость к окислительному стрессу [135]. Вазопрессин способствует снижению плотности белка KLOTHO, и вполне возможно, что этот антивозрастной эффект вазопрессина будет выявлен и в отношении ДГПЖ.
Новая церебрально-эпифизарно-гипоталамо-гипофизарно-адреналово-гонадная модель патогенеза ДГПЖ
Описанные выше ключевые возрастные гормональные дисбалансы, находящиеся в тесном взаимодействии, развиваются не одновременно и не в один день. Для более глубокого понимания многофакторной эндокринной природы ДГПЖ, поражающей один из самых гормонозависимых органов мужчины – предстательную железу, можно сопоставить стадии естественного течения ДГПЖ с периодами развития наиболее важных возрастных гормональных дисбалансов (рис. 8) [9, 136, 137].
Как видно из рисунка 8, уже к 30 годам у многих мужчин развиваются важные гормональные дисбалансы, способные приводить к активации пролиферации предстательной железы. Среди наиболее значимых – персистирующий с детства и прогрессирующий с возрастом дефицит витамина D наряду с алиментарным дефицитом важнейших микроэлементов (в частности, цинка, меди, железа, магния) и омега-3 полиненасыщенных жирных кислот, обусловленные неправильным питанием современного человека [48, 138, 139].
Неправильный режим питания на фоне гиподинамии закономерно приводит к развитию и прогрессированию ожирения, которое сегодня очень «помолодело» и стало важнейшим механизмом патогенеза большинства ассоциированных с возрастом заболеваний, включая метаболический синдром, сахарный диабет 2 типа, сердечно-сосудистые заболевания. Эти состояния существенно повышают риск развития онкологических заболеваний в целом и опухолей предстательной железы (включая ДГПЖ и рак простаты) в частности [140–146]. В США было проведено крупное исследование Southern Community Cohort Study (2011), которое охватило 7318 мужчин в возрасте 40–79 лет. Было показано, что умеренные и выраженные СНМП у мужчин достоверно ассоциируются с возрастом, увеличением индекса массы тела и снижением степени физической активности, а клиническое ожирение закономерно сопровождается достоверно более выраженными СНМП [147].
И.А. Тюзиков и соавт. (2015) установили, что у мужчин с ожирением достоверно выше частота ноктурии по сравнению со здоровыми мужчинами. При наличии инсулинорезистентности отмечались более выраженные СНМП/ДГПЖ. У пациентов с ожирением, инсулинорезистентностью и андрогенным дефицитом наблюдались тяжелые СНМП/ДГПЖ, был выявлен наибольший средний объем предстательной железы и объем остаточной мочи по сравнению с другими группами (р < 0,05). Авторами сделан вывод о том, что ожирение, инсулинорезистентность и андрогенный дефицит – неблагоприятные сопутствующие патологические состояния. Они существенно отягощают клиническое течение СНМП/ДГПЖ, отрицательно влияют на параметры ДГПЖ как отдельно, так и в совокупности [148].
Аналогичные результаты получены и в зарубежных исследованиях, также показавших негативное влияние компонентов метаболического синдрома на клинико-морфометрические параметры и скорость прогрессирования ДГПЖ [149–152].
После 30 лет у представителей обоих полов снижается секреция надпочечникового ДГЭА, который, как было показано ранее, играет важную роль в метаболизме предстательной железы и, возможно, в патогенезе ДГПЖ [51, 55, 56, 153]. В итоге на фоне гормонально-метаболических дисбалансов уже у 30-летних мужчин можно выявить гистологические признаки ДГПЖ, которая в этом возрасте в большинстве случаев остается асимптоматической, а потому недиагностированной и нелеченой (см. рис. 8).
На фоне сохранения и прогрессирования описанных возрастных эндокринопатий к 40 годам у мужчин развиваются новые гормональные дисбалансы. Прежде всего возрастной дефицит тестостерона (возрастной андрогенный дефицит), сопровождающийся нарушениями эстрогенового баланса, а также возрастной феномен гиперинсулинемии/инсулинорезистентности. За счет их синергизма прогрессирует ожирение, развиваются эндотелиальная дисфункция и системное хроническое воспаление (цитокиновый каскад), усугубляется клеточная и тканевая гипоксия, активируется железисто-стромальная простатическая пролиферация на фоне инактивации процессов апоптоза. В итоге у многих метаболически и гормонально дискредитированных мужчин в 40–45 лет выявляются физикальные признаки ДГПЖ в виде увеличения предстательной железы с клиническими симптомами или без них (см. рис. 8).
После 50 лет на фоне персистирования и прогрессирования всех указанных выше гормональных дисбалансов у мужчин могут иметь место новые возрастные гормональные дисбалансы (в частности, дефицит мелатонина и вазопрессина). Это знаменует переход физикальной асимптоматической ДГПЖ в симптоматическую ДГПЖ, которая при отсутствии адекватного лечения прогрессирует вплоть до стадии осложненной ДГПЖ (рис. 9) [9, 137].
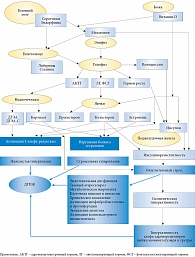
Таким образом, литературные и собственные клинические данные позволяют рассматривать патогенез ДГПЖ гораздо шире, чем он обычно трактуется в учебниках и руководствах по урологии. В регуляции функций предстательной железы как гормонозависимого органа принимают участие большое количество гормонов, синтезирующихся на разных уровнях эндокринной системы. В этой связи многофакторная церебрально-эпифизарно-гипоталамо-гипофизарно-адреналово-гонадная модель патогенеза данного заболевания, отражающая весь спектр сложных гормональных взаимодействий и взаимовлияний на системном и клеточно-тканевом (органном) уровнях (рис. 10), позволяет более глубоко понять сущность патогенеза ДГПЖ. Эта модель может послужить фундаментальной базой для оптимизации современной фармакотерапии ДГПЖ.
ДГПЖ как новое системное гормонально-метаболическое заболевание. Пути оптимизации современной фармакотерапии
Представленный выше новый методологический интегративный подход основан на анализе системных и локальных эндокринологических аспектов патогенеза ДГПЖ. Все локальные патоморфологические и патофизиологические процессы, сопровождающие ДГПЖ, неразрывно связаны, что обусловлено гормонозависимостью предстательной железы, системными гормональными дисбалансами, оказывающими достоверное влияние как на метаболизм железы, так и на прогрессирование ДГПЖ. Это уже привело к формированию в современной урологии нового междисциплинарного взгляда на ДГПЖ как на гормонально-метаболическое заболевание с системным патогенезом и преимущественно локальными клиническими проявлениями, что требует пересмотра традиционного узкопрофильного подхода к диагностике и фармакотерапии [153–158].
Сегодня применяются препараты с локальным воздействием на предстательную железу: альфа-1-адреноблокаторы, М-холинолитики, агонисты бета-3-адренорецепторов, фитопрепараты, биологически активные добавки, биорегуляторные пептиды (симптоматическое локальное лечение), ингибиторы 5-альфа-редуктазы и ингибиторы фосфодиэстеразы 5 типа (патогенетическое локальное лечение). Однако если рассматривать естественное течение ДГПЖ с системных позиций возрастной эндокринологии, то открываются новые и очень перспективные направления ранней профилактики и фармакотерапии этого заболевания с использованием препаратов с системным патогенетическим действием. Системная патогенетическая терапия, влияющая и на организм в целом, и на предстательную железу в частности, позволит лечить не болезнь, а больного. Иначе говоря, будут реализованы ключевые задачи персонифицированной полимодальной интегративной фармакотерапии и профилактики ДГПЖ, которые, к сожалению, до сих пор в урологии практически не разработаны.
Вместе с тем уже сегодня в научной литературе накапливаются данные, свидетельствующие об эффективности и безопасности терапии СНМП – ноктурии – ДГПЖ не только препаратами тестостерона, но и при наличии показаний витамином D, донаторами серотонина и селективными ингибиторами обратного захвата серотонина, гормоном сна мелатонином, аналогами вазопрессина (десмопрессином), метформином (инсулиновым сенситайзером из группы бигуанидов, ликвидирующим инсулинорезистентность), омега-3 полиненасыщенными жирными кислотами [159–165]. Никто не умаляет достоинств имеющихся традиционных простатоселективных препаратов для лечения СНМП/ДГПЖ. Однако очевидно, что только в комбинации с персонифицированным подбором препаратов, оказывающих системное воздействие на эндокринно-метаболические механизмы патогенеза ДГПЖ, можно реализовать индивидуальный комплексный подход к лечению, существенно улучшить результаты патогенетической терапии и профилактики ДГПЖ, максимально приблизив при этом показатели пациента к показателям здорового мужчины.
Заключение
Новый методологический интегративный подход к ДГПЖ, основанный на анализе современных эндокринно-метаболических механизмов патогенеза заболевания, подразумевает неразрывную связь всех локальных патологических процессов, сопровождающих ДГПЖ. Эта связь обусловлена выраженной гормонозависимостью предстательной железы, системными возрастными гормональными дисбалансами, оказывающими влияние на старение мужчины в целом и на метаболизм предстательной железы и ДГПЖ в частности. Представление о ДГПЖ как о новом системном гормонально-метаболическом заболевании влечет за собой кардинальные изменения в фармакотерапии и профилактике, в том числе отказ от традиционных узкопрофильных подходов. Актуальность проблемы эффективного лечения ДГПЖ обусловлена в том числе наблюдающимся в XXI в. значительным увеличением средней продолжительности жизни и соответственно ростом числа заболеваний, ассоциированных с возрастом.
I.A. Tyuzikov, S.Yu. Kalinchenko
Russian Peoples' Friendship University, Moscow
Professor Kalinchenko Clinic, Moscow
Contact person: Igor Adamovich Tyuzikov, info@proandro.ru
A concept of multifactorial pathogenesis for benign prostatic hyperplasia (BPH) viewed by author as a systemic age-associated hormone-metabolic disease based on age-related endocrinology and key theories of common biological aging according to the current publications and personal data are presented in the review. Key age-related hormone imbalances paralleling biological body aging, their impact on prostate metabolism and a role of pathogenetic mechanisms of glandular-stromal prostatic hyperplasia and dysfunction of receptor system in the lower urinary tract underlying BPH pathogenesis are discussed in detail. Age-related prostatic changes (BPH) develop during systemic endocrine impairment at different levels of neuroendocrine body regulation as well as in the prostate as a hormone-dependent organ. A novel cerebro-epiphyseal-hypothalamic-pituitary-adrenal-gonadal model regulating prostatic functions and metabolism unifying all contemporary classic theories of BPH pathogenesis is proposed, which, therefore, reflects an essence in a more full and comprehensive way of its multifactorial pathogenesis. Our model allows to consider cell-tissue prostatic aging inseparably linked to the aging of the whole body. From this viewpoint, BPH should be interpreted as a systemic hormone-metabolic disease, and its drug therapy must be aimed both at correcting detrusor-prostatic disorders (locally acting selective drugs) as well as timely pathogenetic action on all systemic signs of aging found in patients. By using such inter-disciplinary and personalized approach it may allow not only to eliminate BPH clinical symptoms but also fully recover, and improve patient’s parameters closer to healthy men as well as significantly improve patient’s quality of life.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.