Опыт ведения пациента с хронической обструктивной болезнью легких с частыми обострениями
- Аннотация
- Статья
- Ссылки
- English



Введение
Хроническая обструктивная болезнь легких (ХОБЛ) остается одной из наиболее распространенных патологий. Показатели заболеваемости и смертности демонстрируют неуклонный рост, несмотря на разработку и внедрение международных и национальных рекомендаций по диагностике и лечению ХОБЛ [1–4].
В России особое внимание уделяется не только ранней диагностике ХОБЛ в ходе скрининга при ежегодной диспансеризации взрослого населения, но также первичной и вторичной профилактике в процессе диспансерного наблюдения пациентов с данным заболеванием [4–6].
Создание эффективных персонифицированных программ диспансерного наблюдения возможно лишь при фенотипическом подходе к диагностике и детальной оценке как текущих симптомов, так и риска потенциальных обострений и сопутствующих заболеваний [1, 7–10].
Согласно федеральным клиническим рекомендациям, обострение ХОБЛ – острое событие, характеризующееся ухудшением респираторных симптомов, выходящим за рамки их обычных ежедневных колебаний, и приводящее к изменению режима используемой терапии [4].
В многочисленных исследованиях показано, что частые обострения ХОБЛ неизбежно приводят к прогрессирующему ухудшению функции дыхания и газообмена, снижению качества жизни, декомпенсации коморбидных состояний и, как следствие, резкому увеличению социально-экономического бремени болезни [2, 7, 11].
Наиболее частыми на амбулаторном приеме являются респираторные жалобы. Вместе с тем раннее выявление и эффективное лечение обострений ХОБЛ представляет определенную проблему для врача первичного звена, поскольку восприятие симптомов у каждого пациента разное в силу индивидуального порога восприятия [8]. До недавнего времени в арсенале врача общей практики не было эффективных инструментов для ретроспективной оценки обострений у больных ХОБЛ [9].
Как показали данные российского исследования SUPPORT, 51% пациентов, пришедших на прием к врачу, имели фенотип с частыми обострениями ХОБЛ [20]. Выделение данного фенотипа позволяет модифицировать базисную терапию пациентов с ХОБЛ для предотвращения преждевременной смерти, достоверно связанной с прогрессированием заболевания. Современные рекомендации и предложенные экспертами Российского респираторного общества опросники для ретроспективной оценки обострений ХОБЛ помогают врачам первичного звена назначать адекватную эффективную терапию ХОБЛ [9].
Клинический случай
Пациент М. 66 лет работает доцентом в техническом университете. 8 августа 2015 г. обратился к пульмонологу по рекомендации мануального терапевта, у которого проходил лечение по поводу поясничной дорсопатии. Во время сеансов терапии больного беспокоил кашель с мокротой, в положении на животе появлялись одышка и дистанционные грубые сухие хрипы. Активно жалоб не предъявлял, неохотно шел на контакт.
При детальном опросе: кашель (сильнее по утрам) с периодическим отхождением вязкой слизистой мокроты, степень одышки определить сложно, поскольку последний год из-за постоянной боли в пояснице пациент очень мало двигался (живет на первом этаже). До этого отмечалась одышка при значительной физической нагрузке, пациент вел достаточно активный образ жизни: три раза в неделю в послеобеденное время совершал велосипедные прогулки.
Острые респираторные вирусные инфекции (ОРВИ) – два эпизода за последний год. Пять месяцев назад был госпитализирован с диагнозом «пневмония справа в нижней доле».
До 2009 г. в течение ряда лет беспокоили постоянная заложенность носа, частые ОРВИ (два-три раза в год), периодически сухой кашель, на фоне острых респираторных заболеваний кашель с мокротой, субфебрильная температура тела. Пациент самостоятельно принимал антибактериальную терапию.
В 2009 г. госпитализирован по поводу пневмонии. В стационаре впервые установлен диагноз ХОБЛ. Объем форсированного выдоха за первую секунду (ОФВ1) – 72%, модифицированный индекс Тиффно (МИТ) – 0,68. Назначенную терапию ипратропия бромидом/фенотеролом по одной ингаляции три-четыре раза в день проводил нерегулярно.
В 2010 г. перенес тяжелый грипп. С тех пор при физической нагрузке отмечал одышку, с которой боролся регулярными физическими тренировками (велотренировки). Одышку связывал с перенесенным гриппом и нарушением носового дыхания. В 2013 г. проходил обследование у аллерголога: выявлен аллергический ринит, сенсибилизации не установлено. Уровень иммуноглобулина (Ig) Е – 125 МЕ/мл. Назначен ингаляционный глюкокортикостероид (ИГКС) интраназально. В течение трех месяцев наблюдался хороший эффект. Обострений респираторных симптомов в 2012 г. не зарегистрировано.
В 2014 г. имели место простудные заболевания каждые два-три месяца. По рекомендации иммунолога больной получал курсовое лечение бактериальными лизатами. Совету бросить курить не последовал из-за усиления кашля при снижении интенсивности курения.
С 2015 г. стали беспокоить нарастающие боли в пояснице. Принимал нестероидные противовоспалительные препараты, проходил физиотерапию, резко ограничил физическую активность, чем и объяснял нарастание одышки. Лечение – без эффекта.
При проведении магнитно-резонансной томографии выявлена клиновидная деформация двух нижних грудных позвонков.
В феврале 2015 г. после очередной перенесенной острой респираторной инфекции с длительной субфебрильной температурой и кашлем с зеленоватой мокротой проведено рентгенологическое обследование грудной клетки. Выявлены пневмония, буллезная деформация легких. Пациент был госпитализирован. Бронхологическое обследование показало хронический атрофический эндобронхит 2-й степени воспаления.
Диагноз при выписке: внебольничная правосторонняя нижнедолевая пневмония (клебсиелла). ХОБЛ среднетяжелая, эмфизематозный фенотип, обострение, дыхательная недостаточность 2-й степени (ДН II).
Рекомендовано: тиотропия бромид 5 мкг/с один раз в сутки – постоянно. Плановая консультация пульмонолога.
Пациент принимал тиотропия бромид в течение пяти месяцев, улучшения не отмечал.
Аллергические заболевания у себя и родственников отрицал. Стаж курения – более 40 лет, в среднем по 20–30 сигарет в сутки. Индекс курения примерно 25 пачка/лет.
При объективном осмотре 8 августа 2015 г.: рост – 187 см, вес – 88 кг, индекс массы тела (ИМТ) – 25,3 кг/м2. Грудная клетка эмфизематозная, перкуторно – легочный звук с коробочным оттенком. Кожные покровы телесного цвета, чистые, цианоза нет. Аускультативно: в легких дыхание везикулярное ослабленное. Выслушиваются низкотональные сухие хрипы по всем полям, усиливающиеся при форсированном дыхании, выдох удлинен более шести секунд.
Тоны сердца ритмичные, приглушены, перкуторно границы сердца расширены влево до срединно-ключичной линии. Частота сердечных сокращений (ЧСС) – 80 в минуту, артериальное давление (АД) – 140/85 мм рт. ст. Частота дыхательных движений (ЧДД) – 20 в минуту. Сатурация периферической крови (SaО2) – 96%. Периферических отеков нет.
В соответствии с Российскими клиническими рекомендациями, пациент заполнил опросники по оценке текущих симптомов САТ – 21 балл, Modified Medical Research Council (mМRC) – 2 (значительное влияние ХОБЛ на жизнь пациента). Согласно тесту шестиминутной ходьбы (6МШП), пройденное расстояние составило 350 м.
С учетом повышенного уровня IgE в анамнезе у пациента исследован уровень оксида азота в выдыхаемом воздухе (NOex) – 54 ррb, что указывало на аллергическое или эозинофильное воспаление респираторного тракта. Данные спирометрии (табл. 1) свидетельствовали об умеренных обструктивных нарушениях вентиляционной способности легких. Бронхолитическая проба отрицательная (прирост ОФВ1 – 75 мл), для обратимой бронхиальной обструкции прирост ОФВ1 должен быть более 200 мл, или 12%.
Согласно критериям комплексной оценки ХОБЛ, высокая выраженность симптомов (САТ > 10 баллов и mМRC > 1) и высокий риск развития обострений (за последние 12 месяцев одна госпитализация или два амбулаторных обострения) позволили причислить пациента к группе D (по Международным рекомендациям GOLD 2017 г.) [3]. Диагноз на приеме: ХОБЛ, среднетяжелое течение (ОФВ1 57% должного), выраженные симптомы (САТ – 21 балл, MRC – 2), эмфизематозный фенотип, высокий риск обострений (GOLD D). ДН I. Аллергический ринит. Остеопороз (?). Поясничная дорсопатия.
Рекомендованы: консультация аллерголога, повторное исследование IgE, клинический анализ крови, определение минеральной плотности кости, проведение электрокардиографии (ЭКГ), эхокардиографии с допплеровским исследованием, рентгенкомпьютерной томографии органов грудной клетки (ОГК). Рекомендовано бросить курить. Назначены:
- ежедневная физическая активность (не менее 5 тыс. шагов);
- вакцинация против пневмококковой инфекции, гриппа;
- тиотропия бромид/олодатерол 2,5/2,5 мкг один раз в сутки постоянно;
- флутиказона фуроат 50 мкг один раз в сутки в оба носовых хода.
Повторный осмотр – через три месяца.
На следующий прием пациент явился через 10,5 месяца (21 июня 2016 г.). Жалоб активно не предъявлял. Отмечал исчезновение хрипов в горизонтальном положении. Вернулся к велосипедным прогулкам, несколько снизил интенсивность курения (до 10 сигарет в сутки).
Кашель отмечал по утрам, иногда вечером перед сном, мокрота скудная, оставалась заложенность носа, отделяемого не было.
Ревматолог диагностировал остеопороз с патологическими переломами. При объективном осмотре 21 июня 2016 г.: рост – 187 см, вес – 86 кг, ИМТ – 25 кг/м2. Грудная клетка эмфизематозная, перкуторно – легочный звук с коробочным оттенком. Кожные покровы телесного цвета, чистые, цианоза нет. Аускультативно: в легких дыхание везикулярное ослабленное, выдох удлинен. Тоны сердца ритмичные, приглушены, ЧСС – 80 в минуту. АД – 130/85 мм рт. ст. ЧДД – 18 в минуту. В покое SaО2 – 96%, при незначительной физической нагрузке – 93%.
Периферических отеков нет. САТ – 15 баллов, MMRC – 1, 6МШП – 420 м. NOex – 64 ррb.
Таким образом, наблюдалась положительная динамика в виде уменьшения показателей оценки текущих симптомов САТ и MMRC, однако по САТ еще имело место умеренное влияние ХОБЛ. Кроме того, отмечались увеличение толерантности к физической нагрузке, по данным 6МШП, но на фоне нагрузки снижалась сатурация. Повышенным оставался уровень оксида азота в выдыхаемом воздухе.
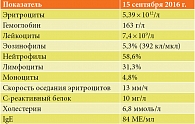
В лабораторных данных (табл. 2) обращали на себя внимание эозинофилия (около 400 кл/мл), повышение уровня С-реактивного белка (более 5 мг/л), что говорило о системной воспалительной реакции, повышенный уровень IgE – признак атопии.
Повторное функциональное обследование показало небольшую положительную динамику, бронхолитический тест – отрицательный (табл. 1).
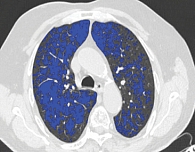
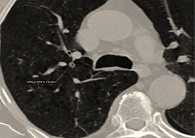
Данные компьютерной томографии (КТ) ОГК: центрилобулярная эмфизема легких. Единичные участки субплеврального уплотнения в правом легком. Пневмофиброзные тяжи в нижних отделах обоих легких. Признаки легочной гипертензии. Атеросклероз аорты. Клиновидная деформация Тh7-8 (рис. 1 и 2).
Таким образом, с помощью КТ был уточнен смешанный фенотип ХОБЛ (эмфизематозный и бронхитический).
ЭКГ: ритм синусовый, 72 в минуту, признаки систолической перегрузки левого желудочка.
Эхокардиография: аорта уплотнена, не расширена. Клапанного поражения нет. Миокард нормальной толщины, эхогенность однородная, зон гипокинеза не выявлено. Систолическая функция левого желудочка сохранена, бивентрикулярная диастолическая дисфункция первого типа. ДКГ-признаки легочной гипертензии 1-й степени. Перикард не изменен. Расчетное давление в легочной артерии – 42 мм рт. ст.
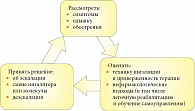
Врач, назначая терапию такому больному, должен ответить на ряд вопросов:
- каков риск обострений на фоне текущей терапии;
- следует ли менять схему лечения;
- если требуются изменения в схеме лечения, что предпочесть;
- каков объем сопутствующей терапии?
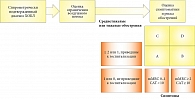
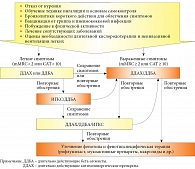
В соответствии с рекомендациями GOLD-2017 (рис. 3), пациент может быть отнесен к группе В GOLD.
Хотя пациент за истекший период не сообщал об обострениях, ему было предложено заполнить опросник для ретроспективного выявления обострений, разработанный экспертным советом Российского респираторного общества (рис. 4) [9]. Согласно опроснику, за истекший период пациент отмечал три амбулаторных обострения (легкой степени). Следовательно, пациент относится к категории D (GOLD-2017). Объем терапии у больных, относящихся к данной категории, базируется на двойной бронходилатирующей терапии с возможностью добавления ИГКС при недостаточной эффективности стартовой терапии.
Диагноз при осмотре: ХОБЛ, среднетяжелая, с выраженными симптомами, частыми обострениями, смешанный фенотип (бронхитический и эмфизематозный) (GOLD D). ДН I. Легочная гипертензия. Аллергический ринит. Гиперхолестеринемия. Остеопороз с патологическими переломами. Гипериммуноглобулинемия Е. В данном случае следовало исключить сопутствующую бронхиальную астму, поскольку имели место атопия и эозинофилия. Астма должна быть заподозрена с учетом истории заболевания в случае:
- значительной вариабельности симптомов и повторно определяемого ОФВ1;
- прироста ОФВ1 ≥ 400 мл или +15% при пробе с бронхолитиками либо прироста ОФВ1 ≥ 400 мл или +15% на фоне приема преднизолона (30 мг/сут) в течение двух недель.
ХОБЛ исключается, если на фоне терапии нормализуются уровни ОФВ1 и ОФВ1/ФЖЕЛ (форсированная жизненная емкость легких). Для диагностики сочетанной патологии ХОБЛ/астма необходимо наличие не менее трех признаков астмы, в том числе вариабельность, обратимость, отсутствие симптомов в период ремиссии [7]. Эозинофилия достаточно часто встречается у пациентов с ХОБЛ и служит маркером персистирующего воспаления бронхиального дерева, предиктором увеличения риска обострений у больных ХОБЛ, получающих бронхолитики без ИГКС, и показанием для назначения ИГКС. Причем эффективность терапии ИГКС в отношении влияния на обострения чаще наблюдается при уровне эозинофилов крови ≥ 2% [11].
Атопия у данного пациента была обусловлена аллергическим ринитом, диагностированным аллергологом.
Показано, что у каждого пятого пациента с ХОБЛ может наблюдаться атопия (по наличию в крови IgE). Подтверждение тому – результаты исследования EUROSCOP, в котором 18% пациентов с ХОБЛ имели атопию (без учета пациентов с астмой, ринитом и экземой) [12].
У пациента диагностирован остеопороз с патологическими переломами. Коморбидность при ХОБЛ весьма распространена, ассоциирована с ухудшением прогноза и системным воспалением, служащим предиктором будущих госпитализаций и неблагоприятного исхода. Поэтому, исходя из недостаточной эффективности, эозинофилии, коморбидности (аллергический ринит, остеопороз, гиперхолестеринемия), пациенту назначили будесонид/формотерол 320/9 мкг по одной ингаляции два раза в день, тиотропия бромид 2,5 мкг по две ингаляции утром. Проведено обучение технике ингаляций, добавлены аторвастатин 10 мг один раз в сутки с контролем уровня трансаминаз через три недели, интраназально флутиказона фуроат 50 мкг однократно в оба носовых хода – три месяца, продолжено лечение остеопороза, назначенное ревматологом (бифосфонаты).
Выбор будесонида/формотерола обусловлен доказанной в клинических исследованиях эффективностью при фенотипе ХОБЛ с системной воспалительной реакцией [13–15]. Кроме того, будесонид/формотерол обладает наименьшими системными проявлениями и биодоступностью, что отмечалось во многих клинических исследованиях, показавших меньший риск развития пневмоний на фоне его применения по сравнению с другими ИГКС [12, 16, 17].
На следующем осмотре в апреле 2017 г. пациент отмечал, что впервые за долгие годы стал выполнять велосипедные прогулки по утрам, одышка при физической нагрузке уменьшилась, стал подниматься без отдыха на третий этаж. Кашель продуктивный, короткими эпизодами два-три раза в неделю. На приеме больной впервые за два года легко общался, был приветлив, с интересом заполнял опросники.
При объективном осмотре 17 апреля 2017 г. в легких дыхание жесткое, слегка ослабленное в нижних отделах. Тоны сердца ритмичные, приглушены, ЧСС – 68 в минуту, АД – 115/75 мм рт. ст., ЧДД – 18 в минуту. В покое и при физической нагрузке SaО2 – 96%. MMRС – 1, САТ – 7 баллов, 6МШП – 460 м, NOex – 24 ррb. Сравнительные данные исследования функции легких представлены в табл. 3.
На фоне базисной терапии в течение месяца самочувствие улучшилось, уменьшились одышка и кашель. Показатели функции внешнего дыхания улучшились, однако сохранялись необратимые обструктивные нарушения, характерные для ХОБЛ. Пациент был отнесен к группе В. Это означало, что предпочтительна двойная бронходилатация.
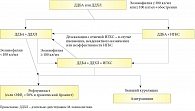
Перед врачом возник вопрос о продолжении ИГКС-терапии. Алгоритм принятия решения врачом первичного звена представлен в российских рекомендациях «Хроническая обструктивная болезнь легких – 2016» (рис. 5).
Согласно рекомендациям, пациентам с легкими симптомами (именно к этой группе относился пациент после лечения) назначают ИГКС при эозинофильном типе воспаления. Кроме того, наличие у пациента атопии и системного воспаления давало дополнительные основания для продолжения ИГКС-терапии.
Как продемонстрировал post-hoc-анализ результатов исследования WISDOM, отмена ИГКС статистически значимо повышает частоту обострений у пациентов с ХОБЛ с исходным количеством эозинофилов в крови ≥ 2% [18].
Было принято решение продолжать ИГКС-терапию в течение 12 месяцев.
Через 11 месяцев на диспансерном осмотре пациент жалоб активно не предъявлял, однако выяснилось, что за этот период больной дважды перенес инфекционное обострение ХОБЛ, по поводу чего принимал антибиотики. Нагрузка SaО2 – 96%, MMRС – 1 балл, САТ – 8 балл, 6МШП – 450 м, NOex – 25 ррb, ОФВ1 – 62%, эозинофилия крови – 142 кл/мл.
У пациента сохранялся риск обострений (два амбулаторных обострения) при достаточно стабильном управлении симптомами, что требовало продолжения ИГКС-терапии. Однако имелся риск побочного действия ИГКС – обострения носили инфекционный характер. Поэтому было принято решение о смене молекулы ИГКС и уменьшении дозы ИГКС. Оптимальным при ХОБЛ является экстрамелкодисперсный аэрозоль беклометазон/формотерол (Фостер, 100/6 мкг) – две дозы два раза в сутки. Показано, что Фостер обеспечивает достоверное снижение количества обострений, сопоставимое с таковым при применении в два раза меньшей суточной дозы будесонида/формотерола [19]. Это обеспечивается за счет экстрамелкодисперсной фракции аэрозоля и системы доставки Модулит, позволяющей доставлять в малые дыхательные пути до 34% ингалируемой дозы [20].
В феврале 2019 г. на очередном осмотре пациент сообщил, что за прошедший год обострений заболевания не отмечалось, физическая активность неограниченна.
Таким образом, после детального обследования открылись перспективы в отношении деэскалации терапии ИГКС у данного пациента, что полностью соответствует концепции GOLD-2019 (рис. 6 и 7) [21].
Выводы
В настоящее время в арсенале врача амбулаторного звена имеются достаточно эффективные инструменты для выбора персонифицированных программ диспансерного наблюдения больных ХОБЛ. В зависимости от течения болезни, выраженности симптоматики, наличия или отсутствия обострений, степени снижения дыхательной функции пациенту могут назначаться те или иные препараты из имеющихся на фармрынке.
В целях предотвращения развития повторных обострений и снижения темпов прогрессирования ХОБЛ к схеме лечения могут добавляться ИГКС-содержащие лекарственные препараты, обеспечивающие дополнительные положительные эффекты.
Опубликованный в начале 2019 г. международный консенсус GOLD-2019 содержит алгоритм выбора терапии ХОБЛ для пациентов, не демонстрирующих достаточного эффекта от ранее использованного лечения. Эскалация терапии с добавлением второго, третьего или последующих лекарственных препаратов рассматривается как логичное решение, поддерживаемое обширной доказательной базой. Однако до принятия решения об интенсификации терапии следует рассмотреть возможность смены системы доставки ингаляционного препарата или используемой молекулы бронходилататора или ИГКС, с подбором такого препарата, который будет максимально соответствовать потребностям пациента. Эффективность такого подхода продемонстрирована на примере пациента с ХОБЛ, характеризующейся обширной симптоматикой и частыми обострениями. Эскалация терапии до уровня назначения комбинации будесонида и формотерола привела к улучшению состояния пациента, но для предотвращения обострения потребовалась смена устройства доставки на дозированный аэрозольный ингалятор, создающий экстрамелкодисперсные частицы. Аэрозоль, характеризующийся средним аэродинамическим диаметром частиц менее 2 мкм, в значительной мере проникает в малые дыхательные пути, являющиеся основным местом патологического процесса при ХОБЛ, и оказывает терапевтическое воздействие при достоверно более низкой стероидной нагрузке, что увеличивает эффективность терапии и снижает риск развития местных нежелательных эффектов, в том числе таких значимых для пациентов с ХОБЛ, как пневмония.
Алгоритм ведения пациентов (GOLD-2019), предусматривающий смену ингалятора или молекулы ИГКС или бронходилататора перед эскалацией терапии, доказал свою эффективность и должен быть использован в широкой практической деятельности.
G.G. Prozorova, MD, PhD, Prof., S.I. Ovcharenko, MD, PhD, Prof., L.V. Tribuntseva, PhD, O.V. Fateyeva
Institute of Additional Professional Education of Voronezh State Medical University named after N.N. Burdenko
I.M. Sechenov First Moscow State Medical University
Contact person: Galina G. Prozorova, prozorovagg@gmail.com
The article presents a modern view of the problem of COPD in the framework of dynamic observation of the patient's physician/primary health care, presents algorithms, diagnostic and therapeutic measures required in a personalized assessment of comorbid of the patient, the rationale for the use of inhaled corticosteroids in patients with chronic obstructive pulmonary disease by analysis of actual clinical cases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.