Основы нейрореабилитации и пути повышения ее эффективности
- Аннотация
- Статья
- Ссылки
- English









Цели нейрореабилитации – создание оптимальных условий для активного участия пациента в бытовой и общественной жизни, соответственно его возвращение к активной социально-бытовой деятельности и в конечном итоге улучшение качества жизни как самого больного, так и его родственников.
Основными задачами нейрореабилитации являются влияние на восстановление жизненных функций человека физическими и психическими методами, воздействие на организм больного с помощью медикаментозной терапии для улучшения и нормализации обменных процессов и разработка системы адаптации при необратимых изменениях, обусловленных патологическим процессом.
В процессе восстановления пациента важно учитывать теоретические аспекты организации физиологических и патологических движений, иметь представления о формировании кратко- и долговременных компенсаторных процессов поврежденных структур и нарушенных функций, функциональных системах организма. Необходимо также учитывать влияние сенсорного и вербального воздействия на эффективность физических методов реабилитации.
На выработку компенсаторных механизмов большое влияние оказывает сигнализация из внешней и внутренней среды организма, так называемая обратная связь. Кроме того, надежность функционирования головного мозга обеспечивается динамичной межнейрональной деятельностью, которая приводит к морфологически избыточной связи. Реабилитация пациентов, перенесших инвалидизирующие неврологические заболевания, основана также на системной организации мозговых функций, которая указывает на резервные возможности головного мозга при реорганизации его структур на фоне патологического процесса. Данная реорганизация вызывает двигательное переобучение пациента, что в свою очередь приводит либо к восстановлению, либо к компенсации нарушенных функций.
При проведении нейрореабилитации необходимо стремиться к истинному восстановлению функций пациентов. Данный уровень реабилитации представляется наиболее высоким и заключается в том, что нарушенные функции полностью возвращаются или максимально приближаются к исходному состоянию. Основным механизмом, обеспечивающим истинное восстановление функций пациентов, является растормаживание инактивированных нервных элементов путем использования методических приемов, направленных на их стимуляцию.
При значительных деструктивных повреждениях головного мозга восстановление функций происходит благодаря компенсации за счет сохранных функциональных систем. Данный процесс обеспечивается пластичностью нервных центров и многосторонними анатомическими связями между различными отделами нервной системы. Пластичность мозга заключается в способности нервной ткани менять как структурную, так и функциональную организацию под влиянием внешних и внутренних факторов и связана с такими механизмами, как [1]:
- функционирование ранее неактивных связей;
- спрауттинг волокон сохранившихся нейронов (возобновление роста пораженного аксона, изменение ветвистости волокон, площади и плотности шипиков дендритов);
- формирование новых синапсов;
- синаптическое ремоделирование (изменение конфигурации и свойств синапсов);
- реорганизация нейрональных цепей (формирование многих цепей, обеспечивающих близкие функции);
- обеспечение внесинаптической нейрональной передачи возбуждения;
- изменения астроглии: изменение структуры астроцитов, увеличение числа контактов синапсов и астроцитов.
Осуществляя медицинскую и социальную реабилитацию, следует помнить, что тяжелые инвалидизирующие неврологические заболевания не только оказывают кратковременное влияние на соматоневрологический статус пациента, но и вызывают длительную инвалидизацию и социальную дезадаптацию.
Медицинская реабилитация осуществляется в рамках трех этапов в зависимости от состояния пациента [2]:
- этап I проводится в остром периоде заболевания в отделениях реанимации и интенсивной терапии в отсутствие противопоказаний к проведению реабилитации;
- этап II приходится на ранний восстановительный период, поздний восстановительный период, период остаточных явлений заболевания в условиях стационарной реабилитации;
- этап III реализуется в течение раннего восстановительного периода, позднего восстановительного периода, периода остаточных явлений заболевания в условиях амбулаторной реабилитации, а также на дому пациента.
Для организации и проведения адекватной и эффективной реабилитации необходимо учитывать особенности нарушения функционирования неврологических систем при различных органических заболеваниях головного мозга. Рассмотрим основные из них.
Нарушения функционирования двигательной системы
Восстановление двигательных функций у пациента с гемиплегией аналогично развитию младенца. То есть последовательность восстановления контроля за статикой и динамикой тела у пациента после, например, сосудистого поражения головного мозга соответствует последовательности стадий развития и роста ребенка.
Так, прежде всего появляется контроль за движениями головы вслед за переворачиванием, далее – сохранность равновесия в положении сидя, затем – в положении стоя, потом – вертикализация и, наконец, хождение с постепенным повышением степени устойчивости и увеличением скорости перемещения.
Для оценки состояния двигательных функций пациента, прогнозирования результатов реабилитации, а также для постановки целей реабилитации важно понимать, на какой «ступени развития» находится пациент [3]. Поэтому оценка контроля движений, устойчивости и походки при осмотре пациента чрезвычайно важна.
Кроме того, необходимо оценивать силу или слабость отдельных мышечных групп и мышц, что удобно выполнять с помощью шкалы MRC (Medical Research Council Scale – Шкала Медицинского исследовательского совета) [3], а также общую выраженность гемипареза с использованием модифицированной шкалы MRC – индекса произвольных движений (Morticity Index) [3].
Нередко для специалистов большую проблему представляют не пациенты с выраженным гемипарезом или гемиплегией, а больные с минимальными двигательными нарушениями, прежде всего с так называемой кортикальной рукой. Порой синдром кортикальной руки расценивают как поражение периферических нервов, но более тщательный анализ свидетельствует о возникновении данного синдрома вследствие очагового поражения головного мозга, например инсульта.
Ограниченный двигательный дефект, нормальный мышечный тонус, отсутствие анизорефлексии и патологических симптомов еще более дезориентируют специалистов, и они не верифицируют диагноз очагового поражения головного мозга.
Кроме того, в данном случае пациент может не предъявлять субъективных жалоб на слабость в конечностях. В такой ситуации наиболее чувствительной пробой для оценки состояния кортикоспинальных путей считается выявление тонких движений пальцев верхней конечности или быстрых движений кисти. Положительный результат пробы соответствует двигательно-функциональным проблемам пациентов с отсутствием жалоб на слабость мышц, таких как трудности при письме. При этом больные описывают подобное состояние не как слабость, а как неловкость/неуклюжесть.
Нередко для выявления синдрома кортикальной руки используют различные пробы и тесты, которые выявляют легкий двигательный дефект в руке при поднятии и удерживании обеих верхних конечностей (верхняя проба Барре, тест позы Будды, симптом Мингаццини). Опускание одной из рук при закрытых глазах признается как достоверный показатель наличия легкого двигательного дефицита, а данные пробы расцениваются как чувствительные скрининговые тесты для оценки двигательных функций. Однако положительный результат таких проб не во всех случаях связан с нарушением функционирования двигательной системы, иногда он может быть обусловлен:
- снижением глубокой чувствительности, вследствие чего пальцы пытаются двигаться самостоятельно (симптом игры на фортепьяно, псевдоатетоз);
- невниманием, приводящим к высокоамплитудным движениям, в том числе и вверх;
- мозжечковой дисфункцией, при которой также возможны высокоамплитудные движения.
Важно! Двигательные нарушения, выявляемые при осмотре пациента в постели, могут не совпадать с двигательными нарушениями, проявляющимися при вертикализации и ходьбе больного. В то же время существенные двигательные нарушения, обнаруженные в постели, могут быть проявлением невнимания, а не слабости, отсутствие признаков мышечной слабости в кровати не исключает наличия тяжелых атактических нарушений, приводящих к трудностям при ходьбе или ее невозможности.
У ряда пациентов при осмотре в кровати, на первый взгляд, выявляется гемиплегия без каких-либо движений как в верхней, так и в нижней конечностях. Однако, как выясняется, они способны к самостоятельному перемещению в вертикальном положении. Данное парадоксальное состояние встречается при капсулярном, так называемом предупредительном синдроме или повторных транзиторных ишемических атаках вследствие поражений мелких артерий и артериол головного мозга [3]. Подобные нарушения также могут быть следствием гемодинамически значимых стенозов внутренней сонной артерии.
Кроме того, синдром невнимания и/или апраксия могут вызывать возникновение капсулярного синдрома, что необходимо учитывать при определении реабилитационного потенциала и прогнозировании функционального исхода заболевания. Так, у пациентов с обширной зоной поражения в субдоминантном полушарии выраженный гемипарез или гемиплегия достаточно быстро регрессируют по мере разрешения синдрома невнимания [4].
Расстройства движений после перенесенного очагового поражения головного мозга нередко вызваны повышенным мышечным тонусом, который приводит к нарушению выполнения простых движений, снижению уровня бытовой адаптации и соответственно качества жизни.
Распределение мышечной спастичности, например, после инсульта имеет неравномерный характер, что проявляется достаточно типичной для постинсультных двигательных нарушений позой Вернике – Манна с большей выраженностью спастичности в аддукторах плеча, сгибателях руки и пронаторах предплечья (рука приведена к туловищу, предплечье согнуто в локтевом суставе и пронировано, кисть и пальцы согнуты) и разгибателях нижней конечности (бедро разогнуто и приведено, голень разогнута, стопа ротирована кнутри, наблюдается ее подошвенное сгибание).
Могут наблюдаться и другие типы распределения повышенного мышечного тонуса у пациентов с очаговым поражением головного мозга:
- выраженная гиперпронация предплечья и разгибание пальцев кисти;
- гиперсупинация предплечья и разгибание кисти;
- причудливые установки кисти и пальцев;
- повышение мышечного тонуса в сгибателях нижней конечности.
Нарушения функционирования системы чувствительности
Нарушения чувствительности при очаговых поражениях головного мозга представляют собой существенную и порой трудноразрешимую проблему.
Так, более чем у 50% пациентов после инсульта нарушается функционирование системы чувствительности, но у половины из них адекватно оценить чувствительность и ее изменения не представляется возможным вследствие спутанности сознания или коммуникативных проблем. В то же время грубые нарушения чувствительности, особенно расстройство глубокой чувствительности, способны привести к выраженной, ничуть не меньшей инвалидизации, чем глубокие парезы.
Безусловно, при осмотре пациента с органическим поражением головного мозга на предмет выявления чувствительных нарушений специалист нередко сталкивается с рядом трудностей. Речь идет о сонливости, нарушении речи, когнитивных расстройствах, деменции, зрительно-пространственных нарушениях, которые затрудняют проведение достоверной диагностики.
При осмотре пациента необходимо помнить о сенсорном угасании. Данное проявление зрительно-пространственных нарушений также влияет на достоверность результатов осмотра. Сенсорное угасание – явление, когда пациент теряет способность воспринимать тактильное раздражение на одной стороне тела при одновременном нанесении с обеих сторон, но воспринимает раздражение в случае последовательного нанесения.
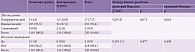
Специалисты нередко сталкиваются с достаточно ограниченными нарушениями чувствительности в необычных сочетаниях, прежде всего с хейро-оральным синдромом [3] (табл. 1).
Нарушения высших мозговых функций
Выявление нарушений высших мозговых функций достаточно важная, в то же время весьма сложная для лечащего врача задача.
Внимание. Недостаток внимания у пациента способствует нарушению концентрации и появлению рассеянности, что, безусловно, негативно сказывается на результатах реабилитации.
Оценка состояния внимания пациента и его концентрации должна проводиться у постели больного и базироваться по крайней мере на четырех тестах и заданиях:
- ориентация в себе, пространстве и времени;
- перечисление названий пальцев с первого до пятого и затем с пятого до первого;
- перечисление дней недели и месяцев года в обратном порядке;
- осуществление серии вычитаний числа «7».
Память. Нередко у пациентов с органическим поражением головного мозга достаточно трудно установить точную причину расстройства памяти, поскольку встречающееся на фоне поражения мозга нарушение концентрации внимания приводит к снижению способности усвоения новой информации. Кроме того, нарушения когнитивных функций отмечаются у многих пациентов до развития заболевания.
Для оценки состояния памяти пациента можно провести краткий тест, предусматривающий:
- ориентацию пациента в собственной личности, пространстве и времени;
- перечисление месяцев года в прямом и обратном порядке;
- перечисление дней недели в прямом и обратном порядке;
- называние пальцев руки;
- осуществление элементарных математических действий.
Речь. Нарушение речи у пациентов с поражением головного мозга проявляется в виде афазии или дизартрии. В большинстве случаев афазия сочетается с аграфией и алексией. В то же время устная и письменная речь являются отдельными важными речевыми функциями и должны рассматриваться и оцениваться отдельно. При поражении субдоминантного полушария головного мозга возможно проявление апросодии, которая характеризуется потерей способности правильно использовать различные просодические характеристики: ударения, колебания тона, интонации и эмоциональные жесты.
Важно проводить дифференциальную диагностику для определения наличия у пациентов афазии/дисфазии и анартрии/дизартии. В первые дни после перенесенного очагового поражения головного мозга, например инсульта, в ряде случае может наблюдаться абсолютное отсутствие экспрессивной речи, что обычно обусловлено грубой афазией. Иногда причиной полного отсутствия экспрессивной речи является анартрия – следствие двустороннего поражения ствола головного мозга.
В большинстве случаев у пациентов данной категории наблюдается смешанная афазия, то есть сочетание экспрессивной и рецептивной афазии, когда нарушается как продукция, так и понимание речи.
Важно! Ряд пациентов с нарушением речи, возникшим после нарушения кровообращения головного мозга, страдают так называемым интактным повторением, что наблюдается либо при нарушении кровообращения в бассейне передней мозговой артерии (транскортикальная моторная афазия), либо при нарушении кровообращения в бассейне задней мозговой артерии (транскортикальная сенсорная афазия). Поэтому, проводя оценку экспрессивной и импрессивной речи, нельзя ограничиваться вопросами, требующими однозначных утвердительных или отрицательных ответов, и простыми так называемыми социальными диалогами.
При реабилитации пациентов, особенно после инсульта, специалисты сталкиваются с трудностями при наличии акустико-мнестической, семантической и амнестической афазии.
Безусловно, восстановление двигательных, чувствительных, когнитивных функций, уровень социально-бытовой адаптации пациентов, а также качество их жизни в определенной степени зависят от своевременного и адекватного применения методов физической и нейропсихологической реабилитации, осуществления правильного ухода, соблюдения мультидисциплинарного принципа ведения данной категории пациентов. Однако, согласно результатам различных исследований, использование медикаментозной терапии в рамках комплексной реабилитации также имеет существенное значение в отношении повышения ее эффективности [1, 5–8].
Одним из основных условий, предъявляемых к лекарственному средству, используемому при реабилитации пациентов с неврологическими заболеваниями, является его благоприятное воздействие на процессы нейропластичности тканей головного мозга. Кроме того, наиболее перспективным направлением медикаментозной реабилитации считается использование предшественников компонентов клеточных мембран с нейромедиаторными, нейротрансмиттерными и нейрорецепторными свойствами и препаратов, восстанавливающих синаптические передачи.
Одним из препаратов, который в полной мере отвечает указанным требованиям, является препарат Целлекс, в состав которого входит ряд сигнальных белков и пептидов: факторы роста и дифференцировки нервных клеток, сигнальные молекулы клеточных ядер, цитоплазмы и межклеточного матрикса с молекулярной массой от 10 до 250 кДа.
Основные клинические эффекты Целлекса обусловлены существенным уменьшением или полным устранением последствий перенесенного повреждения мозгового вещества, обусловленного, в частности, ишемией, за счет нормализации кровоснабжения, синтеза белков, восстановления баланса нейротрансмиттеров и нейромедиаторов, а также активации процессов нейрорегенерации и нейрорепарации.
Целлекс оказывает прямое нейрорепаративное действие, что обусловлено эффектами входящих в его состав тканеспецифических сигнальных белков и полипептидов – факторов роста и дифференцировки нервных клеток и сосудов. При этом тканеспецифическое и системное репаративное действие препарата способствует восстановлению регенеративного и репаративного потенциала клеток мозга [9].
Кроме того, данный препарат активирует вторичную нейропротекцию за счет восстановления сигналов аутофагии, улучшения тканевой иммунорегуляции с торможением иммуногенной цитотоксичности макрофагов.
В экспериментальных условиях показано, что нейропротективный эффект Целлекса связан с наличием в его составе сигнальных молекул, что приводит к конкурентному ингибированию сигналов к апоптозу, обеспечивая сохранение нейронов в зоне пенумбры, а также к торможению местной воспалительной реакции и уменьшению отека, восстановлению локального кровотока ишемизированной зоны с ее реперфузией, превосходящей уровень, наблюдаемый до ишемии [10, 11].
Нейротрофические свойства Целлекса также связаны с его активирующим влиянием на процессы нейропластичности, активацией процессов синаптогенеза сохраненных нейронов, что важно для проведения результативной и эффективной реабилитации.
Для изучения влияния нейроцитопротективной терапии на повышение эффективности комплексной реабилитации пациентов после инсульта нами были проведены два независимых исследования. Цель данных исследований – повысить эффективность реабилитации постинсультных пациентов, задача – проанализировать использование препарата Целлекс при реабилитации пациентов, перенесших инсульт, а именно:
- оценить эффективность препарата Целлекс в повышении степени восстановления различных неврологических функций пациентов (двигательных, чувствительных, когнитивных);
- определить степень влияния препарата Целлекс на уровень социально-бытовой адаптации пациентов;
- изучить эффективность препарата Целлекс в отношении нормализации психоэмоционального состояния;
- оценить безопасность и переносимость препарата Целлекс.
В рамках обоих исследований анализу были подвергнуты результаты лечения 450 пациентов (227 женщин и 223 мужчины) в возрасте 32–82 лет (средний возраст – 64,4 года), перенесших ишемический или геморрагический инсульт.
Рассмотрим данные исследования и их результаты.
Исследование 1
Исследование 1, проведенное в Центре медицинской реабилитации Городской больницы № 38 им. Н.А. Семашко (Санкт-Петербург), было проспективным сравнительным и открытым.
Материал и методы
Анализу были подвергнуты результаты лечения 230 пациентов (124 женщины и 106 мужчин) в возрасте 32–82 лет (средний возраст – 65,3 года), перенесших ишемический инсульт.
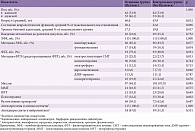
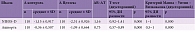
Все пациенты были разделены на две группы по 115 человек (получавшие Целлекс (основная группа) и не получавшие Целлекс (контрольная группа)), которые были стандартизированы по различным показателям, таким как возраст, пол, степень выраженности неврологических и психоэмоциональных нарушений, уровень бытовой адаптации, а также проводимые виды и методы физической, физиотерапевтической, нейропсихологической и психотерапевтической реабилитации (принцип matched-controlled). Стандартизация исследуемых групп, проведенная по перечисленным показателям сопоставимости, представлена в табл. 2.
Целлекс назначали в течение первых шести месяцев инсульта и вводили подкожно по 0,1 мг (1 мл) один раз в сутки в течение десяти дней. Через месяц после окончания данного курса проводили повторный аналогичный курс.
Результаты лечения анализировали по следующим параметрам: восстановление неврологических функций, уровень социально-бытовой адаптации, психоэмоциональное состояние.
Нарушение и степень восстановления неврологических функций определяли по шкалам Бартел [12], Линдмарка [13] и Скандинавской шкале [14]. По шкале Бартел оценивали двигательные функции и бытовую адаптацию, по шкале Линдмарка – функции движения и чувствительности, по Скандинавской – двигательные, речевые функции, ориентацию во времени, пространстве и собственной личности. В соответствии с полученными результатами, степень восстановления определяли следующим образом: отсутствие восстановления – среднее арифметическое количество баллов, набранное по всем трем перечисленным шкалам, менее 30% баллов от их максимального количества; минимальное – 30–49%; удовлетворительное – 50–74%; достаточное – 75–94%; полное – более 94%.
Уровень бытовой и социальной адаптации определяли по шкале самооценки бытовых возможностей повседневной жизни Мертон и Саттон [15]. Степень бытовой адаптации определяли так: отсутствие бытовой адаптации – 0 баллов; минимальная – 1–29 баллов; удовлетворительная – 30–45 баллов; достаточная – 46–58 баллов; полная – 59 баллов. Кроме того, оценивали способность к независимому выполнению отдельных бытовых навыков (использование туалета, умывание, принятие ванны, одевание, прием и приготовление пищи, вождение автомобиля, сексуальная активность).
Психоэмоциональное состояние оценивали с помощью опросника Бека [16] и шкалы самооценки депрессии Уэйкфилда [17], на основании которых в процентном отношении определяли среднее значение распространенности депрессии в каждой группе пациентов. При наличии депрессии с помощью опросника Бека также определяли степень ее выраженности.
Критерии включения пациентов в настоящее исследование:
- диагноз – инфаркт головного мозга, подтвержденный при проведении компьютерной или магнитно-резонансной томографии;
- степень нарушения неврологических функций (количество баллов по шкалам Бартел, Линдмарка и Скандинавской – не более 24% от максимального количества баллов);
- степень социально-бытовой дизадаптации: количество баллов по шкале Мертон и Саттон – не более 24% от максимального количества баллов; зависимость при выполнении и/или невозможность осуществления основных социально-бытовых навыков;
- психоэмоциональное состояние (наличие выявленной с помощью опросника Бека и шкалы Уэйкфилда депрессии любой степени выраженности).
Статистический анализ результатов исследования проводили с использованием пакетов программы SPSS 16.0. Для сравнения качественных признаков и процентных соотношений использовали критерий независимости качественных (категориальных) признаков χ², точный критерий Фишера и коэффициент неопределенности. Наличие зависимости между изучаемыми признаками признавалось, когда доверительный уровень составлял р < 0,05. При частоте изучаемого события менее пяти наблюдений в одной из ячеек таблицы использование критерия χ2 считалось некорректным и требовало использования точного критерия Фишера.
Результаты и обсуждение
Согласно результатам исследования, применение Целлекса в статистически значимой степени влияет на повышение эффективности реабилитации пациентов после инсульта. Так, в основной группе (Целлекс) достаточная и полная степень восстановления неврологических функций отмечалась у 68,7% больных, в контрольной (без Целлекса) – у 31,3% (р < 0,001) (табл. 3).
Показано также, что применение Целлекса способствует статистически значимому повышению уровня бытовой адаптации пациентов после инсульта. В основной группе достаточная и полная степень бытовой адаптации отмечалась в 66,1% случаев, а в контрольной – в 30,4% (р < 0,001) (табл. 3).
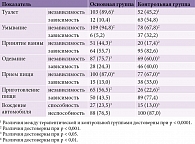
Целлекс оказывает статистически значимое положительное влияние на достижение пациентами независимости при выполнении основных бытовых навыков (табл. 4). Так, в основной группе (Целлекс) 89,6% пациентов, зависимых при использовании туалета, приобрели независимость при выполнении данного бытового навыка, в контрольной (без Целлекса) – 45,2% (р < 0,0001) (табл. 4).
В основной группе 94,8% пациентов, зависимых при умывании, приобрели независимость при выполнении данного бытового навыка, в контрольной группе таковых насчитывалось 67,8% (р < 0,001) (табл. 4).
В основной группе 44,3% больных, зависимых при принятии ванны, приобрели независимость в этом отношении. В контрольной группе этот показатель составил 17,4% (р < 0,001) (табл. 4).
Независимость в одевании приобрели 75,7% пациентов основной группы и 60,0% – контрольной (р < 0,05) (табл. 4).
В основной группе 87,0% пациентов, зависимых в приеме пищи, приобрели независимость в этом отношении, в контрольной группе – 67,0% (р < 0,01) (табл. 4).
Независимость при приготовлении пищи приобрели 56,5% пациентов основной группы и 22,6% – контрольной (р < 0,001) (табл. 4).
Кроме того, согласно результатам исследования, Целлекс способствует возвращению навыка вождения автомобиля. В группе Целлекса 23,5% больных среди тех, кто управлял автомобильными средствами до инсульта и утратил данную способность вследствие заболевания, вновь вернулись к вождению. В контрольной группе данный показатель составил 13,0% (р < 0,05) (табл. 4).
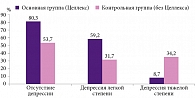
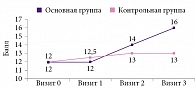
Нормализация психоэмоционального состояния также в существенной степени зависела от использования Целлекса. Так, в основной группе депрессия после курса реабилитационного лечения отсутствовала у 80,3% пациентов (рис. 1). При наличии депрессии ее легкая степень наблюдалась у 59,2% больных, а тяжелая – у 8,7% пациентов основной группы.
В контрольной группе депрессия после курса терапии отсутствовала у 53,7% больных. При наличии депрессии в данной группе ее легкая степень наблюдалась у 31,7% больных, тяжелая – у 34,2% (рис. 1).
Таким образом, применение Целлекса в статистически значимой степени способствует улучшению психоэмоционального состояния постинсультных пациентов (р < 0,001), что в свою очередь положительно влияет на повышение эффективности комплексной реабилитации пациентов, перенесших инсульт.
Результаты настоящего исследования демонстрируют эффективность препарата Целлекс при реабилитации пациентов после инсульта, что проявляется в повышении степени восстановления двигательных, чувствительных, координаторных, когнитивных функций пациентов, уровня их социально-бытовой адаптации, а также нормализации психоэмоционального состояния.
Исследование 2
Материал и методы
Исследование 2, проведенное в нескольких лечебно-профилактических учреждениях г. Краснодара и Краснодарского края, было наблюдательным многоцентровым открытым рандомизированным сравнительным.
Анализу были подвергнуты результаты лечения 220 пациентов (103 женщины и 117 мужчин) в возрасте 45–80 лет (средний возраст – 62,95 года), перенесших ишемический и геморрагический инсульт.
После предварительного обследования в рамках скрининга пациенты, соответствовавшие критериям включения/невключения, случайным образом были распределены в одну из двух групп на визите рандомизации.
Пациенты первой (основной) группы получали препарат Целлекс в дополнение к рутинной практике, у больных второй (контрольной) группы терапия соответствовала рутинной практике.
Пациенты двух групп были стандартизированы по различным многочисленным показателям (табл. 5–11).
В таблице 5 представлена стандартизация пациентов двух групп исследования по полу. Статистически значимые различия между группами по полу не выявлены.
В таблицах 6 и 7 представлена стандартизация пациентов двух групп исследования по возрасту. Статистически значимые различия между группами по возрасту также не выявлены.
При включении в исследование пациенты также были стандартизированы по наличию сопутствующей патологии, которая представляет собой патоморфологические причины развития инсультов: атеросклероз сосудов головного мозга, сахарный диабет, артериальная гипертензия и фибрилляция предсердий (табл. 8).
Как видим, группы были стандартизированы по таким заболеваниям, как атеросклероз сосудов головного мозга, фибрилляция предсердий, сахарный диабет. Наблюдается статистически значимое различие между группами по распространенности артериальной гипертензии. В основной группе пациентов с артериальной гипертензией было 87,3%, в контрольной – 75,5%.
Стандартизация пациентов двух групп исследования по типу инсульта, локализации его очага и срокам давности заболевания представлена в табл. 9–11. Различия между группами по типу инсульта и локализации очага поражения головного мозга не выявлены. Имело место статистически значимое различие между пациентами в группах по давности инсульта (количество дней от момента развития заболевания). Так, 95%-ный доверительный интервал (ДИ) разности средних значений составил от -8,74 до -2,69 дня, то есть средняя давность инсульта в основной группе оказалась как минимум на 2,7 дня меньше, чем в контрольной.
Препарат Целлекс назначали в виде двух десятидневных терапевтических курсов: по 1,0 мл один раз в сутки, подкожно, перерыв между курсами – один месяц.
Во время участия в исследовании пациенты принимали базисную терапию, включавшую антиагреганты, антикоагулянты, гипотензивные препараты, статины, сахароснижающие и иные лекарственные средства. Прием ноотропных препаратов пептидной природы, за исключением Целлекса, не допускался.
Настоящее клиническое исследование состояло из следующих этапов:
скрининг. После подписания информированного согласия все процедуры проводились согласно расписанию исследования. Решение о назначении исследуемого препарата принималось на основании клинической картины заболевания и результатов обследования пациента;
- визит 0 – в первый день (первое введение препарата);
- визит 1 – через 40 (± 5) дней от начала терапии (второе введение препарата);
- визит 2 – через 80 (± 5) дней от начала терапии;
- визит 3 – через 110 (± 5) дней от начала терапии.
Длительность наблюдения за пациентами составила до 115 дней.
Критерии включения пациентов в исследование:
- возраст 45–80 лет независимо от пола;
- полушарный ишемический или геморрагический инсульт в раннем реабилитационном периоде заболевания (от 20 дней до двух месяцев с момента развития заболевания);
- пирамидная симптоматика в виде гемипареза или верхнего монопареза на момент включения в исследование;
- общий балл по шкале MoCa – 20–26;
- общий балл по каждой из субшкал Госпитальной шкалы тревоги и депрессии (HADS) (субшкала тревоги и субшкала депрессии) – 10 и менее;
- способность и готовность пациента к соблюдению требований протокола наблюдения и режима получения исследуемой терапии.
Эффективность проводимой терапии оценивали на основании данных неврологического обследования и оценки по психометрическим шкалам. Неврологические нарушения оценивали по шкале тяжести инсульта Национального института здоровья CША (NIHSS) [18], пирамидные нарушения – по шкале NIHSS (разделы 5 и 6: движения в верхних и нижних конечностях), шкале Ашворта [19], когнитивные функции – по шкале MoCA [20], FAB (батарея тестов лобной дисфункции – БТЛД) [21], пробе Шульте [22]. Степень функциональной независимости определяли по модифицированной шкале Рэнкина [23].
Первичная конечная точка эффективности – динамика балла по шкалам оценки пирамидных нарушений через два месяца после окончания второго курса лечения по сравнению с динамикой в контрольной группе.
Вторичные конечные точки эффективности:
- общий балл по шкале MoCA и его динамика по сравнению с исходным уровнем;
- общий балл, согласно FAB (БТЛД), и его динамика по сравнению с исходным уровнем;
- результат пробы Шульте и его динамика по сравнению с исходным уровнем;
- балл по модифицированной шкале Рэнкина и его динамика по сравнению с исходным уровнем.
Эффективность проводимой терапии оценивали:
- на 40-й (± 5) день (через месяц после завершения первого курса лечения);
- 80-й (± 5) день (через месяц после завершения второго курса лечения);
- 110-й (± 5) день (через два месяца после завершения второго курса лечения).
Безопасность Целлекса оценивали на протяжении всего клинического исследования, согласно плану исследования, по следующим параметрам:
- число пациентов (в процентах к общему числу), которым потребовалась отмена изучаемого препарата из-за развития нежелательных реакций;
- частота и степень выраженности нежелательных реакций.
Статистический анализ проводили с помощью специального программного обеспечения пакета R, версия 3.2.1. Непрерывные (количественные) данные представлены в виде количества наблюдений, среднего арифметического, 95% ДИ для среднего, стандартного (среднеквадратического) отклонения, минимальных и максимальных значений.
Для данных, распределение которых выраженно отличается от нормального, дополнительно представлены медиана и межквартильный размах.
Порядковые, категориальные и качественные данные представлены с помощью абсолютных частот (количество наблюдений) и относительных частот (проценты к итогу).
Результаты и обсуждение
Результаты проведенного исследования продемонстрировали статистически значимо подтвержденную эффективность применения Целлекса при проведении реабилитации пациентов после инсульта.
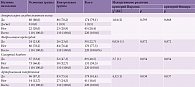
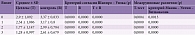
Так, по шкале NIHSS-D (шкала инсульта NIHSS – движения в конечностях) средняя динамика в течение двух месяцев терапии (от визита 0 до визита 3) в основной группе составила 2,31 балла, в контрольной – 1,15 балла. Различие между данными изменениями статистически значимы (p < 0,001), двусторонний 95% ДИ разности изменений – 0,92–1,41 балла (табл. 12).
Кроме того, выявлено статистически значимое различие между группами при сравнении изменения числа баллов от визита 0 к визиту 3 по шкале Ашворта.
Так, среднее изменение суммы баллов в основной группе составило 1,09, в контрольной – 0,36 (p < 0,001), двусторонний 95% ДИ разности динамики суммы баллов в группах – 0,57–0,89 (табл. 12).
Согласно результатам исследования и сформулированной в исследовании статистической гипотезе по типу статистического превосходства, подтверждена альтернативная гипотеза, которая заключается в том, что терапия препаратом Целлекс на фоне комплексной (рутинной) терапии и реабилитации эффективнее только рутинной терапии и реабилитации (табл. 13).
Поскольку полученные значения p существенно меньше установленного в исследовании уровня значимости (0,05), основную гипотезу следует отвергнуть и принять альтернативную, говорящую о том, что, согласно результатам сравнения изменения баллов по шкалам NIHSS-D и Ашворта, комплексное использование Целлекса наряду с рутинной терапией и реабилитацией эффективнее, чем применение только рутинной терапии и реабилитации.
Согласно результатам проведенного исследования, Целлекс оказывает статистически значимое положительное влияние на вторичные конечные точки оценки эффективности:
- средние значения эффективности (динамики изменения значений шкал за два месяца лечения) между группами статистически значимо различаются как при их сравнении параметрическим критерием Стьюдента (Т-тест), так и непараметрическим критерием Манна – Уитни – Вилкоксона;
- при анализе сопряженности значений дельт выявлено статистически значимое различие между частотами значений дельт в группах сравнения.
Применение в рамках комплексной терапии Целлекса оказывало благоприятное влияние на состояние когнитивных функций пациентов, перенесших инсульт. При этом отличия состояния когнитивных функций по сравнению с исходными приобретали статистически значимый характер через 40 дней после начала первого курса терапии Целлексом (р = 0,0049; U-критерий Манна – Уитни) и статистически значимо увеличивались к окончанию второго курса терапии данным препаратом.
У пациентов основной группы после окончания повторного курса использования данного препарата наблюдалась дальнейшая положительная динамика по шкале МоСА. При этом различия носили статистически значимый характер по сравнению с предыдущим обследованием (р = 0,035; U-критерий Манна – Уитни) (рис. 2). Данные показатели также статистически значимо отличались от исходных и превышали таковые пациентов контрольной группы по окончании курса терапии.
Наиболее выраженные различия отмечались при проведении субтестов перерисовывания фигур и воспроизведения слов в течение всего периода наблюдения.
При оценке регуляторных функций с помощью БТЛД статистически значимые различия между группами пациентов, получавших и не получавших Целлекс, регистрировались через 80 дней после окончания терапии (рис. 3).
При исследовании функции внимания, согласно пробе Шульте, статистически значимые отличия по сравнению с исходным уровнем были получены только после двух курсов терапии Целлексом. Так, исходная средняя скорость, затраченная на выполнение задания, составила 87 ± 10'', а после проведения второго курса терапии Целлексом – 69 ± 10''.
Одним из наиболее важных результатов исследования стало свидетельство благоприятного влияния препарата Целлекс на снижение степени инвалидизации пациентов, перенесших инсульт. Это говорит о влиянии данного препарата на повышение эффективности реабилитации данной категории пациентов.
Степень инвалидизации у пациентов основной группы уменьшилась к визиту 3 (через 110 ± 5 дней от начала терапии) по сравнению с визитом 0 на 1,62 балла по модифицированной шкале Рэнкина, в то время как в контрольной группе – на 0,76 балла (табл. 14).
Безопасность терапии в ходе настоящего исследования оценивали во всей популяции. Случаи нежелательных явлений, серьезных и значимых нежелательных явлений, летальных исходов не зарегистрировано.
Переносимость исследуемого препарата была хорошей.
Полученные результаты позволяют сделать вывод о статистически значимой эффективности добавления препарата Целлекс к рутинной терапии и реабилитации пациентов, перенесших инсульт, по сравнению с применением только рутинной терапии и реабилитации. Кроме того, статистически значимо показаны безопасность и хорошая переносимость данного препарата.
Заключение
Результаты проведенных исследований в статистически значимой степени демонстрируют эффективность препарата Целлекс при реабилитации пациентов после инсульта. Использование данного препарата в рамках комплексной реабилитации в статически значимой степени повышает показатели восстановления неврологических функций пациентов, уровень их социально-бытовой адаптации, а также способствует нормализации психоэмоционального состояния больных, перенесших инсульт.
Полученные результаты согласуются с данными других авторов о положительном влиянии Целлекса на повышение эффективности лечения пациентов после инсульта [24–27].
Учитывая большое разнообразие лекарственных препаратов, предлагаемых для реабилитации пациентов, перенесших инсульт, и отсутствие единого мнения исследователей об их эффективности, необходимо отметить, что дальнейшие исследования в данной области представляются интересными и чрезвычайно полезными.
Таким образом, говоря об основных аспектах, направлениях и принципах нейрореабилитации, важно понимать комплексность, целенаправленность и проблемную ориентированность данного процесса, который прежде всего направлен на повышение степени восстановления неврологических функций пациентов, уровня их социально-бытовой адаптации и в конечном итоге на улучшение качества жизни больных и их родственников.
V.V. Kovalchuk, PhD, Prof., L.A. Tsukurova, PhD, A.S. Galkin, PhD, M.A. Bidenko, N.V. Bazilevskaya, M.S. Grigoryan, Ye.A. Guryanova, PhD, Prof., K.V. Nesterin, PhD, F.A. Alkhanov, A.M. Toremukhamet, Ye.V. Mykal, A.I. Mishchenkova, Ye.A. Malysheva
City Hospital № 38 named after N.A. Semashko, Medical Rehabilitation Center, Saint Petersburg
Kuban Medical Institute, Krasnodar
Yeisk Central District Hospital
Institute of Advanced Medical Training, Cheboksary
City Clinical Hospital № 1, Cheboksary
H.A. Yasavi International Kazakh-Turkish University, Turkestan
Central District Hospital, Absheronsk
Kanevskaya Central District Hospital
Slavyanskaya Central District Hospital, Slavyansk-on-Kuban
Contact person: Vitaly V. Kovalchuk, vikoval67@mail.ru
This article is devoted to the basic principles of the organization and carrying out rehabilitation of the neurological patients. Theoretical and practical aspects of effective rehabilitation, features of functioning of neurologic systems at focal damages of a brain are considered. Besides that, the results of two carried out in St. Petersburg and in Krasnodar and Krasnodar’s Region independent researches of efficiency of the medicine Cellex in stroke patients concerning rehabilitation of neurological functions, increase of level of household adaptation, achievement of independence in separate household skills and also normalization of psychoemotional condition and cognitive functions are given in this article. As showed results of the researches, use of the Cellex within complex rehabilitation in statistically significant degree promotes increase the rehabilitation of neurological functions in stroke patients, level of their social adaptation and normalization of cognitive functions and psychoemotional condition.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.