Особенности лечения ИБС на фоне анемии различного генеза
- Аннотация
- Статья
- Ссылки
В последние десятилетия отмечается тенденция к омоложению этой патологии. ИБС – фактор риска внезапной сердечной смерти, на ее долю приходится 2/3 случаев смерти от сердечно-сосудистых заболеваний. Всемирной Организацией Здравоохранения ИБС как самостоятельное заболевание была выделена лишь в 1965 году (6).
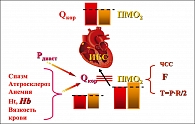
ИБС – несоответствие величины потребления миокардом кислорода (ПМО2) объему коронарного кровотока (Qкор.), доставляющего кислород к сердечной мышце (Qкор. ≤ ПМО2), которые контролируются различными параметрами центральной гемодинамики, состоянием крови и сократительными свойствами кардиомиоцитов (рисунок 1).
Эквивалентом работоспособности сердца как насоса является ПМО2, доставка которого обеспечивается Qкор.. Величина коронарного кровотока регулируется тоническим состоянием коронарных сосудов и разницей давления в восходящем отделе аорты и полости левого желудочка:
где Р1 – давление в восходящем отделе аорты, Р2 – давление в левом желудочке, Rкор – сопротивление коронарных сосудов.
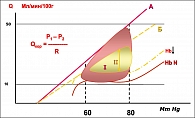
Энергетическое обеспечение насосной деятельности сердца в широком диапазоне его деятельности – от состояния покоя до уровня максимальной нагрузки – происходит за счет коронарного резерва. Коронарный резерв – способность коронарного сосудистого русла во много раз увеличивать коронарный кровоток адекватно уровню ПМО2 за счет дилатации коронарных сосудов (рисунок 2). Величина коронарного резерва (I) в зависимости от давления в коронарных сосудах заключена между прямой, соответствующей коронарному кровотоку при максимально дилатированных сосудах (А – нормальные сосуды, Б – атеросклеротически измененные сосуды), и кривой величины коронарного кровотока при нормальном сосудистом тонусе (область ауторегуляции). При снижении уровня гемоглобина, носителя О2, для адекватного обеспечения ПМО2, необходимо увеличение Qкор (смещение кривой ауторегуляции вверх), что ведет к уменьшению коронарного резерва (II), особенно при атеросклеротическом поражении (Б – область максимальной дилатации атеросклеротически измененных сосудов) коронарных сосудов.
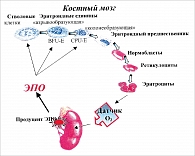
Необходимое количество эритроцитов, циркулирующих в крови, и их насыщенность Hb – основного носителя О2 – поддерживается путем контроля их образования в костном мозге гемопоэзом. Гемопоэз – процесс, при котором происходит ступенчатое образование, развитие и созревание форменных элементов крови, начиная с полипотентной стволовой клетки в костном мозге. Все клетки крови берут свое начало из одной стволовой клетки, дифференцируясь в эритроциты, тромбоциты, лимфоциты, гранулоциты под контролем гормонов и других факторов роста. Как только стволовые клетки становятся детерминированными (способными дифференцироваться) в лимфоциты, тромбоциты, гранулоциты, эритроциты, их производство контролирует механизм обратной связи, и до тех пор, пока уже образовавшиеся клетки не созреют или не выйдут из костного мозга в кровоток, новые клетки не развиваются, чтобы их заменить. Физиологическим регулятором продукции эритроцитов является эритропоэтин (ЭПО), более 90% которого вырабатывается в почках. ЭПО – гликопротеид, гормон, синтезируемый преимущественно в почках, регулирующий синтез эритроцитов в красном костном мозге и их объем, которые осуществляют доставку кислорода к периферическим тканям. Темп синтеза ЭПО в почках контролируется уровнем доставки О2 к почечному эндотелию.
ЭПО в красном костном мозге взаимодействует со специфическими рецепторами на поверхности эритроидных стволовых клеток и стимулирует их превращение в пронормобласты, самую раннюю стадию развития эритроцитов, которые могут быть обнаружены при исследовании костного мозга. На следующем этапе ЭПО стимулирует непрерывное развитие красных кровяных клеток путем усиления синтеза гемоглобина в союзе с Fe и образованием ядерных клеток – ретикулоцитов. Перед тем как попасть в кровяное русло образовавшиеся ретикулоциты остаются в костном мозге около трех дней, где они приблизительно через 24 часа теряют свое ядро, митохондрии, рибосомы и приобретают хорошо знакомую двояковогнутую форму эритроцитов (рисунок 3).
В иностранной литературе часто встречается термин «анемия хронического заболевания». Такие анемии нередко являются следствием тяжелой патологи – ХСН, заболеваний почек, хронических инфекций, онкологических заболеваний (частые спутники ИБС) и в значительной степени определяют объем и стоимость медицинской помощи, качество жизни пациентов.
По данным ежегодного отчета ВОЗ от 1998 года, дефицит железа выявляется у 3,6 млрд населения, а железодефицитной анемией (ЖДА) страдают 1,8 млрд человек. ЖДА является распространенным анемическим синдромом, составляет, по данным различных авторов, 80-90% всех анемий, и в настоящее время не отмечается тенденции в уменьшении этих показателей (6). Крупное канадское исследование, посвященное эпидемиологии АС при ХСН, охватило 12065 пациентов и показало, что в 27% случаев анемия носила характер железодефицитной, в 8% случаев была выявлена В12-зависимая анемия, в 7% – фолиеводефицитная, а в 58% – анемия хронических заболеваний.
В России (по данным отдела медицинской статистики и информатики Информационно-аналитического центра МЗ РФ от 2001 г.) насчитывалось 480 тысяч больных с анемией, из них примерно 432 тысячи – ЖДА (1, 4, 5, 6). Поэтому ранняя диагностика и своевременное лечение ЖДА, усугубляющей тяжесть ХСН, являются актуальными.
Если ИБС развивается на соматически отягощенном фоне, в частности на фоне анемии, это вызывает отягощение в течение заболевания, дополнительные сложности в диагностике и в тактике ведения независимо от возраста данного контингента больных.
Исследования на животных продемонстрировали, что ишемизированный или гипертрофированный миокард более чувствителен, чем миокард здорового сердца, даже к незначительному снижению уровня гемоглобина. Этот негативный эффект анемии на работу сердца как насоса был отмечен и при проведении исследований у пациентов. Оказалось, что в исследованиях на людях и животных поврежденное сердце более чувствительно к анемии, чем нормальное (1, 6). Одновременно снижение уровня гемоглобина способствует уменьшению оксигенации крови в легком, что также способствует уменьшению доставки кислорода к миокарду и развитию ишемического синдрома.
Результаты недавнего ретроспективного исследования, включившего 79000 пациентов в возрасте ≥ 65 лет с ОИМ, показали, что более низкий уровень Ht (< 35%) при поступлении в блоки интенсивной терапии сочетается с более высоким уровнем летальности в первые 30 дней пребывания в стационаре по сравнению с пациентами, которым проводилась гемотрансфузия – летальность значительно уменьшалась (8, 12).
Анемия – снижение концентрации Hb (< 120 г/л) и/или уменьшение общего объема эритроцитов (гематокрит – Ht) периферической крови. В настоящее время выделяют три формы анемии: гипопролиферативные анемии, анемии нарушенного эритропоэза, анемии повреждения (гемолиз, кровотечения) (4, 7).
Анемический синдром – снижение концентрации гемоглобина в единице объема крови, нередко сочетающееся со снижением количества эритроцитов ниже нормы, и сопровождающееся специфическими (для органно-клеточной гипоксии) симптомами: головокружение, шум в ушах, головные боли, мелькание мушек перед глазами, слабость, утомляемость, снижение работоспособности, хроническая усталость, бледность кожи и слизистых, сердцебиение, одышка при незначительной физической нагрузке (7).
Способность анемии ухудшать течение ИБС очевидна. В недавно опубликованной работе W.C. Wu с сотрудниками, в которую включен ретроспективный анализ течения ИБС у 78984 пациентов в возрасте ≥ 65 лет показана сильная обратная взаимосвязь между смертностью в первые 30 дней стационарного лечения ОИМ и уровнем Ht при поступлении. Анализ показал, что пациенты с уровнем Ht > 39% имели летальность в первые 30 дней – 17,2%, пациенты с исходным Ht от 30,1 до 33% имели летальность 30%, а у пациентов с Ht < 30% летальность была в 36% наблюдений. Кроме того, было обнаружено, что анемия значительно чаще встречалась при ИБС и сильнее влияла на прогноз, чем сообщалось ранее, так, при Ht < 39% у пациентов с ИБС в 43,4% случаев была выявлена анемия, а 4,2% пациентов имели Ht < 30%. Эти данные указывают, что диагностика и коррекция анемии являются важными и недооцениваемыми факторами риска у пациентов с ИБС (12).
Результаты обследования и комплексного лечения больных ибс с анемическим синдромом
Под нашим наблюдением находилось 82 пациента с ИБС – стабильная стенокардия III-IV ФК (Классификация Канадского кардиологического общества) осложненная анемией: 54 пациента с ИБС в сочетании с железодефицитной анемией (поставленной на основании уровня сывороточного железа – меньше 10 ммоль/л), 12 больных ИБС – с фолиевой/В12-дефицитной анемией, 16 больных имели анемию хронических заболеваний (9 пациентов – неспецифический язвенный энтероколит, 4 пациента – системные васкулиты, 3 больных – хронический инфекционный эндокардит).
В исследуемой группе больных с ИБС было 36 женщин, средний возраст которых составил 59,2 ± 5,1года, 46 мужчин (средний возраст – 57,1 ± 4,1). Из исследования исключались онкологические больные и больные с хронической почечной недостаточностью.
Функциональный класс стенокардии определяли с помощью нагрузочного теста – количество метров пройденных за 6 минут без дискомфорта в области сердца.
Критериями анемии являлись снижения уровня гемоглобина (Hb<120 г/л) и показатели лабораторного исследования крови: для ЖДА – гипохромия (цветной показатель < 0,85, МСН < 24 пг), микроцитоз (МСV < 75 мм), сывороточное железо – < 12,0 мкмоль/л, насыщение трансферина железом – < 15%; для фолиевой или В12- дефицитной анемией – наличие нормо- или макроцитоза при нормальном уровне сывороточного железа; анемия хронического заболевания – сывороточный ферритин в пределах 20-250 нг/мл с тенденцией к снижению сывороточного железа – ≤ 12 мкмоль/л. Повышенное число ретикулоцитов свидетельствует о нормальной пролиферативной функции костного мозга на стимуляцию ЭПЭ, что более характерно для фолиевой или В12-дефицитной анемии (2, 5).
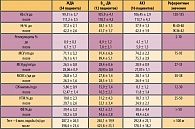
Средний уровень гемоглобина в крови до лечения в целом по группе составил 101,8 ± 4,5 г/л: у женщин – 98,5 ± 4,3 г/л, у мужчин – 104,3 ± 3,5 г/л. Концентрация сывороточного железа до лечения в среднем по группе – 7,76 ± 3,7 ммоль/л: у женщин – 6,8 ± 1,9 ммоль/л, у мужчин – 8,51 ± 2,8 ммоль/л.
Результаты обследования больных до и после лечения в зависимости от вида анемии представлены в таблице 1.
Лечение основного заболевания – ИБС проводили с помощью антиангинальных препаратов (нитратов, антагонистов кальциевых каналов) с исключением аспирина и иАПФ, которые, по данным различных авторов, ингибируют синтез эритропоэтина в почках и блокируют его эритропоэтическое действие на уровне костного мозга (11).
В подгруппе больных с ЖДА (32 пациента) в течение 1-2 недель суммарно было в/в введено 1444 ± 25,4 мг железа (Венофер) с последующей терапией пероральными препаратами Ферро-Фольгамма. У остальных больных (22 пациента) лечение начинали и продолжили железосодержащим препаратом Ферро-Фольгамма из расчета в среднем по группе 384,4 ± 27,3 мг железа в сутки. Ферро-Фольгама (Wöerwag Pharma) – комбинированный препарат, 1 капсула которого содержит 100 мг сульфата железа, 5 мг фолиевой кислоты, 10 мкг цианокобаламина и 100 мг аскорбиновой кислоты, с минимальными побочными эффектами по сравнению с другими железосодержащими препаратами для перорального применения.
Доза вводимого железосодержащего препарата рассчитывалась в соответствии с общим дефицитом железа (ОДЖ) в организме согласно формуле:
ОДЖ = МТ (кг) • 0,24 •(150 г/л – Hb больного) +
депонированное железо; для массы тела (МТ) более 35 кг: количество депонированного железа – 500 мг, Hb – 150 г/л, коэффициент 0,24 = 0,0034 • 0,07 • 1000 (содержание Fe в Hb = 0,34%, объем крови = 7% от массы тела, коэффициент 1000 = перевод «г» в «мг») (3,7).
В подгруппе пациентов с В12-дефицитной анемией лечение анемии проводили подкожным введением цианокобаламина из расчета 1000 мкг + 5 мг фолиевая кислота (перорально) в сутки в течение 7-10 дней.
В подгруппе больных ИБС с анемией хронических заболеваний – лечение проводилось Ферро-Фольгаммой из расчета 300-400 мг в сутки в течение 2-3 недель.
Как видно из таблицы, произошел рост концентрации Hb (после лечения) в целом по группе на 10,8% в результате увеличения сывороточного железа на 66,3%: Hb – от 101,8 ± 4,5 г/л до 112,8 ± 3,7 г/л; концентрация Fe сыворотки – от 7,76 ± 3,7 ммоль/л до 12,9 ± 4,1 (p < 0,01 – 0,001).
На фоне нормализации уровней сывороточного железа и гемоглобина произошло улучшение насосной деятельности сердца, документируемое увеличением ФВ на 27,4%: от 39,64 ± 3,7% (до лечения) до 50,5 ± 3,2% (к концу лечения) (p < 0,01).
Толерантность к физической нагрузке в целом по группе к концу стационарного лечения (3 недели) в среднем возросла на 39,8 %: от 285,06 ± 27,1 м до 398,4 ± 24,7 м (p < 0,01).
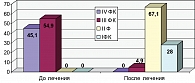
Подобная положительная динамика со стороны толерантности к физической нагрузке позволила изменить соотношение ФК стенокардии: до лечения III и IV ФК были в 100% наблюдений, после лечения – I ФК – у 23 (28%), II ФК – у 55 (67,1%) и III ФК – только у 4 (4,9%) пациентов (диаграмма 1).
При оценке клинических проявлений, в целом по группе, количество приступов стенокардии (боли в области сердца) до лечения в среднем составило 10 приступов в день, после лечения – 4 приступа в день, 12 пациентов полностью отказались от приема антиангинальных препаратов. Суточный прием нитроглицерина сократился практически в три раза: до лечения средняя суммарная доза составляла 10,5 ±1,5 мг, после лечения составила – 3,25 ± 1 мг.
Обсуждение результатов лечения
Ишемическая болезнь сердца – это группа заболеваний, обусловленных абсолютной или относительной недостаточностью коронарного кровообращения. Энергетику (доставка кислорода) нормальной работы сердца как насоса обеспечивает поток объема крови по коронарным артериям. Сужение или закупорка одной или нескольких коронарных артерий лишает сердечную мышцу необходимого ей количества кислорода.
Эпидемиологические исследования свидетельствуют о том, что заболевания сердечно-сосудистой системы, прежде всего, ишемическая болезнь сердца, занимают ведущее место как среди причин нетрудоспособности, так и в структуре смертности. Чаще болеют мужчины в возрасте 40-65 лет. В развитых странах на 1 млн населения приходится 30-40 тыс. больных ИБС (6).
В настоящее время абсолютно ясно, что, несмотря на очевидные достижения в изучении патогенеза, лечение ИБС представляет трудно решаемую проблему из-за ее комплексности. Своеобразие возникновения и течения ИБС, а также фазность самого процесса обусловливают тот факт, что лечение на начальном этапе и в период развернутой клинической картины не может быть идентичным, так как наличие осложнений и сопутствующих заболеваний (анемии) существенно влияет на качество и результаты лечебных мероприятий. Данные многочисленных эпидемиологических исследований и собственный опыт свидетельствуют о том, что лица с ИБС – это пациенты, имеющие, как правило, сопутствующие заболевания, среди которых часто отмечаются различные заболевания ЖКТ, в том числе атрофический гастрит, хронический колит, анемия различного происхождения, хроническая почечная недостаточность.
Факторами, приводящими к развитию сопутствующей анемии у больных ИБС, могут быть мальабсорбция – нарушение всасывания Fe (результат венозного застоя и заболеваний в желудочно-кишечном тракте), применение аспирина (скрытые формы потери крови через ЖКТ). Длительное применение ингибиторов АПФ при лечении ИБС также может приводить к снижению уровня гемоглобина через подавление секреции эритропоэтина (ЭПО) эндотелием почечных канальцев и блокирование эритропоэтической роли ЭПО на уровне костного мозга. Другой причиной развития АС может являться опухолево-некротический фактор, уровень которого повышается у пациентов с ХСН как исход ИБС и коррелирует с тяжестью анемии.
Воспалительные цитокины взаимодействуют не только с ЭПО-ген экспрессией, но и оказывают большое влияние на метаболизм железа, определяя так называемый ретикулоэндотелиальный блок с дефектом доставки железа к месту эритропоэзиса (костный мозг). В настоящий момент молекулярный механизм этого эффекта может быть объяснен частично. Гепсидин (Hepcidin) является регуляторным ключом для метаболизма железа и медиатором анемии во время воспаления. Этот малый пептид, сверхпродукция которого индуцируется воспалительными цитокиназами, активирует захват железа макрофагами, что уменьшает доступ железа к эритропоэзису. Возникший ретикуло-эндотелиальный блок не может быть компенсирован оральным приемом препаратов железа, поэтому более эффективно назначение железа в/в (9,10).
Потенциальные причины развития АС при ИБС:
- ишемическое повреждение костного мозга;
- снижение синтеза ЭПО в почках;
- нарушение захвата ЭПО костным мозгом;
- снижение высвобождения Fe из ретикуло-эндотелиальной системы;
- токсическое действие цитокина тумор-некротического фактора-α (TNFα);
- микрокровотечения вследствие длительного приема препаратов аспирина;
- подавление синтеза ЭПО длительным приемом и АПФ (8, 9, 10, 11, 13, 14).
С учетом выше изложенного лечение ИБС на фоне латентной или клинически развернутой анемии следует проводить дифференцировано с включением антианемических препаратов и, вероятно, с исключением тех препаратов, которые способны вызвать нарушение эритропоэза (иАПФ, аспирин).
Восстановление уровня гемоглобина (основного носителя О2) способствует увеличению коронарного резерва, что обеспечивает энергетику насосной деятельности сердца адекватной основному обмену организма в широком диапазоне – от покоя до нагрузки.
С точки зрения основного манифестирующего признака ИБС (стенокардия), в лечение данной патологии целесообразно использовать органические нитраты (эффективность которых доказана 150-летним использованием в клинической практике купирования «грудной жабы») со 100%-ной биодоступностью, минимальной изменчивостью уровней концентрации в плазме крови, длительным периодом полувыведения и оказывающих влияние на агрегатное состояние тромбоцитов и подвижность эритроцитов. В настоящее время такими положительными характеристиками обладает Эфокс Лонг 50, что делает его перспективным в лечении ИБС, сочетающейся с различными заболеваниями, в частности с анемией.
Аспирин-индуцированные осложнения в слизистой желудочно-кишечного тракта при лечении ИБС диктуют отмену препарата и назначение цитопротекторов – антацидов. В ряде клинических и экспериментальных исследованиях показано, что антациды способны эффективно лечить и профилактировать возникновение эрозий и язв в слизистой оболочке желудка при применении нестероидных противовоспалительных препаратов. Было продемонстрировано, что цитопротекторный эффект антацидов реализуется через стимуляцию образования простагландинов в стенке желудка (снижение простагландинов в слизистой желудка – основной механизм эрозивно-язвенного процесса, вызванного применением аспирина), усиление секреции бикарбонатов и увеличение гликопротеинов в слизистой желудка.
Особый интерес представляет препарат Кардиомагнил (Nycomed), который представляет собой соединение ацетилсалициловой кислоты (в наиболее эффективных и безопасных дозах – 75 и 150 мг) с невсасывающимся антацидом – гидроокисью магния.
Невсасывающиеся антациды являются одними из наиболее часто применяемых препаратов в гастроэнтерологической практике при лечении заболеваний желудка, в том числе и язвенной болезни. Свой положительный эффект невсасывающиеся антациды реализуют через адсорбцию соляной кислоты в желудке. Кроме того, они обладают и рядом других положительных эффектов: снижают протеолетическую активность желудочного секрета (адсорбируют пепсин, снижают его активность через повышение рН среды), обладают обволакивающим свойством, связывают лизолецитин и желчные кислоты, оказывающие неблагоприятное воздействие на слизистую желудочно-кишечного тракта.
Гидроокись магния, входящая в состав Кардиомагнила, является наиболее быстродействующим антацидом по сравнению с гидроокисью алюминия, что является чрезвычайно важным моментом при использовании этого препарата в антиагрегантном лечении. Ацетилсалициловая кислота быстро всасывается из желудочно-кишечного тракта: терапевтические концентрации аспирина в плазме крови достигаются через 15-20 минут от момента приема препарата, при этом специально проведенные исследования показали, что гидроокись магния в составе Кардиомагнила не влияет на скорость всасывания ацетилсалициловой кислоты.
Кардиомагнил – первая комбинация в России ацетилсалициловой кислоты (антиагрегант) и гидроокиси магния (антацидный компонент), устраняет ульцерогенное и диспептическое действие аспирина, что позволяет рекомендовать препарат в практику лечения и профилактики ИБС.
В нашем опыте лечения ИБС, сочетающейся с анемией (62% – ЖДА), при коррекции уровня Нв (от 101,8 ± 4,5 г/л до 112,8 ± 3,7 г/л) за счет увеличения сывороточного железа (от 7,76 ± 3,7 ммоль/л до 12,9 ± 4,1 ммоль/л) железосодержащими препаратами (Венофер – в/в, Ферро-фольгамма – перорально) произошло значительное улучшение клинического состояния пациентов: в 15% пациенты перестали принимать антиангинальные препараты, у остальных пациентов частота стенокардитических приступов сократилась практически вдвое (на 60%) с уменьшением приема нитроглицерина в целом по группе от 10,5 ± 1,5 мг до 3,25 ± 1,0 мг в сутки. Подобная положительная динамика со стороны клинической картины произошла на фоне улучшения показателей насосной деятельности сердца – ФВ увеличилась на 27,4% к концу стационарного лечения в целом по группе наблюдаемых больных ИБС, сочетающейся с анемией: от 39,63 ± 3,4% до 50,5 ± 3,6%.
Аналогичная положительная динамика была отмечена в клинической картине ИБС, сочетающейся с В12-дефицитной анемией: на фоне увеличения Нb (от 105,9 ± 4,1 г/л до 118,7 ± 4,3 г/л) ФВ возросла на 29,7%, толерантность к физической нагрузке – на 62,5%
Таким образом, увеличение уровня Hb (основного носителя кислорода) способствует нормализации соответствий между потреблением миокардом кислорода и величиной коронарного кровотока, что обеспечивает необходимый энергобаланс для эффективной работы сердца как насоса – увеличение фракции выброса и толерантности к физическим нагрузкам.
С учетом вышеизложенного, ранняя диагностика ЖДА является актуальной в общей проблеме профилактики, лечения и улучшении прогноза при ИБС, а ее коррекция – очень важное (если не жизненно необходимое) дополнение к комплексной терапии сердечно-сосудистых заболеваний, способствующих развитию ХСН.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.